PET/MRI双模态显像剂68Ga-NOTA-SPIO的制备及其性质初步研究
2017-06-01吴凡
吴 凡
王欣璐2WANG Xinlu
尹吉林1,2YIN Jilin
张金赫2ZHANG Jinhe
欧阳习2OUYANG Xi
周 崝2ZHOU Zheng
杨玉婷2YANG Yuting
钟建秋2ZHONG Jianqiu
PET/MRI双模态显像剂68Ga-NOTA-SPIO的制备及其性质初步研究
吴 凡1,2WU Fan
王欣璐2WANG Xinlu
尹吉林1,2YIN Jilin
张金赫2ZHANG Jinhe
欧阳习2OUYANG Xi
周 崝2ZHOU Zheng
杨玉婷2YANG Yuting
钟建秋2ZHONG Jianqiu
目的制备高灵敏度、高分辨率的PET/MRI双模态显像探针68Ga-NOTASPIO,对其体外及部分体内生物学性质进行评价,并探讨其作为PET/MRI双模态显像剂的可能。材料与方法制备出前体SPIO-PEG2000-NOTA,并对其表征进行检测。采用“一锅法”对前体进行放射性标记,制备出双模态探针68Ga-NOTA-SPIO,采用快速薄层层析法测定标记率。评估其体外稳定性和脂水分配系数,并观察其在正常鼠的体内生物学分布。结果制备出分散均一、粒径均匀的前体SPIO-PEG2000-NOTA;并合成双模态探针68Ga-NOTA-SPIO,标记率达99%,脂水分配系数Log P=-2.60±0.13,在磷酸盐缓冲液和胎牛血清中2 h内的放化纯度均>95%。小鼠体内生物分布实验显示,该探针主要分布于肝脏和脾脏,血液中廓清速度较快。结论“一锅法”合成双模态探针68Ga-NOTA-SPIO标记率高、无需纯化,具有良好的理化性质及生物相容性,可用于后续的PET/MRI双模态显像研究。
正电子发射断层显像术;磁共振成像;纳米粒子;镓放射性同位素;分子探针;诊断显像
PET/MRI双模态成像结合MRI软组织对比度、功能序列与PET成像的分子信息,可同步采集,并从形态、功能、分子等多方面提供肿瘤的生物学及微环境信息,成为肿瘤早期准确诊断的重要技术[1-2]。利用肿瘤的通透性和滞留效应,纳米粒子可通过渗漏和高通透性的肿瘤血管在实体瘤内部聚集。已有研究针对纳米材料为基础的PET/MRI双模态显像探针开展,但目前用于临床的双模态显像药物仍尚未问世[3-4]。因而设计一种有效的双模态显像药物具有重要意义。本文报道一种新型PET/MRI双模态药物合成和初步性质的研究。
超顺磁性氧化铁(superparamagnetic iron oxide,SPIO)纳米粒子具有良好的生物相容性,对其进行修饰后,可将发射正电子的核素、多肽等靶向分子连接其上,达到靶向载药、MRI T2WI阴性造影剂、细胞磁性分离以及纯化DNA的效果[5]。因此,本研究以SPIO为基础,将正电子核素和MRI造影剂相结合形成一种新型显像探针。使用聚乙二醇衍生物(PEG2000)修饰的SPIO利用表面的氨基将双功能螯合剂1,4,7-三氮环壬烷-1,4,7-三乙酸(1,4,7- triazacyclononane-1,4,7-triacetic acid,NOTA)耦联入纳米表面,获得标记前体SPIOPEG2000-NOTA[6]。68Ga (T1/2=68 min,β+=89%,EC=11%)作为优良的正电子显像核素,可直接由68Ge/68Ga发生器制备,操作简便,68Ga离子半径(0.062 nm)大小合适NOTA的三氮环配体空穴,两者螯合形成的产物热力学和动力学稳定性比较高,在体内可长期保持完整[7-8]。因此本研究拟使用68Ga对SPIO进行放射性标记,得到探针68Ga-NOTA-SPIO,并对其作为双模态显像剂的可能性进行初步研究。
1 材料与方法
1.1 试剂与仪器 SPIO-PEG2000-NH2(1 mg/ml,南京先丰纳米材料科技有限公司),NOTA-NHS(法国CHEMATECH公司),稀盐酸(12.5 mol/L,德国默克公司),乙酸钠、冰乙酸等(上海百灵威化学技术有限公司),MEM培养液、胎牛血清、0.25%胰蛋白酶、PBS液等(美国Gibco公司);正常昆明小鼠,雄性,18~22 g[南方医科大学实验动物中心SYXK(粤)2016-0167]。
JEM-200CX透射电镜(日本JEOL公司),NanoZS纳米粒度电位仪(英国Malvern公司),振动样品磁强计VSM 7407(美国Lakeshore公司),IRAf fi nity-1傅里叶变换红外光谱仪(日本SHIMADAZU公司),锗-镓发生器(德国ITG公司),Radio-TLC(美国Bioscan公司),FC-3200放射检测器(美国Bioscan公司),SN-695γ放射免疫计数器(上海核所日环光电仪器有限公司),DF-101S集热式恒温加热磁力搅拌器(巩义市予华仪器有限责任公司),水浴锅(上海精宏实验设备有限公司DK-S22型),电子天平(瑞士Mettler-toledo)。
1.2 前体SPIO-PEG2000-NOTA的合成 参考Jarrett等[9]的研究,前体SPIO-PEG2000-NOTA的合成路线见图1。取3 mg NOTA-NHS溶解于适量去离子水中,搅拌混匀,待NOTA-NHS完全溶解;取磁纳米颗粒(SPIOPEG2000-NH2)5 mg溶于水中,加入NaOH调节pH至9.0;通N2,将溶解的NOTA-NHS加入pH已调整的纳米颗粒中,加温40℃,超声分散5 min,搅拌过夜,反应24 h后停止;使用超滤管(30K)提纯,离心24 h,获得标记前体SPIO-PEG2000-NOTA。

图1 标记前体SPIO-PEG2000-NOTA的合成路线
1.3 前体SPIO-PEG2000-NOTA基本性质检测 透射电镜测定:取适量SPIO-PEG2000-NOTA纳米粒子进行研磨,以乙醇作为分散剂,超声分散后,取部分悬浮液置于铜网,自然干燥,采用高分辨透射电子显微镜观察粒子的形态、粒径。动态光散射检测:取1%(ω/V)的SPIO-PEG2000-NH2及SPIO-PEG2000-NOTA水溶液加入石英比色皿中,使用633 nm的He/Ne激光在NanoZS纳米粒度电位分析仪样品室中进行扫描测定。Zeta电位测定:使用NanoZS纳米粒度电位分析仪测量SPIO-PEG2000-NH2及SPIO-PEG2000-NOTA电位。磁性分析:取适量SPIO-PEG2000-NH2及SPIO-PEG2000-NOTA装入约7 mm的棉签管中,两端封口于振动样品磁强计(VSM 7407)样品舱中测试。傅里叶变换红外光谱测定:取适量冻干后的SPIO-PEG2000-NH2及SPIOPEG2000-NOTA粉末分别与KBr混合后,研磨压片,在IRAf fi nity-1样品舱中测定。
1.468Ga-NOTA-SPIO的制备 取200 μl Fe浓度为1 mg/ml的SPIO-PEG2000-NOTA于2 ml小反应瓶中,加入500 μl 0.05 mmol/L稀盐酸淋洗下来的68Ga(148 MBq),再加入32.5 μl乙酸钠(1 mol/L),涡旋均匀后,在70℃条件下反应10 min,完成标记。合成路线见图2。

图2 产物68Ga-NOTA-SPIO的合成路线
1.5 标记率的测定 采用快速薄层层析法测定。取2 μl反应液点样于ITLC-SG纸(10 mm×150 mm)上,于超纯水中上行展开,空气中自然晾干。用Bioscan放射性薄层扫描仪进行扫描,计算标记率(%)。
1.6 稳定性评价 取100 μl反应液,分别加入500 μl小牛血清和500 μl PBS(pH=7.24、0.02 mol/L)中。置于37℃的水浴箱中孵育0.5、1、1.5、2 h,分别于不同时间点取约2 μl样品用ITLC法测定其放化纯度,重复3次后取平均值。
1.7 脂水分配系数测定 取10 μl反应液于1.5 ml离心管中(含500 μl正辛醇和500 μl PBS),用胶膜密封,充分涡旋2 min后,高速离心3 min(10 000 r/min),至两相平衡。用移液枪从有机相和水相各取样10 μl分置于2支γ计数管中,测量其放射性计数。按公式(1)计算脂水分配系数(logP)。重复取样测定3次,取平均值。

其中,cts正辛醇和cts PBS分别为正辛醇和PBS中的γ计数。
1.8 正常小鼠体内的生物分布 分别取100 μl反应液(7.4 MBq),经尾静脉注射入12只昆明鼠体内,分别于注射后5、30、60、120 min眼球静脉取血后,断颈处死并解剖,分别取血液、心脏、肺、肝脏、脾脏、肾脏、胃、小肠、胰腺、脑、肌肉、骨骼、皮肤等器官或组织,称重,γ计数,经衰减校正后测定其每克组织的百分注射剂量率(%ID/g)。
2 结果
2.1 前体SPIO-PEG2000-NOTA的合成 经过设计的SPIO-PEG2000-NH2末端含有氨基,与NOTA-NHS酯上的羰基(碱性条件下解离出游离羧基)进行反应,得到前体SPIO-PEG2000-NOTA。
2.2 基本表征检测 前体SPIO-PEG2000-NOTA可溶于超纯水中,为浅棕色透明溶液。透射电镜图像见图3,电镜下纳米粒径为8~12 nm,呈球形,大小均匀,分散均一。

图3 SPIO-PEG2000-NOTA纳米粒子的粒径和形貌
DLS结果见图4。连接NOTA前、后的DLS图均显示为单峰,连接前后纳米的达尔文粒径分别约34和89 nm,连入NOTA后,达尔文粒径明显增大,且分布范围较窄。

图4 水合动力学直径分布。连接NOTA前达尔文粒径为(33.65±6.133)nm(A);连接NOTA后达尔文粒径为(89.24± 12.62)nm(B)
Zeta电位结果见图5。连接NOTA前、后,由于纳米表面氨基为羧基所取代,电位形成翻转(11.6~-29 mV)。
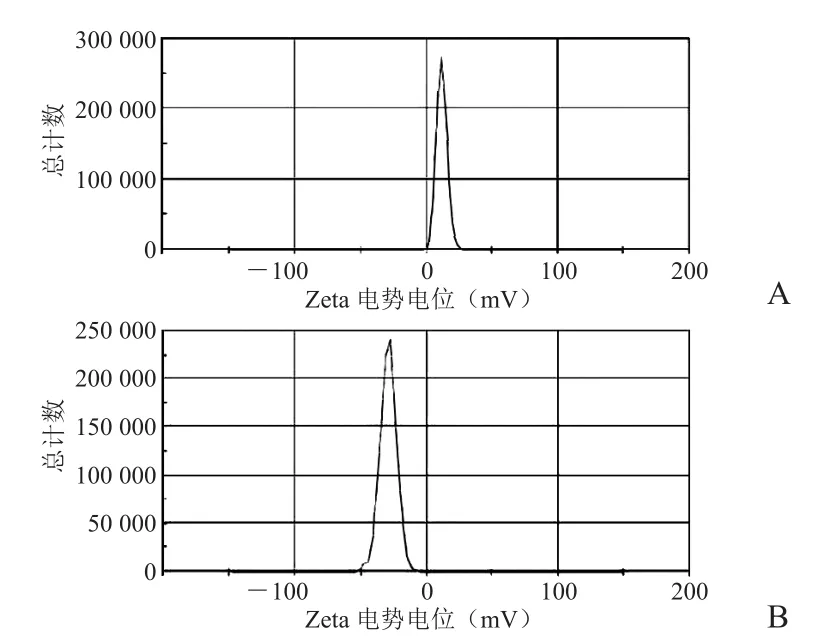
图5 Zeta电位。SPIO-PEG2000-NH2电位11.6 mV(A);SPIOPEG2000-NOTA 电位-29 mV(B)
红外检测结果见图6。NOTA修饰后红外光谱1632.2/cm处(图6B中红线)出现了新的吸收峰,考虑由新形成酰胺键中NH-CO内的N-H弯曲振动和C-N的伸缩振动相互作用而产生。
磁性分析结果见图7。磁滞回曲线示,随外磁场强度增大,纳米粒子磁化强度增大,外加磁强度达到一定值(2000 Oe)时,磁强度增速趋于缓慢,渐达磁饱和状态。SPIO-PEG2000-NOTA比饱和磁化强度为56.04 emu/g,具有良好的超顺磁性,提示此前体具有作为MRI显像剂的潜力。
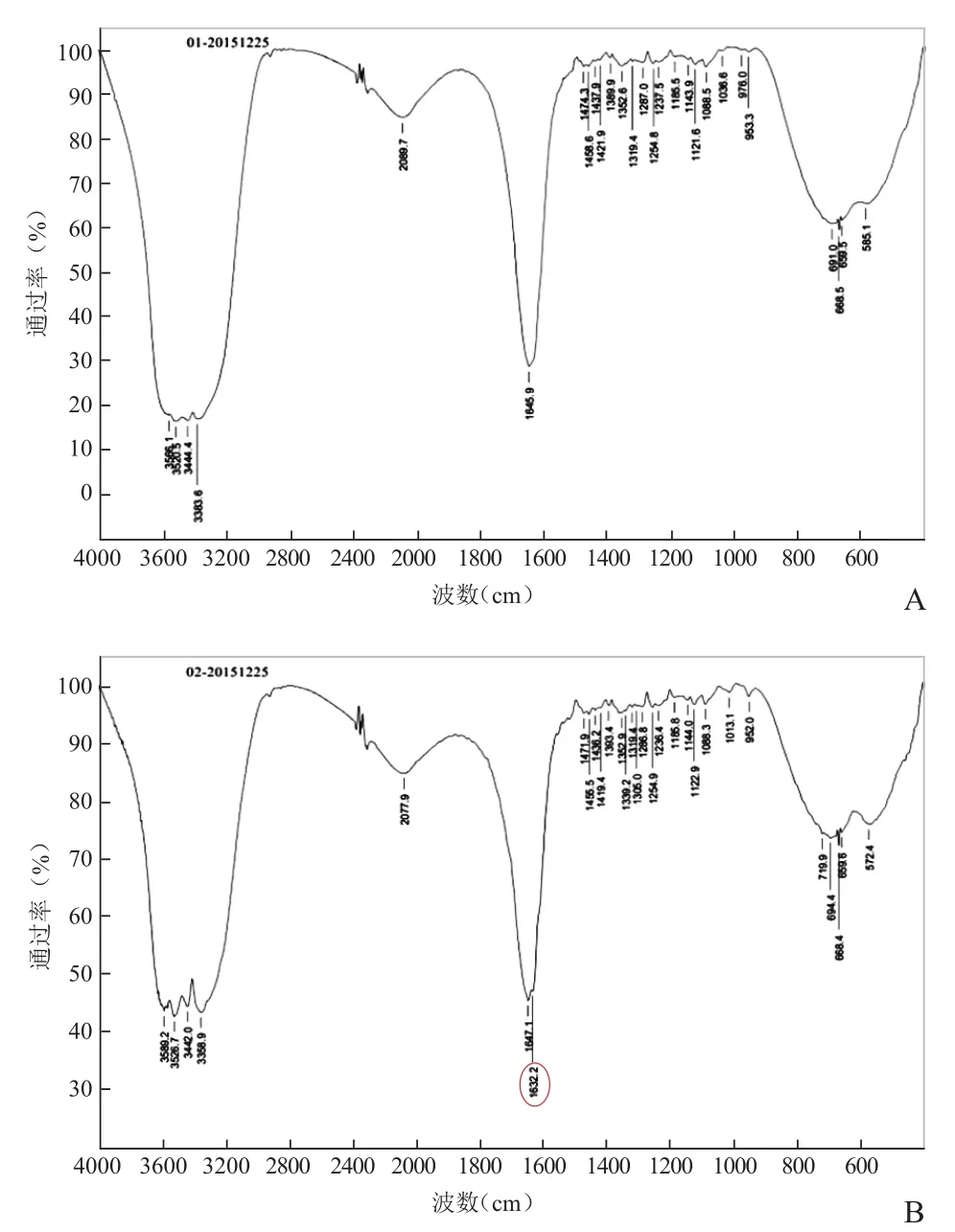
图6 红外光谱。SPIO-PEG2000-NH2(A);SPIO-PEG2000-NOTA(B)

图7 SPIO-PEG2000-NOTA的磁滞回线
2.3 标记率测定 标记产物68Ga-NOTA-SPIO经ITLC分离后,用薄层放射性扫描仪检测,结果见图8。结果显示在此展开体系中,68Ga-NOTA-SPIO保留在原点附近(Rf为0~0.1,Rf=样品点的中心处与点样处距离/展开剂前沿与点样处的垂直距离),游离的68Ga离子随溶剂移动到层析纸前沿,其Rf为0.8~1.0,系统自动积分测得其标记率约99%。
2.4 稳定性评价 37℃的环境下,产物68Ga-NOTASPIO在PBS和FBS中分别孵育0.5、1、1.5、2 h 后,用Radio-TLC测定其放化纯度,结果见图9。由图9可见,直至120 min,68Ga-NOTA-SPIO无论在PBS还是FBS中均具有良好的稳定性,放化纯度均在95%以上,表明其具有良好的体外稳定性。

图8 产物68Ga-NOTA-SPIO的ITLC图谱

图968Ga-NOTA-SPIO在PBS和小牛血清中的稳定性
2.5 脂水分配系数68Ga-NOTA-SPIO的脂水分配系数log P=-2.60±0.13,表现为亲水性。这与其表面修饰有大量PEG有关,其亲水特性可提高68Ga-NOTA-SPIO在活体内的分布运转,延长体内循环时间。
2.6 正常小鼠体内生物学分布68Ga-NOTA-SPIO在正常昆明小鼠体内生物学分布数据见图10及表1。结果显示68Ga-NOTA-SPIO主要为肝、脾摄取,且随时间延长,摄取增高,120 min达最高。肾脏内仅见少量放射性积聚。随时间延长,放射性明显减低。探针在血液中廓清速度较快,随时间延长,放射性明显减低。在其他器官中均未见明显摄取。
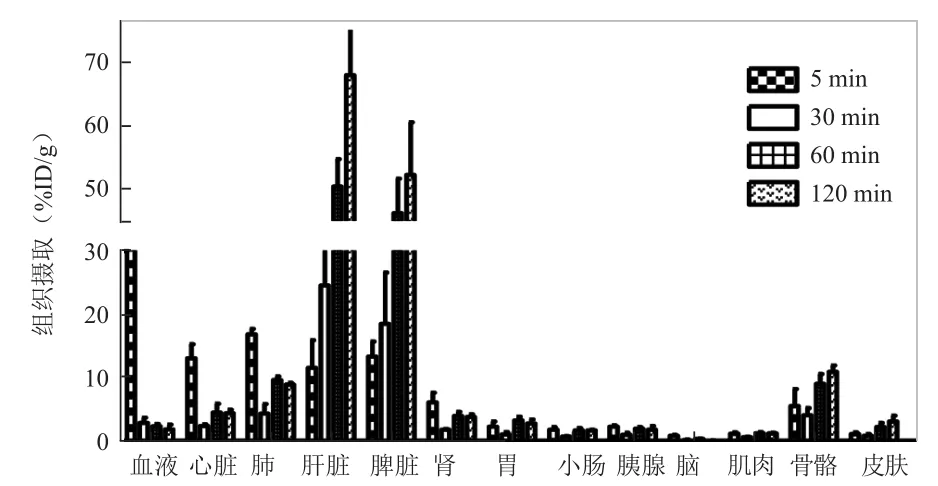
图10 不同时间68Ga-NOTA-SPIO在正常昆明小鼠的体内分布结果
3 讨论
本实验参考Jarrett等[9]的研究,成功合成标记前体SPIO-PEG2000-NOTA,并进行了一系列表征检测进行验证,制备的前体分散性良好,粒径小且均一,透射电镜下粒径约10 nm,水动力尺寸粒径达89 nm,与文献描述一致[10]。主要由于电镜测量颗粒核心粒径,而纳米粒度仪测量的是水合粒径,包含了纳米外层的水溶性包膜。连入NOTA后DLS粒径的增大,Zeta电位的翻转,红外特殊吸收峰的出现均表明SPIO-PEG2000-NOTA合成成功。弛豫率测试表明所得的纳米颗粒有较高的r2弛豫率,可作为构建PET/MRI双模态显像剂的良好平台。
表1 不同时间68Ga-NOTA-SPIO在正常昆明小鼠的体内分布结果(±s,n=3)
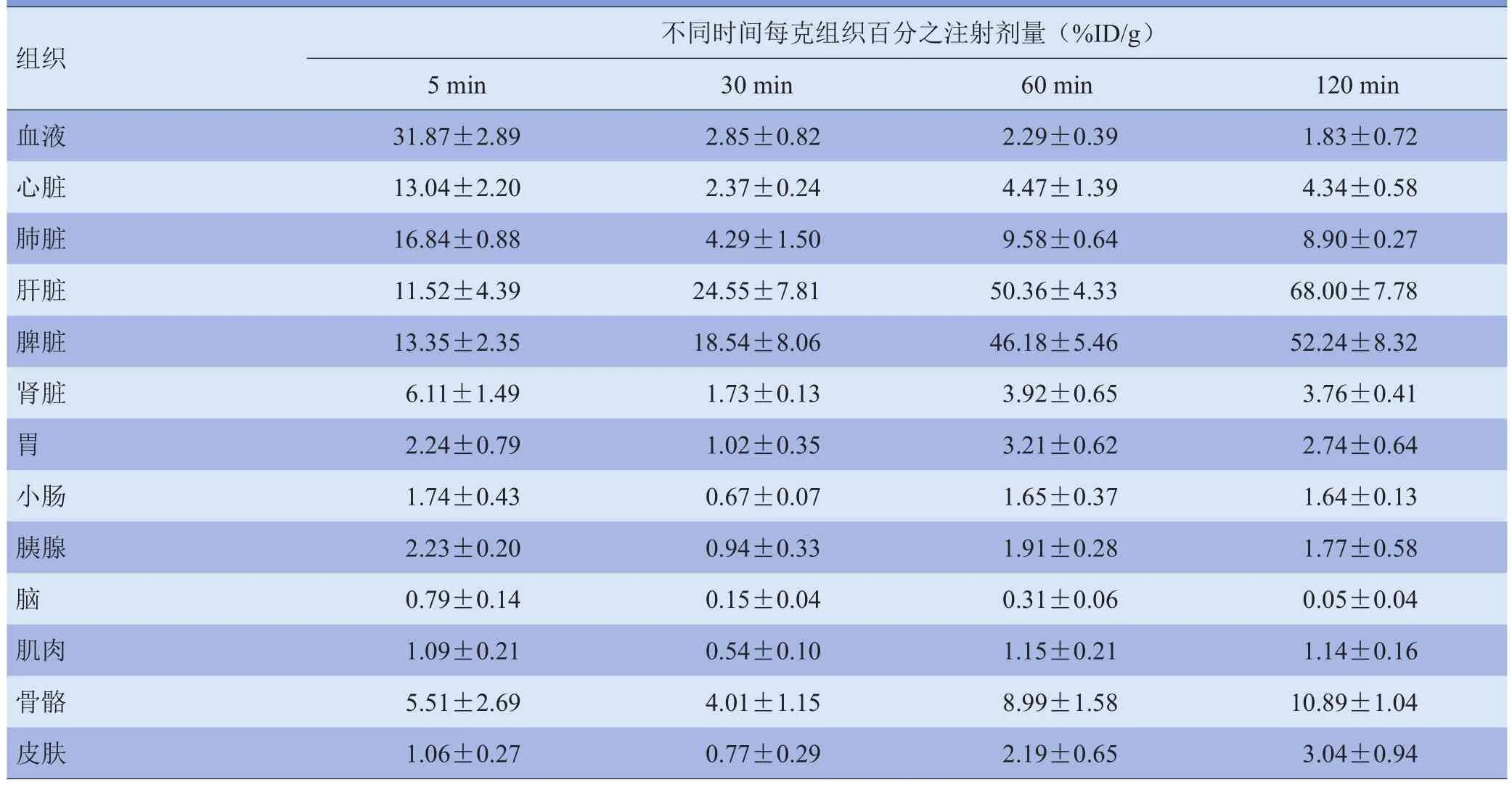
表1 不同时间68Ga-NOTA-SPIO在正常昆明小鼠的体内分布结果(±s,n=3)
组织不同时间每克组织百分之注射剂量(%ID/g)5 min30 min60 min120 min血液31.87±2.892.85±0.822.29±0.391.83±0.72心脏13.04±2.202.37±0.244.47±1.394.34±0.58肺脏16.84±0.884.29±1.509.58±0.648.90±0.27肝脏11.52±4.3924.55±7.8150.36±4.3368.00±7.78脾脏13.35±2.3518.54±8.0646.18±5.4652.24±8.32肾脏6.11±1.491.73±0.133.92±0.653.76±0.41胃2.24±0.791.02±0.353.21±0.622.74±0.64小肠1.74±0.430.67±0.071.65±0.371.64±0.13胰腺2.23±0.200.94±0.331.91±0.281.77±0.58脑0.79±0.140.15±0.040.31±0.060.05±0.04肌肉1.09±0.210.54±0.101.15±0.211.14±0.16骨骼5.51±2.694.01±1.158.99±1.5810.89±1.04皮肤1.06±0.270.77±0.292.19±0.653.04±0.94
目前已有关于标记SPIO的PET/MRI双模态研究报道。史旭东等[11]使用64Cu对SPIO-DOPA-PEG-DOTA/ RGD进行标记,得到了PET/MRI的双模态探针,但其标记率相对较低,仅为71%,需要DTPA进行进一步纯化。有研究报道[64Cu(DTCBP)2]-Endorem的淋巴结显像结果,在PET/MRI显像模式下,髂淋巴结和腘窝淋巴结均清晰显示[3]。Madru等[12]使用99Tcm标记了SPIO,得到了SPECT/MRI双模态探针用于淋巴结显像。但对于使用68Ga标记SPIO的研究报道较少。本研究采用68Ga标记SPIO得到68Ga-NOTA-SPIO,合成时间更短(10 min),反应步骤简单,一步合成,条件温和(70℃),且标记率高达99%,无需进一步纯化即可用于下一步实验,具有转化为临床应用的潜质。
68Ga-NOTA-SPIO在PBS与FBS中均表现出较高的放化纯度,表明其具有良好的体外稳定性,为进一步的体内生物学评价奠定了良好的基础。该探针表面亲水,内核亲脂,良好的水溶性和生物相容性有利于纳米在小鼠活体中的血液循环,为后期活体内的生物学分布提供了基础。
正常小鼠体内分布示,放射性标记物主要聚集于肝脏和脾脏,且随时间延长,放射性摄取进一步升高,120 min达最高,肝脏为(68.00±7.78)%ID/g、脾脏为(52.24±8.32)%ID/g;而其他器官的摄取相对较低,表明该标记物主要通过肝、脾代谢。这与粒径<100 nm的纳米粒子生物分布的一般特性相符[13-14]。体内网状内皮系统(包括肝脏、脾脏、肺及骨髓组织)含丰富的吞噬细胞,可将特定大小纳米作为异物吞噬,截留于某些部位。Laurent等[15]报道粒径100~200 nm的颗粒可较快地被网状内皮吞噬而清除,到达Kupffer细胞的溶酶体中;粒径50~100 nm颗粒可进入肝实质,<50 nm者则主要分布于脾和骨髓中。68Ga-NOTA-SPIO粒径为约为89 nm,主要为肝、脾摄取,有望用于肝、脾显像中。
通过在SPIO表面连入大环配体NOTA,成功合成了标记前体SPIO-PEG2000-NOTA,并使用正电子放射性核素68Ga对其进行标记,合成双模态探针。尽管本研究仅初步对其进行了体外及体内的性质测定,但这种通过将PET显像与MRI显像组分简单混合最终制备双模态分子影像探针的方法为其他双模态分子影像探针的制备提供了新的思路。后期可对其进行进一步的靶向修饰,其作为恶性肿瘤早期准确诊断的研究有待进一步深入。
[1] Cherry SR. Multimodality imaging: beyond PET/CT and SPECT/CT. Semin Nucl Med, 2009, 39(5): 348-353.
[2] Sotoudeh H, Sharma A, Fowler KJ, et al. Clinical application of PET/MRI in oncology. J Magn Reson Imaging, 2016, 44(2): 265-276.
[3] Torres Martin de Rosales R, Tavaré R, Paul RL, et al. Synthesis of64Cu (II) -bis (dithiocarbamatebisphosphonate) and its conjugation with superparamagnetic iron oxide nanoparticles: in vivo evaluation as dual-modality PET-MRI agent. Angew Chem Int Ed Engl, 2011, 50(24): 5509-5513.
[4] Garcia J, Tang T, Louie AY. Nanoparticle-based multimodal PET/MRI probes. Nanomedicine (Lond), 2015, 10(8): 1343-1359.
[5] Reddy LH, Arias JL, Nicolas JA. Magnetic nanoparticles: design and characterization, toxicity and biocompatibility, pharmaceutical and biomedical applications. Chem Rev, 2012, 112(11): 5818-5878.
[6] Zhang LM, Lu ZX, Bai YY, et al. PEGylated denatured bovine serum albumin modi fi ed water-soluble inorganic nanocrystals as multifunctional drug delivery platforms. Journal of Materials Chemistry B, 2013, 1(9): 1289-1295.
[7] 张蓉琴, 尹吉林, 王欣璐, 等. 靶向生长抑素受体正电子显像剂的临床研究进展. 中国医学影像学杂志, 2015, 23(8): 627-631.
[8] Ambrosini V, Campana D, Tomassetti P, et al. PET/CT with 68Gallium-DOTA-peptides in NET: an overview. Eur J Radiol, 2011, 80(2): e116-e119.
[9] Jarrett BR, Gustafsson B, Kukis DL, et al. Synthesis of 64Culabeled magnetic nanoparticles for multimodal imaging. Bioconjug Chem, 2008, 19(7): 1496-1504.
[10] Yang X, Hong H, Grailer JJ, et al. cRGD-functionalized, DOX-conjugated, and64cu-labeled superparamagnetic iron oxide nanoparticles for targeted anticancer drug delivery and PET/ MR imaging. Biomaterials, 2011, 32(17): 4151-4160.
[11] 史旭东, 王晓, 申一鸣, 等. 超顺磁性氧化铁纳米粒子SPIO-dopa-PEG-DOTA/RGD的64Cu标记、纯化及生物分布.核化学与放射化学, 2015, 37(4): 250-256.
[12] Madru R, Kjellman P, Olsson F, et al. 99mTc-labeled superparamagnetic iron oxide nanoparticles for multimodality SPECT/MRI of sentinel lymph nodes. J Nucl Med, 2012, 53(3): 459-463.
[13] Natarajan A, Gruettner C, Ivkov R, et al. NanoFerrite particle based radioimmunonanoparticles: binding af fi nity and in vivo pharmacokinetics. Bioconjug Chem, 2008, 19(6): 1211-1218.
[14] Glaus C, Rossin R, Welch MJ, et al. In vivo evaluation of (64) Cu-labeled magnetic nanoparticles as a dual-modality PET/MR imaging agent. Bioconjug Chem, 2010, 21(4): 715-722.
[15] Laurent S, Forge D, Port M, et al. Magnetic iron oxide nanoparticles: synthesis, stabilization, vectorization, physicochemical characterizations, and biological applications. Chem Rev, 2008, 108(6): 2064-2110.
(本文编辑 闻 浩)
Preparation and Properties of68Ga-NOTA-SPIO as PET/MRI Dual-modal Imaging Agent
PurposeTo prepare68Ga-NOTA-SPIO as PET/MRI dual mode imaging probe with high sensitivity and resolution, and further evaluate itsin vitroand partlyin vivobiological properties.Materials and MethodsThe precursor SPIO-PEG2000-NOTA was prepared and characterized. The precursor was radiolabeled by using "one step" method to prepare68Ga-NOTA-SPIO as dual mode imaging probe. The labeling rate of the probe was determined by rapid thin-layer chromatography. Besides, thein vitrostability and lipid water partition coef fi cient of the probe were evaluated, and its biodistribution in normal mice was also observed.ResultsThe precursor SPIO-PEG2000-NOTA with uniform dispersion and uniform particle size was prepared, and the dual mode probe68Ga-NOTASPIO was synthesized. The labeling rate reached 99%, and the lipid water partition coef fi cient (Log P) was (-2.60±0.13). The radiochemical purity of the probe was higher than 95%, as it was incubated in the phosphate buffer and fetal bovine serum within 2 hours. The probe was mainly distributed in the liver and spleen of mice, and its clearance velocity in blood was fast.ConclusionThe double mode probe68Ga-NOTA-SPIO synthesized by one step method has high labeling rate with no need of puri fi cation, which has good physic-chemical properties and biocompatibility. The probe can be used in the further research of PET/MRI dual modality imaging.
Positron-emission tomography; Magnetic resonance imaging; Nanoparticles; Gallium radioisotopes; Molecular probes; Diagnostic imaging
1.南方医科大学 广东广州 510515
2.广州军区广州总医院核医学科 广东广州510010
尹吉林
Sourthern Medical University, Guangzhou 510515, China; Department of Nuclear Medicine, Guangzhou General Hospital of Guangzhou Military Command, Guangzhou 510010, China
Address Correspondence to:YIN Jilin
E-mail: 13922116201@139.com
国家自然科学基金(81571733);广东省自然科学基金(2016A030313612);广东省省级科技计划项目(2014A020212261);广州市产学研协同创新重大专项(201604020094);广州市科技计划项目(201510010278)。
R33;R445.6
2016-12-05
修回日期:2017-01-24
中国医学影像学杂志
2017年 第25卷 第5期:329-334
Chinese Journal of Medical Imaging
2017 Volume 25 (5): 329-334
10.3969/j.issn.1005-5185.2017.05.003
