131I标记的甲状腺未分化癌人源单链抗体在荷瘤裸鼠模型的放射免疫显像
2017-06-01刘倩
刘 倩
刘 琼LIU Qiong
李文波LI Wenbo
许 璐XU Lu
周 静ZHOU Jing
刘 影LIU Ying
庞 华PANG Hua
131I标记的甲状腺未分化癌人源单链抗体在荷瘤裸鼠模型的放射免疫显像
刘 倩LIU Qian
刘 琼LIU Qiong
李文波LI Wenbo
许 璐XU Lu
周 静ZHOU Jing
刘 影LIU Ying
庞 华PANG Hua
目的测定131I标记的甲状腺未分化癌(ATC)人源单链抗体(scFv)的放射性纯度与比活度,并探讨其在荷瘤裸鼠模型的体内分布情况和放射免疫显像特点,以期为ATC的诊断及治疗提供一种新的方法。材料与方法接种ATC细胞构建荷人ATC裸鼠模型。采用氯胺T法实现scFv的131I标记,Sephadex G25M柱纯化标记抗体,采用三氯醋酸法测定其标记率,采用纸层析法测定131I标记scFv的放化纯度、室温稳定性及血清稳定性。荷瘤裸鼠尾静脉注射131I-scFv后12、24、48、72 h取各组织器官分析131I-scFv在体内组织器官中的生物分布情况,另取荷瘤裸鼠尾静脉注射131I-scFv后12、24、48、72 h进行SPECT静态显像,观察瘤内放射性浓聚,待肿瘤清晰显影,进行SPECT/CT图像融合。结果纯化后的131I-scFv标记率为91.64%,放化纯度为(93.3±0.3)%;131I-scFv放于室温及血清孵育1、6、12、24 h后所测得放射性化学纯度均高于90%。131I-scFv在肿瘤组织、肝、肾、肠、血液中具有较高的放射性分布。SPECT显示131I-scFv能够在肿瘤组织中选择性浓聚,肿瘤组织靶/非靶比值在48 h时达最高为4.38,且显影最清晰。结论成功制备131I-scFv,131I-scFv在荷瘤裸鼠模型中有较好的显像效果,为进一步开展ATC的诊断及治疗研究奠定基础。
甲状腺肿瘤;癌;碘放射性同位素;单链抗体;放射免疫显像;体层摄影术,发射型计算机,单光子;体层摄影术,X线计算机;疾病模型,动物;小鼠,裸
甲状腺未分化癌(anaplastic thyroid carcinoma,ATC)是恶性程度最高的甲状腺肿瘤,在所有甲状腺恶性肿瘤中预后最差,约占所有甲状腺癌的7%~8%[1]。ATC的治疗效果较乳头状癌、滤泡状癌和髓样癌差。目前,ATC的治疗方法主要有基因治疗、抗肿瘤血管形成的基因治疗、钠/碘转运蛋白基因介导的放射性碘治疗、诱导分化治疗以及放射免疫治疗。目前对ATC的治疗尚缺乏有效的手段,分子靶向药物和肿瘤疫苗等新的治疗方法的出现为ATC的治疗提供了可能[2]。随着噬菌体抗体库技术的成熟,通过该方法获得的人源单链抗体克服了鼠源性单克隆抗体的不足。抗体作为实现生物靶向运输的载体是提高显像和治疗效果的关键,在临床肿瘤放射免疫治疗中显示出巨大的潜力。放射免疫治疗是将放射性核素与具有导向性的特异抗体耦联制成放射免疫药物进行体内治疗的方法,为ATC的诊断和治疗提供了新的思路[2-3]。
前期研究已运用噬菌体抗体库技术建立了ATC噬菌体抗体库,通过4轮筛选,得到了ATC噬菌体单链抗体,并对所得到的抗体进行生物学鉴定。本研究用131I标记得到的人源ATC单链抗体scFv,检测其在荷瘤裸鼠模型的放射免疫显像。
1 材料与方法
1.1 实验材料与试剂 人源ATC单链抗体scFv由本实验组前期制备[4];ARO细胞株(人ATC细胞)购于吉尼欧生物科技有限公司;131I购于成都中核高通同位素股份有限公司;氯胺T、偏重亚硫酸钠购于成都西亚试剂有限公司;碘化钾、三氯醋酸、正丁醇、乙酸均购于上海试剂三厂;裸鼠购于重庆医科大学实验动物中心;血清购于重庆医科大学附属第一医院血库;Siemens Symbia T2 SPECT/CT仪。
1.2 方法
1.2.1131I-scFv制备及纯化 氯胺T法标记制备131I-scFv:250 μl scFv混于100 μl131I(放射性强度为50 mCi/ml)中,3 min后加氯胺T 250 μl(1 mg/ml),1 min后加入500 μl偏重亚硫酸钠溶液(2 mg/ml),使其充分混匀1 min,加入100 μl KI终止反应。将混合液上Sephadex G25M柱纯化,0.45 μm过滤器过滤。采用三氯醋酸法检测131I-scFv标记率。采用纸沉析法检测131I-scFv放化纯度,并计算其放射性比活度。纯化的131I-scFv置于室温下1、6、12、24 h,分别检测各时间点的放化纯度,分析其室温稳定性。将131I-scFv纯化液加入新鲜人血清,37℃培养1、6、12、24 h后检测放化纯度,分析其血清稳定性。
1.2.2 荷人ATC裸鼠模型构建 ARO细胞培养至对数生长期,接种至约为4周龄的雌性裸鼠的右前肢皮下,待肿块体积>1 cm3时,观察131I-scFv在荷瘤裸鼠体内的分布情况,并进行放射免疫显像。
1.2.3131I-scFv在荷瘤裸鼠体内的分布 选取裸鼠8只,分为4组,每组2只。尾静脉注射50 μl131I-scFv(18.5 MBq),在注射后12、24、48、72 h处死4组裸鼠,取肿瘤、肝、肾、脾、心脏、肺、胃、肠、脑、肌肉、血液组织进行称重,用γ计数器进行放射性计数。根据公式(1)计算各组织每克组织的百分注射剂量率(%ID/g)。

1.2.4131I-scFv在荷瘤裸鼠的SPECT放射免疫显像 取提前用KI封闭好甲状腺的裸鼠4只,经水合氯醛腹腔麻醉后,尾静脉注射0.1 ml131I-scFv,俯卧位固定于木板上,注射后12、24、48、72 h进行SPECT静态显像测得肿瘤组织靶/非靶(T/NT)值,T/NT值是肿瘤部位与对侧相应部位放射性比值。肿瘤清晰显像时,SPECT/CT图像融合,观察裸鼠体内放射性浓聚。
2 结果
2.1131I-scFv的制备与纯化 运用氯胺T法成功用131I标记scFv,且收集标记液上Sephadex G25M柱纯化后获得100管淋洗液,检测每管放射性计数呈现2个放射峰,第一放射峰位于33~49管,第二放射峰位于57~64管,第一放射峰对应的收集管淋洗液即为纯化的131I-scFv标记液,见图1。采用三氯醋酸法测得标记率为91.64%,纸层析法测得放化纯度为(93.3±0.3)%,放射化学比活度为(3.38±0.64)MBq/µg。131I-scFv置于室温下1、6、12、24 h的放化纯度分别为95.9%、93.8%、92.5%、91.3%,见图2。131I-scFv与新鲜人血清孵育1、6、12、24 h的放化纯度分别为95.2%、94.5%、93.0%、91.9%,见图3。
2.2 荷人ATC裸鼠模型构建 成功构建荷人ATC裸鼠模型,且于4周时肿块长至1 cm。
2.3131I-scFv在荷瘤裸鼠体内分布情况131I-scFv在荷瘤裸鼠体内主要分布于肿瘤、肝、肾、脾、心脏、肺、胃、肠、脑、肌肉、血液组织,其中肿瘤组织、肝、肾、肠、血液在早期均有较高的放射性,见表1。
2.4131I-scFv荷瘤裸鼠SPECT/CT放射免疫显像 SPECT/CT显像结果显示在荷瘤裸鼠尾静脉注射131I-scFv 后48 h,荷瘤裸鼠肿瘤组织仍显像清晰,见图4。SPECT静态显像测得肿瘤组织T/NT值48 h最高为4.38,身体其他部位放射性浓聚明显降低,见图5。
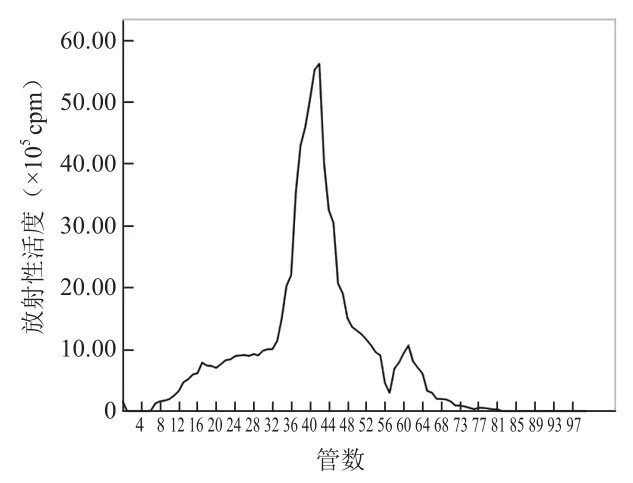
图1131I-scFv纯化
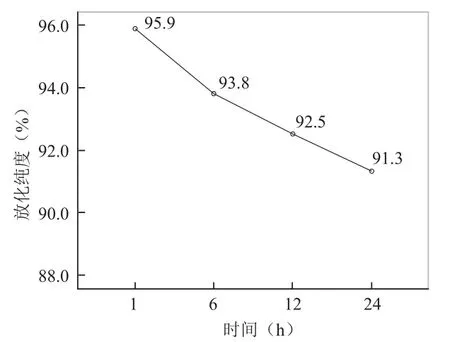
图2131I-scFv室温稳定性检测
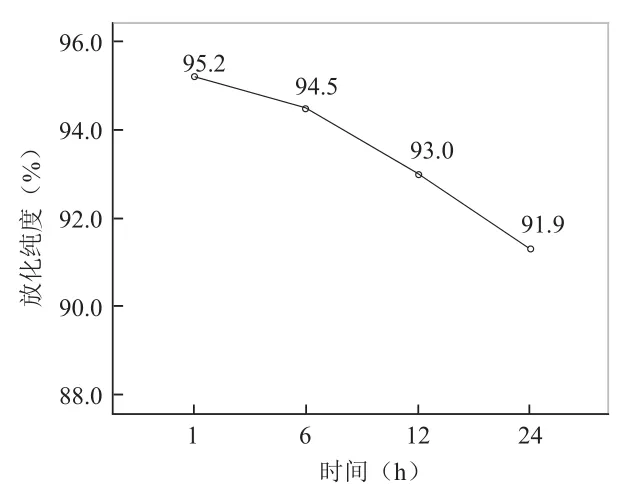
图3131I-scFv血清稳定性检测
表1131I-scFv在荷瘤裸鼠体内分布情况(±s,%ID/g)

表1131I-scFv在荷瘤裸鼠体内分布情况(±s,%ID/g)
部位12 h24 h48 h72 h肝9.92±0.314.57±0.232.97±0.691.32±0.33肾8.72±0.117.59±0.476.08±0.724.23±0.91肠6.57±0.724.32±0.643.32±0.530.96±0.32血液5.67±0.894.43±0.251.09±0.120.55±0.07脾5.32±0.573.29±0.581.72±0.370.56±0.20肿瘤4.47±0.564.31±0.724.01±0.663.23±0.09心脏4.05±0.071.98±0.200.87±0.220.40±0.02胃3.73±0.981.43±0.241.05±0.630.77±0.36肌肉3.08±0.281.59±0.390.65±0.320.54±0.65肺2.73±0.111.57±0.520.69±0.760.38±0.55脑1.56±0.110.89±0.120.73±0.260.37±0.08
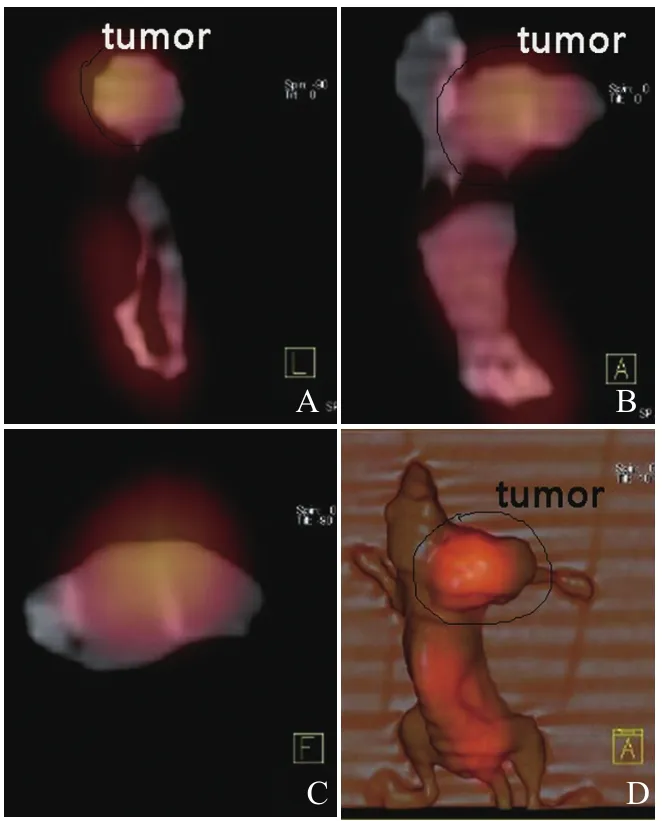
图4131I-scFv荷瘤裸鼠SPECT/CT融合显像(48 h),分别为矢状位(A)、冠状位(B)、横断面(C)及3D融合图像(D)

图5 注射131I-scFv后不同时间荷瘤裸鼠肿瘤组织SPECT静态显像
3 讨论
放射免疫显像是利用放射性核素耦联具有导向性的特异抗体制成放射免疫药物进行体外显像的方法,其优势是利用抗原、抗体特异性结合的原理,并与影像检查方法相结合,对肿瘤的早期定位、定性诊断具有十分重要的价值[5]。目前,放射免疫显像在临床上已经应用于不同系统肿瘤疾病的显像,包括骨骼系统、呼吸系统等[6-7],其良好的显像效果有助于疾病的诊断,Luo等[8]制备了肺腺癌的人源单链抗体,并在荷瘤裸鼠进行放射免疫显像。
本研究前期运用噬菌体展示技术,成功建立人源ATC噬菌体抗体库并筛选出特异性、可溶性的ATC抗体,对其生物学特性进行检测。本研究将131I标记的scFv注入荷ATC裸鼠体内,实现放射免疫显像。本研究将131I标记在抗体分子上,使ATC细胞间接吸碘,从而达到显像的目的。本研究结果显示,荷瘤裸鼠经尾静脉注射131I-scFv后48 h肿瘤显像清晰,同时T/NT值也在48 h最高,达4.38,提示该抗体对ATC细胞具有特异性。放射免疫显像的最终目的是探索放射免疫治疗方法,即利用放射性药物标记抗体后能特异性地与肿瘤抗原结合,针对性地破坏甚至杀死肿瘤细胞[9]。131I是目前临床上用于甲状腺疾病诊断及治疗的良好显像剂[10],将其与纯化的scFv结合,用于荷瘤裸鼠的显像,以期为ATC的诊断和治疗提供一种新的思路。本课题组将进一步研究131I-scFv与肿瘤药物耦联后注射入荷瘤裸鼠体内的抑瘤效果,探讨治疗ATC的新方法。
本研究的局限性:在进行131I-scFv在荷瘤裸鼠体内生物分布实验中,每组选取裸鼠2只,数量较少,可能会影响实验数据的可靠性,在后续实验中会增加裸鼠数量进行相关生物学分布的研究。显像早期,血液、肝脏、肾脏组织均具有较高的放射性浓聚,但是随着时间延长,上述部位的放射性浓聚显著降低。肾脏放射性浓聚高可能与标记抗体的排泄有关,肝脏高浓聚则可能是因为被网状内皮细胞非特异性摄取,或存在一些Fc受体[11-12]。因此,如何能够在设计scFv时对其进行一些化学修饰,减少肝脏等非肿瘤组织的放射性摄取,使其能够长时间停留于肿瘤组织,是以后需要重点完善的内容。
[1] Amodeo C, Caglià P, Gandolfo L, et al. Undifferentiated carcinoma of the thyroid. Tumori, 2003, 89(Suppl 4): 205-206.
[2] Vanden BP, Mcfadden DG, Gunda V, et al. The next generation of orthotopic thyroid cancer models: immunocompetent orthotopic mouse models of BRAFV600E-positive papillary and anaplastic thyroid carcinoma. Thyroid, 2014, 24(4): 705-714.
[3] Jo VY, Renshaw AA, Krane JF. Relative sensitivity of thyroid fi ne-needle aspiration by tumor type and size. Diagn Cytopathol, 2013, 41(10): 871-875.
[4] 奚级梅, 庞华, 张森, 等. 甲状腺未分化癌人源单链抗体库的构建及筛选. 免疫学杂志, 2015, 31(8): 692-696.
[5] Denaro N, Nigro CL, Russi EG, et al. The role of chemotherapy and latest emerging target therapies in anaplastic thyroid cancer. Onco Targets Ther, 2013, 9: 1231-1241.
[6] 杨敏星, 高宝祥, 陈翯, 等. 全身MRI在特发性炎性肌病中的应用. 中国医学影像学杂志, 2015, 23(5): 383-387.
[7] 唐勇, 曹林德, 杨鸿, 等. CT引导下中心型肺癌肺段支气管病变穿刺针吸活检. 中国医学影像学杂志, 2015, 23(3): 209-212.
[8] Luo Y, Pang H, Li SJ, et al. Production and radioimmunoimaging of novel fully human phage display recombinant antibodies and growth inhibition of lung adenocarcinoma cell line overexpressing Prx I. Cancer Biol Ther, 2009, 8(14): 1369-1377.
[9] 李淑杰, 罗弋, 庞华, 等.131I标记抗Peroxiredoxin I肺腺癌噬菌体抗体在荷瘤裸鼠体内的分布及其对肿瘤生长的抑制作用. 中国医科大学学报, 2010, 29(10): 790-793.
[10] Yu M, Zhou HZ, Liu XQ, et al. Study on biodistribution and imaging of radioiodinated arginine-arginine-leucine peptide in nude mice bearing human prostate carcinoma. Ann Nucl Med, 2010, 24(1): 13-19.
[11] 段东, 李少林, 朱玉泉, 等.99Tcm-EGFR-McAb及99Tcm-CD44-McAb单独及联合用于荷人肺腺癌裸鼠的显像研究.第三军医大学学报, 2009, 31(13): 1287-1290.
[12] 刘琼, 庞华, 李文波, 等.131I标记的抗甲状腺髓样癌人源单链抗体在荷瘤裸鼠的体内分布和放射免疫显像. 中国医学影像技术, 2016, 32(1): 3-7.
(本文编辑 饶亚岚)
Radioimmunoimaging of131I Labeled Human scFv Against Anaplastic Thyroid Carcinoma in Tumor Bearing Nude Mice
PurposeTo study the radioactive purity and activity of131I labeled human single chain variable fragments antibodies (scFv) against anaplastic thyroid carcinoma (ATC), and to explore its distribution and radioimmunoimaging characteristics in tumor bearing nude mice modelin vivoso as to provide a new method for anaplastic thyroid carcinoma diagnosis and treatment.Materials and MethodsThe nude mice model bearing human anaplastic thyroid carcinoma was constructed. The chloramine T method was used to label scFv with131I and the Sephadex G25M was used for puri fi cation of labeled scFv. Labeling rate was determined by trichloroacetic acid method; radiochemical purity, room temperature stability and serum stability were examined using paper chromatography.131I-scFv was injected via tail vein in mice, and the distribution of131I-scFv in body tissues and organs was analyzed at 12, 24, 48, 72 h after injection. Static SPECT imaging was performed at 12, 24, 48, 72 h after injection to observe the intratumoral accumulation of radioactivity. The SPECT/CT image fusion was performed when the tumor tissues were clearly visible.Results131I-scFv was purified, and the labeling rate was 91.64%; the radiochemical purity was (93.3±0.3)%. The radiochemical purity of131I-scFv placed at room temperature and the serum for 1, 6, 12, 24 h were all >90%. The radioactive distribution of131I-scFv in tumor, liver, kidney, intestine and blood was high. SPECT imaging showed131I-scFv was selectively concentrated in tumor tissue; the target/non-target ratio was the highest at 48 h, and the imaging was most satisfactory.Conclusion131I-scFv can be successfully prepared. SPECT imaging of131I-scFv in nude mice model is satisfactory, which lays the foundation for further research in ATC diagnosis and treatment.
Thyroid neoplasms; Carcinoma; Iodine radioisotopes; Single-chain antibodies; Radioimmunodetection; Tomography, emission-computed, single-photon; Tomography, X-ray computed; Disease models, animal; Mice, nude
重庆医科大学附属第一医院核医学科 重庆400016
庞 华
Department of Nuclear Medicine, the First Af fi liated Hospital of Chongqing Medical University, Chongqing 400016, China
Address Correspondence to:PANG Hua
E-mail: ph1973@163.com
国家自然科学基金(81071171);重庆市科技计划面上项目(CSCT2013JCYJA10072);国家临床重点专科建设项目(国卫办医函[2013]544号)。
R445.5;R736.1
2016-12-13
修回日期:2017-03-30
中国医学影像学杂志
2017年 第25卷 第5期:321-324
Chinese Journal of Medical Imaging
2017 Volume 25 (5): 321-324
10.3969/j.issn.1005-5185.2017.05.001
