超声造影定量评估失血性休克肝微循环灌注的实验研究
2017-06-01龙春艳
龙春艳
何晶玲1HE Jingling
魏 芳1WEI Fang
段琬璐1DUAN Wanlu
王莎莎2WANG Shasha
李叶阔2LI Yekuo
超声造影定量评估失血性休克肝微循环灌注的实验研究
龙春艳1LONG Chunyan
何晶玲1HE Jingling
魏 芳1WEI Fang
段琬璐1DUAN Wanlu
王莎莎2WANG Shasha
李叶阔2LI Yekuo
目的研究超声造影(CEUS)定量分析技术评估急性失血性休克(HS)肝微循环灌注的价值,探讨CEUS定量分析对HS诊断及治疗的意义。材料与方法选择60只健康成年新西兰大耳白兔,雌雄不限,按完全随机法平均分为3组,分别建立轻、中、重度HS模型。建模前及建模稳定30 min分别行肝CEUS检查,并储存原始图像。CEUS结束后采血检测乳酸、肝功能,并取肝组织行病理检查。脱机分析到达时间(AT)、达峰时间(TTP)、上升时间(RT)、峰值强度(PI)、曲线下面积(AUC)。结果与建模前比较,轻度HS组AUC降低,差异有统计学意义(P<0.05);与建模前比较,中、重度HS组TTP、RT均延迟,PI、AUC均降低,差异有统计学意义(P<0.05);轻、中、重度HS各组间TTP、RT、PI、AUC差异有统计学意义(P<0.05);与建模前比较,重度HS模型组AT延迟,差异有统计学意义(P<0.05);与建模前比较,各组乳酸均显著升高,肝功能指标均发生不同程度的改变,肝细胞病理改变程度与HS病变程度密切相关。结论CEUS可定量评估不同程度HS引发的肝微循环灌注改变。
休克,出血性;超声检查;造影剂;肝;微循环;血液灌注;疾病模型,动物;兔
失血性休克(hemorrhagic shock,HS)属于低血容量性休克。HS发生时,机体重点保证心、脑、肾等器官血流灌注,肝血流量灌注减少;而肝细胞对缺氧十分敏感,易导致急性肝衰竭[1]。因此,掌握HS时肝微循环灌注至关重要。核素显像、CT灌注成像、MRI灌注成像等可评估肝微循环灌注,但检查灵活性差、耗时长,在急救中应用受限。已有研究采用超声造影(CEUS)定量分析HS兔肾皮质血流灌注情况[2]。本研究拟在此基础上,应用CEUS定量分析技术进一步评估HS状态肝微循环灌注情况。
1 材料与方法
1.1 动物模型 健康新西兰大耳白兔60只(合格证号44007600003461),体重2.5~3.0 kg,雌雄不限,由广州军区广州总医院动物实验中心提供,并经该院实验动物伦理委员会批准。实验兔经耳缘静脉按1 ml/kg注射3%戊巴比妥钠进行麻醉,肝肾区备皮,仰卧位固定。注射200 U/kg肝素钠,经左侧颈动脉连接三通管,一端作为放血通道,另一端连接动物心电监护仪,监测动物平均动脉压(mean arterial pressure,MAP)。以建模前(100% MAP)为正常对照组,通过控制放血量建立定压型HS模型。60只大耳白兔随机分为3组,每组20只,分别建立轻度休克(70% MAP)、中度休克(50% MAP)及重度休克(40% MAP)3 个等级休克状态[3]。
1.2 设备及试剂 GE Logiq E9 超声诊断仪,配备低机械指数超声造影模式及TIC-Analysis软件,9L-D探头,频率6~9 MHz。动物心电监护仪,超声造影剂SonoVue(Bracco公司),3% 戊巴比妥钠(广州军区广州总医院超声科动物实验中心配置),肝素钠(江苏万邦生化医药股份有限公司,规格2 ml∶1.25 万U)。
1.3 CEUS检查 建模前及每个休克状态MAP稳定30 min后,沿兔右肋缘下纵切,选取肝肾切面,尽量避开肋骨及肝脏大血管[4]。在Smalls parts-TUZI条件下启动造影模式,实验过程中保持仪器设置固定。经兔耳缘静脉团注微泡浓度为2×108个/ml的SonoVue混悬液0.10 ml/kg,同时启动计时器,随即注入1 ml生理盐水冲管[5]。以DICOM格式存储100 s图像资料,采用GE TIC-Analysis 软件包分析,感兴趣区(ROI)设置为直径3 mm的圆形取样框,放置在与声束垂直的中心肝实质区,避开大血管,深度为1.5 cm[5-6]。采用双盲法,以伽马拟合方式获得肝实质灌注时间-强度曲线(time-intensity curves,TIC),分析参数到达时间(arrival time,AT)、达峰时间(time to peak,TTP)、上升时间(rising time,RT)、峰值强度(peak intensity,PI)、曲线下面积(area under the curve,AUC)[2]。
1.4 实验室及病理检查 建模前及每个HS模型造影结束立即采血,检测血清乳酸(lactic acid,LAC)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)及天门冬氨酸氨基转移酶(aspartate transaminase,AST)。每组随机抽选1只兔于建模前处死,立即取肝左叶及右叶组织标本;轻、中、重度HS每组随机抽选3只兔,于超声造影、采血后同法取肝组织标本,所有标本固定后行HE染色。
1.5 统计学方法 采用SPSS 19.0软件,计量资料多组间比较采用方差分析,两两比较采用LSD法。P<0.05表示差异有统计学意义。
2 结果
2.1 动物模型建立 3只实验兔于建模前处死并取肝组织病理标本,57只实验兔成功建立HS模型。实验结束时存活55只,2只死于重度休克。
2.2 超声造影结果 所有实验兔均顺利完成CEUS检查。在正常状态下,造影剂信号一般在数秒内到达肝实质,然后信号强度快速增强,一段时间后缓慢消退,TIC呈单峰,正常状态上升较陡直,到达峰值后出现短暂平台期,然后缓慢下降。随着休克程度加重,TIC上升及下降逐渐变缓,峰值逐渐降低,表现为TTP和RT逐渐延迟,PI和AUC逐渐降低,见图1。TIC参数分析:与建模前比较,轻度HS组AUC降低,差异有统计学意义(P<0.05);TTP、RT略有延迟,PI略有降低,差异无统计学意义(P>0.05)。与建模前比较,从中度HS开始,TTP、RT、PI、AUC差异均有统计学意义(P<0.05),且轻、中、重度HS组间比较差异均有统计学意义(P<0.05);与建模前比较,AT在轻度HS组及中度HS组延迟不明显(P>0.05),仅重度HS组延迟差异有统计学意义(P<0.05)。CEUS-TIC各参数统计结果见表1。

图1 实验兔不同休克等级的CEUS-TIC。A.正常状态;B.轻度休克;C.中度休克;D.重度休克,显示进入HS后,TIC上升及下降逐渐变缓,峰值逐渐降低
2.3 实验室结果 HS时LAC升高,与对照组相比,轻、中、重度HS组差异均有统计学意义(P<0.05),且轻、中、重度HS组间差异均有统计学意义(P<0.05)。与对照组相比,轻度HS组AST、ALT变化差异无统计学意义(P>0.05);中度HS组AST、ALT略有升高,但差异无统计学意义(P>0.05);重度HS组AST、ALT升高显著,差异有统计学意义(P<0.05)。见表2。
2.4 病理结果 在正常状态下,肝小叶结构完整,中央静脉可见,肝细胞排列规则,肝细胞未见水肿及坏死样病理改变。轻度HS病理表现无明显改变;中度HS肝细胞出现水肿,体积增大,肝小叶结构无明显改变;重度HS肝细胞水肿明显,体积明显增大,呈气球样改变,血窦有充血,小叶结构完整。见图2。
表1 实验兔不同休克等级组肝CEUS-TIC参数比较(±s)
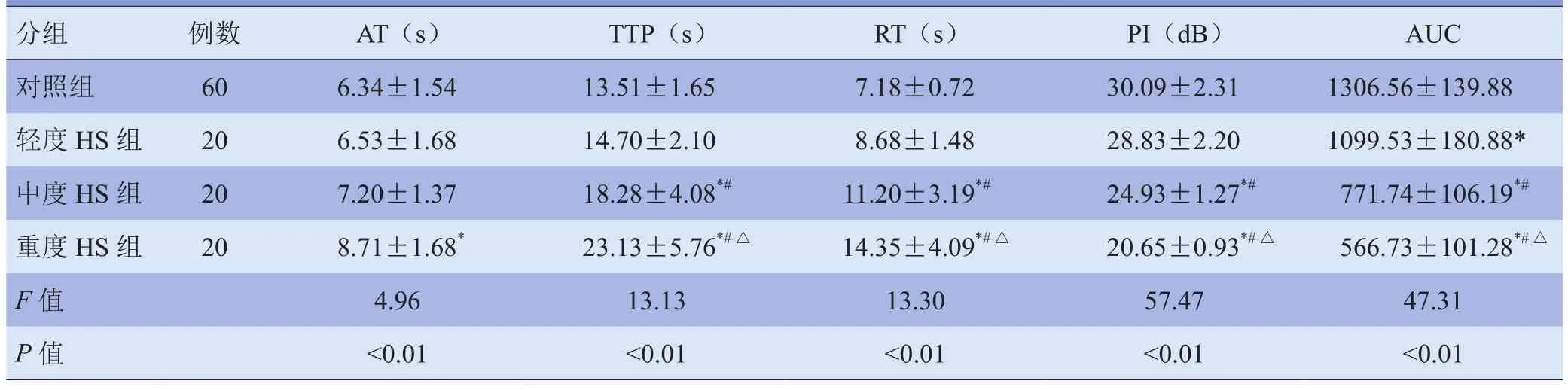
表1 实验兔不同休克等级组肝CEUS-TIC参数比较(±s)
注:与对照组比较,*P<0.05;与轻度HS组比较,#P<0.05;与中度HS组比较,△P<0.05
分组例数AT(s)TTP(s)RT(s)PI(dB)AUC对照组606.34±1.5413.51±1.657.18±0.7230.09±2.311306.56±139.88轻度HS组206.53±1.6814.70±2.108.68±1.4828.83±2.201099.53±180.88*中度HS组207.20±1.3718.28±4.08*#11.20±3.19*#24.93±1.27*#771.74±106.19*#重度HS组208.71±1.68*23.13±5.76*#△14.35±4.09*#△20.65±0.93*#△566.73±101.28*#△F值4.96 13.13 13.30 57.47 47.31P值<0.01<0.01 <0.01 <0.01 <0.01
表2 实验兔不同休克等级组LAC、ALT、AST水平比较(±s)
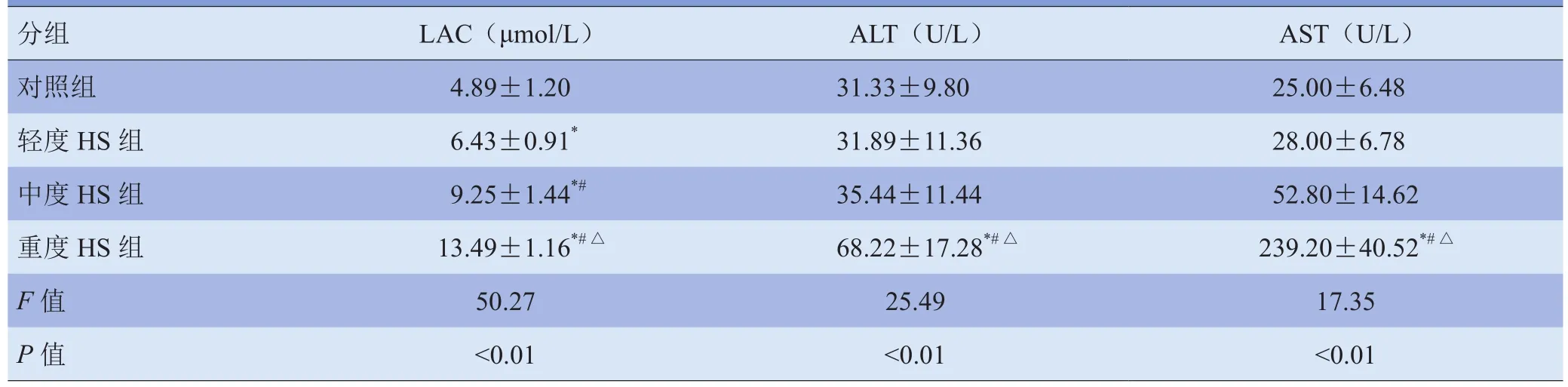
表2 实验兔不同休克等级组LAC、ALT、AST水平比较(±s)
注:与对照组比较,*P<0.05;与轻度HS组比较,#P<0.05;与中度HS组比较,△P<0.05
分组LAC(μmol/L)ALT(U/L)AST(U/L)对照组4.89±1.2031.33±9.8025.00±6.48轻度HS组6.43±0.91*31.89±11.3628.00±6.78中度HS组9.25±1.44*#35.44±11.4452.80±14.62重度HS组13.49±1.16*#△68.22±17.28*#△239.20±40.52*#△F值50.27 25.49 17.35P值<0.01<0.01 <0.01
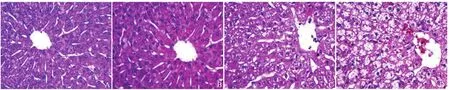
图2 实验兔不同休克等级病理结果对照(HE,×200)。正常状态下肝小叶结构完整,中央静脉可见,肝细胞排列规则(A);轻度休克与正常状态对比改变不明显(B);中度休克状态下肝细胞水肿,体积增大(C);重度休克状态下肝细胞水肿明显,呈气球样改变,血窦出血(D)
3 讨论
HS是外科最常见的休克类型之一,病死率较高。休克后并发内脏器官功能不全是导致死亡的重要原因。因此监测HS状态下组织器官的微循环灌注,对于HS的诊断及治疗具有重要的临床价值[7]。肝是HS时容易受损的器官之一,且肝功能的受损可进一步引发全身代谢紊乱、扩散性血管内凝血、多器官功能障碍综合征等,最终导致死亡[8]。因此,肝微循环灌注是HS期间临床重要的监测对象。CEUS可反映组织微循环灌注情况[9],但既往研究主要应用于肝脏肿瘤、肝硬化及肝再灌注损伤等方面,用于监测HS肝微循环灌注的研究报道较少。本研究应用CEUS定量分析技术,联合血生化及病理检查,探讨在不同休克程度时肝微循环灌注的变化规律及CEUS定量分析评估肝微循环灌注的应用价值。
本研究结果显示,与正常状态相比,HS发生时AT、TTP和RT延迟,PI和AUC降低,轻度HS时AUC差异显著,中度HS时TTP、RT、PI、AUC差异显著,重度HS时所有变量差异显著。轻度HS模型有效血容量降低,机体通过增加儿茶酚胺及肾素-血管紧张素的分泌等启动代偿机制,选择性收缩外周及内脏血管,肝血流量减少,开始进入低灌注状态,TIC综合参数AUC可敏感反映这一改变。中度及重度HS时机体代偿加剧,肝血流灌注进一步减少,缺血缺氧导致肝细胞及内皮细胞水肿,体积增大,突向肝窦造成阻塞,肝内发生血液瘀滞[10];血管内皮细胞损伤导致白细胞黏附增加,并激活血小板-凝血-抗纤溶系统,机体处于高凝血状态[11];缺血缺氧可损害肝功能,引起内毒素血症,加重代谢紊乱及酸中毒,使淤滞的血液在酸性环境中处于高凝状态,最终导致肝血流阻力增加,流速减慢,微循环灌注减少。反映血流速度的参数TTP、RT、AT及反映血容量的参数AUC、PI依次出现显著差异,从而证明了上述改变。对照本实验的病理结果,中度HS出现肝细胞水肿,重度HS肝细胞水肿加剧,血窦出血,TIC参数改变与病理改变一致;甚至轻度HS时,AUC先于病理检查出现显著改变。
本研究结果表明,TTP、RT、PI、AUC在轻、中、重度HS组间差异显著,表明TIC参数可对不同程度HS时肝的微循环灌注减少情况进行量化,有望为HS的分度诊断及治疗方案提供新的依据;而AT不敏感,仅重度HS有显著改变。刘锐洪等[2]报道,实验兔肾实质TIC分析,PI自轻度HS降低显著,AT自中度HS延迟显著,与本实验结论不一致,这可能与肝动脉缓冲效应机制维持肝总血流量的相对稳定有关。
本实验结果证实,动脉LAC浓度是反映组织缺氧的高度敏感指标。LAC增高常较其他休克征象先出现[13-14]。LAC自轻度HS升高显著,且所有组间差异均有统计学意义,表明LAC与急性HS及休克程度高度相关,TIC参数改变与LAC改变一致。但LAC作为机体缺氧的全身指标,不具有组织特异性。ALT、AST为临床常用的急性肝功能损害指标[15]。ALT主要存在于细胞质中,AST存在于细胞质及线粒体中。本实验结果显示,仅重度HS时,ALT及AST的升高差异有统计学意义,表明仅当肝微循环灌注减少到肝细胞出现明显损伤使ALT、AST大量释放入血时,才能被检测到,故具有一定的滞后性。
总之,CEUS定量分析技术能准确、客观评估不同程度HS时实验兔肝微循环灌注的改变并进行量化,与血乳酸变化一致,较病理及肝功能检查敏感,有望成为HS时监测器官微循环灌注的新方法。
[1] Bonanno FG. Hemorrhagic shock: the "physiology approach". J Emerg Trauma Shock, 2012, 5(4): 285-295.
[2] 刘锐洪, 李叶阔, 孙彬录, 等. 超声造影定量分析急性失血性休克肾血流灌注的实验研究. 中国医学影像学杂志, 2015, 23(9): 641-644.
[3] Fülöp A, Turóczi Z, Garbaisz D, et al. Experimental models of hemorrhagic shock: a review. Eur Surg Res, 2013, 50(2): 57-70.
[4] 周小峰. 超声造影定量分析兔肝缺血再灌注损伤微循环的变化. 南宁: 广西医科大学, 2015.
[5] 吴玉泉, 杨红, 何云, 等. 兔肝缺血再灌注损伤模型超声造影定量分析中参考感兴趣区的选取. 中国介入影像与治疗学, 2016, 13(1): 56-59.
[6] 蒋洁, 王金锐, 曲恩泽. 肝脏超声造影定量分析中的影响因素. 中国医学影技术, 2011, 27(8): 1621-1625.
[7] Angele MK, Schneider CP, Chaudry IH. Bench-to-bedside review: latest results in hemorrhagic shock. Crit Care, 2008, 12(4): 218.
[8] 赵志伶, 曹书华, 王勇强, 等. 血浆补体C5a预示创伤失血性休克大鼠肝脏损害严重性. 中华急诊医学杂志, 2011, 20(5): 498-501.
[9] 郭万学. 超声医学. 第6版. 北京: 人民军医出版社, 2011: 80-81.
[10] 熊成龙, 赫杰, 邬善敏, 等. 肝脏缺血再灌注损伤与肝微循环变化. 微循环学杂志, 1999, 9(2): 10-12.
[11] Morel N, Biais M, Delaunay F, et al. Erythrocytes and microvascular tone during acute traumatic haemorrhagic shock. Ann Fr Anesth Reanim, 2013, 32(5): 339-346.
[12] 吴在德, 吴肇汉. 外科学. 第6版. 北京: 人民卫生出版社, 2003: 44-72.
[13] 王伟, 张利远. 动态监测血乳酸水平对创伤失血性休克患者预后的评估. 临床医学工程, 2013, 20(5): 559-560.
[14] 刘勇胜. 急性创伤性休克患者血乳酸水平与预后的相关性研究. 中外医疗, 2014, 33(1): 1-2.
[15] 冯卢. 创伤失血性休克并发急性肝功能损害的临床分析.中国医药指南, 2014, 12(33): 19-20.
(本文编辑 闻 浩)
Quantitative Evaluation of Hepatic Microcirculation Perfusion in Hemorrhagic Shock by Contrast-enhanced Ultrasound
PurposeTo study the value of contrast-enhanced ultrasound (CEUS) quantitative technique in evaluating the perfusion of hepatic microcirculation in acute hemorrhagic shock (HS), and to investigate the value of CEUS quantitative analysis in HS diagnosis and treatment.Materials and MethodsSixty healthy adult New Zealand white rabbits of either gender were randomly divided into three groups for establishing mild, moderate and severe HS models, respectively. Before modeling and 30 min after stable modeling, liver CEUS examination was performed, and the original images were stored. Blood test of lactic acid, liver function, and liver biopsy for pathological examination were conducted after CEUS. Finally, the arrival time (AT), time to peak (TTP), rising time (RT), peak intensity (PI) and area under the curve (AUC) were analyzed offline.ResultsCompared with pre-modeling, AUC decreased in mild HS group (P<0.05); TTP and RT were delayed, but PI and AUC decreased in moderate and severe HS groups (allP<0.05); AT was delayed in severe HS group (P<0.05). The differences of TTP, RT, PI and AUC between the groups of mild, moderate and severe HS were signi fi cant (P<0.05). Compared with pre-modeling, lactic acid in three HS groups increased signi fi cantly, the liver function indexes were changed to different degrees, and the degree of liver cell pathological changes was closely related to the degree of HS.ConclusionCEUS can quantitatively evaluate the changes of hepatic microcirculation induced by HS at different degrees.
Shock, hemorrhagic; Ultrasonography; Contrast media; Liver; Microcirculation; Hemoperfusion; Disease models, animal; Rabbits
1.南方医科大学 广东广州 510010
2. 广州军区广州总医院超声科 广东广州510010
李叶阔
Department of Ultrasound, General Hospital of Guangzhou Military Command, Guangzhou 510010, China
Address Correspondence to:LI Yekuo
E-mail: yekuoli@163.com
广东省科技计划项目(2014A020212255);广东省自然科学基金项目(2016A030313611);全军医学科研“十二五”计划课题(CWS12J076)。
R445.1;R459.7
2016-12-13
修回日期:2017-01-19
中国医学影像学杂志
2017年 第25卷 第5期:325-328
Chinese Journal of Medical Imaging
2017 Volume 25 (5): 325-328
10.3969/j.issn.1005-5185.2017.05.002
