经颅电刺激对睡眠剥夺后脑局部一致性影响的fMRI表现
2017-06-01李继元
李继元
蔡喜平3CAI Xiping
周 璐4ZHOU Lu
邵永聪4SHAO Yongcong
经颅电刺激对睡眠剥夺后脑局部一致性影响的fMRI表现
李继元1,2LI Jiyuan
蔡喜平3CAI Xiping
周 璐4ZHOU Lu
邵永聪4SHAO Yongcong
目的运用功能磁共振成像(fMRI)观察24 h睡眠剥夺对脑局部一致性(ReHo)的影响,并初步探讨经颅电刺激对睡眠剥夺后脑ReHo变化的干预作用。资料与方法采用自身前后对照的研究设计,16例健康受试者参加试验,并分别在清醒状态、睡眠剥夺后及给予经颅电刺激(真刺激或假刺激)后进行静息态fMRI扫描,应用ReHo分析方法,计算全脑在不同状态下的ReHo值,并分析睡眠剥夺前后及睡眠剥夺后经颅电刺激(真、假刺激)组间的差异。结果与正常睡眠状态相比,睡眠剥夺后ReHo显著增加的脑区主要包括左侧中央前回、右侧中央后回、双侧颞叶及丘脑;下降的脑区主要包括右侧楔前叶、左侧枕上回、边缘叶及双侧角回、额上回、额中回。经颅电刺激作用于前额叶区域后,与假刺激组相比,真刺激组ReHo增加的脑区主要包括双侧楔前叶、角回以及右侧额、上中回;ReHo下降的脑区主要包括左侧额叶内侧面、右侧中央前回、海马旁回、黑质以及双侧颞叶、脑桥等。结论睡眠剥夺可引起大量脑区的ReHo发生改变。以经颅电刺激的方式刺激前额叶区域后,可使因睡眠剥夺引起ReHo降低的脑区得到改善,以双侧楔前叶/后扣带回皮质为主,表明经颅电刺激作用于前额叶区域能干预因睡眠剥夺引起的脑功能紊乱。
睡眠剥夺;磁共振成像;电刺激;静息态;脑
睡眠剥夺(sleep deprivation,SD)可引起人体一系列认知功能改变,如注意力、记忆及决策等。已有静息态功能磁共振成像(resting state function magnetic resonance imaging,rs-fMRI)研究表明SD后个体的脑神经活动——局部一致性(regional homogeneity,ReHo)会发生改变,而ReHo的异常升高或降低与局部神经元活动在时间方面的变化有关[1-4]。这种异常变化既可反映局部脑神经功能的活动异常,也可反映整个脑功能网络的调节紊乱。多年来研究人员一直寻求可对抗SD的措施包括药物措施以及非侵入式的物理刺激方法,希望能够使人在SD条件下维持认知功能,增长作业时间并提高作业效率。经颅电刺激作为一种新型非侵入性的脑刺激技术,已受到越来越多的关注[5];但针对SD后经颅电刺激(transcranial direct current stimulation,tDCS)对脑神经活动干预作用的功能磁共振成像(fMRI)研究鲜有报道。本研究将收集SD前后以及在SD后进行tDCS真假刺激后的rs-fMRI影像数据,从ReHo的角度分析静息态下SD前后正常人脑神经活动变化的fMRI表现,并初步探讨tDCS对SD后脑ReHo变化的干预作用,为未来tDCS治疗或改善睡眠障碍相关疾病提供依据。
1 资料与方法
1.1 研究对象 收集2016年4-7月第四军医大学西京医院的健康志愿者16例,其中男7例,女9例;年龄18~24岁,平均(20.94±1.73)岁。受试者均为右利手,视力或矫正视力正常,无MRI扫描禁忌证,无严重躯体疾病;经精神卫生筛选表及神经症筛选表排除个人精神疾病史,排除酒精依赖、药物依赖患者或近期有严重感染或手术者、妊娠或哺乳期妇女以及参加其他临床药物研究者;经瑞文检验智力正常(IQ≥110),匹兹堡睡眠质量指数(Pittsburgh sleep quality index,PSQI)测验得分<5分,表明受试者睡眠习惯良好。要求受试者在试验开始前1周及试验过程中不能摄入酒精、咖啡等刺激性食物、饮料,不参加剧烈、竞争性运动。本研究经第四军医大学伦理委员会批准,试验开始前向受试者详细说明试验流程及注意事项,所有受试者均自愿参加并签署知情同意书。
1.2 研究设计 试验采用自身对照设计,受试者分别参加2次试验,2次试验间隔3周,分别随机接受tDCS(真刺激或假刺激)。受试者于试验开始前1日15时进入实验室,完成生理、心理各项测试,22时后正常睡眠,于试验第1天7时起床后进行1次SD前rs-fMRI扫描,然后开始SD,剥夺时长为24 h,第2天7时再次进行SD后rs-fMRI扫描,扫描完成后给予tDCS(真刺激或假刺激),至9时再次进行rs-fMRI扫描后结束试验。3周后进行第2次试验。SD试验在专用睡眠实验室和医疗监护条件下进行,由主试人员全程陪伴,试验期间受试者不允许离开实验室。
1.3 仪器与方法 采用GE 3.0T MR 750Discovery成像设备及8通道专用头线圈采集MRI信号。受试者平躺于扫描床上,头部以海绵及绷带固定。在静息态扫描期间,要求受试者保持头部静止不动、闭眼不想任何事情。在扫描过程中同步记录受试者的心率和呼吸频率,用于在数据处理中去除心跳及呼吸对fMRI信号的影响。T1解剖像采用SE序列,扫描参数:TR 2000 ms,TE 9 ms,翻转角150°,层厚5 mm,层间距 1 mm,矩阵320×320。rs-fMRI采用回波平面成像序列,每个时间节点间隔采集45帧图像,210个时间节点,共计9450帧图像,采集参数:TR 2 s,TE 30 ms,视野256 mm×256 mm,层厚5 mm,层间距1 mm,翻转角90°,采集矩阵64×64。为保证受试者在MRI扫描期间保持清醒,在扫描前均通过麦克风提醒受试者,在扫描完成后询问扫描期间是否保持清醒并经受试者确认。
tDCS由德国NeuropathyConn公司生产的DC-TIMULATOR治疗仪提供,两电极片分别置于右侧前额部(阳极)及左侧乳突水平(阴极),电流大小为1 mA,真刺激每次作用时间为20 min,假刺激作用时间为20 s[3]。
1.4 fMRI数据预处理及ReHo分析 数据预处理过程基于Matlab 2010b软件,应用SPM 8软件对fMRI原始数据依次进行DICOM数据转换、时间校正、头动检查及校正、分割配准和空间标准化(T1解剖像),其中经过头动校正后得到每个受试者的水平头动及旋转头动图;参照头动校正曲线,剔除头动平移>1.5 mm和(或)旋转>1°的受试者。然后再将预处理得到的数据进行去线性漂移和低频滤波(0.01~0.08 Hz)处理。最后使用REST软件(http://www.restfmri.sourceforge.net)计算每个受试者的全脑ReHo图,并进行高斯平滑(4 mm×4 mm×4 mm)。
1.5 统计学方法 采用SPM 8软件,对SD前后及SD后真刺激及假刺激组进行重复测量的方差分析,设定对比差异(FWE校正,P<0.001),体素范围(K值)>20为差异显著。结果呈现采用REST及Xjview软件工具箱。
2 结果
经头动校正后发现有1名受试者不符合条件,予以剔除,其余受试者均未发现异常。
2.1 SD前后ReHo分析结果 与正常睡眠状态下相比,24 h SD后既有ReHo显著升高的脑区,也有ReHo显著降低的脑区。其中ReHo显著升高的脑区包括左侧中央前回、右侧中央后回、双侧颞叶及丘脑;显著降低的脑区包括右侧楔前叶、左侧枕上回、边缘叶及双侧角回、额上回、额中回。见表1、图1。
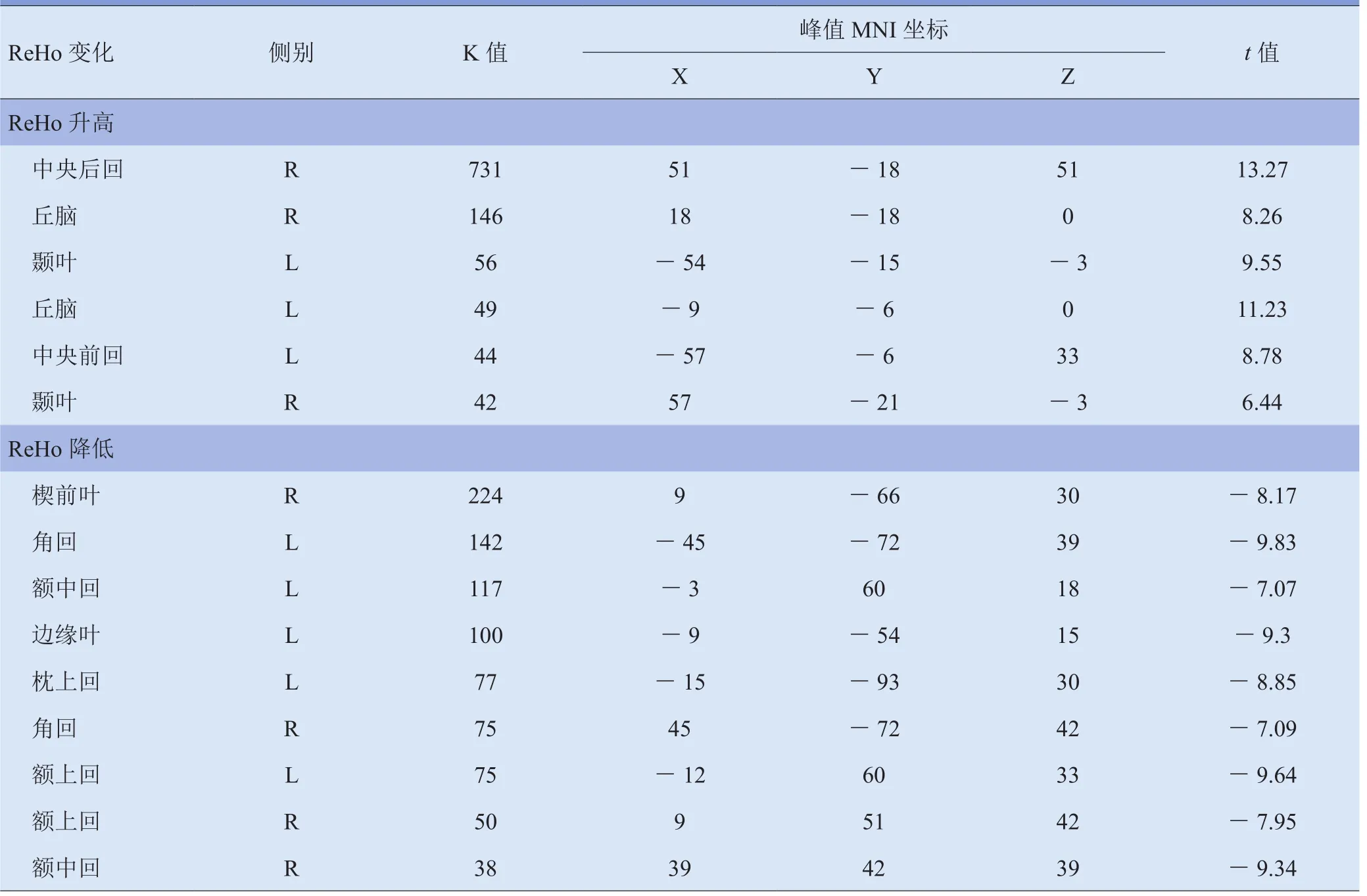
表1 24 h SD前后ReHo升高和降低的脑区
2.2 tDCS真、假刺激的ReHo模式差异 与SD后假刺激组比较,真刺激组ReHo显著升高的脑区主要为右侧额上、中回,双侧楔前叶及角回;ReHo显著降低的脑区主要为左侧额叶内侧面、右侧中央前回、海马旁回、黑质以及双侧颞叶、脑桥。见表2、图2。
3 讨论
本研究采用自身前后对照的试验设计,运用ReHo分析法观察24 h SD前后全脑ReHo的变化情况,并初步探讨tDCS刺激前额叶区域对SD后脑功能紊乱的干预作用。结果显示24 h SD可引起全脑多个脑区的ReHo改变。与正常睡眠状态相比, ReHo显著升高的脑区包括左侧中央前回、右侧中央后回、双侧颞叶及丘脑;显著降低的脑区包括右侧楔前叶、左侧枕上回、边缘叶及双侧角回、额上回、额中回,与既往研究结论一致[1,4-5]。进一步从功能定位的角度对SD前后ReHo增加或减低的脑区进行分析后可以发现,24 h SD后,脑内与信息加工处理密切相关的脑区ReHo明显增强。如主要负责听觉信息加工的颞叶皮质,主要负责感觉、运动信息加工的顶叶皮质,以及信息加工处理中枢——丘脑等。这些重要脑区在SD后出现的变化,可能为SD后引起相应认知、行为学改变的基础。另外,近期能量分配模型理论认为,SD与觉醒之间的转换伴随着个体能量分配的变化[6]。当工作时间延长时,机体需要分配更多的能量用于觉醒的维持。由于SD后机体认知能力下降,这些区域的ReHo增强反映了SD后机体对感觉加工能量分配的增加,说明机体需要更多的投入来保持对外界信息的觉知,而与此同时减少部分功能区的能量分配。
本研究还发现,与默认网络主要节点相关的区域在SD后ReHo出现下降。默认网络的脑区主要包括内侧前额叶皮质、后扣带回、角回等[7-10]。已有多项研究表明SD后默认网络的功能联络出现下降[11-15]。本研究从局部脑功能的角度支持这一结论。由于默认网络主要负责清醒状态的维持,尤其是内部稳态的维持,其功能联络的下降反映了机体在SD后脑网络功能调节的紊乱[16-17]。默认网络功能节点ReHo的降低也是机体需要将更多能量分配到感觉信息整合加工的一个佐证。

图1 SD前后主要脑区ReHo变化,图像左侧代表实际的右侧,其中暖色调代表ReHo升高的脑区,冷色调代表ReHo降低的脑区(A);激活脑区的三维图像(B)
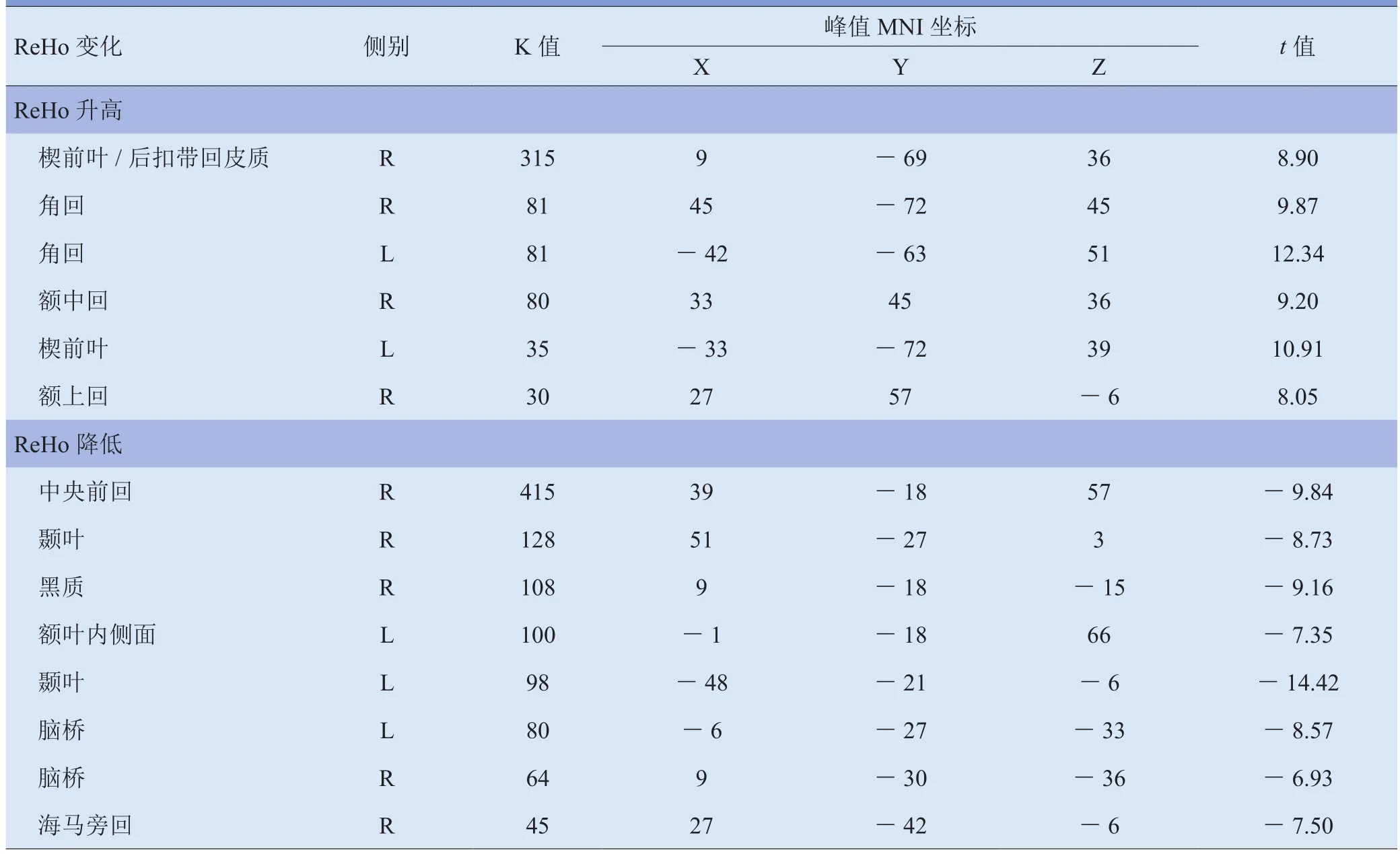
表2 24 h SD后tDCS真、假刺激组间ReHo升高和降低的脑区
本研究显示,在SD后出现ReHo降低的部分脑区,在给予tDCS后,其功能网络ReHo得到恢复,ReHo升高,如右侧额上、中回,双侧楔前叶及角回等,表明tDCS对SD后局部脑神经功能有一定的恢复作用。tDCS通过微弱的电流作用于大脑皮质,降低(阳极)或提高(阴极)神经元的静息膜电位的阈值,即阳极刺激可增加皮质兴奋性,提高脑神经功能水平[18];阴极刺激可降低皮质兴奋性[19]。可因电极片放置位置的不同而产生不同的效应。本研究的tDCS阳极位于右侧额部,作用于背外侧前额叶皮质,阴极置于后枕叶区域。试验中内侧前额叶皮质、楔前叶/后扣带回皮质的功能联系增强也可能与其在电流直接穿越的区域有关。
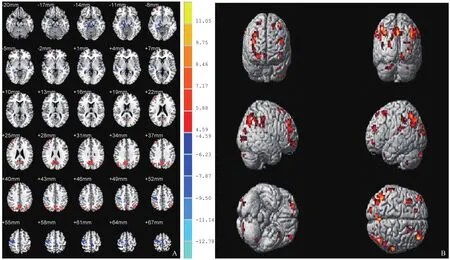
图2 SD后运用tDCS真/假刺激后脑区的ReHo变化,图像左侧代表实际的右侧,其中暖色调代表ReHo升高的脑区,冷色调代表ReHo降低的脑区(A);激活脑区的三维图(B)
本研究的局限性:①样本量偏小,由于个体对睡眠缺失的易感性不同,故SD后个体认知功能改变的差异性较大,因此需要更多的样本来增加统计推断的准确性;②因本研究只是tDCS对SD后脑内ReHo变化干预作用的初步研究,仅单纯运用了ReHo分析方法,未设计相关心理学量表来采集行为学资料。
总之,24 h SD能引起全脑广泛的ReHo变化,而tDCS刺激前额叶区域可有效干预部分SD所致ReHo下降的脑区,主要集中于双侧楔前叶/后扣带回皮质等区域。在未来的研究中将进一步扩大样本量,运用功能连接等分析方法,并同时结合相关行为学资料,进一步分析tDCS对SD引起脑功能紊乱的干预作用,为未来tDCS用于睡眠障碍类疾病的治疗提供依据。
[1] 戴西件, 龚洪翰, 闵友江, 等. fMRI观察静息状态下健康人睡眠剥夺前后脑局部一致性差异. 中国医学影像技术, 2012, 28(2): 243-246.
[2] 娄江华, 马丽佳, 李中林, 等. 基于实时功能磁共振神经反馈系统对初级运动皮层自主调节研究. 中国医学影像学杂志, 2016, 24(4): 241-244.
[3] Joyal M, Fecteau S. Transcranial direct current stimulation effects on semantic processing in healthy individuals. Brain Stimul, 2016, 9(5): 682-691.
[4] Verweij IM, Romeijn N, Smit DJ, et al. Sleep deprivation leads to a loss of functional connectivity in frontal brain regions. BMC Neurosci, 2014, 15(1): 88.
[5] Philip NS, Kuras YI, Valentine TR, et al. Regional homogeneity and resting state functional connectivity: associations with exposure to early life stress. Psychiatry Res, 2013, 214(3): 247-253.
[6] Schmidt MH. The energy allocation function of sleep: a unifying theory of sleep, torpor, and continuous wakefulness. Neurosci Biobehav Rev, 2014, 47: 122-153.
[7] 史丹丹, 陈莉, 罗天友, 等. 重性抑郁患者电休克治疗前后脑默认网络的静息态功能磁共振研究. 中国医学影像学杂志, 2016, 24(10): 721-724, 728.
[8] Mantini D, Gerits A, Nelissen K, et al. Default mode of brain function in monkeys. J Neurosci, 2011, 31(36): 12954-12962.
[9] 雷煜, 王路斌, 邵永聪, 等. 睡眠剥夺影响大脑情绪功能网络的静息态功能磁共振成像研究. 第三军医大学学报, 2015, 37(22): 2278-2284.
[10] Wang Y, Liu H, Hitchman G, et al. Module number of default mode network: inter-subject variability and effects of sleep deprivation. Brain Res, 2015, 1596: 69-78.
[11] Dai XJ, Liu CL, Zhou RL, et al. Long-term total sleep deprivation decreases the default spontaneous activity and connectivity pattern in healthy male subjects: a resting-state fMRI study. Neuropsychiatr Dis Treat, 2015, 11: 761-772.
[12] Connolly CG, Wu J, Ho TC, et al. Resting-state functional connectivity of subgenual anterior cingulate cortex in depressed adolescents. Biol Psychiatry, 2013, 74(12): 898-907.
[13] Shao Y, Wang L, Ye E, et al. Decreased thalamocortical functional connectivity after 36 hours of total sleep deprivation: evidence from resting state FMRI. PLoS One, 2013, 8(10): e78830.
[14] De Havas JA, Parimal S, Soon CS, et al. Sleep deprivation reduces default mode network connectivity and anti-correlation during rest and task performance. Neuroimage, 2012, 59(2): 1745-1751.
[15] 叶恩茂, 邵永聪, 毕国华, 等. 睡眠剥夺对静息态脑功能默认网络的影响. 南方医科大学学报, 2009, 29(12): 2523-2532.
[16] Shao Y, Lei Y, Wang L, et al. Altered resting-state amygdala functional connectivity after 36 hours of total sleep deprivation. PLoS One, 2014, 9(11): e112222.
[17] Bosch OG, Rihm JS, Scheidegger M, et al. Sleep deprivation increases dorsal nexus connectivity to the dorsolateral prefrontal cortex in humans. Proc Natl Acad Sci U S A, 2013, 110(48): 19597-19602.
[18] Liebetanz D, Nitsche MA, Tergau F, et al. Pharmacological approach to the mechanisms of transcranial DC-stimulationinduced after-effects of human motor cortex excitability. Brain, 2002, 125(Pt 10): 2238-2247.
[19] Nitsche MA, Paulus W. Excitability changes induced in the human motor cortex by weak transcranial direct current stimulation. J Physiol, 2000, 527(Pt 3): 633-639.
(本文编辑 周立波)
Effect of Transcranial Direct Current Stimulation on Regional Homogeneity After Sleep Deprivation by fMRI
PurposeTo observe the impact of sleep deprivation (SD) for 24 hours on human brain regional homogeneity (ReHo) by using functional magnetic resonance imaging (fMRI), and briefly discuss the intervening effect of transcranial direct current stimulation (tDCS) on ReHo after SD.Materials and MethodsSixteen healthy individuals were enrolled, and self-controlled study were adopted. Resting-state fMRI scans were performed in wakefulness, after SD, and after tDCS (true or placebo stimuli). The ReHo analysis approach was employed to calculate the ReHo values of whole brain in different states. The differences between before and after SD, and between true and false tDCS after SD, were analyzed.ResultsCompared with wakefulness, SD mainly enhanced ReHo in brain regions of left precentral gyrus, right precentral gyrus, bilateral temporal lobe and thalamus, but decreased ReHo in brain regions of right precuneus, left superior occipital gyrus, limbic lobe and bilateral angular gyrus, superior frontal gyrus, middle frontal gyrus. Compared with placebo stimuli, the true tDCS enhanced ReHo in brain regions of bilateral precuneus, angular gyrus and right forehead, superior middle gyrus, but decreased ReHo in brain regions of the medial side of left frontal lobe, right precentral gyrus, parahippocampal gyrus, substantia nigra and bilateral temporal lobe, pons and so on.ConclusionSD can cause ReHo change in a large number of brain regions. The tDCS on the prefrontal cortex improves the brain regions with ReHo reduction caused by SD. The improved brain regions mainly include bilateral precuneus/posterior cingulate cortex. Therefore, tDCS on the prefrontal cortex can improve brain dysfunction caused by SD.
Sleep deprivation; Magnetic resonance imaging; Electric stimulation; Resting-state; Brain
1.安徽医科大学 安徽合肥 230032
2. 中国人民解放军空军总医院CT&磁共振室北京 100142
3.陆军总医院神经内科 北京 100700
4. 军事医学科学院基础医学研究所 北京100010
邵永聪
Beijing Institute of Basic Medical Sciences, Cognitive and Mental Health Research Center, Beijing 100010, China
Address Correspondence to:SHAO Yongcong
E-mail: budeshao@aliyun.com
全军“十二五”重大项目(AWS14J011)。
R454.1;R445.2
2016-10-10
修回日期:2016-12-22
中国医学影像学杂志
2017年 第25卷 第5期:335-339,343
Chinese Journal of Medical Imaging
2017 Volume 25 (5): 335-339, 343
10.3969/j.issn.1005-5185.2017.05.004
