脊髓β-内啡肽参与大麻素2型受体激动剂调节的癌痛吗啡耐受
2017-06-01张明月张招娣王国年
张明月张招娣王国年,
作者单位:150081 哈尔滨1哈尔滨医科大学附属肿瘤医院麻醉科;2黑龙江医学科学院疼痛研究所
脊髓β-内啡肽参与大麻素2型受体激动剂调节的癌痛吗啡耐受
张明月1张招娣2王国年1,2
作者单位:150081 哈尔滨1哈尔滨医科大学附属肿瘤医院麻醉科;2黑龙江医学科学院疼痛研究所
目的 探讨脊髓β-内啡肽是否参与大麻素2型(cannabinoid type 2 receptor,CB2)受体调节的癌症疼痛(以下简称“癌痛”)吗啡耐受。方法 采用Walker 256乳腺癌细胞注射到大鼠右后侧脚掌趾部建立癌痛模型。荷瘤大鼠随机分为6组,每组6只。按需要分别接受鞘内注射CB2受体激动剂、拮抗剂、皮下吗啡注射或联合给药,每天早晚两次,持续8 d。每天早上给药后30min应用von Frey纤维丝和热平板实验评估大鼠的机械性疼痛阈值和热刺激回缩潜伏期。采用酶联免疫吸附试验(enzyme-linked immunoabsorbent assay,ELISA)检测脊髓β-内啡肽表达水平。结果 慢性吗啡治疗可降低荷瘤大鼠机械性疼痛阈值和热疼痛阈值。相对于空白对照组,慢性吗啡治疗可下调脊髓β-内啡肽表达水平[(5.24±1.41)ng vs(12.46±3.50)ng,P<0.01]。共同给予非镇痛剂量的CB2受体激动剂8 d可明显抑制吗啡所引起的机械性疼痛[(19.33±3.36)g vs(9.5±1.07)g,P<0.01]和降低热疼痛阈值[(21.83±2.89)s vs(9.5±2.01)s,P<0.01],同时抑制脊髓β-内啡肽表达下调[(10.11±2.08)ng vs(5.24±1.41)ng,P<0.05]。结论 鞘内注射非镇痛剂量的CB2受体激动剂可能通过抑制吗啡诱导的脊髓β-内啡肽表达下调而调节癌痛吗啡耐受。
癌症疼痛;吗啡耐受;大麻素2型受体;β-内啡肽
疼痛是影响癌症患者生活质量的主要因素,约一半癌症患者经历中到重度疼痛,其中部分患者在癌症转移以及疾病发展过程中要经历剧烈的疼痛[1-2]。吗啡是治疗癌症疼痛(以下简称“癌痛”)的常用药物,但阿片耐受妨碍了吗啡的临床止痛效能,因此需在疾病的发展过程中增加药量控制疼痛。尽管许多研究尝试阐明吗啡耐受机制,但其分子及细胞机制仍未十分明确。
大麻素2型受体(cannabinoid type 2 receptor,CB2)属于G蛋白偶联受体家族,表达于脊髓及背根神经节神经胶质细胞[1-4]、中枢及外周神经元[2,5-6]。我们前期研究表明,非镇痛剂量的CB2受体激动剂可减轻癌痛大鼠的吗啡耐受[7],但是其机制仍有待进一步研究。
吗啡主要作用于Mu-阿片受体(m u opioid receptor,MOR),受体内化被认为是阿片受体脱敏的关键性环节,受体内化后重新整合于细胞膜是使受体重新敏感的关键[8-9]。已有实验证实吗啡不具有促进MOR内化作用,可使受体持续接受刺激而发生适应性改变,从而导致受体敏感性降低发生脱敏而产生吗啡耐受[10]。伤害性刺激导致的内源性阿片肽的释放能诱导中枢及外周MOR的内化[11-12],从而减轻吗啡耐受。已有研究报道CB2受体激动剂AM1241可诱导β-内啡肽释放[13],同时,电针刺激可通过激动CB2受体而上调β-内啡肽表达[14]。因此,我们推测CB2受体激动剂可减轻癌痛吗啡耐受,而此作用可能与上调β-内啡肽表达,从而促进MOR内化有关。本实验应用非镇痛剂量的CB2受体激动剂AM1241及选择性的CB2受体拮抗剂AM630,评价CB2受体激动剂对癌痛吗啡耐受大鼠脊髓β-内啡肽表达的影响,以探讨其是否参与CB2受体激动剂调节的癌痛吗啡耐受。
1 材料与方法
1.1 实验动物
成年雄性Wistar大鼠,SPF级,体重160~180 g,由长春市亿斯实验动物技术有限责任公司提供,共36只,每组4只饲养于笼内,自由进食水,光照与熄灯各12 h,温度维持在(21±1)℃,保持环境安静及最小外界刺激。动物在实验前适应环境1周,操作均由固定人员在8∶00~14∶00进行。动物的处理符合美国国立卫生研究院(n ational i nstitutes of h ealth,NIH)及哈尔滨医科大学动物管理规定的实验动物使用准则。
1.2 癌痛模型的建立
Walker 256乳腺癌细胞以1×107个大鼠腹膜内注射,5 d后抽取腹水,离心后去上清液,细胞团用磷酸盐缓冲盐水(phosphate-buffered saline,PBS,pH7.4)稀释,使细胞悬液达106/100μL。青霉素(120 000单位/ 10 mL细胞悬液)加入细胞悬液中避免微生物污染。100μLWalker 256乳腺癌细胞悬液注入雄性大鼠右侧脚掌趾部[15]。
1.3 动物行为学指标检测
1.3.1 机械性疼痛阈值 机械性疼痛阈值通过标准化von Frey纤维丝(s toelting,w ood d ale,IL)测痛方法测量。将大鼠分别放入底面为金属丝网编织的透明塑料容器中(15 cm3×20 cm3×12 cm3),室温(21±1)℃适应15min。von Frey纤维丝刺激大鼠右侧脚掌中部(起始强度4.0 g,强度范围1.0~60 g),使纤维弯曲成S形,持续6~8 s,如出现阳性反应(突然抬起、舔舐或移开所刺激的后足)则降低一个刺激强度;如为阴性反应,则增加一个刺激强度,直至出现阳性反应。测定3次缩足阳性反应强度值,以平均值代表机械性疼痛阈值[16]。1.3.2 热疼痛阈值 热平板实验测量大鼠后爪热缩足潜伏期。大鼠分别放在52℃热平板上,记录大鼠从接触平板到舔舐后爪或蹦起的时间间隔。为防止组织损伤,设定热板加热最长时间为30 s,若30 s后大鼠仍末出现阳性反应,则记录为30 s。重复测量3次出现阳性反应的时间间隔,每次测量间隔5~10 min,取3次测量的平均值代表热疼痛阈值。
1.4 动物分组及处理
Walker 256乳腺癌细胞种植5 d后,将荷瘤大鼠按计算机产生的随机数字编号随机分为6组,每组6只。CB2受体激动剂AM1241与拮抗剂AM630分别溶于50%二甲基亚砜中进行鞘内注射。空白对照组鞘内注射药物溶剂(20μL 50%二甲基亚砜)和皮下注射生理盐水,吗啡组鞘内注射药物溶剂(20μL 50%二甲基亚砜)和10 mg/(kg·mL)-1吗啡;AM1241处理组鞘内注射0.07μg AM1241,同时皮下注射吗啡;AM630处理组鞘内注射10μg AM630,同时鞘内注射AM1241和皮下注射吗啡;AM1241对照组鞘内注射0.07μgAM1241;AM630对照组鞘内注射10μgAM630。接种肿瘤细胞5 d后给予药物治疗,药物治疗第一天记为d1,每天8∶00和20∶00各治疗1次,连续给予8 d(d1~8);AM630先于AM1241 30 min注射,AM1241先于吗啡30 min注射。分别在第一天给药前及每天上午吗啡注射后30min进行行为学指标检测。
1.5 酶联免疫吸附试验检测脊髓β-内啡肽的表达
采用酶联免疫吸附试验(enzyme-linked immunoabsorbentassay,ELISA)检测脊髓腰3-腰5节段β-内啡肽的表达水平。组织经PBS(0.02mol/L,pH 7.0~7.2)冲洗后剪碎放入2 mL EP管中,加入100μL PBS,均浆器将组织研碎,再加入100~160μL PBS混匀。将组织匀浆液放入液氮20 s,然后放入37℃水浴箱20 s,再放入液氮中,如此反复3次,充分裂解细胞。然后置于4℃1 500 r/min离心15min,取上清液待检测。
1.6 统计学处理
采用SPSS 22.0统计学软件对数据进行统计学分析,所有数据以均数±标准差(±s)表示。行为学指标数据采用重复测量双因素方差分析,多重比较采用Bonferroni检验;其余结果采用单因素方差分析,多重比较采用Bonferroni检验。以P<0.05为差异有统计学意义。
2 结果
2.1 AM1241对吗啡治疗癌痛大鼠机械性刺激痛阈的影响
注射吗啡可明显增加癌痛大鼠后爪的机械性疼痛阈值。AM1241处理组的吗啡效能在第1天和第2天与吗啡组无明显差别,但第3天开始AM1241处理组的吗啡效能明显高于吗啡组[(48.67±10.14)g vs(38.28±4.66)g,P<0.05]。尽管AM1241处理组吗啡效能在随后的几天进行性下降,但至第8天仍明显高于吗啡组[(19.33±3.36)g vs(9.5±1.07)g,P<0.001,图1A]。通过计算机械性疼痛阈值与时间围成的曲线下面积(area under the curve,AUC),发现AM630预先治疗可废除AM1241对吗啡治疗癌痛效能的调节作用(图1B)。单独给予AM1241或AM630对癌诱发的机械性疼痛阈值无明显影响(图1B)。
2.2 AM1241对吗啡治疗癌痛大鼠后爪热刺激回缩潜伏期的影响
吗啡组可明显增加癌痛大鼠后爪的热刺激回缩潜伏期,但是其效能呈进行性下降,第7天时,吗啡组热刺激回缩潜伏期与空白对照组已无明显差别[(12.64± 2.83)s vs(8.85±1.83)s,图2A)],表明癌痛大鼠出现吗啡耐受。AM1241处理组的吗啡效能在第1天至第5天与吗啡组无明显差别。从第6天开始,AM1241处理组吗啡止痛效能明显高于吗啡组[(27.23±1.94)s vs(15.47±3.79)s,P<0.001)]。第8天时,相对于吗啡组,AM1241处理组吗啡注射后仍产生明显的止痛效能[(21.83±2.89)s vs(9.5±2.01)s,P<0.001)]。通过计算AUC,得出AM630预先治疗可废除AM1241对吗啡抗热痛觉过敏作用(图2B)。单独给予AM1241或AM630对癌诱发的热痛觉过敏无明显影响(图2B)。
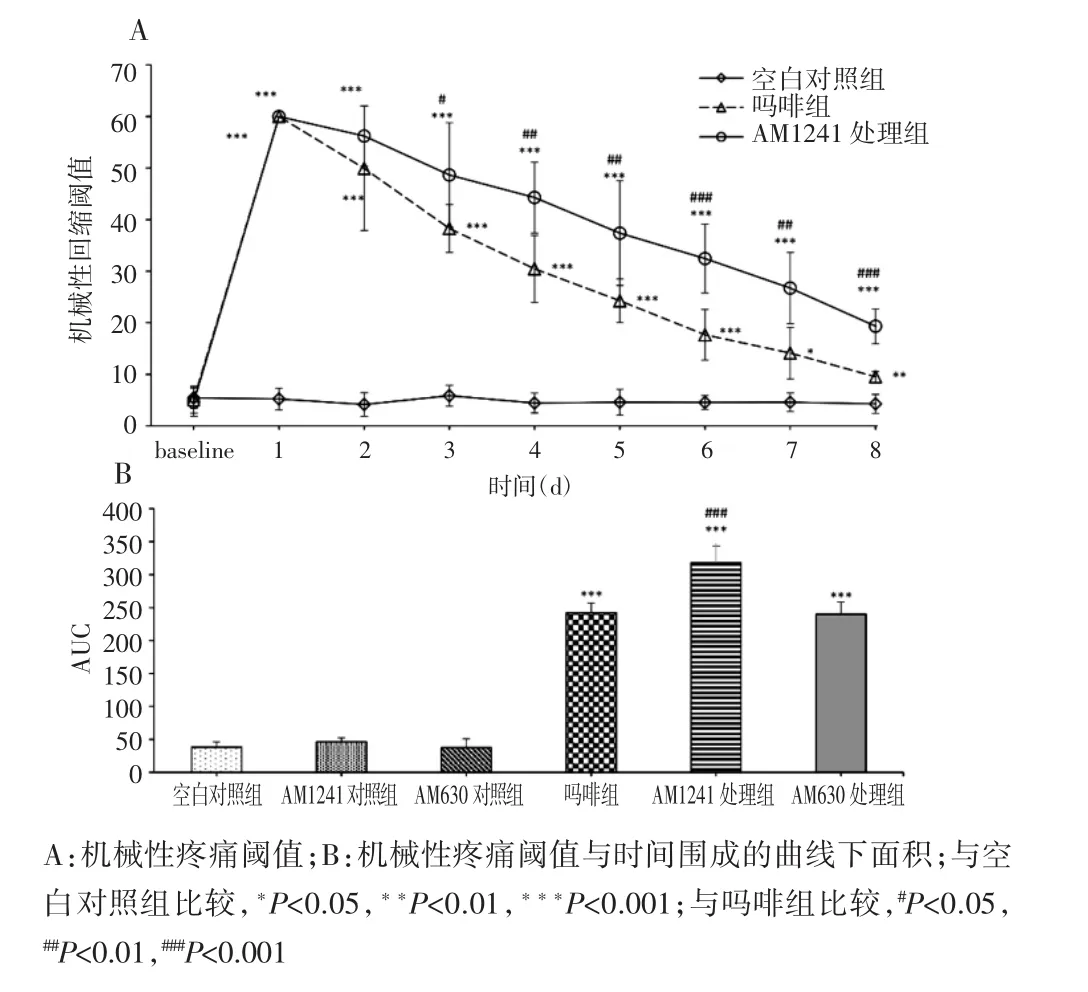
图1 AM 1241对吗啡治疗癌痛大鼠机械性刺激痛阈的影响
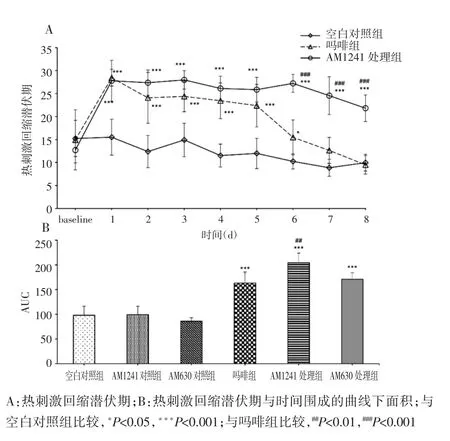
图2 AM 1241对吗啡治疗癌痛大鼠后爪热刺激回缩潜伏期的影响
2.3 AM1241对吗啡治疗癌痛大鼠脊髓β-内啡肽表达的影响
ELISA检测肿瘤种植同侧脊髓β-内啡肽表达水平。相对于空白对照组,持续8 d的吗啡治疗(吗啡组)可明显降低脊髓β-内啡肽表达水平[(12.46±3.50)n g vs(5.24±1.41)n g,P<0.001]。而AM1241预先治疗(AM1241处理组)可明显抑制慢性吗啡治疗所引起的脊髓β-内啡肽表达下调[(10.11±2.08)n g vs(5.24± 1.41)n g,P<0.005]。AM630先于AM1241 30min注射可废除AM1241对脊髓β-内啡肽表达的调节作用。见图3。
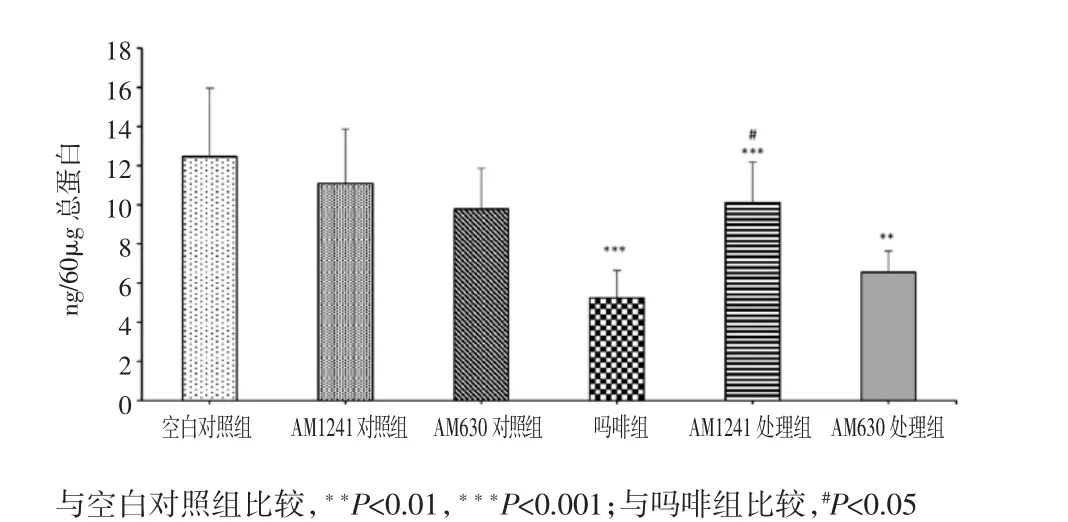
图3 AM 1241对吗啡治疗癌痛大鼠脊髓β-内啡肽表达的影响
3 讨论
本实验通过测量癌痛大鼠后爪机械性疼痛阈值和热刺激回缩潜伏期证实鞘内注射非镇痛剂量的CB2受体激动剂AM1241能够增强吗啡镇痛并抑制吗啡耐受,这一结果与我们前期的研究结果一致[7],进一步证实了CB2受体激动剂在癌痛吗啡耐受中的作用。另外,本研究发现,CB2受体激动剂可抑制吗啡所引起的脊髓β-内啡肽表达下调,而CB2受体拮抗剂AM630可废除AM1241对脊髓β-内啡肽的调节作用。这一结果提示CB2受体参与癌痛吗啡耐受可能与抑制β-内啡肽的下调有关。
研究报道,长期应用吗啡引起阿片受体的适应性改变参与吗啡耐受的形成[17-18]。适应性改变发生在中枢神经系统的不同水平,从受体及细胞的改变到不同神经元网络功能的改变[19-20]。这种发生在受体水平的改变导致信号的有效性逐步减弱,导致对阿片类药物的敏感性降低,即脱敏感。在受体重新敏感的过程中,受体内化整理后重新表达于膜表面是一个重要的步骤。而吗啡不具有使MOR受体内化的作用,这一观点已在转基因小鼠实验中证实。利用转基因技术,用对吗啡刺激可产生快速内化作用的突变体MOR代替野生型MOR,发现吗啡治疗5 d后,吗啡效能在野生型小鼠基本丧失,即产生吗啡耐受[10]。说明MOR受体的内化、整合、再敏感的过程可能参与吗啡耐受的形成。因此,促进MOR的内化可减轻吗啡耐受。已有实验证实,内源性阿片肽如β-内啡肽的释放可诱导中枢及外周MOR的内化[11-12]。而CB2受体激动剂AM1241可诱导人类角质细胞β-内啡肽释放,并能刺激大鼠皮肤组织释放β-内啡肽[13]。同时,在炎症疼痛模型中,电针刺激可通过激动CB2受体而上调β-内啡肽表达[14]。本研究检测了癌痛大鼠持续8 d吗啡治疗后其脊髓β-内啡肽表达情况,ELISA结果显示,吗啡治疗后脊髓β-内啡肽表达下调,提示其可能参与了吗啡耐受的形成。此外,还发现CB2受体激动剂AM1241预先给药后可抑制吗啡导致的脊髓β-内啡肽表达下调,因此推测,CB2受体激动剂可能通过上调β-内啡肽的表达,从而促进MOR内化而达到减轻吗啡耐受的目的。
综上所述,本实验结果显示CB2受体激动剂参与癌痛吗啡耐受可能通过增加脊髓β-内啡肽表达实现。但是,其细胞及神经生理学机制尚不明确,这是下一步研究的方向。尽管一些国家已允许大麻素制剂用于癌症引起的神经性疼痛[21],但是大麻素用于治疗慢性疼痛的研究大部分仍处于临床前阶段[22],因此,大麻素药物仍具有广阔的应用前景。本实验研究结果可为应用CB2受体激动剂加强吗啡止痛从而治疗严重疼痛,减少吗啡使用剂量及副作用提供新的药理学途径。
[1] MarcusDA.Epidemiologyofcancerpain[J].CurrPain HeadacheRep,2011,15(4):231-234.
[2] Goudas LC,Bloch R,Gialeli-Goudas M,et al.The epidemiology of cancer pain[J].Cancer Invest,2005,23(2):182-190.
[3] Balding L.The World Health Organisation analgesic ladder:its place in modern lrish medical practice[J].Ir Med J,2013,106(4):122-124.
[4] Gaertner J,Schiessl C.Cancer painmanagement:what’s new?[J].Curr Pain Headache Rep,2013,17(4):328.
[5] Schmidt BL,Hamamoto DT,Simone DA,et al.Mechanisms of cancer pain[J].Mol Interv,2010,10(3):164-178.
[6] SchweiMJ,Honore P,Rogers SD,et al.Neurochemical and cellular reorganization of the spinal cord in amurinemodel of bone cancer pain[J].JNeurosci,1999,19(24):10886-10897.
[7] ZhangM,Wang K,MaM,etal.Low-dose cannabinoid type2 receptor agonist attenuates tolerance to repeated morphine administration via regulatingμ-opioid receptor expression inWalker 256 tumor-bearing rats[J].Anesth Analg,2016,122(4):1031-1037.
[8] Bohn LM,Dykstra LA,Lefkowitz RJ,et al.Relative opioid efficacy is determined by the complements of the G protein-coupled receptor desensitization machinery[J].Mol Pharmacol,2004,66(1):106-112.
[9] Koch T,WideraA,Bartzsch K,etal.Receptorendocytosiscounteracts the developmentofopioid tolerance[J].Mol Pharmacol,2005,67(1):280-287.
[10]Nagi K,Pi n eyro G.Regulation of opioid receptor signalling:implications for the development of analgesic tolerance[J].Mol Brain,2011,4:25.
[11]Zollner C,Mousa SA,Fischer O,et al.Chronic morphine use does notinduceperipheral tolerance in a ratmodelof inflammatory pain[J].JClin Invest,2008,118(3):1065-1073.
[12]ChenW,Marvizón JC.Acuteinflammation inducessegmental,bilateral,supraspinally mediated opioid release in the rat spinal cord,as measured by mu-opioid receptor internalization[J].Neuroscience,2009,161(1):157-172.
[13]Ibrahim MM,Porreca F,LaiJ,etal.CB2 cannabinoid receptoractivation produces antinociception by stimulating peripheral release of endogen-ous opioids[J].Proc Natl Acad Sci USA,2005,102(8):3093-
3098.
[14]Su TF,Zhang LH,Peng M,et al.Cannabinoid CB2 receptors contribute to upregulation ofβ-endorphin in inflamed skin tissues by electroacupuncture[J].Mol Pain,2011,7:98.
[15]Brigatte P,Sampaio SC,Gutierrez VP,et al.Walker 256 tumorbearing rats as amodel to study cancer pain[J].JPain,2007,8(5):412-421.
[16]Chaplan SR,Bach FW,Pogrel JW,etal.Quantitative assessmentof tactile allodynia in the rat paw[J].JNeurosciMethods,1994,53(1):55-63.
[17]Gainetdinov RR,Premont RT,Bohn LM,et al.Desensitization of G protein-coupled receptors and neuronal functions[J].Annu Rev Neurosci,2004,27:107-144.
[18]Martini L,Whistler JL.The role ofmu opioid receptor desensitization and endocytosis in morphine tolerance and dependence[J].Curr Opin Neurobiol,2007,17(5):556-564.
[19]Ko SW,Wu LJ,Shum F,et al.Cingulate NMDA NR2B receptors contribute to morphine-induced analgesic tolerance[J].Mol Brain,2008,1:2.
[20]Christie MJ.Cellular neuroadaptations to chronic opioids:tolerance,
withdrawal and addiction[J].Br JPharmacol,2008,154(2):384-396.[21]Schug SA,Chandrasena C.Painmanagementof the cancer patient[J].
Expert Opin Pharmacother,2015,16(1):5-15.
[22]Dhopeshwarkar A,Mackie K.CB2 Cannabinoid receptors as a therapeutic target-what does the future hold?[J].Mol Pharmacol,2014,86(4):430-437.
[2016-12-08收稿][2017-02-10修回][编辑 罗惠予]
·麻醉镇痛与肿瘤专栏·
基础研究
Involvement ofβ-endorphin in cannabinoid type 2 receptor agonist-mediated morphine tolerance in cancer pain
Zhang Mingyue1,Zhang Zhaodi2,Wang Guonian1,2(1Department of Anesthesiology,Affiliated Hospital of Harbin Medical University;2Institute of Pain,Heilongjiang Provincial Academy of Medical Sciences,Harbin 150081,P.R.China)
Wang Guonian.E-mail:wangguonian609cn@aliyun.com
Objective The purpose of this research was to testwhether the CB2 receptor is involved in morphine tolerance by upregulatingβ-endorphin in spinal cord in cancer pain.M ethods Walker 256 cells were implanted into the plantar region of the rat right hind paw.Tumor-bearing animals received intrathecal injections of a CB2 receptor agonist or antagonist with or without subcutaneous injections ofmorphine twice daily for 8 days.Mechanical paw withdrawal threshold and thermal paw withdrawal latency were assessed daily using the von Frey test and hot plate test.Expression ofβ-endorphin in the spinal cord was detected by ELISA after the last day of drug administration.Results Repeated morphine treatments reduced the mechanical withdrawal threshold and thermal latency,aswell as down-regulatedβ-endorphin in the spinal cord[(5.24±1.41)ng vs(12.46±3.50)ng,P<0.001].Repeated co-administration of AM1241 with morphine for 8 days significantly inhibited the development of mechanical withdrawal threshold [(19.33±3.36)g vs(9.5±1.07)g,P<0.001]and thermal latency[(21.83±2.89)s vs(9.5±2.01)s,P<0.001)],and reversed the down-regulation ofβ-endorphin expression in tumor-bearing rats[(10.11±2.08)ng vs(5.24±1.41)ng,P<0.05].Conclusions Intrathecal injection of the CB2 receptor agonist alleviated morphine tolerance in tumor-bearing rats by up-regulatingβ-endorphin expression in spinal cord.
Cancer pain;Morphine tolerance;Cannabinoid type 2 receptor;β-endorphin
R730.5
A
1674-5671(2017)01-05
10.3969/j.issn.1674-5671.2017.01.05
中俄医学研究中心转化医学专项基金资助项目(CR201418)
王国年。E-mail:wangguonian609cn@aliyun.com
