SNL大鼠鞘内注射KB-R7943的镇痛作用研究
2017-06-01黄洋温丽丽欧阳汉栋陈东泰李强曾维安
黄洋 温丽丽 欧阳汉栋 陈东泰 李强 曾维安
作者单位:510060 广东 中山大学附属肿瘤医院麻醉科
SNL大鼠鞘内注射KB-R7943的镇痛作用研究
黄洋 温丽丽 欧阳汉栋 陈东泰 李强 曾维安
作者单位:510060 广东 中山大学附属肿瘤医院麻醉科
目的 评价SNL大鼠鞘内注射KB-R7943的镇痛作用,并探讨其可能的机制。方法 选取成年雄性SD大鼠(180~220 g),建立SNL模型,通过测定机械痛阈选取SNL模型建立成功的大鼠,采用免疫荧光检测其手术侧L4~6脊髓背角钠钙交换蛋白(sodium calcium exchanger,NCX)定位情况;成年雄性SD大鼠进行鞘内置管,置管成功后1周,制作SNL模型,于SNL模型建立的第7天给予鞘内注射不同剂量(5μg、10μg、20μg)KB-R7943以及1%DMSO对照溶剂,通过行为学检测其鞘内注射后引起的机械痛阈和热痛阈变化;记录成年雄性SD大鼠脊髓背角C纤维诱发电位,给予坐骨神经强直电刺激诱发C纤维电位长时程增强(long-term potentiation,LTP),局部脊髓表面给予KB-R7943以及1%DMSO对照溶剂,记录C纤维电位LTP的幅度变化。结果 NCX表达在大鼠L4~6脊髓背角浅层的C纤维投射区内。SNL大鼠在术后第7天给予鞘内注射NCX反向转运抑制剂KB-R7943,KB-R7943注射组大鼠手术侧足底的机械痛阈及热痛阈均高于溶剂组(P<0.05),其抑制作用与剂量呈正相关。大鼠诱发脊髓C纤维电位LTP后,给予局部孵育KB-R7943后可降低C纤维电位幅度,单纯给予溶剂不会影响C纤维电位幅度。结论 SNL大鼠鞘内注射KB-R7943具有剂量依赖性的抗神经病理性疼痛作用,其机制与抑制大鼠脊髓背角内的NCX反向转运功能,并抑制脊髓背角C纤维诱发电位的长时程增强有关。
神经病理性疼痛;癌症疼痛;KB-R7943;钠钙交换蛋白;鞘内注射;长时程增强
神经病理性疼痛(n europathic pain,NPP)是由损伤、病毒感染或退行性病变引起的病理性疼痛,是肿瘤的一种慢性疼痛方式,以自发性疼痛、痛觉过敏和痛觉超敏为主要特点,是目前慢性疼痛最主要的病因[1]。其产生的机制主要是神经损伤或病毒感染后,神经元表面受体、离子通道改变以及神经系统内胶质细胞激活释放炎症介质等作用于神经元,引起神经系统的初级传入神经元敏感性和中枢神经系统神经元敏感性增加,包括中枢敏化和外周敏化[1-2]。有实验研究发现鞘内注射喹巴因对神经病理性疼痛的大鼠具有良好的镇痛作用[3]。喹巴因是一种Na+/Ka+-ATP酶抑制剂,属于强心苷类化合物,同时还具有抑制钙钠交换蛋白(sodium calcium exchanger,NCX)反向转运的功能。目前已有研究证明鞘内注射Na+/Ka+-ATP酶抑制剂(如蟾毒灵)具有抑制疼痛中枢敏感化作用[4],然而到目前为止尚未有研究阐明NCX与神经病理性疼痛的关系。鞘内注射喹巴因对神经病理性疼痛的镇痛作用是否与抑制钙钠交换蛋白的反向转运功能有关尚不知晓,因此我们猜测NCX可能是神经病理性疼痛治疗的新靶点。本研究通过行为学、分子生物学、电生理方法测定KB-R7943的镇痛作用及其可能的作用机制。
1 材料与方法
1.1 动物模型的制备
大鼠分笼饲养,自由摄水、摄食,并维持12 h/12 h昼夜的循环光照。所有行为学测试在11∶00至17∶00间进行,大鼠在实验前适应环境1周以降低应激相关的疼痛效应。每天和实验开始前观察所有大鼠有无体重减轻、毛发脱落、排泄物异常、探索行为减退和厌食等。1.1.1 SNL大鼠的制备 选取健康成年雄性SD大鼠33只(180~220 g),随机分为免疫荧光实验组18只(均制作SNL模型),Western blot实验组15只(3只行假手术、12只制作SNL模型)。
大鼠腹腔注射400mg/kg水合氯醛(100mg/mL),麻醉后取俯卧位,在左侧腰背部区消毒剃干净毛发,取1.5~2 cm长皮肤切口逐步钝性分离软组织和肌肉,在中央暴露左侧L5脊神经用4.0丝线结扎并在结扎处远端剪断该神经,具体步骤参考文献[5]。结扎过程中小心分离和暴露周围的脊神经,以防结扎错误。观察大鼠在结扎过程中的异常情况,如果出现体动或撕咬等苏醒症状,按需要追加水合氯醛。手术操作过程需注意保暖和遮挡,防止在麻醉和暴露术野过程中热量和水分过度散失。SNL模型手术完成后,擦拭干净肌肉和皮肤组织。用3.0和4.0丝线逐层缝合,消毒表皮。
1.1.2 鞘内置管SNL大鼠的制备 选取健康成年雄性大鼠33只(180~220 g),随机分为行为学组24只,其中1%DMSO溶剂组6只、5μg KB-R7943组6只、10μg KB-R7943组6只,20μg KB-R7943组6只;Western blot组9只,其中1%DMSO溶剂组3只,20μg KB-R7943注射后1 h组3只,20μg KB-R7943注射后2 h组3只。
大鼠腹腔注射400mg/kg水合氯醛(100mg/mL),麻醉后取俯卧位,在腰背部区消毒剃干净毛发,沿脊柱棘突取长2~2.5 cm的皮肤切口逐步钝性分离软组织和肌肉,在第3、第4腰椎小关节结合处,向上置入PE-10导管,导管另一端经皮下隧道于颈部引出,固定并封堵,具体过程参考改良Yaksh法鞘内置管[6]。随后擦拭干净肌肉和皮肤组织。用3.0和4.0丝线逐层缝合,消毒表皮。术后第2天经PE-10导管注入2%盐酸利多卡因,如注射后大鼠下肢出现可恢复性瘫痪则说明置管成功,偏侧瘫痪和不出现瘫痪的置管大鼠则舍去。鞘内置管模型成功的大鼠在置管术后1周进行SNL模型制备,制备方法同上。
1.2 KB-R7943的配制和鞘内注射
利用1%DMSO溶液将KB-R7943(英国Tocris生物科技公司生产)溶解配制成浓度为1μg/μL的KB-R7943原液,SNL大鼠鞘内置管模型建立成功后分为4组,每组6只,分别为(1%DMSO)溶剂组9只(其中6只用于行为学检测,3只用于Western blot检测)、5μg KB-R7943组6只、10μg KB-R7943组6只、20μg KB-R7943组12只(其中6只用于行为学检测,6只用于Western blot检测)。SNL模型建立后第7天给予上述溶液鞘内注射,根据其剂量不同分别抽取KB-R7943原液,并将注射的体积均配制为20μL,注射后用于行为学检测和Western blot检测。
1.3 痛阈的测定
采用up-down法计算大鼠机械痛阈[7]。大鼠置于透明有机玻璃箱,底部为1 cm×1 cm铁丝网,采用von Frey纤维丝(Ugo Basile,意大利)刺激大鼠右后肢足底中部,出现抬足、躲避或舔脚动作则为阳性反应,纤维丝弯曲90°无抬足反应则为阴性反应。von Frey纤维丝压力值分别为0.45 g、0.70 g、1.20 g、2.00 g、3.63 g、5.65 g、8.50 g、15.10 g,每次至少间隔30 s。初始刺激强度为2.00 g,若出现阴性反应,选择高一级强度3.63 g;若出现阳性反应,则选择低一级强度1.20 g,依此类推,直至出现可诱发阳性或阴性反应相邻的2个刺激强度后,继续依序测定4次。采用内推法计算每只大鼠50%机械缩足痛阈作为机械痛阈,公式为50% MWT(g)=[10(Xf+κδ)]/10 000(Xf为最后一次刺激强度;κ为不同刺激方式系数,在内推法表格中查找;δ为各刺激强度取对数后间距的平均值,δ=0.179)。
参照Hargreaves等[8]的方法测定热痛阈。采用爪热痛觉测试仪(U go 37370,意大利),将大鼠置于3 mm厚玻璃板上,热辐光源照射右后肢足底中部,记录从照射到出现缩足反应的时间,反映热痛阈,连续测定3次,每次间隔5min,单次照射时间不超过25 s,取其平均值。
1.4 免疫荧光双染法检测脊髓背角NCX的表达定位
取SNL模型建立后第7天的大鼠18只,腹腔注射400mg/kg水合氯醛(100mg/mL)麻醉,且经心脏灌注磷酸钠缓冲的5mmol/L 0.9%(w/v)生理盐水200mL(PBS,pH 7.3),然后以500 mL的4%(w/v)多聚甲醛灌注。灌注完成后,取材的组织(L4-6节段脊髓)在4%(w/v)多聚甲醛中固定30min,转入30%蔗糖中脱水2 d,樱花SAKURA冷冻包埋剂包埋,并通过冷冻切片机制备为脊髓20μm厚的切片,在0.3%Triton X-100以2%山羊血清室温封闭1h。小鼠分为6组,每组3只。脊髓切片分为NCX1+NF200、NCX1+NUEN、NCX1+IB4、NCX2+NF200、NCX2+NUEN、NCX2+IB4。一抗分别为NCX1-2兔IgG(1∶400;Santa cruz,USA)、抗Neu n小鼠IgG(1∶400;Chemicon,Temecula,CA,USA)、抗NF200小鼠IgG(1∶500;Chemicon,Temecula,CA,USA)、抗IB4小鼠IgG(1∶200;Chemicon,Temecula,CA,USA),4°C过夜。PBS洗净多余的未结合抗体,重复3次。分别添加二抗,羊-抗-兔 Cy3红色(1∶500,Beijing Zhongshan Golden Bridge Biotechnology Co,中国)和羊-抗-小鼠FITC(1∶800,Beijing Zhongshan Golden Bridge Biotechnology Co,中国)。标记后的切片应用尼康(Tokyo,Japan)免疫荧光显微镜和CCD成像技术采集荧光信号。
1.5 脊髓背角场电位记录
雄性SD大鼠(180~220 g)腹腔注射乌拉坦(1.5 g/kg)麻醉后,改仰卧位,行气管切开术,插入气管导管,保持大鼠自主呼吸通畅,随后改为俯卧位,切除胸12~腰1(T12/L1)腰椎板和棘突,暴露脊髓的腰膨大部分(L4~6节段脊髓),游离大鼠左侧坐骨神经。手术完成后将大鼠固定在立体定位仪,拉起大鼠左腿皮瓣,用缝线固定在外支架形成观察槽,注入37℃石蜡油覆盖暴露的坐骨神经,使用双极绿化银电极勾住坐骨神经,两电极间距0.5 cm。暴露的脊髓上下节段各用一对脊柱架固定,将琼脂与生理盐水混合,放入微波炉加热融化,制成1.5%液态琼脂,冷却至37℃后,将琼脂浇注在暴露的脊髓表面,琼脂凝固后,将覆盖在腰膨大表面的琼脂挖除,在显微镜下用尖镊挑开脊膜,暴露脊髓。
按Liu等[9]描述的方法记录脊髓背角C纤维诱发电位,通过氯化银双极电极刺激左侧坐骨神经,诱发脊髓背角场电位。用尖端直径1~2μm的钨丝微电极(World Precision Instruments,USA,电阻0.5~1MΩ)进行细胞外记录,通过电控微量推进器调节电极插入脊髓的深度,将深度控制在脊髓表面以下100~500μm,用数/模转换器(DT2821-f-16SE)以10 k Hz速度处理和储存数据。以C纤维诱发电位幅度作为参数。实验以单方波(10~20 V,0.5 ms,1 min-1)刺激分离的左侧坐骨神经诱发脊髓场电位,稳定30 min后给予强直刺激(40 V,0.5ms,100 Hz,持续1 s,间隔10 s,4次),诱导C纤维电位长时程增强(long-term potentiation,LTP),建立LTP后30 min,在脊髓记录节段表面分别加入1 mmol/L KB-R7943和溶剂(1%DMSO),记录药物对脊髓背角LTP维持的影响。每只大鼠进行1次实验,实验结束后腹腔注射过量乌拉坦处死大鼠。
1.6 统计学处理
采用SPSS 13.0软件对数据进行统计学分析。数据以均数±标准差(±s)表示,采用t检验或方差分析进行处理。P<0.05为差异有统计学意义。
2 结果
2.1 SNL大鼠鞘内注射KB-R7943的行为学结果
NCX在背根神经节表达水平发生变化发生在SNL模型术后第7天,因此选取SNL模型术后第7天的大鼠给予鞘内注射1%DMSO溶剂和不同剂量的KB-R7943。行为学结果显示,鞘内注射KB-R7943后SNL大鼠手术侧足底的机械痛阈(图1A)和热痛阈(图1B)均高于1%DMSO溶剂组大鼠(P<0.05),随鞘内注射KB-R7943的剂量增加,其抗神经病理性疼痛作用越强,最多可持续3 h以上,其中20μg KB-R7943组的机械痛阈和热痛阈在注射后90 min达到最高,分别为(10.73±1.30)g和(-0.45±0.21)s。见图1。
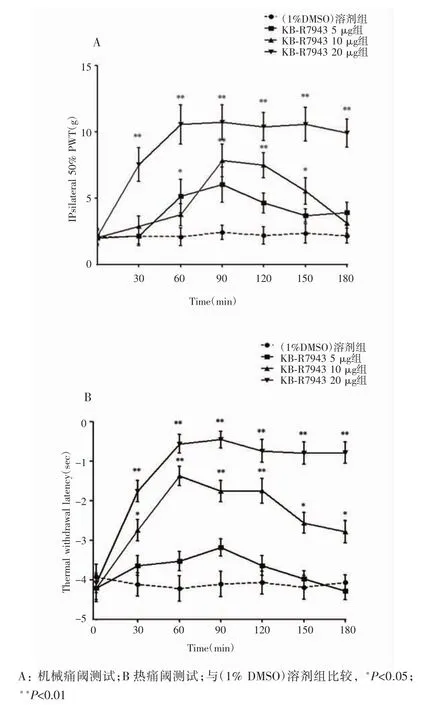
图1 机械痛阈测试以及热痛阈测试中大鼠鞘内注射KB-R7943治疗神经病理性疼痛的剂量-时间效应曲线
2.2 SNL大鼠脊髓背角NCX表达的定位
SNL大鼠建模后,免疫荧光双染法检测脊髓背角NCX(两种亚型NCX1、NCX2)的表达定位,结果显示在大鼠脊髓背角中(L4~6节段脊髓),NCX1主要表达于脊髓背角浅层C纤维投射区(IB4标记),而不在神经元(NeuN标记细胞)和A纤维投射区(NF200标记)中表达(图2)。NCX2少量表达于脊髓背角浅层A纤维投射区(NF200标记),而不在神经元(NeuN标记细胞)和C纤维投射区(IB4标记)中表达(图3)。
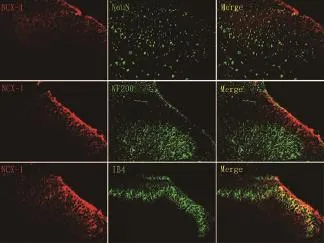
图2 免疫荧光双染法检测NCX1在L4~6节段脊髓背角的表达位置(x200)
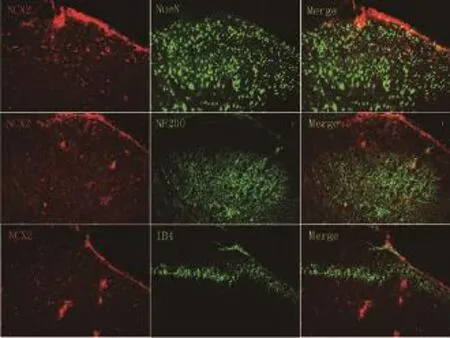
图3 免疫荧光双染法检测NCX2在L4~6节段脊髓背角的表达位置(x200)
2.3 KB-R7943对脊髓背角LTP的影响
脊髓浅层C纤维诱发电位的LTP是研究病理性疼痛中枢敏感化的一种突触模型。为进一步评价KB-R7943对中枢敏感化的影响,本研究观察脊髓表面局部给予1mmol/L浓度KB-R7943,并与1%DMSO溶剂组对照,观察其对脊髓背角LTP的影响。结果显示,诱导脊髓LTP 30min后,记录节段脊髓表面加入KB-R7943 1 mmol/L,给药10 min后脊髓背角LTP幅度开始下降,给药30min对脊髓背角LTP的抑制达到最大程度,并维持此水平至实验记录结束,1%DMSO溶剂组对脊髓背角LTP的幅度无明显影响。
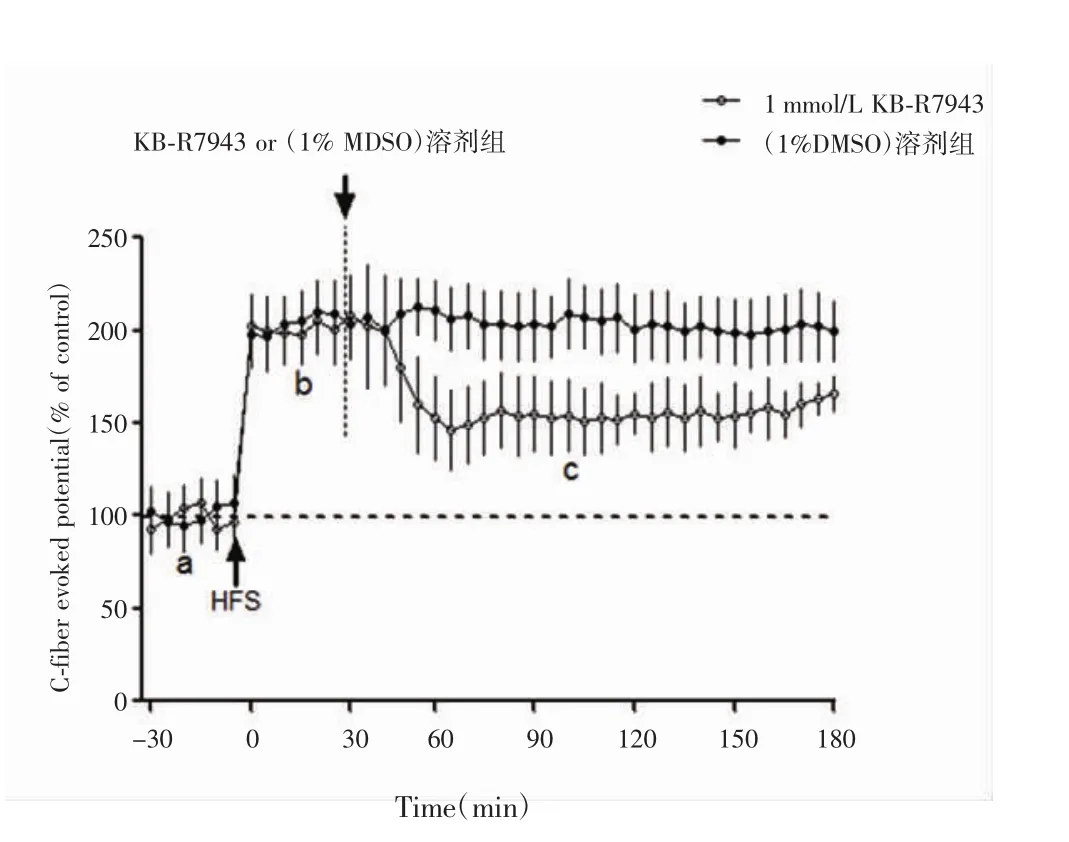
图4 KB-R7943对脊髓背角LTP的影响
3 讨论
神经病理性疼痛的产生有很多机制,主要分为中枢机制和外周机制,中枢机制主要是由脊髓背角神经元和胶质细胞的活化引发,而外周机制主要是由外周伤害性感受器、传入神经以及背根神经节神经元的敏感性变化导致[1-2]。SNL模型是神经病理性疼痛研究中常用的模型,该模型疼痛持续时间长而稳定,其疼痛的产生既有中枢敏感机制也有外周敏感机制,引起其痛觉敏感化的原因主要是神经损伤后各种致炎细胞因子(TNF-α、IL、CCL等)的作用[5]。NCX是调节细胞内外Ca2+浓度的重要转运体,生理状态下主要负责将Ca2+从细胞内泵出,病理状态下会转换为反向转运方式,将Ca2+泵入细胞内,并引起细胞内钙超载,导致细胞的退行性病变和凋亡[10-12]。KB-R7943是NCX反向转运的选择性抑制剂,可减少病理状态下钙离子的内流,还对NMDA受体、Na+-K+交换蛋白和K+通道有很弱的抑制作用[13]。在本实验使用的剂量和浓度下,KB-R7943以抑制NCX反向转运为主。在过去的研究中,KB-R7943可通过抑制NCX的过度表达和防止NCX的反向传输模式而作为治疗心力衰竭心肌钙超载的药物[14],心肌细胞虽然与神经元细胞不同,但其电生理活动状态和神经元的神经冲动非常相似,NCX在神经元中可能具有相同的生理功能。NCX的作用和功能与多种信号通路相关,除了在胶质细胞的活化和凋亡过程中起重要作用,还在背根神经节和脊髓背角的神经元敏感化过程中起关键作用。
众所周知,C纤维的功能主要是传递痛觉信息至脊髓背角,而脊髓背角是初级感觉神经元与第二级感觉神经元形成突触的部位[15],在传递和整合痛觉信息中具有重要作用。C纤维与脊髓背角神经元之间的突触传递效能增强,意味着脊髓背角痛觉传递信号增强[16-17]。也有研究报道强直刺激大鼠坐骨神经诱发脊髓LTP,可引起大鼠同侧后足热痛觉过敏,持续6 d后痛觉才恢复正常[18]。除了电刺激,其他伤害性刺激如神经损伤、神经退行性病变和周围炎症都能引起脊髓背角C纤维诱发电位的LTP。目前脊髓背角C纤维诱发电位的LTP被认为是疼痛中枢敏感化的基础,同时也是研究疼痛中枢敏感化一种常用的突触模型[19]。
总之,神经病理性疼痛发生发展的机制较复杂,多种炎性因子的释放、胶质细胞的激活和神经元表观蛋白的表达变化交织其中,理清其中的机制和因果关系是寻求有效治疗方法的重要前提。本实验结果发现,鞘内注射KB-R7943可抑制SNL大鼠的疼痛行为学,抑制程度与注射剂量相关,KB-R7943作用的靶蛋白主要表达在大鼠脊髓背角浅层的C纤维投射区,同时还发现KB-R7943可抑制脊髓背角C纤维诱发电位LTP,这些结果提示KB-R7943可能通过抑制脊髓中枢敏感化的过程而产生抗神经病理性疼痛的作用。该结果给我们两方面启示:首先证明了鞘内注射喹巴因产生的抗神经病理性疼痛作用不仅通过抑制Na+/ Ka+-ATP酶的功能而产生,还与抑制背根神经节内的NCX反向转运功能相关;其次提示了NCX可作为治疗神经病理性疼痛的新靶点,其具体机制还需深入挖掘,期待今后有更多新的发现,为此观点提供有力的支持,并为神经病理性疼痛的研究和治疗提供依据。
[1] Campbell JN,Meyer RA.Mechanismsof neuropathic pain[J].Neuron,2006,52(1):77-92.
[2] Ji RR,Strichartz G.Cell signalling and the genesis of neuropathic pain[J].Sci STKE,2004,2004(252):reE14.
[3] Zeng W,Chen X,Dohi S.Antinociceptive synergistic interaction between clonidine and ouabain on thermal nociceptive tests in the rat[J].JPain,2007,8(12):983-988.
[4]Wen L,Huang Y,Xie X,et al.Anti-inflammatory and anti-nociceptive activities of bufalin in rodents[J].Mediators Inflamm,2014,2014:171839.
[5]Kim SH,Chung JM.An experimentalmodel for peripheral neuropathy produced by segmental spinal nerve ligation in the rat[J].Pain,1992,50(3):355-363.
[6] Yaksh TL,Rudy TA.Analgesia mediated by a direct spinal action of narcotics[J].Science,1976,192(4246):1357-1358.
[7] Chaplan SR,Bach FW,Pogrel JW,et al.Quantitative assessment of tactile allodynia in the rat paw[J].JNeurosciMethods,1994,53(1):55-63.
[8] Hargreaves K,Dubner R,Brown F,et al.A new and sensitivemethod for measuring thermal nociception in cutaneous hyperalgesia[J].Pain,1988,32(1):77-88.
[9] Liu XG,Sandkühler J.Long-term potentiation of C-fiber-evoked potentials in the rat spinal dorsal horn is prevented by spinal N-methyl-D-aspartic acid receptor blockage[J].Neurosci Lett,1995,191(1-2):43-46.
[10]Blaustein MP,LedererWJ.Sodium/calcium exchange:its physiological implications[J].Physiol Rev,1999,79(3):763-854.
[11]Ambesi A,Vanalstyne E,Bagwell EE,et al.Effect of polyclonal antibodieson the cardiac sodium-calcium exchanger[J].Ann NY Acad Sci,1991,639:245-247.
[12] Altura BT,Zhang AM,Altura BM.Sodium-calcium exchange mechanism in vascular smooth muscle tissue as revealed by manipulating external magnesium[J].Magnes Trace Elem,1990,9(3):163-175.
[13]Iwamoto T,Kita S.Development and application of Na+/Ca2+exchange inhibitors[J].Mol Cell Biochem,2004,259(1-2):157-161.
[14]Satoh H,Ginsburg KS,Qing K,et al.KB-R7943 block of Ca(2+)influx via Na(+)/Ca(2+)exchange doesnotalter twitchesorglycoside inotropy butprevents Ca(2+)overload in rat ventricularmyocytes[J].Circulation,2000,101(12):1441-1446.
[15]Ikeda H,Heinke B,Ruscheweyh R,et al.Synaptic plasticity in spinal lamina I projection neurons that mediate hyperalgesia[J].Science,2003,299(5610):1237-1240.
[16]Sandkuhler J.Learning and memory in pain pathways[J].Pain,2000,88(2):113-118.
[17]Ji RR,Kohno T,Moore KA,et al.Central sensitization and LTP:do pain and memory share similarmechanisms?[J].Trends Neurosci,2003,26(12):696-705.
[18]Zhang HM,Zhou LJ,Hu XD,et al.Acute nerve injury induces longterm potentiation of C-fiber evoked field potentials in spinal dorsal horn of intact rat[J].Sheng Li Xue Bao,2004,56(5):591-596.
[19]Sandkuhler J.Understanding LTP in pain pathways[J].Mol Pain,2007,3:9.
[2016-12-02收稿][2017-02-10修回][编辑 罗惠予]
Analgesic effect of intrathecal injection of KB-R7943 on SNL rats
Huang Yang,Wen Lili,Ouyang Handong,Chen Dongtai,Li Qiang,Zeng Wei'an(Department of Anesthesiology,the Affiliated Cancer Hospital,Sun Yat-sen University,Guangdong 510060,P.R.China)
ZengWei'an.E-mail:zengwa@mail.sysu.edu.cn
Objective To evaluate the analgesic action of intrathecal injection of KB-R7943 in SNL rats,and explore the possible mechanism of analgesia.M ethods Male Sprague-Dawley rats(180-220 g)were randomly assigned to four groups,treated with a subarachnoid catheter and subjected to SNL surgery.On day 7 after surgery,the groups received intrathecal injection of solvent or KB-R7943 in doses of 5,10 or 20μg.Behavioral tests were used to detect changes in mechanical pain threshold and thermal pain threshold.In addition,expression of the sodium-calcium exchanger protein(NCX)on the operation side of the L4-6 spinal dorsal horn was measured using immunofluorescence,and spinal dorsal horn C fiber-evoked potentials were measured.Tetanic stimulation was used to induce long-term potentiation of the C fiber,and changes in C fiber potential amplitude were recorded after applying KBR7943 or control solvent to the surface of the local spinal cord.Results NCX was expressed on the C fiber projection area of the L4-6 spinal dorsal horn.Intrathecal injection of NCX inhibitor KB-R7943 significantly increased the threshold ofmechanical and thermal pain(P<0.05),and these effects positively correlated with KB-R7943 dose.KB-R7943 also reduced the potential amplitude of the C fiber observed after tetanic stimulation.Conclusions Intrathecal injection of KB-R7943 produces a dose-dependent analgesic effect in SNL rats.This effectmay involve inhibition of the reverse transfer function of NCX in the spinal dorsal horn,as well as reduction in long-term potentiation of C fiber-evoked potential in the spinal dorsal horn.
Neuropathy pain;Cancer pain;KB-R7943;Sodium-calcium exchanger protein(NCX);Intrathecal injection;Long-term potentiation
R730.5
A
1674-5671(2017)01-06
10.3969/j.issn.1674-5671.2017.01.04
国家自然科学基金资助项目(81571076)
曾维安。E-mail:zengwa@mail.sysu.edu.cn
