木薯种子体细胞胚诱导发生及植株再生体系建立
2017-05-30韦祖生杨秀娟付海天田益农
韦祖生 杨秀娟 付海天 田益农

摘要:【目的】建立木薯杂交种子诱导体细胞胚发生及植株再生体系,为木薯育种及种质创新提供技术参考。【方法】以不同成熟度的木薯华南5号(SC5)杂交种子组织为外植体材料,包括未成熟种子子叶(a1)和胚芽(b1)、成熟种子子叶(a2)和胚芽(b2)及诱导萌发种子子叶(a3)、胚芽(b3)和胚轴(c3),利用不同外源激素诱导其体细胞胚胎发生、子叶器官形成、不定芽(茎叶器官)发生和生根,并比较不同外源激素的诱导效果。【结果】利用基本培养基(M1)预培养外植体材料可有效控制其污染率(<5.00%),保持其生物活性(>90.00%),预培养材料的褐化率比对照(未预培养,CK)降低30.00%~40.00%,且预培养的子叶(a)、胚芽(b)和胚轴(c)膨大率分别比cK提高6.67%~13.33%、6.67%~50.00%和20.00%。利用4.00 mg/L 2,4-D和12.00 mg/L Picloram诱导体细胞胚胎发生,结果发现胚芽出胚率较高,胚轴次之,子叶较低;成熟度高的种子材料出胚率高于成熟度低的种子材料;4.00 mg/L 2,4-D诱导的体细胞胚胎发生效果优于12.00 mg/L Picloram。0.10 mg/L BAP和1.00 mg/L NAA均可诱导体细胞胚胎分化、增殖,但0.05 mg/L BAP+0.50 mg/L NAA诱导下a、b和c体细胞胚胎增殖率均比单独添加0.10 mg/L BAP或1.00 mg/L NAA显著提高(P<0.05,下同)。a2、a3、b1、b2、b3和c3的不定芽发生率分别为30.00%、40.00%、40.00%、53.33%、70.00%和13.33%,即对于同一组织,成熟度高的种子材料体细胞诱导不定芽发生效果优于成熟度低的种子材料,且不同成熟度的种子均以b最优。a2、a3、b1、b2、b3和c3的生根率分别为23.33%、23.33%、16.67%、30.00%、56.67%0,其中b3的生根率显著高于其他材料,a2、a3、b1和b2的生根率无显著差异,也表现为成熟度高的种子材料比成熟度低的种子材料更易诱导生根,发育更好。7种不同成熟度的杂交种子材料组织中,a2、a3、b1、b2和b3经体细胞诱导获得再生植株,成功率为71.43%。【结论】通过预培养可有效防止木薯杂交种子组织褐化,提高其膨大诱导效果。在木薯生产中,应在培养基中添加4.00 mg/L2,4-D进行体细胞胚胎发生诱导,混合添加0.05 mg/L BAP和0.50 mg/L NAA进行体细胞胚胎增殖培养,且应选择成熟度高的种子材料(如萌发种子胚芽等)作為外植体材料。
关键词:木薯;种子;体细胞;诱导;再生
中图分类号:S533.035.3 文献标志码:A 文章编号:2095-1191(2017)12-2129-07
0引言
【研究意义】木薯(Manihot esculenta Crantz)为大戟科木薯属植物,是全球重要的粮食作物和经济作物,也是我国工业发展中淀粉原材料的主要来源。在自然条件下,木薯可异花授粉形成蒴果,产生杂交种子,因此有性杂交是木薯育种最常规、最有效的方法。近年来,国际热带农业研究中心(CIAT)通过优化木薯杂交后代的田间选育程序缩短新品种选育周期(Ceballos et al.,2012),但木薯是基因高度杂合的群体,在杂交育种工作过程中常遇到种子胚败育、种子成熟度低、数量少等技术难题。因此,开展木薯杂交种子体细胞胚胎诱导发生及其植株再生研究,离体培养杂交种子幼胚体,诱导体细胞发生(分化、增殖)、茎叶器官形成及生根,最终发育成新植株,不仅能提高杂交种子的成株率,打破育种瓶颈,还获得大量无性株系,对木薯遗传育种研究具有重要意义。【前人研究进展】目前,以植物细胞全能性为理论基础的组织培养技术已日趋成熟。在适宜条件下,任何一个植物细胞均可发育成一个新植株(刘进平,2005;郑成木和刘进平,2006),如把未成熟的种子幼胚体剥离出来,接种在人工合成的培养基上培养,可发育成正常植株,是解决种子败育的有效途径(Zhang et al.,2000;陈颖等,2011;宋剑灵等,2012;陆柳英等,2014;孙贝贝等,2016)。根据植物种子胚龄大小,种子胚培养可分为幼胚培养和成熟胚培养:幼胚培养不仅能克服远缘杂交的不亲和性,对杂交种子进行“胚挽救”,还能有效提高植株繁育率;成熟胚培养能有效提高种子发芽率和增殖率,“抢救”储藏过久或储藏不当的种子(贺涛等,2012)。宋剑灵等(2012)研究表明,不同发育期的木薯幼胚萌发率为5.00%~100.00%;赵珊珊等(2010)、郭军辉(2012)利用木薯脆性胚性愈伤发生及芽器官发生诱导技术已建立成熟的木薯体细胞再生体系和遗传转化体系,不仅可获得大量无性株系,还可对其进行遗传改良,成功培育木薯新品种(系)。【本研究切入点】至今,尚无利用木薯杂交种子诱导体细胞胚胎发生及再生植株的研究报道。【拟解决的关键问题】以不同成熟度的华南5号(SC5)杂交种子组织为外植体材料,利用不同外源激素诱导其体细胞胚胎增殖、子叶器官形成、不定芽(茎叶器官)发生和生根,并比较不同外源激素的诱导效果,优化木薯种子体细胞胚胎诱导发生及其植株再生体系,为木薯种质创新和杂交育种提供技术支撑。
1材料与方法
1.1试验材料
SC5由广西木薯研究所提供,于2013-2015年在广西亚热带作物研究所木薯种质圃和中国科学院(上海)植物生理生态研究所三亚大茅育种基地进行开放式杂交育种试验,收集杂交种子。主要试剂:基础培养基(MS)、2,4-二氯苯氧乙酸(2,4-D)、4-氨基-3,5,6-三氯吡啶羧酸(Picloram)、6-苄基腺嘌呤(BAP)和a-萘乙酸(NAA)均购于上海美艾斯生物科技有限公司。主要仪器设备:高压蒸汽灭菌锅(LDZF-30KB)、超净工作台(SW-CJ-1FD/1F)和人工气候培养箱(RQH-250)等。
1.2试验方法
1.2.1培养基配制 由于2,4-D和Picloram可诱导植物体细胞胚胎发生,BAP和NAA可促进植物细胞分化和增殖,因此,本研究参照前人研究结果(赵珊珊等,2011;张东向等,2011;宋剑灵等,2012;陆柳英等,2014)对培养基的激素浓度进行改良。基本培养基(M1):基础培养基(MS,含维生素)+2.00 μmol/LCuSO4+2.00%蔗糖+0.30%Gelrite,pH 5.8;诱导膨大培养基(M2):MI+10.00 mg/L BAP,pH 5.8;诱导体细胞胚胎发生培养基(M3):M1+4.00 mg/L 2,4-D或12.00 mg/L Picloram,pH 5.8;诱导体细胞胚胎增殖培养基(M4):MI+0.10 mg/L BAP或1.00 mg/L NAA或0.05 mg/L BAP+0.50 mg/L NAA,pH 5.8;诱导体细胞胚胎成熟培养基(M5):M1+0.10 mg/L BAP+0.50 mg/L IBA,pH 5.8;诱导茎叶器官发生及生根培养基(M6):M1+0.40 mg/L BAP,pH 5.8。
1.2.2样品采集及前处理 采集不同成熟度的杂交种子组织,包括未成熟种子(图1-A)子叶(a1)和胚芽(b1)、成熟种子(图1-B)子叶(a2)和胚芽(b2)及诱导萌发种子(图1-C)子叶(a3)、胚芽(b3)和胚轴(c3)。种子材料消毒处理:ddH20冲洗30 s,2次→无水乙醇浸泡冲洗10 s→ddH2O冲洗30 s,2次→0.1%升汞浸泡冲洗(未成熟/成熟种子2 min,诱导萌发种子60 s)1次→ddH2O冲洗30 s,2次→75%乙醇浸泡冲洗20 s,2次+ddH2O浸泡冲洗30 s,2次→无菌滤纸吸干。在无菌条件下,解剖、切取子叶(a)、胚芽(b)和胚轴(c)(2.00~3.00 mm)为外植体材料,放置于M1上培养基上保湿,每皿10个外植体,3次重复。
1.2.3膨大诱导处理 将外植体置于M1进行预培养处理3 d,以无预培养材料为对照(CK),然后转置于M2,26.0℃下16 h光/8 h暗、光照强度800~1000 lX培养1周;在体视显微镜下,用无菌针头挑取无褐化的膨大材料(图1-D和图1-E)备用,并统计不同种子材料的污染率、褐化率及膨大率。
1.2.4体细胞胚胎发生诱导 将膨大材料转置于M3,26.0℃下24 h暗培养2周。每隔3 d在体视显微镜下观察体细胞胚胎的发生情况,当出现球型胚和鱼雷型胚茧状嵌合体(图1-F和图1-G),将其分离后于M3继代培养,统计不同种子材料的出胚率。
1.2.5体细胞胚增殖培养 将体细胞胚胎转置于M4,26.0 ℃下16h光/8 h暗培养,光照强度800~1000 lx,诱导体细胞胚胎分化、增殖(图1-H和图1-I),每2周继代1次,观察体细胞胚胎分化情况,统计不同种子材料的体细胞胚胎增殖率。
1.2.6体细胞胚胎成熟及子叶器官发生诱导 将2~3个体细胞胚胎组成的小团簇置于M5,26.0℃下24 h光培养,光照强度800-1000 lx培养,2周后观察体细胞胚状体成熟及不定芽诱导发生情况,直至观察到出现有子叶明显长大并变绿(图1-J和图1-K),再继代培养,并及时处理褐化材料,统计不同种子材料的不定芽发生率。
1.2.7茎叶器官伸长及生根诱导 切取3.00~5.00cm长的成熟不定芽(图1-L)或面积约0.04 cm2绿色子叶(图1-M)置于M6,26.0℃下16 h光/8 h暗培养,光照强度800-1000 lx,每周继代1次,3周后观察茎叶器官伸长及生根情况(图1-N和图1-O),并统计不同种子材料的生根率。
1.2.8再生植株繼代培养 将再生植株小苗转置于M1,26.0℃下16 h光/8 h暗培养,光照强度800~1000 lX,每2周继代培养1次,繁育无性株系。
1.3统计分析
采用SAS 9.0和SPSS 19.0对试验数据进行整理分析。
2结果与分析
2.1膨大诱导处理结果
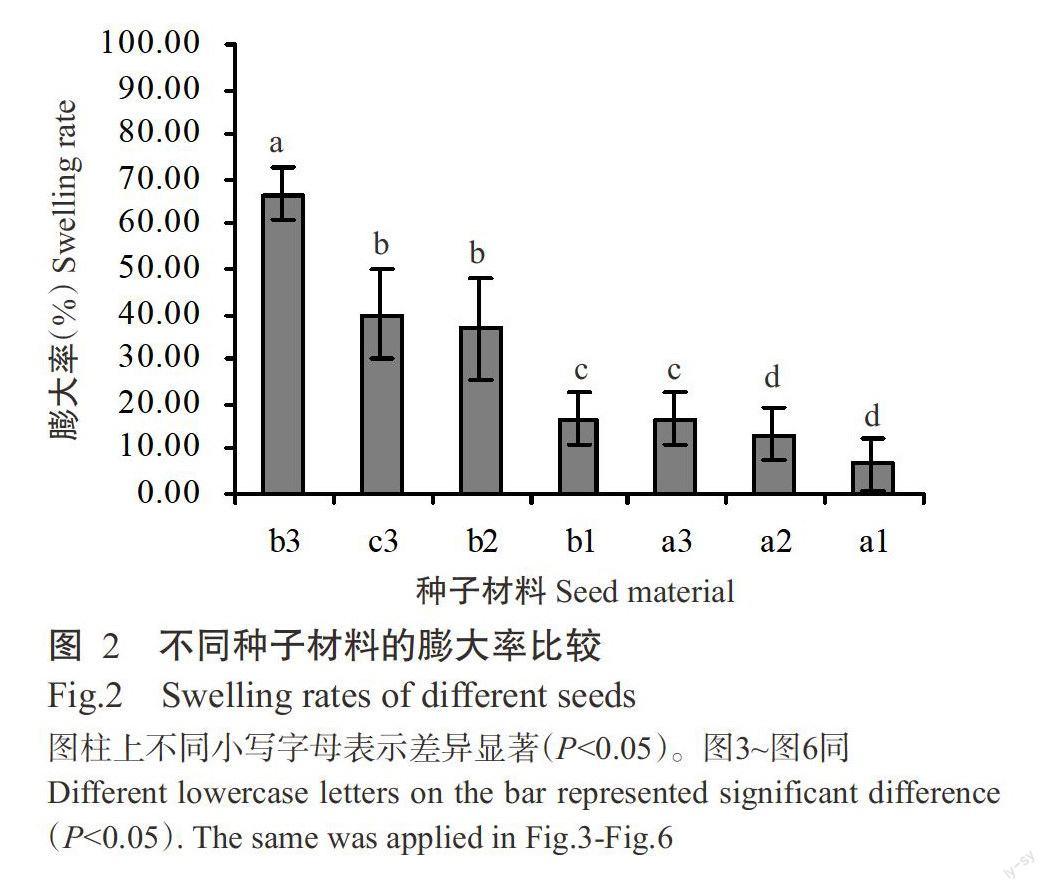
通过外植体预培养可有效控制外植体污染率(<5.00%)和保持其生物活性(>90.00%)。将外植体置于M1预培养后,转置于M2进行诱导膨大培养,结果表明,预培养材料的褐化率比CK降低30.00%~40.00%;预培养的a、b和c膨大率分别比CK提高6.67%~13.33%、6.67%~50.00%和20.00%,且同一成熟度种子材料的不同组织膨大率均存在显著差异(P<0.05,下同),以a的膨大率最低(图2)。综上所述,外植体预培养可有效防止其褐化,提高其膨大诱导效果。
2.2体细胞胚胎发生诱导结果
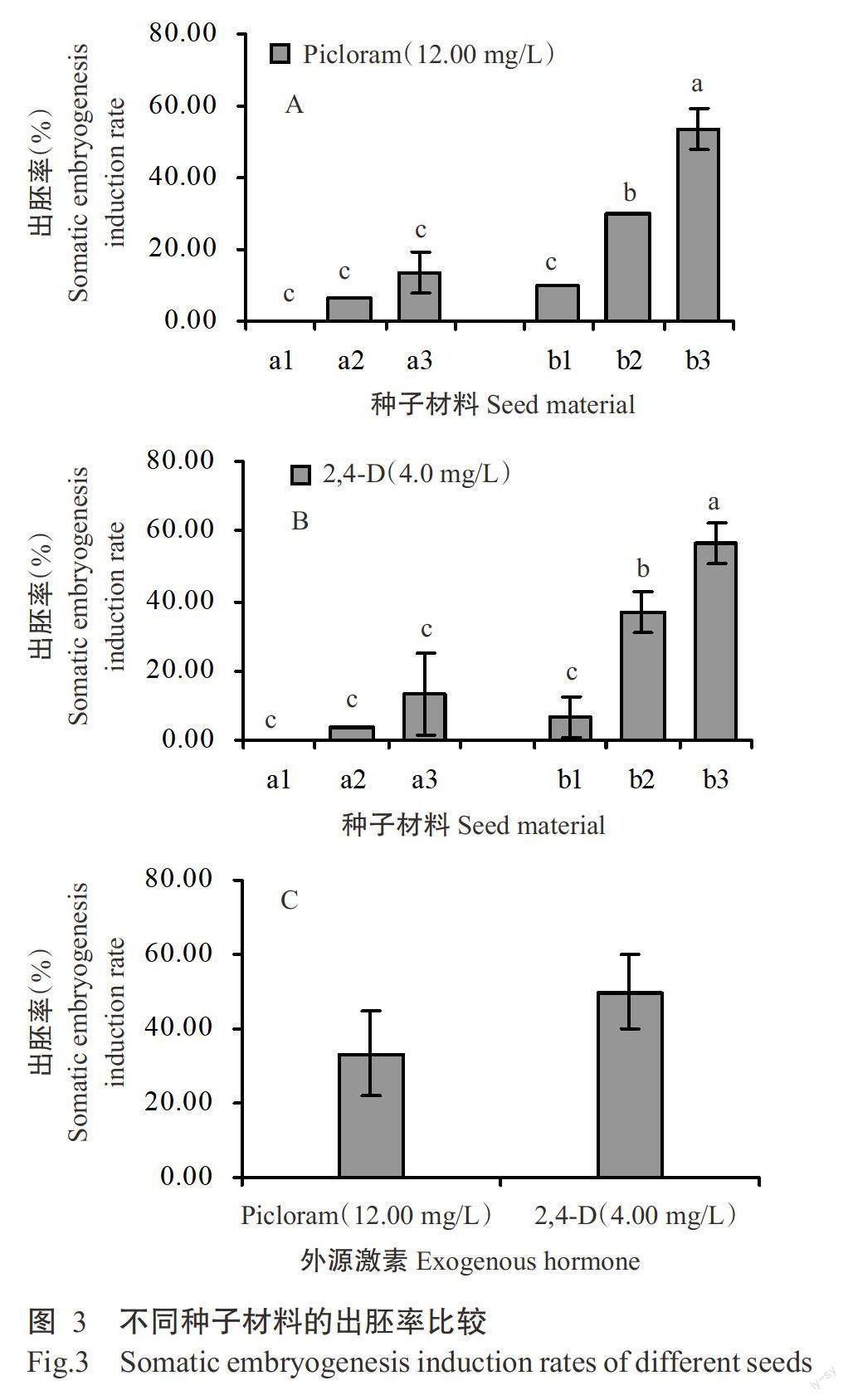
将膨大外植体置于M3诱导其体细胞胚胎发生,结果表明,4.00 mg/L 2,4-D诱导下不同种子材料的出胚率存在一定差异,其中a1为0,a2为3.33%,a3为13.33%,b1为6.67%,b2为36.67%,b3为56.67%,c3为50.00%;12.00 mg/L Picloram诱导下不同种子材料的出胚率也存在差异,其中a1为0,a2为6.67%,a3为13.33%,b1为10.00%,b2为30.00%,b3为50.00%,c3为33-33%;4.00 mg/L 2,4-D和12.00 mg/L Picloram诱导下a1、a2和a3的出胚率均无显著差异(P>0.05,下同)(图3-A),而b1、b2和b3的出胚率均存在显著差异(图3-B);4.00 mg/L 2,4-D诱导3的出胚率比12.00 mg/LPicloram提高了16.67%,但差异不显著(图3-C)。综上所述,以b的出胚率较高,c次之,a较低,且4.00mg/L 2,4-D的体细胞胚胎发生诱导效果优于12.00mg/L Picloram,成熟度高的种子材料更有利于诱导体细胞胚胎发生。
2.3体细胞胚胎增殖培养结果
将体细胞胚胎置于M3诱导其分化、增殖,结果表明,0.10 mg/L BAP诱导下a、b和c的体细胞胚胎增殖率分别为26.67%,36.67%和33.33%;1.00 mg/LNAA诱导下a、b和c的体细胞胚胎增殖率分别为23.33%、36.67%和40.00%,0.10 mg/L BAP诱导下a、b和c的体细胞胚胎增殖率与1.00 mg/L NAA均无显著差异;0.05 mg/L BAP+0.50 mg/L NAA诱导下a、b和c的体细胞胚胎增殖率分别为73.33%、83.33%和73.33%,比单独使用0.10 mg/L BAP分别显著提高46.66%、46.66%和40.00%,比单独使用1.00 mg/LNAA分别显著提高50.00%、46.66%和33.33%(图4)。综上所述,混合使用0.05 mg/L BAP和0.50 mg/LNAA能更有效地促进体细胞胚胎分化和增殖。
2.4体细胞胚胎成熟及子叶器官发生诱导结果
将体细胞胚胎小团簇置于M5诱导其成熟及子叶器官发生,结果表明,a2、a3、b1、b2、b3和c3的不定芽发生率分别为30.00%、40.00%、40.00%、53.33%、70.00%和13.33%,其中b3不定芽发生率显著高于其他材料,b1、b2、a2和a3的不定芽发生率无显著差异,a1、a2和c3间的不定芽发生率差异显著(图5);诱导体细胞胚胎成熟较容易,但诱导子叶器官发生较难,诱导胚状体不定芽形成存在明显差异,多数以叶簇的形式生长(图1-J),少数胚状体相对独立,发育成完整的绿色子叶(图1-K)。综上所述,对于同一组织,成熟度高的种子材料体细胞诱导不定芽发生效果优于成熟度低的种子材料,且不同成熟度的种子均以b最优。
2.5茎叶器官伸长及生根诱导结果
将成熟不定芽或绿色子叶置于M5进行培养,胚状体子叶逐渐变粗、增长,发育为茎叶器官,而诱导其生根较难。由图6可知,a2、a3、b1、b2、b3和c3的生根率分别为23.33%、23.33%、16.67%、30.00%、56.67%和0,其中b3的生根率显著高于其他材料,a2、a3、b1和b2的生根率无显著差异,c3未获得诱导生根材料,表明对于同一组织,成熟度高的种子材料比成熟度低的种子材料更易诱导生根,发育更好,且不同成熟度的种子均1)Ab最优。综上所述,7种不同成熟度的杂交种子材料中,a2、a3、b1、b2和b3经体细胞诱导获得再生植株,成功率为71.43%。
2.6不定芽及再生株系的培养与扩繁
将不定芽及再生株系转置于M1,每2周继代培养1次,可有效获得大量无性株系,a2、a3、b1、b2和b3的扩繁率无显著差异。经过3次继代培养,获得了再生植株共269株,其中a2有40株,a3有52株,b1有43株,b2有66株和b3有68株。
3讨论
目前,植物组织培养技术已日趋完善和成熟,但仍存在很多因素影响其成功率。其中,外植体材料是决定植物组织培养中植株繁殖速率和再生植株直立的重要因素。本研究选取外植体材料的理论依据:子叶为种子萌发提供养料,也是暂时性叶器官,幼苗出土后可进行光合作用;胚芽位于胚轴的顶端,具有极小幼叶(真叶—初生叶)包卷,萌发后发育成幼苗的叶和茎;胚轴为子叶着生点与胚根之间的轴体,发育成为连接茎和根的部分。结果表明,在不同木薯种子材料中,胚芽体细胞出胚率较高,胚轴次之,子叶较低,其原因是胚芽为细胞分化、发育最旺盛的组织部分。但对于同一组织,成熟度高的种子材料明显优于成熟度低的种子材料。其次外植体消毒和灭菌处理是植物组织培养的关键,常用的消毒液为无水/75.0%乙醇和0.10%升汞,可使生物细胞内蛋白质变性、失活、致死,从而达到灭菌的目的,但对外植体材料有毒害作用,使其产生褐化、水渍状坏死及腐烂。本研究根据外植体材料特点选择最佳消毒剂量和消毒时间,外植体消毒均在无菌条件下进行,并在短时间内进行反复多次的液体浸泡冲洗(其中0.1%升汞1次,无水乙醇1次,75%乙醇2次,ddH2O共8次,消毒时间控制在6~7 min),既有利于消毒液对有害生物的灭活、清除,还能及时去除残留在外植体的消毒液,减少对其毒害作用,提高材料的使用效率。
此外,培养基中外源激素种类及浓度也是植物组织培养的重要影响因素。本研究将2,4-D和Piclo-ram添加至诱导培养基中,其原因是二者均可干扰植物体内激素平衡,影响核酸和蛋白质代谢,从而促进或抑制某些器官生长发育。已有研究表明,2,4-D既可诱导愈伤组织发生,也可抑制细胞进一步发育,而Picloram在诱导培养后期对体细胞胚胎的发育不具有明显抑制作用(殷丽青等,2013)。本研究结果表明,2,4-D和Picloram可诱导体细胞胚状体发生,与郭军辉(2012)研究结果相符。本研究还发现,在培养基中添加BAP(0.10 mg/L)或NAA(1.00 mg/L)均可诱导木薯体细胞胚胎分化、增殖,但混合添加BAP(0.05 mg/L)和NAA(0.5 mg/L)可极显著提高体细胞胚胎增殖率,进一步证实混合添加激素对植物体细胞胚胎分化增殖具有促进效应(别晓敏等,2011;时剑等,2011;张燕等,2013)。
4结论
以木薯杂交种子组织外植体经预培养可有效防止其褐化,提高膨大诱导效果。在实际生产中,应在培养基中添加4.00 mg/L 2,4-D进行体细胞胚胎发生诱导,混合添加0.05 mg/L BAP和0.50 mg/L NAA进行体细胞胚胎增殖培养,且应选择成熟度高的種子材料(如萌发种子胚芽等)作为外植体材料。
