基于流式细胞术的5种鼠尾草基因组C值测定
2017-05-30周翔宇林峰徐莉李卫正
周翔宇 林峰 徐莉 李卫正

摘要:【目的】测定5种鼠尾草植物C值,为鼠尾草属的基因组学、细胞生物学和种质资源研究提供参考依据。【方法】以斑花鼠尾草、深蓝鼠尾草、天蓝鼠尾草、耶路撒冷鼠尾草和腺毛鼠尾草的嫩叶为材料,以已知基因组的水稻日本晴为内标,建立适合于鼠尾草基因组的流式细胞术C值测定方法。【结果】经解离液筛选,LB01解离液为鼠尾草属植物的最佳选择,测定5种鼠尾草和对照水稻的变异系数(CV)均小于5.0%;细胞悬浮液在加入碘化丙啶(PI)染色5 min左右即可上机检测。斑花鼠尾草、深蓝鼠尾草、天蓝鼠尾草、耶路撒冷鼠尾草和腺毛鼠尾草的1C值分别为0.555、1.170、1.515、1.031和0.884 pg,存在显著差异(P<0.05)。【结论】测定的5种鼠尾草C值可丰富鼠尾草属植物的C值库;基于流式细胞术建立的鼠尾草属植物C值测定方法可为该属其他植物的相关研究提供借鉴。
关键词: 鼠尾草;基因组C值;流式细胞术
中图分类号: S682.3 文献标志码:A 文章编号:2095-1191(2017)06-0960-06
Measurement of genomic C value of five Salvia species
by flow cytometry
Abstract:【Objective】The genomic C value of five Salvia species were determined in order to provide reference for further study on genomics, cytobiology and germplasm resource of Salvia species. 【Method】Fresh leaves of S. forskaohlei, S. guaranitica, S. uliginosa, S. hierosolymitana and S. viscosa were taken as samples. The known genome of Oryza sativa subsp. japonica‘Nipponbare was set as internal standard. Genomic C value detection by flow cytometry(FCM) was established for Salvia. 【Result】Screened by dissociation liquid, LB01 dissociation liquid was the optimal one for Salvia species. The detected variable coefficient(CV) of five Salvia species and control were smaller than 5.0%. Cell suspension could be tested on equipment after adding propidium iodide(PI) for 5 min staining. The genomic C value of S. forskaohlei, S. guaranitica, S. uliginosa, S. hierosolymitana and S. viscosa were 0.555, 1.170, 1.515, 1.031 and 0.884 pg respectively. And there was significant defference between the C values(P<0.05). 【Conclusion】The detected C values of five Salvia species can enrich C value database of Salvia. The C value detection method established based on FCM for Salvia species can provide reference for the related research on other Salvia species.
Key words: Salvia; genomic C value; flow cytometry
0 引言
【研究意義】鼠尾草属(Salvia)隶属于唇形目(Lamiales)唇形科(Labiatae),是一年生或多年生草本或小灌木,包含约1000种,我国有84种,在全国各地均有分布,以西南地区分布较多(Li and Hedge,1994)。其中药用植物43种(不包括变种),是一个重要的药用植物类群,属内的许多植物具有极高药用价值,可用于治疗肺结核、感冒、呕吐、癫痫等多种疾病(李旻辉等,2011)。鼠尾草属植物还可用于提取精油,且有一定的观赏价值,具有良好的开发利用前景。因此,研究鼠尾草属的基因组对更好地利用该属植物具有重要意义。【前人研究进展】生物体不复制的单倍体细胞核(无论倍性水平)所含DNA数量称为C值(Dole?觩el et al.,2003),一般认为DNA的量1 pg相当于978 Mb(Bennett and Leitch,2011)。C值与植物的种群进化、物种分类及分布、遗传信息总量等有密切关系,是各种植物的一项重要特征参数。目前测定基因组的方法主要有3种,即孚耳根微显影(Feulgen microdensitometry)、基因组测序法和流式细胞术(Flow cytometry,FCM),其中流式细胞术制样简单、分辨率和准确率高,成为近年来测定基因组含量最常用的方法之一(汪艳等,2015;金亮等,2016)。至今,全世界关于鼠尾草植物C值的报道共有10个,分别为:一串红(S. splendens)0.85 pg(Olszewska and Osiecka,1983)、长毛鼠尾草(S. broussonetii)0.43 pg(Suda et al.,2003)、加拿利鼠尾草(S. canariensis)0.50 pg(Suda et al.,2005)、短齿鼠尾草(S. brachyodon)0.48 pg、药用鼠尾草(S. officinalis)0.49 pg(Maksimovi■ et al.,2007)、林下鼠尾草(S. nemorosa)0.55 pg、南欧丹参(S. sclarea)0.58 pg、圆盔鼠尾草(S. ringens)0.61 pg、轮叶鼠尾草(S. verticillata)0.70 pg(Siljak-Yakovlev et al.,2010)和胶质鼠尾草(S. glutinosa)1.07 pg(Temsch et al.,2010)。【本研究切入点】目前国内尚无关于鼠尾草基因组C值的研究报道。【拟解决的关键问题】利用流式细胞仪对5种鼠尾草的基因组进行测定分析,以期为鼠尾草属的基因组学、细胞生物学和种质资源研究提供参考依据。
1 材料与方法
1. 1 试验材料
斑花鼠尾草、深蓝鼠尾草、天蓝鼠尾草、耶路撒冷鼠尾草和腺毛鼠尾草均为上海辰山植物园科研苗圃所栽培。对照水稻日本晴(Oryza sativa subsp. japonica ‘Nipponbare)由福建农林大学提供,将种子置于20 ℃光照培养箱培养10 d后备用。鼠尾草和水稻日本晴均采摘刚抽出的幼嫩叶片作为试验材料。荧光染料、滤膜和鞘液均购自南京博巧生物科技有限公司,Influx流式细胞仪购自美国BD公司。
1. 2 试验方法
1. 2. 1 解离液选择与荧光染料配制 分别采用LB01、Galbraiths(简写Gal)、WPB、GPB、Tris-MgCl2、Otto等多种配方进行试验,找出测定鼠尾草基因组的最佳裂解液配方。将荧光染料碘化丙啶(PI)配成终浓度50 μg/mL,置于4 ℃冰箱保存。
1. 2. 2 细胞核悬液制备与DNA特异性染色 分别选取鼠尾草和水稻的嫩叶约1 g,蒸馏水洗净表面尘土,滤纸吸干后放入预冷的培养皿中,加入预冷的解离液1.0 mL(LB01),用锋利的刀片一次性快速切碎,在整个过程中材料需浸没在解离液中;用0.5 mL冰解离液清洗刀片,将培养皿摆成斜面,使液体和切碎的材料流至皿底半弧侧,用枪头轻吸打液体,放置约1 min;吸取培养皿中的解离液(弃去碎材料)置于1.5 mL EP管,用400目滤膜过滤,并置于冰中孵育5 min。于4 ℃下1100 r/min离心5 min,弃上清液,再加入150.0 μL冰解离液,将待测样品与标样等比例混合,在250.0 μL解离液中加入0.5 μL PI储备液,使终浓度达100 μg/mL;再加入终浓度为10 μg/mL的RNase,避光,在冰箱孵育20 min。上机检测:低速收集8000~10000个颗粒。
1. 3 统计分析
采用488 nm蓝光激发,收集670/30通道的荧光并检测PI发射的荧光强度。变异系数(CV)控制在5%以内。使用BD Influx自带软件FACSTM Sortware 1.0.0.650进行分析。
待测样本细胞核DNA含量=对照样本细胞核DNA含量×■。每个样本进行5次平行试验,用SPSS 19.0对数据进行统计分析。
2 结果与分析
2. 1 解离液的选择
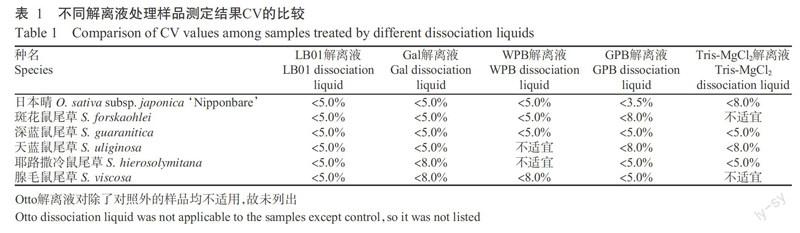
在细胞核悬液制备过程中,不同解离液对不同植物的解离效果存在明显差异,故在试验前需对常用的LB01、Gal、WPB、GPB、Tris-MgCl2、Otto等解离液进行逐一对比,结果发现GPB解离液对水稻的解离效果最佳,对鼠尾草的解离效果一般,而LB01解离液对二者的解离效果均表现为噪音少、分离得到的峰形最佳。由表1可知,除LB01解离液对5种鼠尾草和水稻均适用外(CV<5.0%),其他解离液则存在不适宜或CV过大的情况,考虑到试验结果的准确性与可对比性,故最终统一采用LB01解离液,即15 mmol/L Tris、2 mmol/L EDTA-Na2、0.5 mmol/L四盐酸精胺、80 mmol/L KCl、20 mmol/L NaCl、0.1%(v/v)TritonX-100、pH 7.0~8.0。
2. 2 基因组大小的测定结果
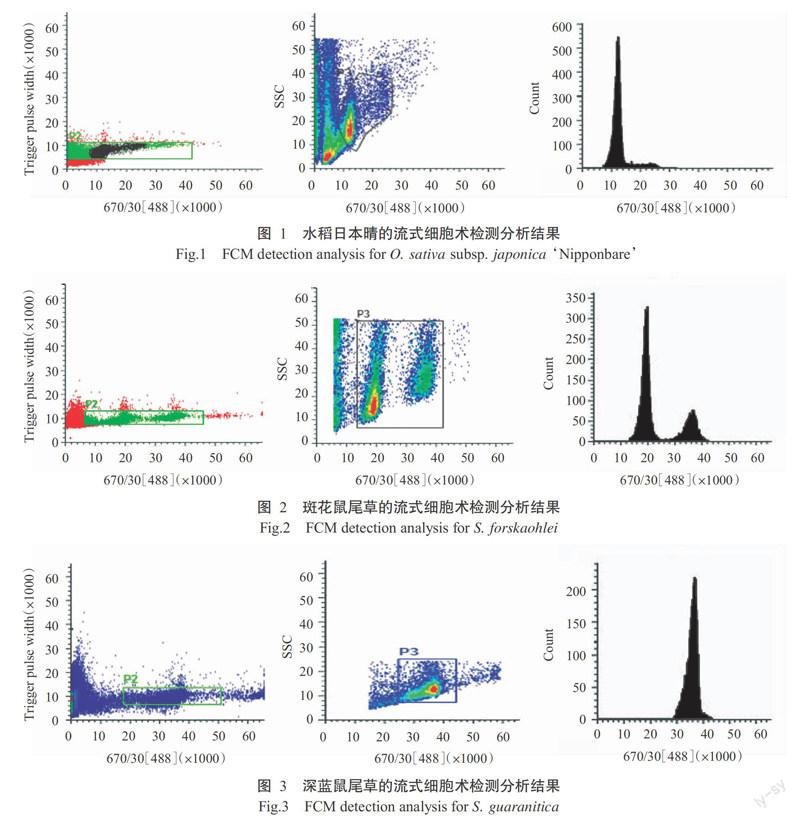
以水稻日本晴为内标,分别测定鼠尾草悬浮液、水稻悬浮液及两者混合液,测试结果如图1~图7所示。在上机检测时,先以日本晴与各鼠尾草单独上机检测,初步确定对照与待测样本的荧光强度范围。荧光强度表现为流式细胞术检测图种峰的位置,如图1所示,水稻日本晴的荧光强度在12000附近,在同一检测模板下,斑花鼠尾草的荧光强度在18000附近(图2)。说明在下一步混合样品流式细胞术检测中,机器设置条件一致的情况下,水稻日本晴的峰将出现在检测图的左侧,而样品在检测图的右侧。在图7中,左侧的P1峰代表水稻日本晴的荧光强度,右侧的P2(A-E)峰分别代表样品:斑花鼠尾草、深蓝鼠尾草、天蓝鼠尾草、耶路撒冷鼠尾草、腺毛鼠尾草。
水稻日本晴2C DNA含量为0.795 pg(Sasaki and Burr,2000)。5种鼠尾草的1C值见表2,其中以天蓝鼠尾草的1C值最高(1.515 pg),其次是深蓝鼠尾草(1.170 pg),最低的是斑花鼠尾草(0.555 pg),5种鼠尾草的1C值间存在显著差异(P<0.05)。
3 讨论
早在20世纪初,鼠尾草属植物的观赏和药用价值已得到广泛关注,从134个物种中分离获得773种次生代谢化合物,具有巨大的应用前景(Wu et al.,2012)。目前,国内尚无关于鼠尾草基因组C值的研究报道。本研究采用已知基因组大小的水稻日本晴为内标,结果显示,水稻日本晴与5种鼠尾草样品的测定峰区分度良好,DNA含量CV均控制在5.0%以内,试验结果稳定、可靠。此外,CV只能在线性标尺模式下计算,对于在数标尺模式下的测定则无意义(Dole?觩el et al.,2003)。因此,本研究采用的是线性标尺进行测定。
植物樣品检测过程中,解离液、材料选择和染色时间是关键(Dole?觩el et al.,2003)。在解离液选择方面,水稻对解离液要求不高,解离液LB01、Gal、WPB、GPB、Tris-MgCl2和Otto均能检测出良好的峰形,其中以GPB解离液的效果最佳;鼠尾草由于叶片内富含挥发油类、二萜类和酚酸类等成分,碎片较多,仅LB01解离液的解离效果最佳,故最终选择标样与待测样本均适宜的LB01解离液进行前处理。在供试叶片方面,水稻采用种子萌发后、在培养箱培育10 d的嫩叶,鼠尾草均采用新鲜的嫩叶,使用的叶面积不超过1 cm×1 cm,以减少碎片。悬浮液在加入PI后避光染色5~10 min再进行流式检测。
Greilhuber等(2005)提出了“1C值”的概念:1C值代表体细胞DNA含量(2C)的一半。本研究所用的内标水稻日本晴基因组大小为389 Mb,根据公式计算得到斑花鼠尾草、深蓝鼠尾草、天蓝鼠尾草、耶路撒冷鼠尾草及腺毛鼠尾草的1C含量分别为0.555、1.170、1.515、1.031和0.884 pg,与国外报道的同属10种植物C值范围(0.43~1.07 pg)相近(Olszewska and Osiecka,1983;Suda et al.,2003,2005;Maksimovi■ et al.,2007;Siljak- Yakovlev et al.,2010;Temsch et al.,2010)。方差分析结果表明,5种鼠尾草基因组C值存在显著差异;这种差异较普遍,甚至在种内也存在差异(Ramsey and Ellis,1996)。基因组C值既有种的特征,又具有生态适应上的意义。已有研究表明,C值与被子植物中的多样性、物种灭绝风险性等均有一定关系(Bancheva and Greilhuber,2006)。全世界有1000多种鼠尾草植物,但迄今为止仅有10种鼠尾草植物基因组C值被测定,本研究结果可为加快该属植物的C值测定提供借鉴。
4 結论
测定的5种鼠尾草C值可丰富鼠尾草属植物的C值库;基于流式细胞术建立的鼠尾草属植物C值测定方法可为该属其他植物的相关研究提供借鉴。
参考文献:
金亮,徐伟韦,李小白,刘建新,田丹青,葛亚英,潘晓韵,王炜勇. 2016. DNA流式细胞术在植物遗传及育种中的应用[J]. 中国细胞生物学学报,38(2):225-234. [Jin L,Xu W W,Li X B,Liu J X,Tian D Q,Ge Y Y,Pan X Y,Wang W Y. 2016. Application of DNA flow cytomtetry to plant genetics and breeding[J]. Chinese Journal of Cell Biology,38(2):225-234.]
李旻辉,宋晓玲,王振旺,张娜,肖培根. 2011. 中国鼠尾草属植物传统药物学的调查[J]. 时珍国医国药,22(2):476-479. [Li M H,Song X L,Wang Z W,Zhang N,Xiao P G. 2011. The ethnopharmacological investigation of Chinese Salvia plants[J]. Lishizhen Medicine and Materia Medica Research,22(2):476-479.]
汪艳,肖媛,刘伟,李婷婷,胡锐,乔志仙. 2015. 流式细胞仪检测高等植物细胞核DNA含量的方法[J]. 植物科学学报,33(1):126-131. [Wang Y,Xiao Y,Liu W,Li T T,Hu R,Qiao Z X. 2015. Operation skills of flow cytometer for detecting nuclear DNA contents in higher plant cells[J]. Plant Science Journal,33(1):126-131.]
Bancheva S,Greilhuber J. 2006. Genome size in Bulgarian Centaurea s.l.(Asteraceae)[J]. Plant Systematics and Evolution,257(1-2):95-117.
Bennett M D,Leitch I J. 2011. Nuclear DNA amounts in angiosperms:Targets,trends and tomorrow[J]. Annals of Botany,107(3):467-590.
Dole?觩el J,Barto?觢 J,Voglmayr H,Greilhuber J. 2003. Nuclear DNA content and genome size of trout and human[J]. Gytometry A,51(2):127-128.
Greilhuber J,Dole?觩el J,Lysák M A,Bennett M D. 2005. The origin,evolution and proposed stabilization of the terms ‘genome size and ‘C-value to describe nuclear DNA contents[J]. Annals of Botany,95(1):255-260.
Li X W,Hedge I C. 1994. Flora of China. Vol. 17[M]. Beijing:Science Press,St. Louis:Missouri Botanical Garden Press.
Maksimovi■ M,Vidic D,Milo?觢 M,?譒oli■ M E,Abad?觩i■ S,Siljak-Yakovlev S. 2007. Effect of the environmental conditions on essential oil profile in two Dinaric Salvia species:S. brachyodon Vandas and S. officinalis L.[J]. Biochemical Systematics and Ecology,35(8):473-478.
Olszewska M J,Osiecka R. 1983. The relationship between 2C DNA content,life cycle type,systematic position and the dynamics of DNA endoreplication in parenchyma nuclei during growth and differentiation of roots in some dicotyledonous herbaceous species 1[J]. Biochemie Und Physiologie Der Pflanzen,178(8):581-599.
Ramsey A D,Ellis P R. 1996. Resistance in wild brassicas to the cabbage whitefly,Aleyrodes proletella[J]. Acta Horticulturae,407:507-514.
Sasaki T,Burr B. 2000. International rice genome sequencing project:The effort to completely sequence the rice genome[J]. Current Opinion in Plant Biology,3(2):138-141.
Siljak-Yakovlev S,Pustahija F,?譒oli■ E M,Boguni■ F,Muratovi■ E,Ba?觢i■ N,Catrice O,Brown S C. 2010. Towards a genome size and chromosome number database of Balkan flora:C-values in 343 taxa with novel values for 242[J]. Journal of Computational & Theoretical Nanoscience,3(2):190- 213.
Suda J,Kyncl T,Freiova R. 2003. Nuclear DNA amounts in Macaronesian angiosperms[J]. Annals of Botany,92(1):153-164.
Suda J,Kyncl T,Jarolimová V. 2005. Genome size variation in Macaronesian angiosperms:Forty percent of the Canarian endemic flora completed[J]. Plant Systematics and Evolution,252(3):215-238.
Temsch E M,Temsch W,Ehrendorfer-Schratt L,Greilhuber J. 2010. Heavy metal pollution,selection,and genome size:The species of the ?譕erjav study revisited with flow cytome-
try[J]. Journal of Botany. doi:10.1155/2010/596542.
Wu Y B,Ni Z Y,Shi Q W,Dong M,Kiyota H,Gu Y C,Cong B. 2012. Constituents from Salvia species and their biolo-
gical activities[J]. Chemical Reviews,112(11):5967- 6026.
(責任编辑 罗 丽)
