温度与原料组成对硼/碳热还原法制备高纯ZrB2粉体的影响
2017-05-25冯慧丽黄启忠苏哲安
冯慧丽,黄启忠,苏哲安
温度与原料组成对硼/碳热还原法制备高纯ZrB2粉体的影响
冯慧丽,黄启忠,苏哲安
(中南大学粉末冶金国家重点实验室,长沙 410083)
以ZrO2、硼源(B4C和B2O3)、碳源(石墨粉和炭黑)为原料,分别采用ZrO2-B4C-C体系和ZrO2-B4C-B2O3-C体系,在氩气气氛下通过硼/碳热还原反应合成ZrB2粉体,研究合成温度、碳源、硼源以及原料配比对ZrB2粉体纯度、形貌及粒度的影响。结果表明:随反应温度升高,ZrB2粉体的纯度提高;以石墨粉为碳源时,适当增加过量的B4C也可提高ZrB2粉体的纯度;由B4C和B2O3同时充当硼源时,需加入更多过量的B才能获得高纯度的ZrB2;与采用石墨粉做碳源相比,用炭黑做碳源可在较低温度下合成ZrB2粉体,并且不需加入过量的B。以ZrO2,B4C和炭黑为原料,按照(ZrO2):(B4C)=2:1配比,在1 350 ℃保温1.5 h,得到纯度高于99%的柱状ZrB2粉体,宏观平均粒径50为12.67 μm。
硼化锆;硼/碳热还原;高纯;碳源;合成工艺
随着宇航、航空、冶炼新技术和原子能等现代技术的发展,对高温结构材料的要求越来越苛刻,要求材料具有良好的高温性能,如抗热震、强度高、耐腐蚀和抗氧化等。ZrB2陶瓷因其优异的物理化学性能,如高熔点、高模量和高硬度,良好的导电性、耐磨性和抗腐蚀性能以及较好的抗氧化性能等,成为目前最有前途的高温材料之一[1−3],在高温结构材料、电极材料[4]、耐火材料[5]、防静电耐磨涂层[6−7]和切削刀具等领域具有广泛的应用。目前ZrB2粉体的主要制备方法有硼热还原法[8]、碳热还原法[9]、硼/碳热还原法[10−12]、自蔓延高温合成法[13]、溶胶–凝胶法[14−15]等,其中硼/碳热还原法为ZrB2粉体的主要合成方法。马良秋等[10]以氧化锆、碳化硼和炭黑为原料,在真空感应炉和电弧炉中于1750 ℃保温90 min(其中在1400 ℃保温60 min)合成了ZrB2粉体,碳化硼和碳需适当过量,ZrB2粉体中含1.6%的C,ZrB2纯度达98%。GUO等[11]加入过量10%~25%的B4C(质量分数),在真空条件下 1650 ℃保温60 min合成棒状ZrB2粉体,当温度升至1750 ℃时合成的ZrB2粉体为近球状,含氧量(质量分数)为0.7%。ZHAO等[12]以ZrO2,B4C和C为原料,在电炉中1600 ℃温度下合成ZrB2粉体。以上方法中合成温度都在1600 ℃以上,并且合成ZrB2粉体的纯度低于99%。本文以ZrO2,B4C,B2O3,石墨粉和炭黑为原料,分别采用ZrO2-B4C-C体系和ZrO2-B4C- B2O3-C体系,在氩气气氛下硼/碳热还原合成ZrB2粉体,研究合成温度、碳源、硼源以及原料配比对ZrB2粉体纯度的影响,预期在降低反应烧结温度(低于1600 ℃)的条件下合成形貌规则且低含氧量、高纯度(>99%)的ZrB2粉体。
1 实验
1.1 原料
二氧化锆,50=3.3 μm,纯度(质量分数,下同)为99.9%,致磨(上海)新材料科技有限公司生产;碳化硼,粒径1~10 μm,纯度98%,阿拉丁试剂(上海)有限公司生产;三氧化二硼,50=75 μm,纯度为98%,阿拉丁试剂(上海)有限公司生产;天然鳞片石墨,粒径小于50 μm,纯度98%;炭黑,50=2 μm,纯度98%。
1.2 硼/碳热还原合成ZrB2粉体
按照表1所列原料配比称量原料粉末。将配好的原料粉末充分研磨混合均匀后放入石墨坩埚中,再将石墨坩埚放置在高温石墨化炉(型号SMH−201,长沙科源真空技术有限公司)内,于氩气气氛中(纯度99.9%,0.2 L/min)硼/碳热还原合成ZrB2粉体,合成温度为1150~1750 ℃,升温速率为400 ℃/h,保温时间为1.5 h。
1.3 分析与测试
采用日本理学D/max2550全自动(18 kW)转靶X射线衍射仪分析硼化锆粉体的物相组成;用美国FEI公司的Nova Nano SEM230场发射扫描电镜(field emission scanning electron microscope,FESEM)观察粉体形貌;用英国MALVERN公司生产的MICRO−PLUS型激光衍射粒度分析仪分析硼化锆粉体的平均粒度及粒度分布;分别用CS600碳硫分析仪和TCH600氮氧氢分析仪测定粉体中的碳含量与氧含量。

表1 硼/碳热还原合成ZrB2粉体的原料配比
2 结果与讨论
2.1 热力学分析
ZrO2与B4C和C发生硼/碳热还原反应的反应方程式为:
2ZrO2+B4C+3C=2ZrB2+4CO(g) (1)
采用B2O3和B4C同时充当硼源时,反应方程式为:
3ZrO2+B4C+B2O3+8C=3ZrB2+9CO(g) (2)
有研究表明,硼/碳热还原反应过程中可能发生的反应方程式如下[16−18]:
7ZrO2+5B4C→7ZrB2+3B2O3+5CO(g) (3)
ZrO2+B2O3+5C=ZrB2+5CO(g) (4)
ZrO2+3C=ZrC+2CO(g) (5)
ZrC+B2O3+2C=ZrB2+3CO(g) (6)
根据文献[19]的数据可知,标准状态下,反应(1)~ (6)的吉布斯自由能变分别为:
Δ1=1179.14−0.681(7)
Δ2= 2641.738−1.608(8)
Δ3=1472.6−0.986(9)
Δ4=1474.36−0.866(10)
Δ5=679.733−0.361(11)
Δ6=796.627−0.505(12)
图1所示为标准状态下反应(1)~(6)的吉布斯自由能变随温度的变化。从图中可看出在温度低于1300 ℃时,主要发生反应(3);温度高于1400 ℃时,反应(1)~ (4)同时进行;温度高于1610 ℃时,反应(5)才可能发生。根据图1,选取实验温度范围为1150~1750 ℃。

图1 标准状态下式(1)~(6)所示反应的吉布斯自由能变ΔG随温度的变化
2.2 ZrO2-B4C-C体系
图2(a)和(b)所示分别为表1中的ZC1和ZG2混合粉末在不同温度下合成ZrB2粉体的XRD谱。图3(a)和(b)分别是以炭黑和石墨粉为碳源,ZrO2与B4C的配比对反应产物XRD谱的影响。由图2(a)和3(a)可知,合成温度为1150 ℃时,无论采用炭黑或石墨作为碳源,硼/碳热还原产物的主要物相为ZrO2,存在少量ZrB2,ZG2混合粉末的反应产物中还存在大量C。根据以上热力学分析可知,在此温度下只有反应(3)发生,ZrO2部分被还原,原料中大量的B以B2O3的形式挥发。温度升高至1350 ℃时ZC1的还原产物为纯ZrB2;ZG2的反应产物主要为ZrB2,存在少量C。温度升至1550 ℃时,ZC1和ZG2的产物均为纯ZrB2。这说明反应温度越高,ZrO2-B4C-C体系的硼/碳热还原反应越彻底,ZrB2粉体的纯度越高。比较图2(a)和3(a)可知,用炭黑作为碳源制备ZrB2的温度较低。
从图2(a)明显看出,用炭黑做碳源时不需加入过量的B4C,产物为纯ZrB2。从图3(b)可看出,用石墨粉做碳源,硼锆比为2时反应产物主要为ZrB2,存在少量ZrO2。适当加入过量的B4C时,反应产物为纯ZrB2。这是因为反应(3)生成的B2O3熔点很低,蒸汽压很高,在高温下极易挥发[20−21],从而导致B的短缺,故需加入过量的B4C来弥补B的不足。在加入过量B4C的同时需相应减少C的加入量,否则产物中会有碳剩余。而用炭黑作还原剂时,炭黑粒径较小,比表面积大,对B2O3有良好的吸附效果,从而保证原料中B的有效使用,因此不需加入过量的B4C参与反应。

图2 ZC1和ZG2混合粉末在不同温度下合成ZrB2粉体的XRD谱
综合图2和图3的结果与分析可知,无论采用石墨或炭黑作为碳源,升高反应温度都可提高ZrB2粉末的纯度;用石墨做碳源时,加入适当过量的B4C可提高ZrB2粉末的纯度。与炭黑做碳源相比,用石墨粉与B4C合成硼化锆所需的温度高,且需加入过量的B4C。
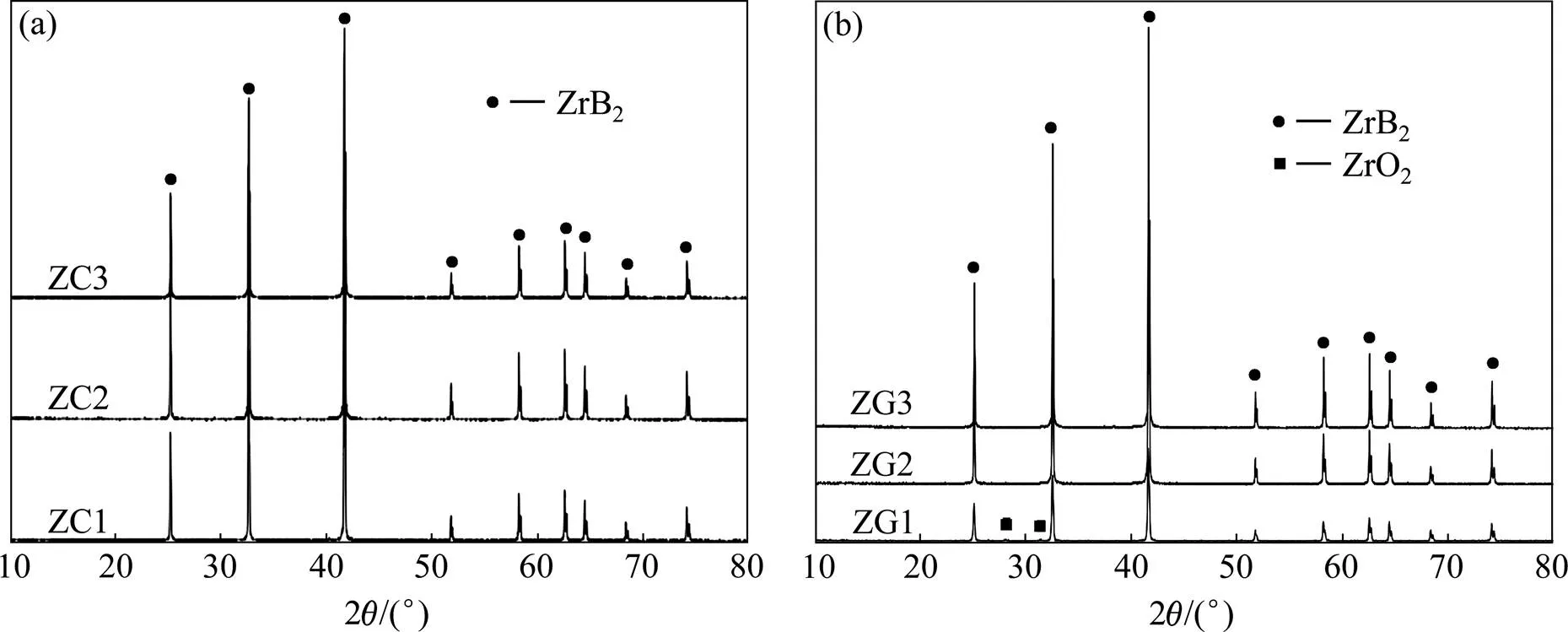
图3 ZrO2-B4C-C体系的原料配比对ZrB2粉体XRD谱的影响
图4所示为ZC1混合粉末在不同温度下合成ZrB2粉体的SEM形貌。由图可见,随温度升高,ZrB2颗粒形貌由表面有棱角的柱状向光滑柱状转变,颗粒长径比由3~4减小到2~3,温度升至1750 ℃时为无规则块状。在1350,1550和1750 ℃下合成ZrB2粉的氧含量(质量分数,下同)分别为0.49%,0.24%和0.11%,碳含量(质量分数,下同)分别为0.23%,0.50%和0.58%,碳氧总含量不到1%,并且氧含量随温度升高而降低。在1350 ℃温度下合成的粉末,其硼与锆的平均原子比为1.99:1,非常接近理论值2:1,ZrB2纯度高于99%,宏观平均粒径50为12.67 μm。

图4 ZC1粉末在不同温度下合成ZrB2粉体的SEM形貌
图5所示为ZG2混合粉在不同温度下合成ZrB2粉体的SEM形貌。由图可见,当温度从1350℃升高至1550℃,ZrB2颗粒的形貌由长径比为2~3的柱状向近球状转变,温度升至1750℃时为柱状和近球状同时存在。在1350,1550和1750℃下合成ZrB2粉的氧含量分别为2.61%,0.25%和0.05%,碳含量分别为2.38%,0.80%和0.38%。在1750℃下合成的粉末,其硼与锆的平均原子比为2.08:1,宏观平均粒径50为7.68 μm。

图5 ZG2在不同温度下合成ZrB2粉体的SEM形貌
ZrB2粉体颗粒的形貌随合成温度变化的原因有2个:一个是硼/碳热还原法制备ZrB2粉体的反应过程中产生B2O3,由于其熔点较低而呈液态,ZrB2粉体颗粒在形核长大过程中,B2O3始终为其提供液相环境,利于ZrB2晶体颗粒定向生长[22]。另一个是还原反应合成ZrB2的过程为熔融析出过程,ZrB2颗粒从整体中长大析出,作为独立颗粒存在。在反应温度较低时,反应过程中原子迁移速度较慢,合成的粉体颗粒没有足够的动力从整体中析出而烧结在一起作为大颗粒存在,粉体的整体宏观平均粒径较大。随温度升高,原子迁移速度加快,反应后ZrB2颗粒析出而单独存在,颗粒较分散,粉体的整体平均粒径减小。
综上所述,碳源种类和合成温度对ZrB2粉末的形貌以及氧含量都有影响。随温度升高,ZrB2粉末的氧含量降低。用炭黑做碳源时,随温度升高ZrB2粉体颗粒由表面有棱角的柱状变为表面光滑的柱状直至不规则块状。用石墨粉作为碳源时,随温度升高ZrB2粉体由柱状向近球状和柱状转变。
2.3 ZrO2-B4C-B2O3-C体系
图6(a)和(b)所示分别为ZCB1混合粉末与ZGB3混合粉末在不同温度下反应合成产物的XRD谱。从图6(a)看出,以炭黑为碳源,反应温度为1150 ℃时合成的产物由ZrO2和ZrB2组成;温度升高至1350 ℃以上时反应产物为纯ZrB2。从图6(b)看出,以石墨为碳源时,在1150 ℃温度下反应后的产物由ZrO2,ZrB2和C组成;温度升高至1350 ℃时反应产物主要为ZrB2,同时有少量C存在;温度进一步升至1750 ℃时,反应产物为纯ZrB2。对比图6(a)与图2(a)可知,用B4C和B2O3同时提供硼源比单独用B4C提供硼源时合成纯ZrB2的温度高。
图7(a)和(b)所示分别为改变ZCB和ZGB中的硼锆比对反应产物XRD谱的影响。对比图6(b)与2(b)可看出,与用B4C单独提供硼源时相似,用B4C和B2O3同时提供硼源、用炭黑做碳源时几乎不需额外增加B的用量,产物均为纯ZrB2。对比图7(b)与3(b)可看出,ZG1和ZGB2反应后产物中均含有ZrC杂质,杂质含量随B4C加入量增加而减少。由热力学分析可知,加热温度为1750 ℃时,满足反应(5)进行的热力学条件,反应后产生ZrC,在B加入量不足时,由于B2O3不足导致反应(6)无法充分进行,ZrC无法被完全硼化为ZrB2而以杂质形式存在。以上现象表明用B4C和B2O3共同充当硼源时,采用炭黑作为碳源,增加B的用量对ZrB2的制备无重大影响,这是因为炭黑粒径小,粉末比表面大,B2O3被吸附,从而有效防止因B2O3挥发而造成B的缺失;采用石墨粉作为碳源时,增加B的用量可明显促进硼/碳热还原反应的进行,适当加入过量的B,反应后产物为纯ZrB2,其主要原因是随反应温度升高,反应(3)产生的B2O3挥发速度加快,需加入更多的B4C弥补B的不足。另一个原因是反应初始使用B2O3代替部分B4C提供B,B2O3的挥发持续整个升温反应过程,挥发的B2O3越多,需要补充的B越多。
综合以上结果与分析:采用石墨粉为碳源时,与单独使用B4C做硼源比较,采用B4C+B2O3作为硼源,需要在较高的温度下才能合成纯ZrB2,同时需加入更多额外的B。用炭黑作为碳源时,不需加入过量的B参与反应,但相同温度下合成粉体的碳氧含量比用单硼源时高,粉末纯度低。

图6 ZCB1和ZGB3 混合粉末在不同温度下合成ZrB2粉体的XRD谱

图7 ZrO2-B4C-B2O3-C体系的原料配比对ZrB2粉体XRD谱的影响
图8所示是ZCB1粉末在不同温度下合成ZrB2粉体的SEM形貌。从图中可看出,不同温度下合成的ZrB2粉体颗粒的主要形貌均为有棱角的柱状,合成温度为1350 ℃时ZrB2颗粒有明显的烧结现象,柱状颈部相连,合成温度为1750 ℃时柱状颗粒团聚。这主要是由ZrB2颗粒的生长机制决定的,低温时ZrB2颗粒未析出而呈大颗粒存在,随温度升高颗粒析出完成,成为单独存在的颗粒,温度过高时颗粒发生团聚。在1350,1550和1750 ℃下合成的ZrB2粉宏观平均粒径50分别为13.16,12.67和16.55 μm,颗粒越分散,粉体的宏观平均粒径越小。在1350,1550和1750 ℃下合成的ZrB2粉体的氧含量为分别为0.62%,0.10%和0.25%,1550 ℃温度下合成的粉末碳含量为1.5%,比相同温度下采用单硼源合成粉末的纯度低。

图8 ZCB1粉末在不同温度下合成ZrB2粉体的SEM形貌
图9所示是ZGB3粉末在不同温度下合成ZrB2粉体的SEM形貌。从图中可看出,随反应温度升高,ZrB2粉体颗粒由柱状向近球状和长径比较小的柱状转变,颗粒之间团聚现象减轻。低温时原子迁移速度慢,所以合成的ZrB2颗粒烧结在一起呈大颗粒存在。随温度升高,原子迁移速度更快,颗粒析出越彻底,因而呈单颗粒存在。温度越高,提供液相的B2O3挥发速度越快,ZrB2颗粒轴向生长受到限制,颗粒形貌为近球状和长径比较小的柱状同时存在。

图9 ZGB3粉末在不同温度下合成ZrB2粉体的SEM形貌
在1350,1550和1750 ℃下合成ZrB2粉的宏观平均粒径50分别为21.47,12.57和12.42 μm,温度较低时,ZrB2颗粒未析出而呈大颗粒存在,粒径较大;随温度升高,颗粒析出完成,因而粉体粒径减小。在1350,1550和1750 ℃下合成ZrB2粉的氧含量分别为5.126%,0.24%和0.10%,碳含量分别为3.76%,1.72%和0.42%,碳氧含量均比相同温度下采用单硼源合成粉末时高,纯度较采用单硼源时低。
3 结论
1) 采用ZrO2-B4C-C和ZrO2-B4C-B2O3-C这2种反应体系,硼/碳热还原制备ZrB2粉体,随反应温度升高,产物中ZrO2,C和O含量减少,ZrB2纯度提高;用石墨充当碳源时,适当加入过量的B可提高ZrB2粉体的纯度;相同温度条件下,ZrO2-B4C-C体系合成的ZrB2粉体纯度较高。
2) 与炭黑相比,用石墨做碳源需在较高温度下并加入过量的B才能获得高纯ZrB2粉体;用石墨做碳源时,与单一硼源相比,使用双硼源时需要加入更多过量的B。
3) 随合成温度升高,ZrB2粉末的粒径先减小后增大,在单硼源条件下,由炭黑合成的ZrB2粉末形貌由表面有棱角的柱状变为表面光滑的柱状直至不规则块状,由石墨合成的ZrB2粉末形貌由柱状变为近球状直至近球状和柱状同时存在。
4) 采用ZrO2+B4C+炭黑混合粉在1350 ℃保温1.5 h,可获得氧含量为0.49%,碳含量为0.23%,硼与锆的平均原子比为1:1.99的ZrB2粉体,纯度不低于99%。
[1] 刘国玺, 郭在在, 燕东明, 等.二硼化锆超高温陶瓷的研究进展[J]. 兵器材料科学与工程, 2012, 35(1): 102−106. LIU Guoxi, GUO Zaizai, YAN Dongming, et al. Research and development of ZrB2ultra-high temperature ceramics[J]. Ordnance Material Science and Engineering, 2012, 35(1): 102− 106.
[2] 邓晓军, 谢征芳.硼化锆基超高温陶瓷研究进展[J]. 现代化工, 2012, 32(7): 20−25. DENG Xiaojun, XIE Zhengfang. Development of zirconium boride based ultrahigh temperature ceramics[J]. Modern Chemical Industry, 2012, 32(7): 20−25.
[3] 田庭燕, 张玉军, 张娜, 等.二硼化锆系复合材料研究进展[J]. 现代技术陶瓷, 2005, 26(4): 21−23. TIAN Tingyan, ZHANG Yujun, ZHANG Na, et al. Research and development of zirconium diboride composites[J]. Advanced Ceramics, 2005, 26(4): 21−23.
[4] 冯大淦.非金属热电偶及其热电性能[J]. 自动化仪表, 1994, 15(7): 8−12. FENG Dagan. Nonmetal thermoelectric couple and its thermoelectric propertie[J]. Automatic Instruments, 1994, 15(7): 8−12.
[5] 李友芬, 王德伟, 王舒凡.二硼化锆及其在耐火材料中应用[J]. 现代技术陶瓷, 2006, 27(3): 26−29. LI Youfen, WANG Dewei, WANG Shufan. Application of zirconium boride in refractory linings[J]. Advanced Ceramics,2006, 27(3):26−29.
[6] 王天奇, 周立娟, 张泳昌.二硼化锆涂层材料的研究进展[J]. 中国陶瓷, 2013, 49(6): 5−8. WANG Tianqi, ZHOU Lijuan, ZHANG Yongchang. Research progress of zirconium boride coating material[J]. China Ceramics, 2013, 49(6): 5−8
[7] 贾成科, 张鑫, 任先京, 等.硼化物陶瓷基涂层制备技术的研究进展[J]. 热喷涂技术, 2012, 4(1): 5−11. JIA Chengke, ZHANG Xin, REN Xianjing, et al. Research progress of preparation technology on the borie ceramic-based coating[J]. Thermal Spray Technology, 2012, 4(1): 5−11.
[8] MILLET P, HWANG T. Preparation of TiB2and ZrB2: Influence of a mechanochemical treatment on the borothermic reduction of titania and zireonia[J]. Journal of Materials Science, 1996, 31(2): 351−355.
[9] LI Fei, KANG Zhuang, HUANG Xiao, et al. Synthesis of ZrB2nanofibers by carbothermal reduction via electrospinning[J]. Chemical Engineering Journal, 2013, 234(1): 184−188.
[10] 马成良, 封鉴秋, 王成春, 等.二硼化锆粉体的工业合成[J]. 硅酸盐通报, 2008, 27(3): 622−625. MA Chengliang, FENG Jianqiu, WANG Chengchun, et al. Synthesis of ZrB2powders in industry[J]. Bulletin of the Chinese Ceramic Sociey, 2008, 27(3): 622−625.
[11] GUO Weiming. ZHANG Guojun. Reaction processes and characterization of ZrB2powder prepared by boron/carbothermal reduction of ZrO2in vacuum[J]. Journal of the American Ceramic Society, 2009, 92(1): 264−267.
[12] ZHAO Hong, HE Yu, JIN Zongze. Preparation of zirconium boride powder[J]. Journal of American Ceramic Society, 1995, 78(9): 2534−2536.
[13] 方舟, 王皓, 傅正义. Zr-B体系自蔓延高温合成ZrB2陶瓷粉末[J]. 硅酸盐学报,2004, 32(8): 1016−1018. FANG Zhou, WANG Hao, FU Zhengyi. Preparation of ZrB2ceramics powder in Zr-B systerm bu self-propagating high-temperature synthesis[J]. Journal of the Chinese Ceramic Society, 2004, 32(8): 1016−1018.
[14] JI Huiming, YANG Ming, LI Minmin, et al. Low-temperature synthesis of ZrB2nano-powders using a sorbitol modified sol–gel processing route[J]. Advanced Powder Technology, 2014, 25(3): 910−915.
[15] 贾全利, 张海军, 贾晓林, 等.溶胶−凝胶微波碳热还原制备二硼化锆粉体[J].材料导报,2007, 21(11A): 65−67. JIA Quanli, ZHANG Haijun, JIA Xiaolin, et al. Microwave carbothermal synthesis of ZrB2powders using sol-gol presursors [J]. Materials Review, 2007, 21(11A): 65−67.
[16] QIU Huiyu, GUO Weiming, ZOU Ji, et al. ZrB2powders prepared by boro/carbothermal reduction of ZrO2: The effects of carbon source and reaction atmosphere[J]. Powder Technology, 2012, 217(2): 462−466.
[17] NI Dewei, ZHANG Guojun, KAN Yanmei, et al. Synthesis of monodispersed fine hafnium diboride powders using carbo/borothermal reduction of hafnium dioxide[J]. Journal of the American Ceramic Society, 2008, 91(8): 2709−2712.
[18] 张海军, 贾全利, 贾晓林, 等.微波碳热还原低温合成ZrB2粉体的研究[J]. 材料导报, 2007, 21(11A): 61−64. ZHANG Haijun, JIA Quanli, JIA Xiaolin, et al. Study on sythesis ZrB2powders by microwave carborthermal reduction at low temperature[J]. Materials Review, 2007, 21(11A): 61−64.
[19] 叶大伦, 胡建华. 实用无机物热力学数据手册[M]. 第2版. 北京: 冶金工业出版社, 2002. YE Dalun, HU Jianhua. Handbook of Thermodynamic Data for Practical Inorganic Materials[M]. The second edition. Beijing: Metallurgical Industry Press, 2002.
[20] PESHEV P, BLIZNAKOV G. On the borothermic preparation of titanium, zirconium and hafnium diborides[J]. Journal of Less-Common Metals, 1968, 14(1): 23−32.
[21] LIU Jixuan, KAN Yanmei, ZHANG Guojun. Synthesis of ultra-fine hafnium carbide powder and its pressureless sintering[J]. Journal of the American Ceramic Society, 2010, 93(4): 980−986.
[22] 李瑞. 超细二硼化锆粉体的合成与机理研究[D]. 武汉: 武汉理工大学. LI Rui. Study on synthesis and mechanism of ultrafine ZrB2[D]. Wuhan: Wuhan Institute of Technology.
(编辑 汤金芝)
Effects of temperature and raw materials composition on high-purity ZrB2powders prepared by boro/carbothermal reduction
FENG Huili, HUANG Qizhong, SU Zhean
(State Key Laboratory of Powder Metallurgy, Central South University, Changsha 410083, China)
ZrB2powders were synthesized using ZrO2, two kinds of boron sources (B4C and B2O3) and two kinds of carbon sources (graphite and carbon black) as raw materials in argon atmosphere with the reaction system of ZrO2-B4C-C and ZrO2-B4C-B2O3-C. The effects of heating temperature, carbon source, boron source and reaction system on the purity, morphologies and powder size of ZrB2powders were studied. The results show that the purity of ZrB2powders can be improved by elevating the reaction temperature. Adding the appropriate amount of excessive B4C can also enhance the purity when the graphite is used as carbon source. More excessive B should be added when using both B4C and B2O3as boron source. Compared with graphite, the carbon black can be used to synthesize ZrB2powders with lower temperature and no excess B. When the mole ratio of ZrO2/B4C is 2, the columnar ZrB2with purity over 99% can be synthesized at 1350 ℃ for 1.5h in argon atmosphere using ZrO2, B4C and carbon black as raw materials, the macroscopical average grain size of ZrB2powders is 12.67 μm.
ZrB2; boro/carbothermal reduction; high-purity; carbon source; synthesis process
TQ174.75
A
1673-0224(2017)02-212-09
国家重点基础研究发展规划(973计划)资助项目(2011CB605801)
2016−03−14;
2016−06−22
黄启忠,教授,博士。电话:0731 88877671;E-mail: qzhuang@csu.edu.cn
