三疣梭子蟹PtCrustin3成熟肽在毕赤酵母中的重组DNA表达
2017-05-22卢希阳
卢希阳,陶 妍
上海海洋大学 食品学院,上海水产品加工及贮藏工程技术研究中心,上海 201306
三疣梭子蟹PtCrustin3成熟肽在毕赤酵母中的重组DNA表达
卢希阳,陶 妍*
上海海洋大学 食品学院,上海水产品加工及贮藏工程技术研究中心,上海 201306
Crustin抗菌肽是一类由甲壳动物表达的具有抗菌作用的小分子肽,它们在动物抵御病原微生物侵染的免疫系统中发挥了重要作用,被认为是替代抗生素的良好候选者。Crustin的N端含有一个信号序列,与之相连接的C端为成熟肽序列,内含一个WAP(Whey acidic protein)结构域,为Crustin的活性区域;根据信号肽与WAP结构域之间的结构差异,可以将Crustin分为三种类型。本文以三疣梭子蟹(Portunus trituberculatus)I型Crustin的一个同工型“PtCrustin3”的成熟肽(mPtCrustin3)为研究对象,通过RT-PCR从鳃中克隆到编码mPtCrustin3的cDNA,并通过巢式PCR对其添加EcoRⅠ和XbaⅠ酶切位点以及6×His标签。以pPICZαA为真核表达载体,成功构建了重组表达载体pPICZαA-mPtCrustin3,电转入毕赤酵母X-33,在29℃、250 r/m的条件下,经1.0%甲醇诱导表达96 h后,获得的表达产物经Tricine-SDS-PAGE分析,证明分子量约为11.6 kD的重组体mPtCrustin3在毕赤酵母X-33中被成功表达。
三疣梭子蟹;RT-PCR;PtCrustin3成熟肽;毕赤酵母;重组表达
Relf等[1]首次从普通滨蟹(Carcinus maenas)血细胞中分离到Crustin抗菌肽,其分子量为11.5 kD、富含脯氨酸和半胱氨酸。Crustin的N端含有一个信号序列,与之相连接的C端为成熟肽序列,内含一个WAP(Whey acidic protein)结构域,该结构域包含8个保守的半胱氨酸残基,形成一个含有4个二硫键的紧密包裹结构,是Crustin的主要功能域[2]。Smith等[3]根据Crustin信号肽与WAP结构域之间的结构差异,将Crustin分为三种类型。I型Crustin:主要存在于蟹类、螯虾和龙虾等甲壳动物中,在信号肽与WAP结构域之间存在一个序列长度多变、富含半胱氨酸残基的结构域;II型Crustin:主要存在于对虾中,在信号肽与WAP结构域之间不仅富含半胱氨酸,还富含甘氨酸;III型Crustin:在信号肽与WAP结构域之间既没有半胱氨酸残基也没有甘氨酸残基,故被称为SWD(Single-whey domain)蛋白,亦或Antileukoproteinase-like蛋白或者Chelonianin-like蛋白。抑菌实验表明,Crustins除了对微球菌属、气球菌属、动性球菌属、葡萄球菌属、链球菌属、棒状杆菌属和芽孢杆菌属等革兰氏阳性菌有抑菌活性外[1,4‒6],还对铜绿假单胞菌(Pseudomonas aeruginosa)、溶藻弧菌(Vibrio alginolyticus)等革兰氏阴性菌有不同程度的抑菌活性[7]。
2013年,Cui等[7]从三疣梭子蟹(Portunus trituberculatus)的鳃和眼柄中分离到编码I型Crustin的三种同工型基因(PtCrustin1、PtCrustin2、PtCrustin3),并对其中的PtCrustin3成熟肽基因进行了大肠杆菌原核表达,获得的重组体PtCrustin3成熟肽显示了一定的抑菌作用。然而,原核表达系统存在无翻译后折叠修饰功能、易在细胞内形成包涵体等众所周知的缺点[8],且不适合大规模制备。相比之下,毕赤酵母(Pichia pastoris)表达系统能高效表达外源蛋白、表达稳定性高,并具有翻译后修饰功能,有利于获得具生物学活性的重组蛋白,并适合扩大制备[9]。据此,本研究以三疣梭子蟹I型Crustin的PtCrustin3成熟肽(mPtCrustin3)为研究对象,旨在初步建立基于毕赤酵母表达系统的mPtCrustin3的重组DNA表达方法,为进一步扩大制备和对其生物学功能的研究奠定基础。
1 材料与方法
1.1 材 料
三疣梭子蟹(400 g)购自上海芦潮港海鲜市场。毕赤酵母X-33菌株及表达载体pPICZαA为Invitrogen公司(美国)产品;大肠杆菌DH5α为本实验室保存;限制性内切酶EcoRⅠ、XbaⅠ、SacⅠ和T4 DNA连接酶以及克隆质粒pMD-19T simple购自TaKaRa公司(日本)。胰蛋白胨、酵母粉为OXOID公司(英国)产品。博来霉素为Invitrogen公司(美国)产品;DNA回收试剂盒、质粒提取试剂盒、酵母DNA提取试剂盒、DNA分子量标准、蛋白质分子量标准和PCR反应试剂均购自天根生化科技有限公司(北京)。引物合成由上海生工生物工程有限公司完成。其他试剂为国产或进口分析纯。
1.2 总RNA提取和第一链cDNA合成
三疣梭子蟹运至实验室后,取其眼柄和鳃快速置于液氮中冻结,按照RNAiso Plus说明书提取总RNA。第一链cDNA的合成按照Prime Script试剂盒(TaKaRa)操作:总RNA 6 μL、Oligo(dT)Primer (50 μmol/L)1 μL、dNTP Mixture(10 mmol/L each)1 μL、ddH2O 2 μL混匀,65℃保温5 min,冰上迅速冷却;依次加入5×Buffer 4 μL、RNase inhibitor(40 U/μL)0.5 μL、Prime Script RTase(200U/)1 μL (200 U)、RNase Free dH2O 4.5 μL,缓慢混匀后42℃保温30~60 min;95℃保温5 min,冰上冷却后得到第一链cDNA。
1.3 含限制性酶切位点的mPtCrustin3基因的PCR扩增

图1 通过PCR扩增目的基因的策略图Fig.1 Strategic map for PCR amplification of target gene
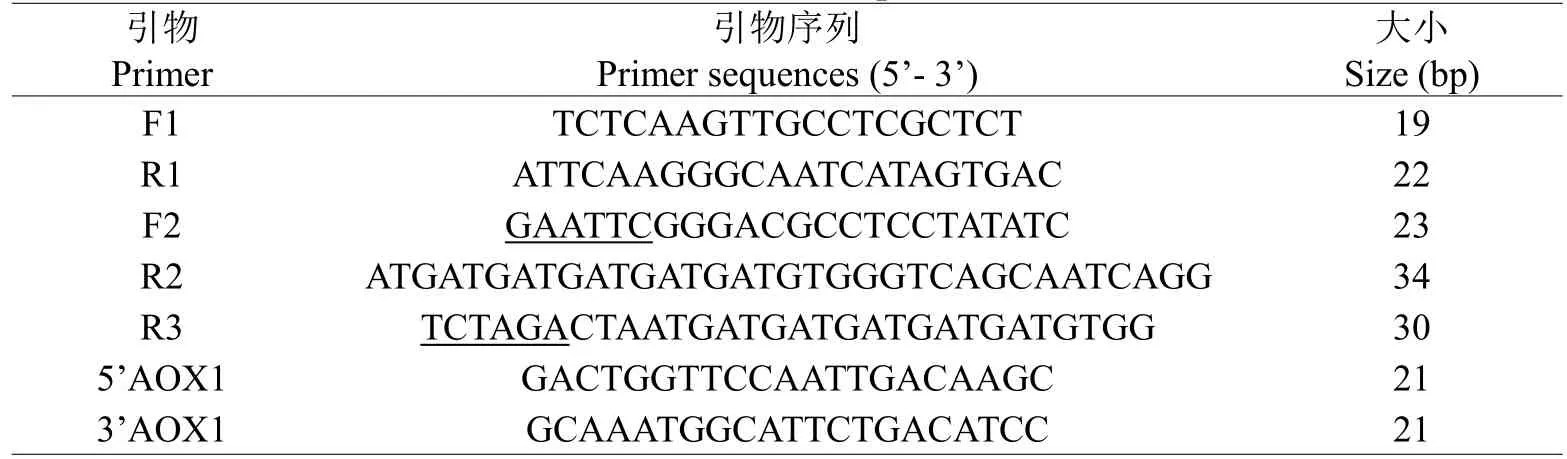
表1 引物序列Table 1 Primer sequences
PCR策略如图1所示,参考PtCrustin3的cDNA序列(GenBank注册号:JQ728424)设计一对特异性引物F1和R1(表1),以第一链cDNA为模板进行第一次PCR,反应体系和条件为:上下游引物(10 mol/L)各0.8 L、10×Buffer 2.0 L、dNTP(2.5 mmol/L)1.6 L、Taq DNA聚合酶(2.5 U/L)0.2 L、DNA模板0.5 L,加无菌水至20 L;94℃预变性3 min、94℃变性30 s、退火(56.5℃)30 s、72℃延伸1 min,最终72℃延伸5 min,30个循环。以第一次PCR产物为模板,设计含EcoRⅠ酶切位点的前引物F2和含6×His标签的后引物R2(表1)进行第二次PCR,反应体系和条件同第一次PCR,除了退火温度改为56℃;再以第二次PCR产物为模板,设计含XbaⅠ酶切位点的后引物R3(表1),采用F2与R3进行第三次PCR,反应体系和条件同第一次PCR,除了退火温度改为57.9℃。第三次PCR产物经割胶纯化后与pMD-19T质粒连接得到重组质粒pMD-19T-mPtCrustin3,转化大肠杆菌DH5α感受态细胞,37℃培养过夜,挑1个阳性克隆由上海生工生物工程有限公司测序。
1.4 Crustin氨基酸序列的多重比对及分子系统树的构建
使用DNAMAN6.0对Crustin全长氨基酸序列进行多重比对,各序列来自NCBI网站,序列号分别为:PtCrustin3(GenBank登录号:AFU61580.1)、美洲螯龙虾(Homarus americanus,GenBank登录号:ABM92333.1)、眼斑龙虾(Panulirus argus,GenBank登录号:AAQ15293.1)、欧洲龙虾(Homarus gammarus,GenBank登录号:CAH10349.1)、远海梭子蟹(Portunus pelagicus1,GenBank登录号:ABM65762.1;Portunus pelagicus2,GenBank登录号:AFN37210.1)、罗氏沼虾(Macrobrachium rosenbergii,GenBank登录号:ACL15396.1)、日本囊对虾(Marsupenaeus japonicas,GenBank登录号:AME17866.1)、紫螯青蟹(Scylla tranquebarica1,GenBank登录号:AGU01540.1;Scylla tranquebarica2,GenBank登录号:AFI56572.1)、挪威海螯虾(Nephrops norvegicus,GenBank登录号:CCE46014.1)、日本仿长额虾(Pandalopsis japonica1,GenBank登录号:AFN80342.1;Pandalopsis japonica2,GenBank登录号:AGU01543.1)。分子系统树根据上述生物Crustin全长的氨基酸序列构建,采用MEGA6.0邻位相联法,各结点的置信度由自引导值估计,重复次数为1000。
1.5 重组表达载体pPICZαA-mPtCrustin3的构建及电转化毕赤酵母X-33
采用EcoRⅠ和XbaⅠ对测序无误的pMD-19T-mPtCrustin3进行双酶切,将获得的目的片段mPtCrustin3与经相同酶处理过的表达载体pPICZαA混合,在T4 DNA连接酶作用下,16℃反应过夜;转化感受态细胞DH5α后,37℃培养过夜;通过菌落PCR、双酶切和DNA测序鉴定重组表达载体pPICZαA-mPtCrustin3。采用SacⅠ对其酶切后,以1:8(V/V)与毕赤酵母X-33感受态细胞混合,转入预冷的0.2 cm电转杯中,冰浴5 min,1.5 kV、25 F、200 Ω,电击5 ms,立即加入1 mL预冷的1 mol/L的山梨醇,离心后菌体涂布于含100 μg/mL博来霉素的YPDS平板(1%酵母提取物、2%胰蛋白胨、2%D(+)葡萄糖、1 mol/L山梨醇、2%琼脂),30℃培养72 h至单克隆产生。
1.6 甲醇利用快速型酵母转化子的筛选和鉴定
挑取10个单菌落分别接种至MM平板(1.34%YNB、0.4 mg/L生物素、5 mL/L甲醇、15 g/L琼脂)和MD平板(1.34%YNB(Yeast Nitrogen Base without Amino Acids)、0.4 mg/L生物素、20 g/L葡萄糖、15 g/L琼脂)上,筛选甲醇利用快速型转化子。对筛选到的酵母转化子提取基因组DNA,以此为模板,采用pPICZαA的通用引物5'AOX1和3'AOX1进行PCR鉴定。
1.7 mPtCrustin3的诱导表达及Tricine-SDS-PAGE
挑取经鉴定无误的酵母转化子接种于25 mL BMGY培养基(1.34%YNB、0.4 mg/L生物素、1%甘油、100 mmol/L磷酸钾缓冲液,pH 6.0)中,29℃、250 r/min培养至OD600为3.0-6.0;离心(5000 r/min)收集菌体,重悬于100 mL BMMY培养基(配方同BMGY培养基,除了1%甲醇取代甘油)中,调OD600至1.0,30℃、250 r/min培养96 h,每隔24 h补加甲醇至总体积的1.0%;收集发酵培养液用作Tricine-SDS-PAGE分析,浓缩胶浓度4%,夹层胶浓度10%,分离胶浓度16.5%,超低分子量蛋白标准由中科瑞泰(北京)生物科技有限公司提供。
2 结果
2.1 通过PCR扩增含酶切位点的mPtCrustin3基因
第一次PCR扩增到一个557 bp长度的片段(图2-A),该片段应编码PtCrustin3前体肽(由N端的信号肽和C端的成熟肽组成),并含部分5’和3’非编码区;以此片段为模板,第二次PCR扩增到一个306 bp的片段(图2-B),该片段应编码PtCrustin3的成熟肽(mPtCrustin3),其5’端和3’端应分别含EcoRⅠ酶切位点和6×His标签;以此片段为模板,第三次PCR扩增到一个315 bp的片段(图2C),该片段的3’端应含XbaⅠ酶切位点。最后一次PCR产物经克隆进pMD-19T质粒和DNA测序,证明两个限制性酶切位点和6×His标签被成功添加(图3);推断的氨基酸序列表明该基因编码102个氨基酸残基,除去N端的2个额外残基(E,F)和C端的的6个组氨酸残基外,其余94个残基组成了mPtCrustin3区域,且10个高度保守的半胱氨酸残基位于该区域内。
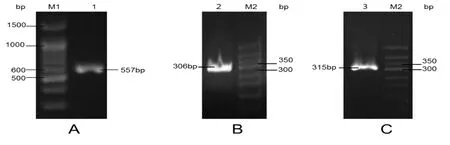
图2 目的基因的PCR扩增Fig.2 PCR amplification of target gene

图3 编码mPtCrustin3的cDNA及其推断的氨基酸序列Fig.3 Nucleotide and deduced amino acid sequences of mPtCrustin3
2.2 不同来源Crustin之间氨基酸序列的比较
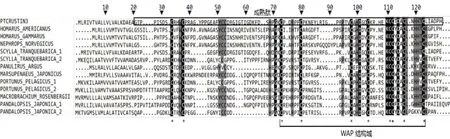
图4 不同来源Crustin氨基酸序列的多重比较Fig.4 Multiple comparison of Crustin amino acid sequence from different species
对不同来源Crustin一级结构的多重比对结果如图4所示,不同来源的Crustin氨基酸序列中显示了14个高度保守的氨基酸残基(黑色阴影),它们均位于成熟肽区域中,其中11个高度保守的残基位于WAP结构域区域,内有8个半胱氨酸残基在空间上可以形成4对二硫键,被认为与Crustin的稳定和抗菌活性有关,由此证明了WAP结构域的重要性。在被比较的甲壳类动物中,与PtCrustin3同源性最高的是远海梭子蟹同工型1(76%),其次是眼斑龙虾(53%);其余来源的Crustin与PtCrustin3之间的氨基酸同源性在37~44%(表2)。

表2 不同来源Crustin之间氨基酸序列的同源性Table 2 Homology of the Crustin amino acid sequences among different species
2.3 基于Crustin氨基酸序列的分子系统树分析
由图5可见,根据不同Crustin氨基酸序列构建的分子系统树可分为1个大的分支和1个小分支。三疣梭子蟹PtCrustin3和远海梭子蟹同工型1位于大分支下面的1个小分支,由自引导值100支持,证明它们之间的亲缘关系最近,该分子系统树的分析结果与氨基酸序列多重比对的结果基本一致。

图5 基于Crustin氨基酸序列的分子系统树Fig.5 Molecular phylogenetic tree based on Crustin amino acid sequence
2.4 构建重组表达载体pPICZαA-mPtCrustin3及其鉴定
将上述经测序验证的mPtCrustin3片段与表达载体pPICZαA连接以获得重组表达载体pPICZαA-mPtCrustin3(图6)。转化感受态细胞DH5α后,使用载体上的引物5’AOX1和3’AOX1进行菌落PCR鉴定,由图7A可见,在约835 bp处有明显条带,与理论值相符;另一方面,采用EcoRⅠ和XbaⅠ对重组表达载体pPICZαA-mPtCrustin3进行双酶切验证,由图7B泳道3可见,仅显示了1个大分子量的条带(切下目的片段后剩下的载体片段),却未见315 bp目的片段的条带(可能由于浓度太低);但未酶切的阴性对照(泳道4)显示了一个更大分子量的条带,初步证明重组表达载体pPICZαA-mPtCrustin3已构建成功。此外,DNA测序结果也证明mPtCrustin3与pPICZαA正确连接,未发生基因变异。
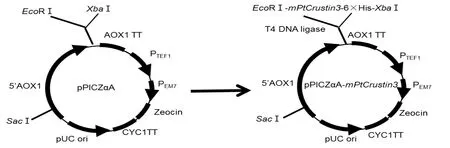
图6 重组表达载体pPICZαA-mPtCrustin3的构建Fig.6 Construction of recombinant expression vector pPICZαA-mPtCrustin3
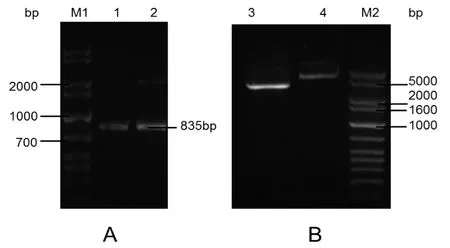
图7 pPICZαA-mPtCrustin3的菌落PCR(A)和双酶切鉴定(B)Fig.7 Identification of pPICZαA-mPtCrustin3 by colony PCR(A)and restriction endonuclease digestion(B)
2.5 酵母转化子的筛选及其鉴定
将重组表达载体pPICZαA-mPtCrustin3电转入毕赤酵母X-33细胞后,经含100 μg/mL博来霉素的YPDS平板、MM和MD平板筛选后,获得10株甲醇利用快速型酵母转化子;选择2株经YPD液体培养基过夜培养后,提取其酵母基因组DNA为模板,使用载体上的通用引物5’AOX1和3’AOX1进行PCR验证,如图8所示,2株样品均在2200 bp和835 bp处有明显条带,前者为毕赤酵母X-33中因存在醇氧化酶基因AOX1自身的引物结合位点而扩增的条带,后者为含目的基因的扩增条带,与理论值相符。由此证明pPICZαA-mPtCrustin3成功嵌合进毕赤酵母基因组DNA。

图8 酵母转化子的PCR鉴定Fig.8 PCR identification of yeast transformants
2.6 重组体mPtCrustin3的诱导表达及Tricine-SDS-PAGE分析
对上述筛选到的1号酵母转化子采用BMM培养基、1%甲醇诱导表达96 h后,离心取上清用作Tricine-SDS-PAGE分析,由图9可见,与阴性对照(含pPICZαA空质粒的酵母转化子)相比,该酵母转化子在小于14.4 kD处有明显的条带,接近理论分子量位置(11.6 kD),证明重组体mPtCrustin3被成功表达。

图9 培养液上清的Tricine-SDS-PAGE分析Fig.9 Tricine-SDS-PAGE analysis for supernatants from culture solutions
3 讨论
迄今为止,仅Cui等[7]报道了三疣梭子蟹PtCrustin3成熟肽在大肠杆菌中的重组DNA表达,并且是以融合蛋白的形式表达的,显然不利于目的蛋白的获取。鉴于此,本研究拟通过构建毕赤酵母表达系统,以期实现三疣梭子蟹mPtCrustin3的真核重组表达,所选的宿主菌为野生型毕赤酵母X-33,其对外源蛋白具有较好的分泌和适应能力[10],有利于获得目的蛋白。由本研究结果可知,基本上已实现上述目标,但在进一步的研究中还有待于对有些方面进行改变和完善。例如,图9中1号泳道的目的条带下方还显示了1个淡条带,其原因分析如下:载体pPICZαA中α因子信号肽的N端存在Kex2和Ste13两个切割位点,若在Kex2位点处被切割的话,目的片段5’端的EcoR I与Kex2位点之间的序列会导致重组体mPtCrustin3的N端额外引入6个氨基酸残基;另一方面,虽然Ste13位点被切割的效率不高,但若在该位点被切割的话,可能导致重组体mPtCrustin3的N端引入2个或4个额外的氨基酸残基,由此获得分子量不同的目的蛋白。上述两种情况均不能获得天然的N末端,该结果是否会对重组体mPtCrustin3的空间结构以及生物学活性产生影响还有待于进一步的研究。进一步的研究将聚焦于选择合适的限制性内切酶,以期获得具有天然N末端的重组体mPtCrustin3。
因本研究中目的蛋白在毕赤酵母中的表达量较低,故图9显示的是对发酵液上清进行浓缩处理后的电泳结果。关于表达量低的原因可能与使用的是天然cDNA有关,经分析,编码mPtCrustin3的94个氨基酸残基的天然密码子中有7个密码子对于毕赤酵母而言属于低频密码子。已有研究表明,对密码子进行优化可提高目的蛋白在毕赤酵母中的表达量[11‒14],因此在后续研究中将根据毕赤酵母的密码子偏爱性,对目的基因进行优化合成,以期提高目的蛋白的表达量。
4 结论
本研究通过RT-PCR从三疣梭子蟹鳃中克隆到编码PtCrustin3成熟肽的基因mPtCrustin3,经巢式PCR获得含EcoRⅠ和XbaⅠ酶切位点及6×His标签的目的基因,经与pPICZαA连接成功构建重组表达载体pPICZαA-mPtCrustin3,转化至毕赤酵母X-33后,在29℃、250 r/m下,经1%甲醇诱导培养96 h后,成功表达重组体mPtCrustin3。本研究为进一步研究三疣梭子蟹PtCrustin3的功能及其应用奠定了良好基础。
[1]Relf JM,Chisholm JRS,Kemp GD,et al.Purification and characterization of a cysteine-rich 11.5-kDa antibacterial protein fromthegranularhaemocytesoftheshorecrabCarcinusmaenas[J].EuropeanJournalofBiochemistry,1999,264(2):350-357
[2]Mu C,Zheng P,Zhao J,et al.A novel type I crustin(CrusEs2)identified from Chinese mitten crab Eriocheir sinensis [J].Fish&Shellfish Immunology,2011,31(1):142-147
[3]Smith VJ,Fernandes JMO,Kemp GD,et al.Crustins:Enigmatic WAP domain-containing antibacterial proteins from crustaceans[J].Developmental&Comparative Immunology,2008,32(7):758-772
[4]Afsal VV,Antony SP,Bright AR,et al.Molecular identification and characterization of Type I crustin isoforms from the hemocytes of portunid crabs,Scylla tranquebarica and Portunus pelagicus[J].Cellular Immunology,2013,284(1-2):45-50
[5]Yu AQ,Shi YH,Wang Q.Characterisation of a novel Type I crustin involved in antibacterial and antifungal responses in the red claw crayfish,Cherax quadricarinatus[J].Fish&Shellfish Immunology,2016,48(1):30-38
[6]Imjongjirak C,Amparyup P,Tassanakajon A,et al.Molecular cloning and characterization of crustin from mud crab Scylla paramamosain[J].Molecular Biology Reports,2009,36(5):841-850
[7]Cui Z,Song C,Liu Y,et al.Crustins from eyestalk cDNA library of swimming crab Portunustri tuberculatus:molecular characterization,genomicorganizationandexpressionanalysis[J].Fish&ShellfishImmunology,2012,33(4):937-945
[8]Jonasson P,Liljeqvist S,Nygren PA,et al.Genetic design for facilitated production and recovery of recombinant proteins in Escherichia coli[J].Biotechnology and Applied Biochemistry,2002,35(2):91-105
[9]Macauley-Patrick S,Fazenda ML,McNeil B,et al.Heterologous protein production using the Pichia pastoris expression system[J].Yeast,2005,22(4):249-270
[10]曹慕琛,徐健勇,罗立超,等.黑曲霉糖化酶基因的克隆及其在毕赤酵母X-33中的表达[J].安徽农业科学,2011,39(14):8226-8230
[11]宋长丰,陶妍,赵冬梅,等.斑点叉尾鮰铁调素成熟肽在毕赤酵母中的表达及其抑菌活性[J].农业生物技术学报,2015,23(3):380-387
[12]简思美,蔡斌斌,吴程,等.基因改造AiiA蛋白在毕赤酵母中的表达[J].福建师范大学学报:自然科学版,2015,31(6):55-63
[13]刘真英,李文利.密码子优化后的柞蚕溶菌酶在酵母中的表达及活性测定[J].微生物学通报,2016,43(2):292-300
[14]孙风敏,韩焱,李文利.基于密码子优化的蛋白酶K在毕赤酵母中的表达及分离纯化[J].微生物学通报,2014,41(11):2198-2207
Recombinant DNAExpression of PtCrustin3 Mature Peptide from Portunus trituberculatus in Pichia pastoris
LU Xi-yang,TAO Yan*
Shanghai Engineering Research Center of Aquatic-Product Processing&Preservation/College of Food Science and Technology/Shanghai Ocean University,Shanghai 201306,China
Crustins are series of small molecular antimicrobial peptides expressed mainly in crustaceans.They play important roles in the animal immune system against pathogenic microorganism infection,thus,they are considered to be good candidates to replace antibiotics.The N-terminal of Crustin contains a signal sequence and its C-terminal contains a mature peptide sequence including the WAP(whey acidic protein)domain.The mature peptide is responsible for bioactivity of Crustin.According to structural differences of the region between signal peptide and WAP domain,Crustin can be divided into three types.The present study focused on the mPtCrustin3,the mature peptide of an isoform for Crustin typeI from Portunustri tuberculatus.The cDNA encoding mPtCrustin3 was cloned from gill of P.tuberculatus by RT-PCR.EcoR I site, and XbaⅠsite and 6×His tag were added to 5’and 3’of this cDNA,respectively,by nested PCR.This target fragment was ligated to pPICZ α A vector to construct a recombinant expression vector pPICZ α A-mPtCrustin3.Then the pPICZαA-mPtCrustin3 was transformed into competent Pichia pastoris X-33 cells.Recombinant mPtCrustin3 was induced with 1.0%(V/V)methanol at 29℃,250 r/m for 96 h.Tricine-SDS-PAGE analysis demonstrated that the expressed product was the recombinant mPtCrustin3 with molecular weight of about 11.6 kD.
Portunus trituberculatus;RT-PCR;Ptcrustin3 mature peptide;Pichia pastoris;recombinant expression
TQ465.6
:A
:1000-2324(2017)02-0303-07
10.3969/j.issn.1000-2324.2017.02.029
2016-06-01
:2016-07-12
上海市教育委员会产学研项目(15CXY30);农业部都市农业(南方)重点实验室开放基金(UA201307)
卢希阳(1989-),男,硕士研究生,研究方向:水产生物分子生物学.E-mail:125119453@qq.com
*通讯作者:Author for correspondence.E-mail:ytao@shou.edu.cn
