ERK1/2通路在低氧上调大鼠PASMCs钙激活性氯离子通道表达的作用*
2017-05-20赵美平马迎春张聪聪黄林静郑梦晓黎关龙王万铁
赵美平, 马迎春, 张聪聪, 黄林静, 郑梦晓, 黎关龙, 应 磊,2, 王万铁,2△
(1. 温州医科大学基础医学院病理生理学教研室, 2. 温州医科大学缺血-再灌注损伤研究所, 浙江 温州 325035; 3. 兰州军区兰州总医院病理科, 甘肃 兰州 7300504; 4. 浙江省医学科学院卫生学研究所毒理学研究室, 杭州 310013)
ERK1/2通路在低氧上调大鼠PASMCs钙激活性氯离子通道表达的作用*
赵美平1, 马迎春3+, 张聪聪1, 黄林静1, 郑梦晓1, 黎关龙4, 应 磊1,2, 王万铁1,2△
(1. 温州医科大学基础医学院病理生理学教研室, 2. 温州医科大学缺血-再灌注损伤研究所, 浙江 温州 325035; 3. 兰州军区兰州总医院病理科, 甘肃 兰州 7300504; 4. 浙江省医学科学院卫生学研究所毒理学研究室, 杭州 310013)
目的:探讨钙激活性氯离子通道(CLCA2)在大鼠低氧性肺动脉平滑肌细胞(PASMCs)中mRNA和蛋白表达的变化及其与ERK1/2信号通路的关系。方法:PASMCs随机分为:常氧组(N组),低氧组(H组),DMSO对照组(D组), U0126干预组(U组),Staurosporine aglycone干预组(SA组),采用免疫印迹法检测CLCA2蛋白的表达;选用半定量逆转录-聚合酶链反应(RT-PCR)技术测定CLCA2 mRNA水平的表达。结果:PASMCs中CLCA2 mRNA和蛋白的表达量,H组较N组明显上调(P<0.01);U组较D组明显上调(P<0.01);SA组较D组mRNA的表达显著下调(P<0.01),蛋白的表达轻微下调。结论:低氧可上调CLCA2中 mRNA和蛋白在PASMCs的表达;ERK1/2通路激活剂-Staurosporine aglycone能下调CLCA2在PASMCs中 mRNA和蛋白的表达量;ERK1/2通路抑制剂-U0126可上调CLCA2在PASMCs中 mRNA和蛋白的表达量。
钙激活性氯离子通道;低氧; PASMCs;ERK1/2;大鼠
【DOI】 10.12047/j.cjap.5436.2017.011
研究表明[1],存在于肺动脉内皮细胞和平滑肌细胞上的氯离子通道,大多是钙激活性氯离子通道(calcium activated chloride channel, CLCA2)和容量激活性氯离子通道(volume activated chloride channel,C1swell)。慢性低氧会诱导大鼠肺动脉平滑肌细胞上的钙激活性氯离子通道,增强血管持续收缩,产生细胞增殖、血管重建进而导致肺动脉高压的形成。而细胞外信号调节激酶(extracellular signal regulated kinase1/2, ERK1/2)表达的变化主要见于肺小动脉平滑肌细胞和内皮细胞[2]。以往研究发现[3],低氧能激活肺动脉平滑肌上的氯离子通道和ERK。那么钙激活性氯离子通道与ERK1/2之间是否存在一定联系呢? ERK1/2是否为钙激活性氯离子通道的上下游信号通路呢?为了阐明这一问题,本实验利用培养细胞法观察了CLCA2在大鼠低氧性肺动脉平滑肌细胞(pulmonary artery smooth muscle cells,PASMCs)中mRNA和蛋白表达的变化,初步探讨了CLCA2与 ERK1/2信号通路之间的关系,为临床低氧性肺动脉高压发病机制的研究及其防治提供实验依据。
1 材料与方法
1.1 材料
SPF级标准健康雄性SD大鼠14只, 体重(body weight, BW) 200±50 g, 由温州医科大学实验动物中心提供[SCXK(浙)2010-0101号]
1.2 试剂及仪器
U0126(美国, Sigma公司); Staurosporine aglycone(美国,Sigma公司); 二甲基亚砜(dimethyl sulfoxide, DMSO,上海申工生物技术有限公司); α-SM actin鼠单克隆抗体、辣根过氧化物酶(HRP)标记的羊抗兔二抗(英国,abcam公司);胎牛血清、DMEM高糖培养基、胰酶/EDTA(美国,Gibco公司);CLCA2兔抗人多克隆抗体(美国,Sigma公司);HRP标记β-actin(上海,康城公司);50 bp DNA Marker、RT-PCR试剂盒(Fermentas life sciences公司);RT-PCR引物(上海生工生物工程技术服务有限公司);PVDF膜(美国,Milipore公司);彩色预染蛋白maker(MBI,Fermentas公司);BCA蛋白定量试剂盒、增强化学发光试剂盒(美国,Pierce公司)。
生物倒置相差显微镜XDS-1B(重庆光学仪器设备厂);低氧培养箱(Herareus, 美国);显微外科用显微镜(Olympus, 日本); 恒温二氧化碳培养箱(Thermo Forma,美国); 722N分光光度计(上海精密科学仪器有限公司); EXL-808酶标仪(USA); 稳压稳流电泳仪(DYY-3型,北京六一仪器厂); 蛋白电泳转移系统(Bio-Rad公司);凝胶定量软件Quantity One(Bio-Rad公司);PCR仪(Thermo Hybaid, 美国)。
1.3 方法
1.3.1 PASMCs的培养 具体操作步骤详见参考文献[4]。
1.3.2 PASMCs的鉴定 普通光学显微镜下细胞形态鉴定:倒置相差显微镜下观察细胞形态并摄片;免疫荧光染色法鉴定:先将细胞以合适密度接种于盖玻片上,放入常氧培养箱中培养 1~2 d,用PBS清洗细胞爬片,4%的多聚甲醛固定细胞10~15 min,PBS漂洗3次,用3% H2O2去离子水封闭后结合血管平滑肌α-SM actin单抗(用PBS稀释1∶100),4℃过夜后避光加入FITC标记的浓度为1∶100的山羊抗小鼠IgG二抗,室温避光孵育20~30 min。PBS漂洗后滴加细胞核染色液DAPI(1∶1 000稀释),室温避光孵育3~5 min,PBS洗3次,免疫荧光显微镜下对同一视野以不同激发波长(FITC:激发光波长488 nm,发射光峰值525 nm;DAPI:358 nm的激发光波长,461 nm的发射光峰值)观察并拍照。
1.3.3 实验分组 实验前将SD大鼠4~6代肺动脉平滑肌细胞置于无血清的DMEM培养液中24 h,分为5组,每组6皿细胞;分别为:(1)常氧组(N): 21% O2, 5% CO2,37℃,DMEM培养基培养48 h; (2)低氧组(H): 2% O2, 5% CO2, 37℃, DMEM培养基培养48 h; (3) DMSO对照组(D): 2% O2, 5% CO2, 37℃,0.05% DMSO培养 48 h; (4) U0126干预组(U): 2% O2, 5% CO2, 37℃, 10 μmol/L U0126,DMEM培养基培养, 48 h; (5)Staurosporine aglycone干预组(SA):2% O2, 5% CO2, 37 ℃, 30 μmol/L Staurosporine aglycone,DMEM培养基培养48 h。
1.3.4 蛋白免疫印迹法及RT-PCR法检测PASMCs CLCA2的蛋白及mRNA含量 具体操作步骤详见参考文献[4]。
1.4 统计学处理
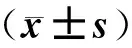
2 结果
2.1 原代培养大鼠PASMCs的培养和鉴定
2.1.1 细胞形态学生长特点 选取预先准备好的SPF级SD雄性大鼠,从其身上分离出原代肺动脉平滑肌细胞[5],离体培养后的2~3 d开始增殖,6~7 d开始融合呈典型的“峰谷”状生长,肺动脉平滑肌细胞为贴壁细胞,呈长梭形,镜下观察可见其折光性较好,细胞核可为多个(图1)。
2.1.2 免疫细胞荧光法鉴定PASMCs 染色后在免疫荧光显微镜下观察,约99%呈阳性反应,胞浆内细丝状发绿色荧光且与PASMCs长轴平行的为FITC标记的平滑肌α-actin,实为平滑肌α-肌动蛋白,仅平滑肌细胞呈阳性反应;经DAPI染色细胞核呈蓝色荧光(图2)。

Fig. 1 Rat PASMCs by primary culturing(×100)

Fig. 2 Immunobiochemical identification of rat PASMCs(×400)
2.2 各组PASMCs上CLCA2 mRNA表达的变化
2.2.1 低氧对PASMCs上CLCA2 mRNA表达的影响 与N组(0.841±0.039)相比 ,H组(1.116±0.013)CLCA2 mRNA表达量显著增加,有统计学意义(P<0.01,图3、图4)。

Fig. 3 Expression of CLCA2 mRNA in all groups


2.2.2 低氧条件下U0126对PASMCs上CLCA2 mRNA表达的影响 与N组(0.841±0.039)比较, D组(1.121±0.038)、U组(1.812±0.013)、SA组(1.051±0.041)CLCA2 mRNA表达均明显上调(P<0.01);与H组(1.116±0.013)比较,D组(1.121±0.038)CLCA2 mRNA表达无明显差异);与D组(1.121±0.038)比较,U组(1.812±0.013)CLCA2 mRNA表达显著上调(P<0.01),SA组(1.051±0.041)CLCA2 mRNA表达显著下调(P<0.01,图3、图4)。
2.3 各组PASMCs上CLCA2蛋白表达的变化
2.3.1 低氧对CLCA2蛋白表达的影响 与N组(0.424±0.010)相比,H组(0.530±0.017)CLCA2蛋白的表达明显上调,差异有统计学意义(P<0.01,图5、图6)。
2.3.2 低氧条件下U0126对PASMCs上CLCA2蛋白表达的影响 与N组(0.424±0.010)比较,D组(0.533±0.007)、U组(0.568±0.007)、SA组(0.505±0.026)CLCA2蛋白的表达均明显上调(P<0.01);与H组(0.530±0.017)比较,D组(0.533±0.007)CLCA2蛋白的表达无显著差异;与D组(0.533±0.007)比较,U组(0.568±0.007)CLCA2蛋白的表达显著上调(P<0.01),SA组(0.505±0.026)CLCA2蛋白的表达下调,但无统计学差异 (图5、图6)。

Fig. 5 Expression of CLCA2 protein in all groups

3 讨论
研究表明[6,7],钙激活性氯离子通道在肺动脉平滑肌细胞的兴奋机制中起到重要作用,慢性低氧会诱导肺动脉平滑肌细胞上的钙激活性氯离子通道上调,导致血管反应增强,收缩增加,在调控血管张力和收缩性方面起重要作用。细胞膜氯离子的静息通透性相对较大,血管平滑肌细胞静息膜电位约-55 mv,氯离子平衡电位约-34 mv,故激活CLCA2可引起肺动脉血管强烈收缩等去极化效应[8]。有研究发现[9],在生理状态下,CLCA2参与了苯肾上腺素引起的肺主动脉收缩,PASMCs上CLCA2的重要性是由于有相对高的细胞内氯离子浓度,[Ca2+]i升高是激活此通道的必要条件。本研究发现:CLCA2在 PASMCs中mRNA和蛋白的表达量,低氧较常氧环境明显升高。表明低氧可上调CLCA2在PASMCs中 mRNA和蛋白的表达量,其机制尚不完全明确,可能与低氧环境下PASMCs 膜通透性增加,[Ca2+]i升高进而激活CLCA2,引起细胞内氯离子外流,被激活的CLCA2使细胞膜去极化,电压依赖性钙通道开放,更多Ca2+内流进而引起肺动脉平滑肌细胞收缩、增殖等一系列反应[10]。
有文献指出[11],间歇低氧可引起ERK蛋白表达,进而激活ERK信号通路。本室先前的研究[12]也表明,在低氧高二氧化碳条件下,ERK1/2通路抑制剂-U0126可抑制二级肺动脉的Ⅱ期持续收缩反应。本实验发现:应用ERK1/2通路抑制剂-U0126后,CLCA2在大鼠PASMCs中 mRNA和蛋白的表达量高于对照组DMSO组,应用Staurosporine aglycone后,CLCA2在大鼠PASMCs中 mRNA和蛋白的表达水平不同程度下调,均低于对照组DMSO组。除SA组CLCA2蛋白表达结果较D组而言未达统计学意义外,U0126组CLCA2mRNA及蛋白、SA组CLCA2mRNA较对照组D组有统计学意义。以上结果提示,ERK1/2通路可参与调控SD大鼠低氧性PASMCs中CLCA2 mRNA和蛋白表达, ERK1/2可能是CLCA2的上游调控分子,但具体情况有待进一步深入研究。
综上所述,低氧可上调CLCA2在PASMCs中 mRNA和蛋白的表达量;ERK1/2通路激活剂-Staurosporine aglycone能下调CLCA2在PASMCs中 mRNA和蛋白的表达量;ERK1/2通路抑制剂-U0126可上调CLCA2在PASMCs中 mRNA和蛋白的表达量。
[1] 马建法. 肺动脉平滑肌细胞离子通道在肺动脉高压中的作用[J]. 重庆医学, 2014, 43(12): 1518-1520.
[2] We C, Li HZ, Wang YH,etal. Exogenous spermine inhibits the proliferation of human pulmonary artery smooth muscle cells caused by chemically-induced hypoxia via the suppression of the ERK1/2- and PI3K/AKT-associated pathways[J].IntJMolMed, 2016, 37(1): 39-46.
[3] Young KC, Torres E, Hehre D,etal. Antagonism of Stem Cell Factor/c-kit Signaling Attenuates Neonatal Chronic Hypoxia-Induced Pulmonary Vascular Remodeling[J].PediatrRes, 2016, 79(4): 637-646.
[4] 黄林静, 黎关龙, 何金波, 等. 钙激活性氯离子通道在大鼠低氧高二氧化碳性PASMCs中的表达及与MAPK通路的关系[J]. 中国细胞生物学学报, 2013, 35(9): 1321-1327.
[5] 王 静, 戴爱国. 原代大鼠肺动脉平滑肌细胞的提取和鉴定以及缺氧对其增殖的影响[J]. 中国呼吸与危重监护杂志, 2012, 11(02):147-152.
[6] Sun H, Xia Y, Paudel O,etal. Chronic hypoxia-induced upregulation of Ca2+-activated Cl-channel in pulmonary arterial myocytes: a mechanism contributing to enhanced vasoreactivity[J].JPhysiol, 2012, 590(15): 3507-3521.
[7] 刘建华, 张晓芸, 李 鑫, 等. CaCCs通道钙离子依赖性机制的研究进展[J]. 现代生物医学进展, 2015, 15(29): 5782-5785.
[8] 王 蕊, 李 丽, 马克涛, 等. 钙激活氯通道对大鼠脑基底动脉舒缩活动的影响[J]. 生理学报, 2014, 66(03): 295-301.
[9] 杨 朝. 急性低氧大鼠肺动脉平滑肌内质网钙信号的变化及意义[J]. 中国病理生理杂志, 2008, 24(10): 2016-2019.
[10]潘宣任, 王 凯, 庞玉生. 钙激活性氯离子通道抑制剂对肺动脉平滑肌作用的研究进展[J]. 重庆医学, 2015, 44(26): 3699-3701.
[11]张盼盼, 韩晓庆, 李 琳, 等. 间歇低氧大鼠细胞外信号调节激酶与认知功能变化[J]. 中国神经精神疾病杂志, 2014, 40(9): 517-521.
[12]朱阿楠, 王万铁, 林丽娜, 等. MAPK通路抑制剂对低氧高二氧化碳性肺动脉收缩的影响[J]. 中国病理生理杂志, 2008, 24(8): 1538-1542.
The effects of ERK1/2 pathway on the expression of calcium activated chloride channel in hypoxia in PASMCs rat model
ZHAO Mei-ping1, MA Ying-chun3+, ZHANG Cong-cong1, HUANG Lin-jing1, ZHENG Meng-xiao1, LI Guan-long4, YING Lei1,2, WANG Wan-tie1,2△
(1. Department of Pathophysiology, Wenzhou Medical University, 2. Research Institute of Wenzhou Medical University in ischemia-reperfusion injury, Wenzhou 325035; 3. Department of Pathology, Lanzhou General Hospital of Lanzhou Military Region, Lanzhou 730050; 4. Zhejiang Provincial Academy of Medical Sciences and Health Research Institute of Toxicology Laboratory, Hangzhou 310013, China)
Objective: To investigate the expression of mRNA and protein of Calcium activated chloride channel (CLCA2) in hypoxic pulmonary artery smooth muscle cell (PASMCs) of rat and it’s relationship with ERK1/2 signal pathway. Methods: PASMCs were randomly divided into 5 groups including normal group(N group), hypoxia group(H group), DMSO group(D group), U0126 group (U group) and Staurosporine aglycone group(SA group). The protein expression of CLCA2 in PASMCs was detected by Western blot.The mRNA expression of CLCA2 was detected by half quantitative reverse transcription polymerase chain reaction (RT-PCR). Results: The mRNA and protein expressions of CLCA2 in H group were significantly higher than N group (P<0.01). Comparing with D group,the mRNA and protein expressions of CLCA2 were significantly increased in U group (P<0.01),the mRNA expression of CLCA2 in SA group was obviously decreased (P<0.01) with slightly decreasing of its protein expression. Conclusion: Hypoxia promotes the expressions of mRNA and protein of CLCA2 in rat PASMCs. The ERK1/2 pathway activator Staurosporine aglycone reduces the mRNA and protein expression of CLCA2 in rats PASMCs and the ERK1/2 pathway inhibitor U0126 induces the upregulation of the mRNA and protein expressiosn of CLCA2 in rats PASMCs.
calcium activated chloride channel; hypoxia; ERK1/2; rat
浙江省公益性技术应用研究计划项目(2015C37121)
2016-03-11 【修回日期】2016-10-22
R363
A
1000-6834(2017)01-047-04
△【通讯作者】Tel: 0577-86689817; E-mail: wwt@wmu.edu.cn;+: 并列第一作者
