β3-AR阻断剂SR59230A对大鼠胸主动脉张力及microRNA表达的影响*
2017-05-20赵倩倩景佳妮李海清李晓鹏崔香丽
赵倩倩, 景佳妮, 李海清, 刘 蓉, 李晓鹏, 崔香丽
(山西医科大学生理学系, 细胞生理学实验室, 太原 030001)
β3-AR阻断剂SR59230A对大鼠胸主动脉张力及microRNA表达的影响*
赵倩倩, 景佳妮, 李海清, 刘 蓉, 李晓鹏, 崔香丽1△
(山西医科大学生理学系, 细胞生理学实验室, 太原 030001)
目的:探讨β3肾上腺素受体(β3-AR)阻断剂SR59230A(SR)对大鼠胸主动脉张力和microRNA(miRNA)表达的影响。方法:44只正常雄性SD大鼠,24只用于观察SR对离体胸主动脉环张力的影响。另20只SD大鼠随机分为对照组(control)及SR组(n=10),SR组大鼠给予SR腹腔注射,control组大鼠给予等量生理盐水腹腔注射。给药5周后2组大鼠进行无创血压测量,并检测胸主动脉环对去甲肾上腺素诱导的张力;留取2组大鼠胸主动脉组织,检测SR对大鼠胸主动脉miRNA表达的影响。结果:①SR预孵时30 mmol/L KCl引起的离体血管环收缩张力增加(P<0.05);②SR在体给药5周后大鼠收缩压升高(P<0.05);③SR在体给药后去甲肾上腺素(NA)浓度为1 μmol/L和10 μmol/L时诱导大鼠胸主动脉环张力增加(P<0.05,P<0.01);④SR组大鼠胸主动脉18个miRNA表达下调,其中7个有统计学意义,分别是rno-miR-143-3p、rno-miR-29b-3p、rno-miR-31a-5p、rno-let-7b-5p、rno-miR-214-3p、rno-miR-222-3p和rno-miR-352;11个表达上调,其中4个有统计学意义,分别是rno-miR-206-3p、rno-miR-223-3p、rno-miR-342-3p、rno-miR-499-5p。结论:SR59230A可引起大鼠胸主动脉血管张力增加,在体给药后可使大鼠收缩压升高及胸主动脉rno-miR-143-3p、rno-miR-29b-3p、rno-miR-31a-5p、rno-let-7b-5p、rno-miR-214-3p、rno-miR-222-3p、rno-miR-352表达下调和rno-miR-206-3p、rno-miR-223-3p、rno-miR-342-3p、rno-miR-499-5p表达上调。
大鼠;SR59230A;胸主动脉;张力;microRNA
【DOI】 10.12407/j.cjap.5447.2017.002
肾上腺素受体在心血管系统的调节中起着很重要的作用,β1,2肾上腺素受体(β1,2adrenergic receptors,β1,2-AR)的作用已广被人知,随后β3-AR的出现再次引起人们的注意。该受体在心脏中主要介导心肌负性肌力效应[1, 2]。其在血管中介导血管舒张效应,1999年Trochu JN等研究发现选择性β3-AR激动剂SR 58611可产生血管舒张效应且该效应可被β3-AR阻断剂所抑制[3]。2002年,Rautureau Y等通过RT-PCR发现β3-AR在胸主动脉及分离出的内皮细胞中均可转录合成[4]。但是Brahmadevara N等人对β3-AR在血管的舒张效应持质疑态度[5, 6]。迄今为止,β3-AR在血管的作用及相关机制尚不明确。近年来miRNA在心血管疾病中的作用也逐渐受到人们的关注,研究发现miRNA可调节血管内皮细胞功能、血管平滑肌细胞增生、迁移等,综上可以推测β3-AR对血管的效应可能与其对血管miRNA的调控有关。所以本实验采用SR59230A干预观察其对大鼠胸主动脉miRNA表达的影响,从而为研究β3-AR血管效应的相关分子机制提供实验线索。
1 材料及方法
1.1 实验动物及分组
清洁级SD大鼠44只,体重180~220 g,购自中国人民解放军军事医学科学院实验动物中心(SCXK(京)2009-0019)。24只大鼠用于离体血管环实验,大鼠在室温22℃~25℃、湿度50%~60%、12 h∶12 h明暗交替的环境中饲养,自由摄入饮食与水,饲养2周后开始实验。其余20只大鼠随机分为control组和SR组(n=10):SR组大鼠给予SR腹腔注射5周,每次取SR59230A注射液1 ml,每日2次;Control组大鼠给予等量的生理盐水腹腔注射,同样在室温22℃~25℃、湿度50%~60%、12 h∶12 h明暗交替的环境中饲养,自由摄入饮食与水,给药结束后开始实验。SR59230A配制方法如下:25 mg的SR59230A溶解于2.5 ml DMSO配制成浓度为0.024 mol/L的SR59230A储存液。取此储存液35.4 μl溶解于10 ml的生理盐水,成为85 nmol/ml的SR注射液。
1.2 试剂
SR59230A(3-(2-Ethylphenoxy)-1-[[(1S)-1,2,3,4-tetrahydronaphth-1-yl]amino]-(2S)-2-propanol oxalate salt)、二甲基亚砜(DMSO)、乙酰胆碱(acetylcholine,Ach)均购自美国Sigma公司,重酒石酸去甲肾上腺素注射液购自天津金耀氨基酸有限公司,miRNeasy mini kit、miScript II RT Kit、miScript SYBR Green PCR kit、96 panel miScript miRNA PCR arrays、RNA Stabilization reagent、RNA zap购自德国QIAGEN公司。
1.3 离体血管灌流
1.3.1 血管环的制备 配制HEPES灌流液(mmol/L):NaCl 144,KCl 5.8, Glucose 11.1, HEPES 5.0, MgCl21.2, CaCl22.5,用1 mol/L的NaOH将pH调至7.4。将SD大鼠麻醉后迅速取出其胸主动脉,置于4℃ HEPES液中,小心分离周围的脂肪组织及结缔组织,将其剪成4~5 mm长的血管环,用相应直径的棉棒穿过血管擦拭去除内皮。将剪好的血管环置于盛有5 ml灌流液的水浴槽中,上端挂于连接张力换能器的细钢丝环,下端穿过固定的L型金属针,保持自然松弛状态。浴槽中灌流液温度为37.5℃并给予充氧。调零后给予血管环2 g的初始张力,15 min换1次灌流液,稳定60 min后用30 mmol/L KCl溶液预收缩来检验血管活性,血管张力达到2 g且相邻两次收缩幅度相差<10%即可用于实验。
1.3.2 内皮完整性检测 在灌流液中加入去甲肾上腺素(noradrenaline, NA)使其终浓度为1 μmol/L,血管收缩达平台期后加入Ach使其终浓度为10 μmol/L,观察血管舒张情况,舒张百分比达70%以上表示内皮完整性较好。
1.3.3 大鼠胸主动脉张力检测 (1)离体血管张力测定:分别保留和去除大鼠胸主动脉内皮,在SR预孵及不预孵的情况下给予30 mmol/L的KCl溶液预刺激,记录血管收缩达到平台期时的张力。(2)SR在体给药5周后血管张力检测:分别取2组大鼠胸主动脉环,随后按浓度累计法依次加入NA,使其终浓度为0.01、0.1、1、10 μmol/L,待收缩稳定后分别记录血管张力。
1.4 无创血压的测量
将待测大鼠放于BP-300A全自动大小鼠无创血压测量系统(购自成都泰盟科技有限公司)预热箱中,仪器开启后预热20~30 min,待其温度升高达到37℃后将大鼠置于合适的鼠笼并放于保温箱中,测量前检测传感器的灵敏度以及系统是否漏气,将加压套套至大鼠尾根端,传感器置于鼠尾中上部1/3处,待软件上显示出正常规律的脉搏波形后测量血压,连续测量3~5次取平均值。整个过程中注意保持环境安静,室温保持在25℃左右。
1.5 miScript miRNA PCR Arrays
1.5.1 大鼠胸主动脉总RNA的提取 按照miRNeasy Mini Kit说明进行操作,步骤如下:(1)留取2组大鼠胸主动脉组织,将其放入盛有700 μl Qiazol裂解液的研磨在冰上充分研碎,将研好的组织移至离心管中,室温静置5 min。(2)加入140 μl氯仿,震荡15 s,室温放置3 min,12 000 r/min 4℃离心15 min。(3)离心后将上清液移至新的离心管,1∶1.5加入无水乙醇,搅匀后将混合液移至过滤管(由无菌离心管及过滤网组成),9 200 r/min室温离心30 s。(4)离心后保留过滤网上的RNA沉淀物,弃去离心管中的液体,加入700 μl的RWT Buffer,同上离心;再次弃去离心管中的液体,加入500 μl的RPE Buffer,同上离心,重复两次。(5)换取新的离心管,打开盖子1 min挥发残余酒精。(6)均匀加入30~50 μl的RNase-free water,保证过滤网完全湿润,静置1~2 min使RNase-free Water与RNA完全互溶,24 000 r/min室温离心1 min,离心管中的液体即为提取出的RNA。(7)利用Nanodrop 2000c分光光度计测量RNA的浓度及纯度,纯度参考范围一般为1.8~2.2,检测结束后将其置于-80℃冰箱保存。
1.5.2 反转录 按照miRNA逆转录试剂盒说明计算反应体系,每个反应体系体积为20 μl,包含RNA样品:250~500 ng、miScript Reverse Transcriptase Mix:2 μl、5ⅹmiScriptHispec Buffer:4 μl、10ⅹmiScriptNucleics Mix:2 μl、其余为RNase-free Water。加好反应体系后震荡离心,反应条件为:37℃ 60 min,95℃ 5 min。反转录结束后置于4℃保存待用。
1.5.3 miScript miRNA PCR Arrays 采用QIAGEN的miScript SYBR Green PCR试剂盒,CFX96 Real-time PCR仪。miRNA PCR Array的反应体系总体积为2 750 μl,包含10ⅹmiScript Universal Primer:275 μl、2ⅹQuantiTect SYBR Green PCR Master Mix:1 375 μl、RNase-free water:1 000 μl、cDNA模板:100 μl。将所有成分加入预先备好的离心管中,震荡离心,随后加入miScript miRNA PCR Arrays 96孔盘中,每孔加25 μl反应体系。室温离心,放入荧光定量PCR仪中,反应条件为94℃ 15 s,55℃ 30 s,70℃ 30 s,40个循环。用基于ΔΔCT相对定量法分析实验结果。
1.6 统计学处理
2 结果
2.1 内皮完整性检测
在NA 1 μmol/L预收缩的基础上给予Ach,使其终浓度达到10 μmol/L,内皮完整时可诱导明显的舒张效应,其舒张百分比不小于70%(图1A),内皮去除时诱导的血管舒张减小(图1B)。
2.2 SR59230A对30 mmol/L KCl诱导的大鼠胸主动脉血管环张力的影响
取正常SD雄性大鼠的胸主动脉环,保留内皮且未预孵SR时30 mmol/L KCl诱导的大鼠胸主动脉环的张力为(2.20±0.08)g(n=6),当预孵SR时,其张力为(2.66±0.58)g(n=6)(P<0.05);去除内皮层且未预孵SR时30 mmol/L KCl诱导的大鼠胸主动脉环的张力为(2.51±0.14)g(n=6),当预孵SR后其张力为(2.77±0.33)g(n=9,P<0.05)。由以上结果可知SR预孵可使30mmol/L KCl诱导的大鼠胸主动脉环张力增大(图2)。
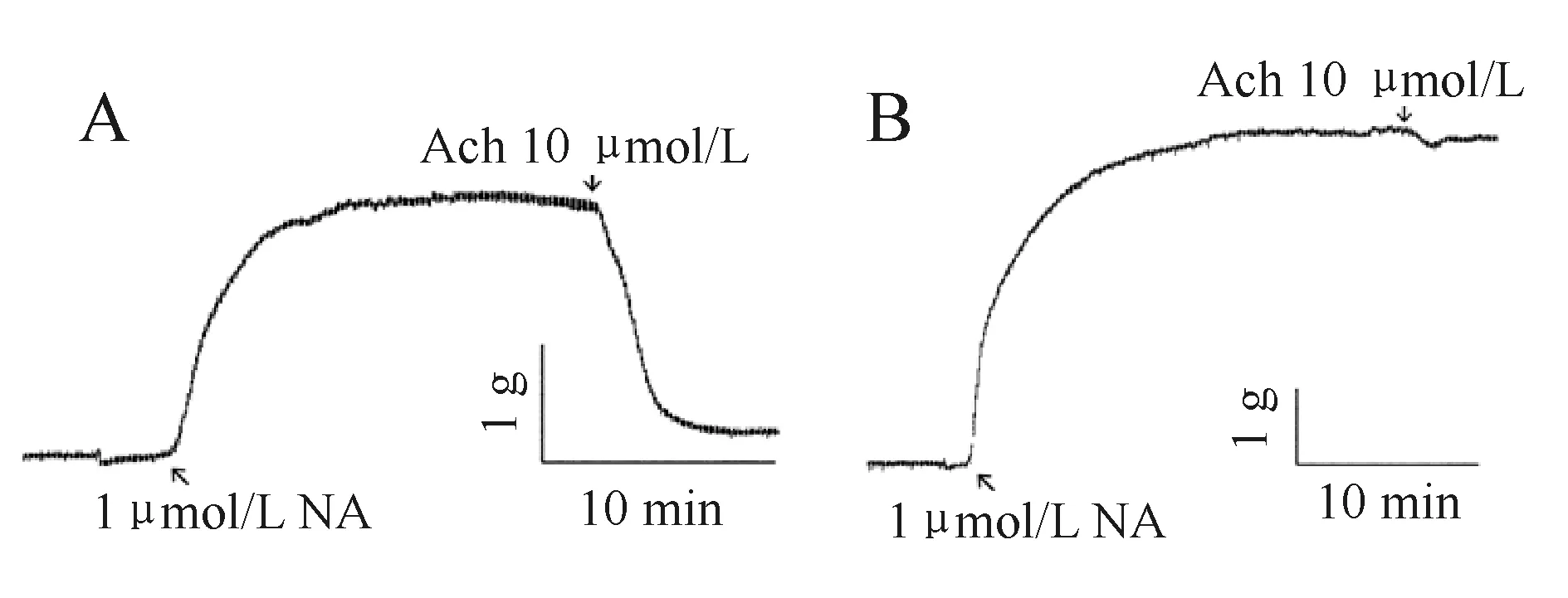
Fig. 1 Endothelium integrity of rat thoracic aorta rings A: Relaxation induced by Ach in endothelium-intact ring; B: Relaxation induced by Ach in endothelium-free ring; Ach: Acetylcholine; NA: Noradrenaline
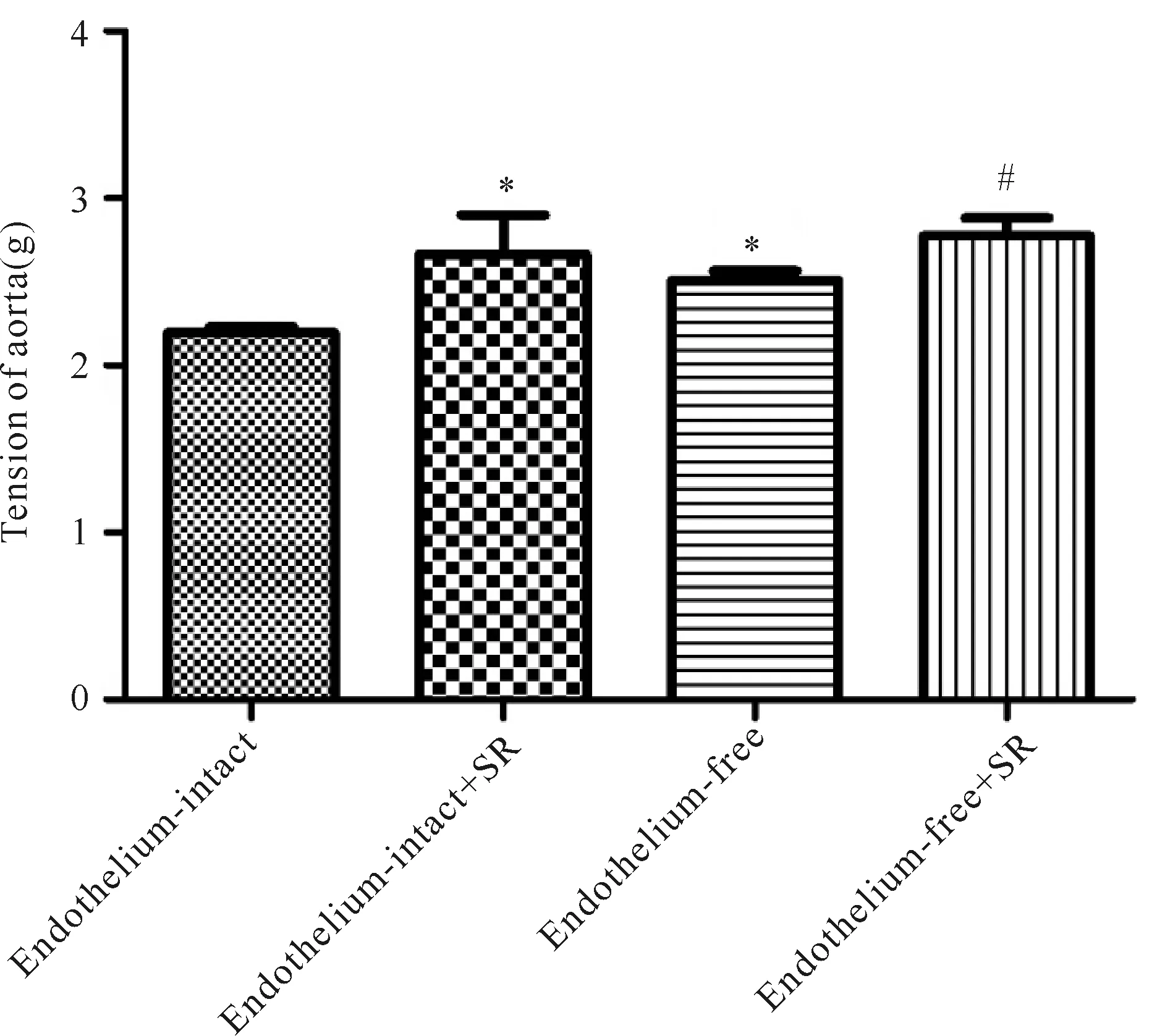
Fig. 2 Effect of SR59230A on the tension of rat thoracic aorta rings induced by 30 mmol/L KCl*P<0.05vsendothelium-intact group;##P<0.05vsendothelium-free group
2.3 SR59230A在体给药对大鼠血压的影响
SR在体给药5周后通过尾动脉无创血压测2组大鼠的收缩压及舒张压,SR组大鼠收缩压及舒张压都有升高的趋势,control组大鼠收缩压的均值为(123.40±9.44)mmHg(n=10),SR组大鼠的收缩压均值为(135.99±19.35)mmHg(n=6,P<0.05);Control组大鼠舒张压的平均值为(98.38±7.62)mmHg(n=10),SR组大鼠的舒张压均值为(107.56±15.27)mmHg(n=6,图3);由以上结果可知SR59230A在体给药后可使大鼠收缩压升高。
2.4 SR59230A在体给药后大鼠胸主动脉环对NA收缩力的检测
SR腹腔注射5周后取2组大鼠胸主动脉环离体灌流,待稳定后给予NA(0.01-10 μmol/L),1 μmol/L的NA诱导control组大鼠离体胸主动脉环产生的张力为(2.54±0.37)g(n=8,图4A),而诱导SR组大鼠离体胸主动脉环产生的张力为(3.28±0.81)g(n=10,P<0.05,图4B、图4C);10 μmol/L的NA诱导control组大鼠离体胸主动脉环产生的张力为(2.86±0.45)g(n=8,图4A),而诱导SR组大鼠离体胸主动脉环产生的张力为(3.68±0.78)g(n=10,P<0.01,图4B、图4C);由以上结果可知NA诱导SR组大鼠胸主动脉环产生的张力较大。
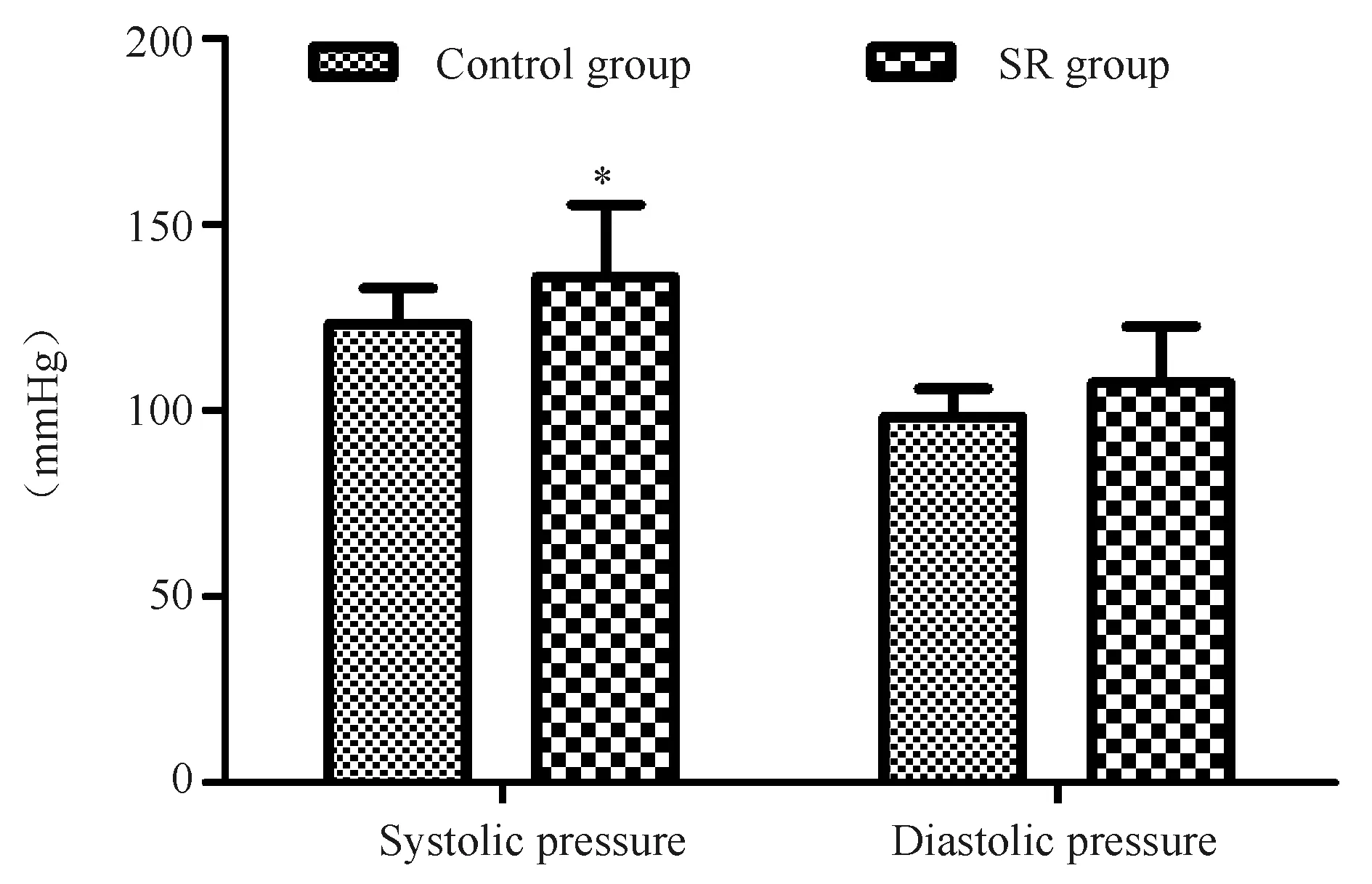
Fig. 3 Blood pressure measurement of rats*P<0.05vscontrol group
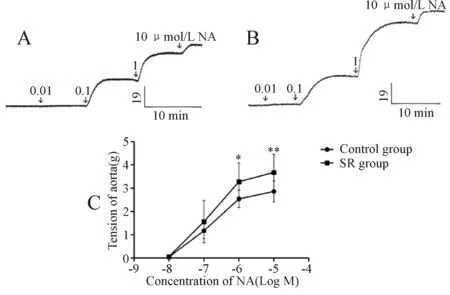
Fig. 4 Effect of SR59230A on the contraction of thoracic aorta induced by NA A: Control group (n=8); B: SR group (n=10); C: The contraction of rat thoracic aorta induced by NA(n=10); NA: Noradrena line*P<0.05,**P<0.01vscontrol group
2.5 SR59230A对大鼠胸主动脉miRNA表达的影响
采用miScript miRNA PCR arrays试剂盒对miRNA进行筛选后用基于ΔΔCT相对定量法分析。结果显示与control组相比,SR组大鼠胸主动脉有29个miRNA表达改变,18个miRNA表达下调,其中rno-miR-143-3p、rno-miR-29b-3p、rno-miR-31a-5p、rno-let-7b-5p、rno-miR-214-3p、rno-miR-222-3p、rno-miR-352变化有统计学意义(图5A),11个miRNA表达上调,其中rno-miR-206-3p、rno-miR-223-3p、rno-miR-342-3p、rno-miR-499-5p变化有统计学意义(图5B),推测这些miRNA的表达改变与β3-AR作用抑制有关。
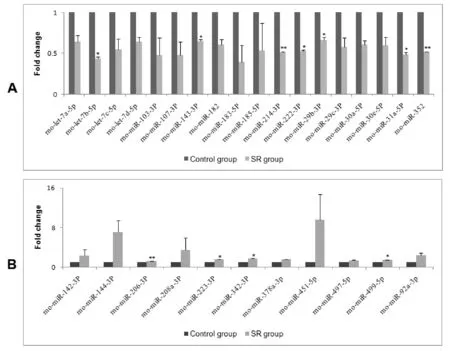
Fig. 5 Influence of in vivo SR59230A application on the expression of miRNA of rat thoracic aorta A: Up-regulated miRNA; B: Down-regulated miRNA*P<0.05,**P<0.01vscontrol group
3 讨论
本研究发现选择性β3-AR抑制剂SR59230A可使大鼠胸主动脉环张力增加,可见β3-AR在血管中诱导舒张效应。β3-AR最先发现于脂肪细胞,随后在许多系统中都发现β3-AR的存在,BRL 37344的舒张效应已被证实存在于大鼠离体胃肠道平滑肌束[7, 8],膀胱平滑肌及子宫平滑肌也都有β3-AR的分布且诱导舒张效应[9,10]。β-AR激动剂异丙肾上腺素、β3-AR激动剂SR 58611均可引起大鼠胸主动脉舒张效应且该舒张效应可被β3-AR阻断剂所阻断[3],但也有学者质疑β3-AR在大鼠胸主动脉的存在及作用[5,6]。李晓鹏采用形态学及功能学方法证明了β3-AR在大鼠胸主动脉存在及舒张效应[11]。本实验选用选择性β3-AR抑制剂SR59230A研究其对胸主动脉环张力的影响,进一步研究β3-AR的舒张效应及其作用机制,发现其可使大鼠离体胸主动脉环张力增加;SR在体给药后通过测量血压可知抑制β3-AR后可使大鼠收缩压升高,可知β3-AR可诱导大鼠胸主动脉舒张效应,这些结果提示β3-AR与高血压等疾病有关系。
β3-AR舒血管效应的机制尚不明确,近年来研究较多的是NOS和PKA信号转导途径[3,11]。本实验室已通过应用NOS抑制剂L-NNA及PKA抑制剂H-89表明β3-AR的舒血管效应与NOS和PKA途径有关[11]。本实验初步观察了β3-AR对miRNA表达调控的影响。miRNA是一类大约22个核苷酸组成的内源性非编码小分子RNA,通过抑制转录后基因表达或促进靶基因mRNA降解发挥作用。经研究发现它可参与个体发育、基因表达等生物学行为的调控,因此对基因功能的研究、疾病治疗及生物进化探索有重要意义。miRNA已被报道参与多种血管疾病如肺动脉高压、动脉粥样硬化等的调节。在动脉粥样硬化血管中,miR-103可能参与血管内皮炎症的调节[12]。miR-145与miR-143的共同作用可促进血管平滑肌分化和抑制平滑肌细胞增殖[13]。let-7f, miR-22, miR-30c等表达下调及miR-322,miR-451的表达上调已经在肺动脉高压大鼠肺组织得到证实[14]。许多研究者表明miR-21、miR-221/222、miR-24、miR-26a及miR-146a可直接介导血管平滑肌的增殖[15-17]。在此基础上我们推测β3-AR可通过调节胸主动脉miRNA表达来达到舒张血管的效应。基于上述假设,本实验采用miScript miRNA PCR Arrays 96孔盘(心血管系统特异的miRNA表达谱)对control组及SR组大鼠胸主动脉miRNA进行定量分析,发现SR组大鼠胸主动脉有29个miRNA发生改变,其中rno-miR-143-3p、rno-miR-29b-3p、rno-miR-31a-5p、rno-let-7b-5p、rno-miR-214-3p、rno-miR-222-3p、rno-miR-352的下调有统计学意义,rno-miR-206-3p、rno-miR-223-3p、rno-miR-342-3p、rno-miR-499-5p的上调有统计学意义。可见这些miRNA在大鼠胸主动脉的表达与β3-AR的抑制有关。
综上所述,本研究证明SR59230A可使大鼠胸主动脉张力增加,进一步证实了β3-AR的舒血管效应;同时发现抑制β3-AR可使大鼠胸主动脉rno-miR-143-3p、rno-miR-29b-3p、rno-miR-31a-5p、rno-let-7b-5p、rno-miR-214-3p、rno-miR-222-3p、rno-miR-352等表达下调以及rno-miR-206-3p、rno-miR-223-3p、rno-miR-342-3p、rno-miR-499-5p等表达上调,提示β3-AR的舒血管效应与miRNA的调控有关。本研究进一步加深人们对β3-AR的认识,为高血压等疾病的治疗靶点提供了新的实验依据,但β3-AR的效应与这些miRNA表达调控之间的关系及其机制还需进一步的研究。
[1] Gauthier C, Leblais V, Kobzik L,etal. The negative inotropic effect of beta3-adrenoceptor stimulation is mediated by activation of a nitric oxide synthase pathway in human ventricle [J].JClinInvest, 1998, 102(7): 1377-1384.
[2] Gauthier C, Tavernier G, Charpentier F,etal. Functional beta3-adrenoceptor in the human heart [J].JClinInvest, 1996, 98(2): 556-562.
[3] Trochu JN, Leblais V, Rautureau Y,etal. Beta 3-adrenoceptor stimulation induces vasorelaxation mediated essentially by endothelium-derived nitric oxide in rat thoracic aorta [J].BrJPharmacol, 1999, 128(1): 69-76.
[4] Rautureau Y, Toumaniantz G, Serpillon S,etal. Beta 3-adrenoceptor in rat aorta: molecular and biochemical characterization and signalling pathway [J].BrJPharmacol, 2002, 137(2): 153-161.
[5] Brahmadevara N, Shaw AM, MacDonald A. Evidence against beta 3-adrenoceptors or low affinity state of beta 1-adrenoceptors mediating relaxation in rat isolated aorta [J].BrJPharmacol, 2003, 138(1): 99-106.
[6] Brahmadevara N, Shaw AM, MacDonald A. ALpha1-adrenoceptor antagonist properties of CGP 12177A and other beta-adrenoceptor ligands: evidence against beta(3)-or atypical beta-adrenoceptors in rat aorta [J].BrJPharmacol, 2004, 142(4): 781-787.
[7] McLaughlin DP, MacDonald A.Evidence for the existence of 'atypical' beta-adrenoceptors (beta 3-adrenoceptors) mediating relaxation in the rat distal colon in vitro [J].BrJPharmacol, 1990, 101(3): 569-574.
[8]McLaughlin DP, MacDonald A. Characterization of catecholamine-mediated relaxations in rat isolated gastric fundus: evidence for an atypical beta-adrenoceptor [J].BrJPharmacol, 1991, 103(2): 1351-1356.
[9] Hristov KL, Cui X, Brown SM,etal. Stimulation of beta3-adrenoceptors relaxes rat urinary bladder smooth muscle via activation of the large-conductance Ca2+-activated K+channels [J].AmJPhysiolCellPhysiol, 2008, 295(5): C1344-1353.
[10]Bardou M, Loustalot C, Cortijo J,etal. Functional, biochemical and molecular biological evidence for a possible beta(3)-adrenoceptor in human near-term myometrium [J].BrJPharmacol, 2000, 130(8): 1960-1966.
[11]李晓鹏, 赵倩倩, 杨 岚. β3肾上腺素能受体对大鼠胸主动脉平滑肌舒缩活动的影响及其机制[J]. 中国应用生理学杂志, 2016, 32(1): 69-73.
[12]Hartmann P, Zhou Z, Natarelli L,etal. Endothelial Dicer promotes atherosclerosis and vascular inflammation by miRNA-103-mediated suppression of KLF4 [J].NatCommun, 2016, 7: 10521.
[13]Cordes KR, Sheehy NT, White MP,etal. miR-145 and miR-143 regulate smooth muscle cell fate and plasticity [J].Nature, 2009, 460(7256): 705-710.
[14]Rothman AM, Chico TJ, Lawrie A. MicroRNA in pulmonary vascular disease [J].ProgMolBiolTranslSci, 2014, 124: 43-63.
[15]Wu WH, Hu CP, Chen XP,etal. MicroRNA-130a mediates proliferation of vascular smooth muscle cells in hypertension [J].AmJHypertens, 2011, 24(10): 1087-1093.
[16]Ji R, Cheng Y, Yue J,etal. MicroRNA expression signature and antisense-mediated depletion reveal an essential role of MicroRNA in vascular neointimal lesion formation [J].CircRes, 2007, 100(11): 1579-1588.
[17]Liu X, Cheng Y, Zhang S,etal. A necessary role of miR-221 and miR-222 in vascular smooth muscle cell proliferation and neointimal hyperplasia [J].CircRes, 2009, 104(4): 476-487.
Effect of β3-AR antagonist SR59230A on the tension and microRNA expression of rat thoracic aorta
ZHAO Qian-qian, JING Jia-ni, LI Hai-qing, LIU Rong, LI Xiao-peng, CUI Xiang-li1△
(Department of Physiology, Cell Physiology Laboratory, Shanxi Medical University, Taiyuan 030001, China)
Objective: To explore the effects of SR59230A on the tension and microRNA (miRNA) expression of rat thoracic aorta. Methods: Forty-four SD rats were used in the experiment. Twenty-four rats were used to observe the effect of SR on the tension of thoracic aortic rings. Another 20 rats were randomly divided into control (n=10) and SR group(n=10). Rats in SR group were injected SR intraperitoneally,and in control group were given 0.9% of saline. After 5 weeks, the blood pressure of all rats were measured. Then the tension to NA and the expression of miRNA of thoracic aorta rings were measured. Results: (1) The tension of thoracic aortic rings responding to 30 mmol/LKCl were increased by pretreatment of SR (P<0.05); (2) After 5 weeks injection of SR, systolic pressure was increased (P<0.05); (3) The tension in SR group was increased in presence of 1 μmol/L and 10 μmol/L of NA (P<0.05,P<0.01). (4) After 5 weeks of SR in vivo application,18 miRNA were down-regulated, 7 of them had statistical significance, they were rno-miR-143-3p, rno-miR-29b-3p, rno-miR-31a-5p, rno-let-7b-5p, rno-miR-214-3p, rno-miR-222-3p and rno-miR-352; 11 miRNA were up-regulated, 4 of them had statistical significance, they were rno-miR-206-3p、rno-miR-223-3p、rno-miR-342-3p and rno-miR-499-5p respectively. Conclusion: SR59230A increased the tension of rat thoracic aorta. In vivo administration of SR led to increase of systolic pressure of rat,down-regulation of rno-miR-143-3p、rno-miR-29b-3p、rno-miR-31a-5p、rno-let-7b-5p、rno-miR-214-3p、rno-miR-222-3p、rno-miR-352 and up-regulation of rno-miR-206-3p、rno-miR-223-3p、rno-miR-342-3p and rno-miR-499-5p.
rat; SR59230A; thoracic aorta; tension; microRNA
山西省自然科学基金(2012201104-8);山西医科大学科技创新基金([2012]11号)
2016-04-20 【修回日期】2016-10-19
R3
A
1000-6834(2017)01-006-06
△【通讯作者】Tel: +86-0351-4135329; E-mail: cuixlcxl@sina.com
