从调控TGF-β/Smads通路途径探讨龙葵防治肝癌的机理*
2017-05-19杨旭峰
杨旭峰
广东省深圳市宝安区中心医院中医科(深圳 518102)
从调控TGF-β/Smads通路途径探讨龙葵防治肝癌的机理*
杨旭峰
广东省深圳市宝安区中心医院中医科(深圳 518102)
目的:探讨龙葵提取物对HepG2细胞增殖、侵袭力和细胞凋亡的影响,阐明龙葵防治肝癌细胞凋亡的机理。方法:选取肝癌患者50例为研究对象,采集其肝癌标本并将处于对数生长期的HepG2细胞分别加入合适浓度的龙葵提取物(龙葵组)、磷酸缓冲盐溶液(PBS组)、转化生长因子-β抑制剂Decorin(TGF-β组),采用TUNEI法及RT-PCR法检测凋亡细胞及HepG2细胞中TGF-β、SMAD3、SMAD4基因表达。结果:在抑制HepG2细胞增殖、降低侵袭力以及促进细胞凋亡比较上,龙葵组效果最佳,PBS组最差,TGF-β组居中, 且均P<0.05;三组TGF-β、SMAD3、SMAD4基因表达比较有统计学差异(均P<0.05)。结论:龙葵提取物可通过调控TGF-β/Smads通路来抑制肿瘤细胞增殖和侵袭力、促进细胞凋亡,对于肝癌的治疗具有重要意义。
原发性肝癌(Primary liver ancer,PLC)属于我国发病率较高的恶性肿瘤,高发年龄段集中在40~50岁之间,男性患者数量显著高于女性[1]。虽然外科手术切除病灶成为提高肝癌患者生存周期的有效手段,但是在临床中原发性肝癌手术切除率仅在20%左右,绝大多数患者在明确诊断时往往已经处于中晚期,错过了最佳手术时间窗[2]。尽管随着医学技术快速发展,肝动脉化疗栓塞术(Transcatheter arterial chemoembolization,TACE)治疗中晚期肝癌可取得一定效果,却不可避免的存在着肝、肾功能损害、机体免疫力下降等问题。大量研究证实,中医药在肝癌防治工作中可收获理想的疗效,特别是龙葵具有抗肿瘤活性,可应用于中晚期肝癌的防治,被我国中医学界列为了十大抗肿瘤中草药之一并引起了国内外的高度关注[3]。鉴于此,本次研究围绕从调控TGF-β/Smads通路途径对龙葵防治肝癌的机理予以深入分析,现报告如下。
资料与方法
1 一般资料 将来自于深圳市宝安区中心医院2015年5月至2016年5月期间内收治的50例肝癌患者为研究对象,其中男性肝癌患者38例,女性肝癌患者12例;年龄35~65岁,平均年龄(50.25±1.33)岁;病程10个月至2.5年,平均病程(20.25±1.25)个月;临床分期:Ⅰb 4例,Ⅱa 10例,Ⅱb 19例,Ⅲa 15例,Ⅲb 2例;临床表现:肝区疼痛37例,全身和消化道症状13例。诊断标准:所有肝癌符合中华人民共和国国家卫生和计划生育委员会颁布的《原发性肝癌诊疗规范(2015年版)》以下标准:①客观存在肝硬化以及乙型肝炎病毒(Hepatitis B virus,HBV)或丙型肝炎病毒(Hepatitis C virus,HCV)感染证据,即:HBV和/或HCV抗原阳性;②在动脉期,多排CT扫描和/或动态对比增强MRI检查结果显示有肝脏占位快速不均质血管强化,而在静脉期或延迟期肝脏占位快速洗脱;③血清AFP持续1个月≥400μg/L 或着持续2个月≥200μg/L,且除外其他原因所致[4]。
2 研究方法
2.1 细胞培养: 在征得患者知情同意下采集其肝癌标本并将处于对数生长期的HepG2细胞接种于培养瓶之中,培养液为DMEM培养液(含10%胎牛血清),随后置于37℃培养箱中隔天更换一次培养液,传代培养[5]。
2.2 龙葵提取物溶液制备: 将干燥的龙葵醇提物溶于DMSO之中并采用Hank’s平衡盐溶液进行稀释,此间DMSO的含量<0.05%(v/v)。
2.3 体外试验: ①HepG2细胞增殖,分别加入合适浓度的龙葵提取物(龙葵组)、磷酸缓冲盐溶液(PBS组)、转化生长因子-β(TGF-β组)抑制剂Decorin药物溶液,培养48 h后加入MTT溶液培养至52 h,采用酶标测试仪测定其吸光度值[6]。②HepG2细胞侵袭,将经过各种药物溶液预处理的HepG2细胞加入到Transwell小室的上室,经过培养后去除培养液后固定,HE染色并于显微镜下计数,以侵袭细胞的相对数目表示其侵袭能力。③HepG2细胞凋亡,采用TUNEI法测定其凋亡,所有操作步骤严格按照试剂盒说明书进行。
2.4 HepG2细胞中TGF-β、SMAD3、SMAD4基因表达的测定:将处于对数生长期的HEPG2细胞种植于6孔板并分别加入包含各组药物溶液的DMEM完全培养液,培育7 d后采用RT-PCR法测定不同组别HEPG2细胞中TGF-β、SMAD3、SMAD4基因表达含量[7]。
3 观察指标 ①HepG2细胞增殖、侵袭力和细胞凋亡;②HepG2细胞中TGF-β、SMAD3、SMAD4基因表达。
4 统计学方法 应用SPSS 17.0统计学软件,采用均数±标准差表示计量资料,进行t检验,P<0.05表示差异具有统计学意义。
结 果
1 三组对HepG2细胞增殖、侵袭力和细胞凋亡的影响 见表1。在抑制HepG2细胞增殖、降低侵袭力以及促进细胞凋亡比较上,龙葵组效果最佳,PBS组最差,TGF-β组居中,组间差异有统计学意义(P<0.05)。
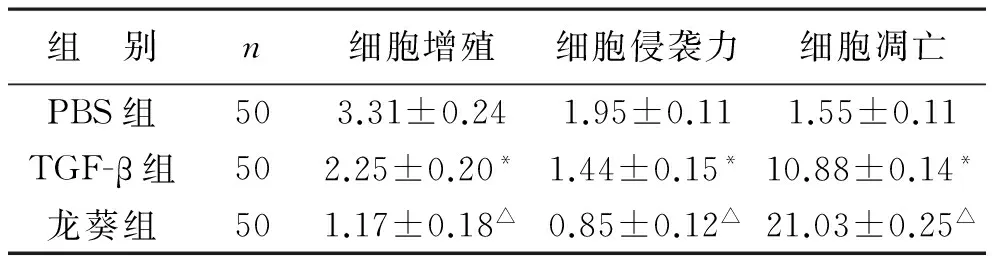
表1 三组对HepG2细胞增殖、侵袭力和细胞凋亡的影响(%)
注:与PBS组相比较, *P<0.05;与PBS组、TGF-β组相比较,△P<0.05
2 三组TGF-β、SMAD3、SMAD4基因表达比较 见表2。三组TGF-β、SMAD3、SMAD4基因表达比较,龙葵组优于其他两组且差异有统计学意义(P<0.05)。
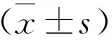
表2 三组TGF-β、SMAD3、SMAD4基因表达比较
注:与PBS组相比较,*P<0.05;与PBS组、TGF-β组相比较,△P<0.05
讨 论
龙葵为一年生直立草本植物,其味苦、性寒、微甘,自身伴有少量毒素,具有清热解毒、活血散结、利水消肿等功效[8]。由于龙葵中生物碱含量较高,在进入肝癌患者体内后可发挥出阻断和逆转肝癌前病变、抑制肿瘤细胞分裂与增殖、诱导癌细胞凋亡、调节机体免疫能力、保护肝肾功能等作用[9-11]。由于目前肝癌发病机制十分复杂,所以肝癌的治疗仍然是困扰当前临床的棘手问题之一。随着医学研究的不断深入开展,通过调控信号通路的手段来遏制肝癌病情的进一步恶化已经成为恶性肿瘤信号转导领域的一个热点。在此其中TGFβ/Smads信号通路则是典型的代表。该信号通路由TGFβ超家族、Smad蛋白家族所构成,其中TGFβ家族能够直接影响肿瘤细胞的增殖与分化,而Smad蛋白家族则是目前已知最早被证实的TGFβ受体激酶的底物,广泛分布在细胞质之中,可以将信号经由细胞膜传递至细胞核,为受体激酶介导的细胞内信号转导途径[12]。二者形成的信号通路具有调控靶基因转录作用,影响肝癌的发生与发展。
本次研究中通过将龙葵作用在人肝癌细胞HepG2以观察其对于HepG2细胞增殖、侵袭力和细胞凋亡的影响,结果发现龙葵提取物除了具有抑制HepG2细胞增殖、降低侵袭力以及促进细胞凋亡的功效外,还可以通过调控TGFβ/Smads信号转导通路,降低TGF-β含量,提高SMAD3、SMAD4基因表达的方式来实现诱导肝癌细胞凋亡,从而为肝癌的临床治疗提供了全新的作用靶点以及药物选择,进一步拓宽了中医药防治包括肝癌在内的恶性肿瘤的思路。
[1] 徐文洋,吴若云,鲁玉辉.基于TGF-β1/Smad信号通路探讨加味茵芍散含药血清对大鼠肝星状细胞增殖作用的影响及机制[J].世界中西医结合杂志,2016,10(5):630-635.
[2] 梁逸强,周 莉,周 端,等.参蛤散对心室重构大鼠TGF-β1/Smads信号传导的影响[J].辽宁中医杂志,2014,21(10):2232-2236.
[3] 王秋虹,林 兰.中药对细胞外信号调节激酶信号转导通路的调节[J].吉林中医药,2015,15(3):289-293.
[4] 李 建,党晓伟,董振花,等.TGF-β1、Smad2、CyclinD1与恶性肿瘤关系的研究进展[J].临床和实验医学杂志,2015,10(2):164-167.
[5] 滑 振,庞立健,赵仲雪,等.中医药防治肺纤维化实验研究不同信号转导通路研究概述[J].辽宁中医药大学学报,2015,17(8):64-67.
[6] 汤志杰,张茂娜,陈 莉.肝癌和肝纤维化发生EMT及相关信号通路的分子机制[J].实用癌症杂志,2014,11(1):113-116.
[7] 刘 玺,郑 勇,陈卫刚.TGF-β/SMADS通路及其Smad4基因在胃癌中的研究现状[J].医学综述,2013,25(21):3841-3843.
[8] 李瀚旻,赵宾宾,高 翔,等.“补肾生髓成肝”改善肝再生微环境、防治肝癌的作用及机制[J].湖北中医药大学学报,2015,21(1):5-8.
[9] 田 青,唐启盛,赵瑞珍,等. 抑郁症模型大鼠皮质、海马cAMP通路的信号表达及颐脑解郁方的干预作用[J].中国实验方剂学杂志, 2012,18(3):121-124.
[10] Amber A,Bokhari,Viqar Syed. Inhibition of transforming growth factor‐β (TGF‐β) signaling by scutellaria baicalensis and fritillaria cirrhosa extracts in endometrial cancer[J]. J Cell Biochem,2015,116(8):1230-1235.
[11] 李 海.解毒祛瘀论治原发性肝癌的临床研究[J]. 陕西中医,2016,37(1): 60-61.
[12] 廖 琦.晚期肝癌患者疼痛及生存质量调查研究[J].陕西医学杂志,2016,45(7): 925-92.
(收稿:2016-12-08)
Mechanism of Solanum nigrum in the prevention and treatment of liver cancer from the regulation of TGF-β/Smads pathway
Yang Xufeng.
Department of Traditional Chinese Medicine, Shenzhen Bao’an Central Hospital(Shenzhen 518102)
Objective:To investigate the effects of solanum nigrum extract on HepG2 cell proliferation,invasion and apoptosis,to clarify the mechanism of solanum nigrum in the prevention and treatment of liver cancer cells apoptosis.Methods:50 cases of patients with liver cancer as the research object,collected liver cancer specimens and HepG2 cells in the exponential growth phase were added to solanum nigrum extract of the appropriate concentration(solanum nigrum group),phosphate buffered saline(PBS group),transforming growth factor beta inhibitors(TGF-β group),TUNEI method and RT-PCR method were used to detect the expression of TGF-β,SMAD3 and SMAD4 in apoptotic cells and HepG2 cells.Results:In inhibiting HepG2 cell proliferation, reducing the invasiveness and promoting cell apoptosis,the effects of solanum nigrum group was the best,the worst in PBS group,TGF-β group was center,P<0.05.Compared the expression of TGF-β,SMAD3 and SMAD4 genes in the three groups,P<0.05.Conclusion:Solanum nigrum extract can regulate TGF-β/Smads pathway to inhibit proliferation and invasion of tumor cells,promote cell apoptosis,plays an important role in the treatment of liver cancer.
Liver neoplasms/ traditional Chinese medicine therapy Solanum nigrum/ therapeutic uses Transforming growth factor beta @Smads pathway
*广东省深圳市宝安区卫生公益性科研项目(2015127)
肝肿瘤/中医药疗法 龙葵/治疗应用 转化生长因子-β @Smads通路
R614
A
10.3969/j.issn.1000-7369.2017.05.002
