扶正解毒法对肺炎模型大鼠的p38MAPK信号通路调控及抗氧化应激作用*
2017-05-19李美凤祁海燕封继宏魏葆琳
李美凤,祁海燕,封继宏△,魏葆琳
1.天津中医药大学第二附属医院(天津 300150),2.陕西省中医医院(西安 710003)
扶正解毒法对肺炎模型大鼠的p38MAPK信号通路调控及抗氧化应激作用*
李美凤1,祁海燕2,封继宏1△,魏葆琳1
1.天津中医药大学第二附属医院(天津 300150),2.陕西省中医医院(西安 710003)
目的:观察扶正解毒中药对肺炎模型大鼠p38MAPK信号通路的调控及抗氧化应激作用。方法:将60只雄性Wistar大鼠随机分为6组,分别为空白对照组、模型组、扶正中药组、解毒中药组、扶正解毒中药组和抗生素干预组,除空白组外均采用气管内滴注肺炎链球菌建立肺炎大鼠模型,然后空白组及模型组给予生理盐水灌服,各干预组对应给予药物治疗,共7 d,分别于第4天、第8天取材,采用生化法检测大鼠血清SOD、MDA、MPO、LPO含量,酶联免疫吸附法(ELISA )检测大鼠血清TNF-α含量,采用免疫印迹法检测肺组织p38MAPK表达情况。结果:模型组大鼠血清中MDA、MPO、LPO、TNF-α均较空白组升高(P<0.05),各药物干预组与模型组相比,上述四种细胞因子水平均下降(P<0.05);模型大鼠血清中SOD较空白组下降(P<0.05),各药物干预组与模型组相比,表达含量均有所升高(P<0.05);模型组大鼠肺组织P38MAPK表达较空白组升高(P<0.05),各药物干预组与模型组相比较,P38MAPK表达水平均下降(P<0.05)。结论:扶正解毒中药可以通过调控p38MAPK信号通路下调炎症因子的表达及促进抗氧化应激,以减轻自由基等过氧化物对机体的损伤,减轻肺部气道炎症应答反应,从而对机体起到保护作用。
社区获得性肺炎(Community acquired pneumonia,CAP)是由细菌、病毒、非典型病原体等引起的、发生在肺实质的炎症。课题组前期研究发现肺炎进展过程中存在以“肺脾气虚”为主的正虚及“痰、热、瘀”为主的邪实,认为其治疗应扶正祛邪,制定了扶正解毒、清热化瘀治则,研制出扶正解毒方。前期临床研究发现联合扶正解毒中药可以明显改善患者临床症状,缩短患者退热时间及住院天数[1]。本文旨在探讨扶正解毒方对肺炎链球菌所致肺炎模型大鼠p38MAPK信号通路的调控与抗氧化应激的作用。
材料与方法
1 动 物 选用清洁级雄性Wistar大白鼠60只,平均体重180g,购于北京华阜康生物科技股份有限公司,常规饲养1周进行造模。
2 造模用细菌 大鼠造模选用肺炎链球菌标准菌株(菌株号:ATC49619),实验开始前制备成 1.2×109cfu/ml 菌悬液(注:标准菌株来自于天津市临检中心)。
3 药 品
3.1 西药:头孢呋辛酯片,规格: 250mg/片(生产批号 H20080328);生产厂家:葛兰素史克(Glaxo Operations UK Limited)。
3.2 中药处方:扶正解毒中药,党参、黄芩、鱼腥草、赤芍、紫菀、冬瓜子、甘草;扶正中药:党参、甘草;解毒中药:黄芩、鱼腥草、赤芍、紫菀、冬瓜子。
实验所用药物均于天津中医药大学第二附属医院药剂科购买,为保证药物转换量精确,将所用中药制备为提取物,最终折合比例为1 g提取物相当于生药3.19 g,4℃保存备用。
4 试剂盒 超氧化物歧化酶SOD试剂盒、丙二醛MDA试剂盒、髓过氧化物酶MPO试剂盒、脂质过氧化物酶LPO试剂盒,均购于南京建成生物工程研究所。
大鼠肿瘤坏死因子TNF-αELISA试剂盒、大鼠抗人磷酸化-p38MAPK抗体由购于华美公司。
5 动物模型构建 采用课题组自创的内窥镜引导下气管内滴注肺炎链球菌菌悬液的方式构建肺炎动物模型[2]。
6 分组及给药
6.1 分组:将大鼠随机分为6组,每组10只,分别为空白组、模型组、扶正中药组、解毒中药组、扶正解毒中药组、抗生素干预组。
6.2 给药:各实验组大鼠在造模结束后第 2 天开始进行实验给药;空白对照组:生理盐水灌胃;模型组:生理盐水灌胃;扶正中药组:灌服扶正中药提取物水溶液,每鼠 0.63 g/(kg·d);解毒中药组:灌服解毒中药提取物水溶液,每鼠 4.58 g/(kg·d);扶正解毒中药组:灌服扶正解毒中药物水溶液,每鼠 5.2 g/(kg·d);抗生素组:灌服头孢呋辛酯水溶液,每鼠50 mg/(kg·d);1次/ d,给药时间持续7 d,每组动物分别于治疗后第 4天和第8天取材。
7 观察指标
7.1 血清SOD、MDA、MPO、LPO、TNF-α测定,打开腹腔,腹主动脉取血2 ml,3 000r/m离心10 min,分离血清,-80℃分装保存。SOD、MDA、MPO、LPO采用生化法, TNF-α采用酶联免疫吸附法(ELISA)测定,操作均根据试剂盒进行。
7.2 开胸取肺组织,用于p38MAPK检测,采用免疫印迹法(West blot)检测。
8 统计学方法 选用SPSS 11.5统计学软件,实验结果采用均数±标准差或四分卫间距形式表示,两组间比较采用t检验,多组比较行ANOVA,方差不齐时采用非参数检验,P<0.05认为差异有统计学意义。
结 果
整个实验过程中,模型组死亡2只,解毒中药组死亡1只,其余各组大鼠例数未发生变化。
1 大鼠血清SOD、MDA、MPO、LPO表达 模型组大鼠血清中MDA、MPO、LPO均较空白组升高,具有统计学差异(P<0.05);各药物干预组与模型组相比,三细胞因子水平均下降,具有统计学差异(P<0.05)。模型大鼠血清中SOD较空白组下降,具有统计学差异(P<0.05);各药物干预组与模型组相比,表达均升高,具有统计学差异(P<0.05),见表1。
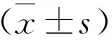
表1 各组大鼠血清SOD、MDA、MPO、LPO结果
注:与空白组相比,*P<0.05;与模型组相比,#P<0.05
2 大鼠血清肿瘤坏死因子TNF-α表达 模型组大鼠血清中TNF-α较空白组升高,具有统计学差异(P<0.05);各药物干预组与模型组相比,三细胞因子水平均下降,具有统计学差异(P<0.05),见表2。
3 大鼠肺组织p38MAPK蛋白表达 模型组大鼠肺组织P38MAPK表达较空白组升高,具有统计学差异(P<0.05);各药物干预组与模型组相比,P38MAPK表达水平均下降,具有统计学差异(P<0.05),见表3。
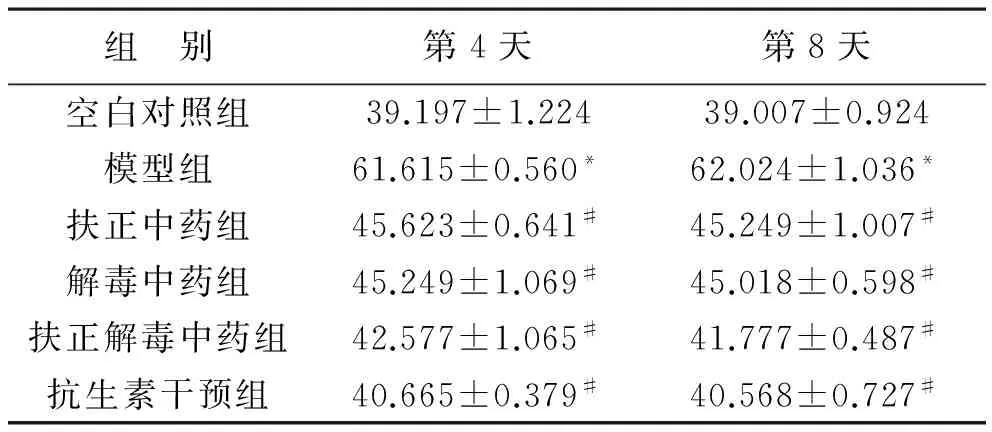
表2 各组大鼠血清TNF-α结果比较(ng/L)
注:与空白组相比,*P<0.05;与模型组相比,#P<0.05

表3 各组大鼠肺组织P38MAPK表达比较
注:与空白组相比,*P<0.05;与模型组相比,#P<0.05;与扶正解毒中药组相比,&P<0.05
肺炎模型大鼠血清、肺组织中存在炎症因子表达异常及氧化应激,扶正解毒中药可以降低炎症因子的表达、减轻氧化应激,进而减轻机体损伤。
讨 论
现代研究[5]证实MAPK通路能被多种生物活性物质(如各种氧化应激中间产物、炎症因子等)激活,调控着炎症的发生和发展;p38MAPK是MAPK家族重要组成成员,扮演着转导枢纽的角色,参与了多种细胞信号(如氧化应激、炎症反应等)的传导,其蛋白磷酸化水平增强是MAPK通路激活的标志,其可以促进炎症因子的表达,亦可激活一氧化氮合成酶(iNOS)基因转录、编码大量蛋白,进而产生大量NO,诱发炎症瀑布。徐蕾等人[3]发现肺炎链球菌Spsp A诱导人类单核细胞分泌细胞因子和趋化因子受ERK和p38MARK 途径调控。吴盈盈等[4]发现HSP40诱导小鼠巨噬细胞产生免疫应答受JNK及p38MAPK信号通路调控。
氧化应激是指在内外环境有害刺激的条件下,机体产生大量高活性分子,例如活性氮自由基、活性氧自由基,超出机体对其清除的能力,氧化-抗氧化失衡,导致大量中性粒细胞(Polymorphonuclear leukocytes,PMN)浸润,促使过多氧化中间产物生成,推动了气道炎症的发生发展,对机体造成损害[6]。活性氧簇ROS、丙二醛MDA、超氧化物歧化酶SOD是评价氧化-抗氧化系统的重要指标,作为脂质氧化终产物的丙二醛为评估机体氧化损伤程度提供了重要依据,SOD帮助清除氧自由基,用来评价机体的抗氧化能力。杨小琼[7]等人通过研究发现肺炎的过程中存在氧化应激,并且参与了细胞DNA 损伤,对肺炎的发生发展起了一定的作用。另有研究[8]显示MAPK可以被氧化应激状态下产生的大量ROS诱导活化。
本课题组根据中医理论和长期临床实践,提出肺炎“因虚致病”的理论,认为肺炎初期及疾病进展过程中都存在正虚,以肺脾亏虚为主;细菌、病毒及非典型病原体等毒邪乘虚而入侵犯机体,正邪相争而发热,热壅血瘀、气机阻滞致使病情加重。认为肺炎治疗需扶正祛邪相结合,健脾益气而扶正,清热解毒以祛邪。因此制定了扶正解毒、清热化瘀治则,尊“参苏饮”、“千金苇茎汤”化裁而出扶正解毒方,其主要组成为党参、黄芩、鱼腥草、虎杖、赤芍、白及、冬瓜子、紫菀和甘草。方中党参健脾益肺,黄芩、鱼腥草清热解毒,虎杖、赤芍清热散瘀,白及、冬瓜子逐瘀排脓兼通腑泄热,紫菀化痰止咳,甘草调和诸药,健脾补肺扶助正气,通腑泄热调畅气机,散瘀解毒祛邪外出。
本研究结果显示,肺炎模型大鼠炎症因子及自由基(TNF-α、MDA、MPO、LPO、p38MAPK)均明显升高,抗氧化能力(SOD)明显下降,给予药物干预后,发现扶正解毒中药及抗生素两组效果较明显。表明扶正解毒中药可以通过抑制前炎症因子的释放和氧化应激过度爆发,进而抑制p38MAPK磷酸化,抑制下游炎症因子的表达,减少对机体的炎症损伤,以对机体起到保护作用。
[1] 封继宏.基于“真实世界”的社区获得性肺炎中医证治初探研究[D].天津:天津中医药大学, 2013.
[2] 封继宏,祁海燕,郑兆晔,等. 经硬式鼻腔镜气管内滴注化学制剂建立AECOPD动物模型[J].辽宁中医药大学学报, 2015, 17(11): 68-70.
[3] 徐 蕾,陈小琴.MAPK 通路对肺炎链球菌表面蛋白A促人类单核细胞分泌细胞因子的影响[J].免疫学杂志,2014,30(2):139 -146.
[4] 吴盈盈,高 松,马 峰,等.肺炎链球菌热休克蛋白40 通过p38MAPK 和JNK通路诱导小鼠巨噬细胞免疫应答[J].细胞与分子免疫学杂志, 2015, 31(6): 730-735.
[5] 张 奇,白晓东,付小兵. p38MAPK信号通路研究进展[J]. 感染、炎症、修复, 2005, 6(2):121-123.
[6] 杨 明,李国平.氧化应激激活的信号传导与支气管哮喘的研究进展[J].重庆医学,2014,43(7) : 875.
[7] 杨小琼,李国平,王孝芸,等.氧化应激 DNA损伤在重症肺炎中的作用研究[J].国际呼吸杂志, 2016, 36(17):1308-1313.
[8] Sun Z, Huang Z, Zhang DD. Phosphorylation of Nrf2 at multiple sites by MAP kinases has a limited contribution in modulating the Nrf2-dependent antioxidant response[J]. PLoS One, 2009, 4(8): e6588.
(收稿:2017-01-11)
*国家自然科学基金资助项目(81373849)
肺炎, 肺炎球菌性/中医药疗法 扶正解毒法 @TNF-α @p38MAPK
R563.1
A
10.3969/j.issn.1000-7369.2017.05.059
天津市科技计划项目(15ZXLCSY00020)
△通讯作者
