用于SRAP分析的大豆DNA快速提取方法
2017-05-18李领川周延清
王 芳,李领川,周延清
(1.郑州工程技术学院 化工食品学院,郑州 450044;2.河南师范大学 生命科学学院,河南 新乡 453007)
用于SRAP分析的大豆DNA快速提取方法
王 芳1,李领川1,周延清2
(1.郑州工程技术学院 化工食品学院,郑州 450044;2.河南师范大学 生命科学学院,河南 新乡 453007)
以大豆干种子为实验材料,采用改良的CTAB法对大豆DNA进行提取,用琼脂糖电泳进行检测,并用聚丙烯凝胶电泳进行SRAP分子标记的PCR扩增。实验结果表明,该方法提取的NDA条带清晰,质量好,适用于SRAP分子标记的PCR扩增,为进行大豆SRAP遗传多样性的研究奠定了基础。
大豆;SRAP;DNA提取
随着分子生物学的快速发展,基于PCR(聚合酶链式反应)的分子标记技术因为其相对简便快捷的特点,目前已经被广泛用于基因组DNA的分析,从而大大促进了遗传育种、遗传进化、种质资源分类和基因克隆、基因定位等方面的研究发展。2001年美国加州大学蔬菜作物系Li和Quiros[1]博士提出了一种新型的分子标记技术——相关序列扩增多态性SRAP(Sequence-Related Amplified Polymorphism),它是针对基因外显子GC含量丰富而启动子、内含子AT含量丰富的特点来设计引物对ORFs(Openreading Frames)进行扩增,具有简便、中等产量、高共显性、重复性、易于分离条带及测序等优点。近年来,SRAP分子标记也得到了快速的发展,目前已在小麦、水稻、花生、黄瓜、西瓜、豌豆、甘薯和辣椒等植物中得到了广泛的应用[2-10]。
研究大豆的SRAP遗传多样性,首先要考虑模板DNA的提取。以往也有实验室采用大豆干种子提取DNA,这样节约时间和液氮费用,具有经济、高效等特点,但是用于SRAP分子标记的大豆DNA的提取国内未见报道[2]。本实验以大豆干种子为材料提取大豆DNA,用琼脂糖电泳检测,并用聚丙烯凝胶电泳进行PCR扩增。结果表明,该方法提取的NDA条带清晰,无拖尾现象,适用于SRAP分子标记的PCR扩增,为进行大豆SRAP遗传多样性的研究奠定了基础。
1 材料与方法
1.1 实验材料
实验材料为豆科(Leguminosae)大豆属(Glycine)的30个大豆(GlycinemaxL.Merr)品种,由河南农业科学院梁凤珍、王树峰和周口农业科学院苑宝军研究员提供(见表1)。
dNTPs和TaqDNA酶:北京天根生物科技有限公司;Marker为λ DNA/Hind Ⅲ+EcorⅠ:上海生工生物工程技术服务有限公司;其他试剂为国产分析纯或化学纯,SRAP引物由上海生工生物工程技术服务有限公司合成(见表2)。
1.2 实验方法
1.2.1 DNA提取
DNA的提取参照李书粉[11]的方法略加改良。
(1)取1粒干燥大豆种子置研钵中, 去除种皮后迅速研成干粉,分装于1.5 mL离心管中(加入适量PVP)。

表1 大豆品种名称

表2 用于大豆研究中SRAP引物
(2)在1.5 mL聚丙烯离心管中加入700 μL 65℃的2×CTAB提取介质,再加14 μL 2%的β﹣巯基乙醇,混匀,放入65℃水浴锅中保温40~60 min(期间翻转1次),拿出离心10 min(12000 rpm)使上下分层,取出水相并转入到另一个离心管中。
(5)重复(3)的操作,可根据情况加入适量酚。
(6)在抽出后的水相中加入1/10体积10 mol/L的NaAC和2/3体积的冰冷异丙醇,-20℃下放置3 h或过夜。
(7)离心10 min(10000 rpm),收集沉淀并在室温下晾干。
(8)加入70%的乙醇溶液洗涤沉淀2次,再用无水乙醇洗涤1次(视情况每次洗前要10000 rpm离心几分钟),并在室温下晾干。
(9)根据DNA沉淀量的多少,将其溶于适量的50~100 μL灭菌双重水中,分装后放入-20℃冰箱中储存或者放入4℃冰箱中随时待用。
(10)用0.8%琼脂糖凝胶电泳检测提取得到DNA溶液,所提DNA样品应出现一条分子量迁移率等于λ DNA/EcoR I+ HindIII Ladder21 kb的清晰条带。
1.2.2 DNA浓度、纯度检测
DNA纯度的检测:取1μL DNA溶液,加入3000μL蒸馏水,将DNA稀释3000倍,用分光光度计检测纯度。
DNA浓度的测定:以蒸馏水作为对照实验,测定DNA的紫外吸收值A260和A280,得到相应的OD值。并使用公式(1)计算DNA浓度。
DNA浓度=OD260×50/1000×3000
(1)
式中:DNA浓度单位为ng/μL;3000为稀释倍数。
1.2.3 电泳检测
配制浓度为0.8%琼脂糖,在120V电压下跑电泳。取DNA溶液8 uL,加入2 uL的溴酚蓝混合点样,以Lambda DNA/HindIII Marker为分子量标准,电泳结果在多功能紫外透射反射仪下观察并照相,检测所提DNA的大小和完整性。将质量好的DNA溶液稀释为50 ng/uL的工作液,并保存在-20℃冰箱中备用。
1.3 SRAP-PCR反应体系
参考Li和Quiros的SRAP扩增程序,稍加修改进行优化实验,建立反应体系。反应体系总体积为25 μL,每管中含有1×PCR buffer和灭菌水。PCR反应程序为:94 ℃预变性3 min,然后前5个循环为94 ℃变性l min,35 ℃退火l min,72 ℃延伸1 min,后35个循环仅将退火温度升为50 ℃,最后72 ℃延伸7 min[7]。
2 结果与分析
2.1 DNA纯度、浓度检测
由表3可以看出,大豆12个样品的OD260/OD280值均在1.7~1.9之间,表明用该方法提取的DNA质量好,纯度高,蛋白及其他杂质去除较为干净。该改良方法提取DNA的浓度基本能满足SRAP-PCR反应要求。
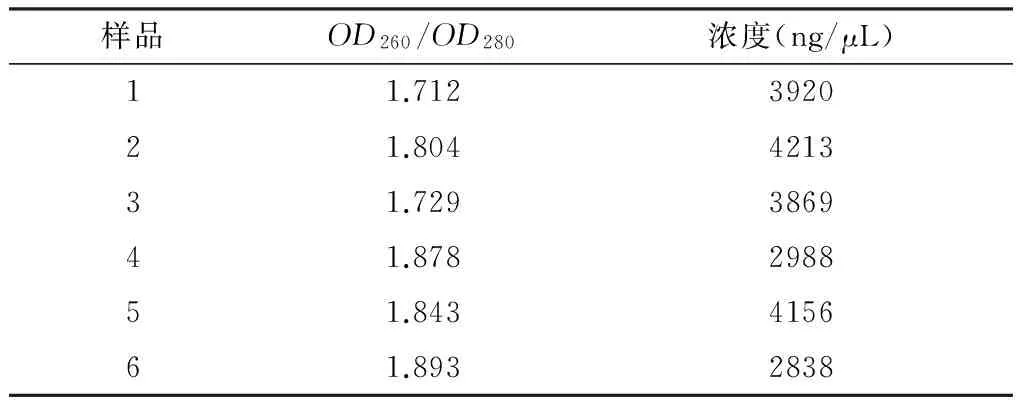
表3 大豆种子DNA提取纯度和浓度
2.2 琼脂糖凝胶电泳检测
图1是用改良的CTAB法所提取DNA的琼脂糖电泳图谱,由该图可以看出所提的模板DNA条带清晰,无拖尾现象,条带比较完整,质量较好,可以用于下一步的实验分析中。
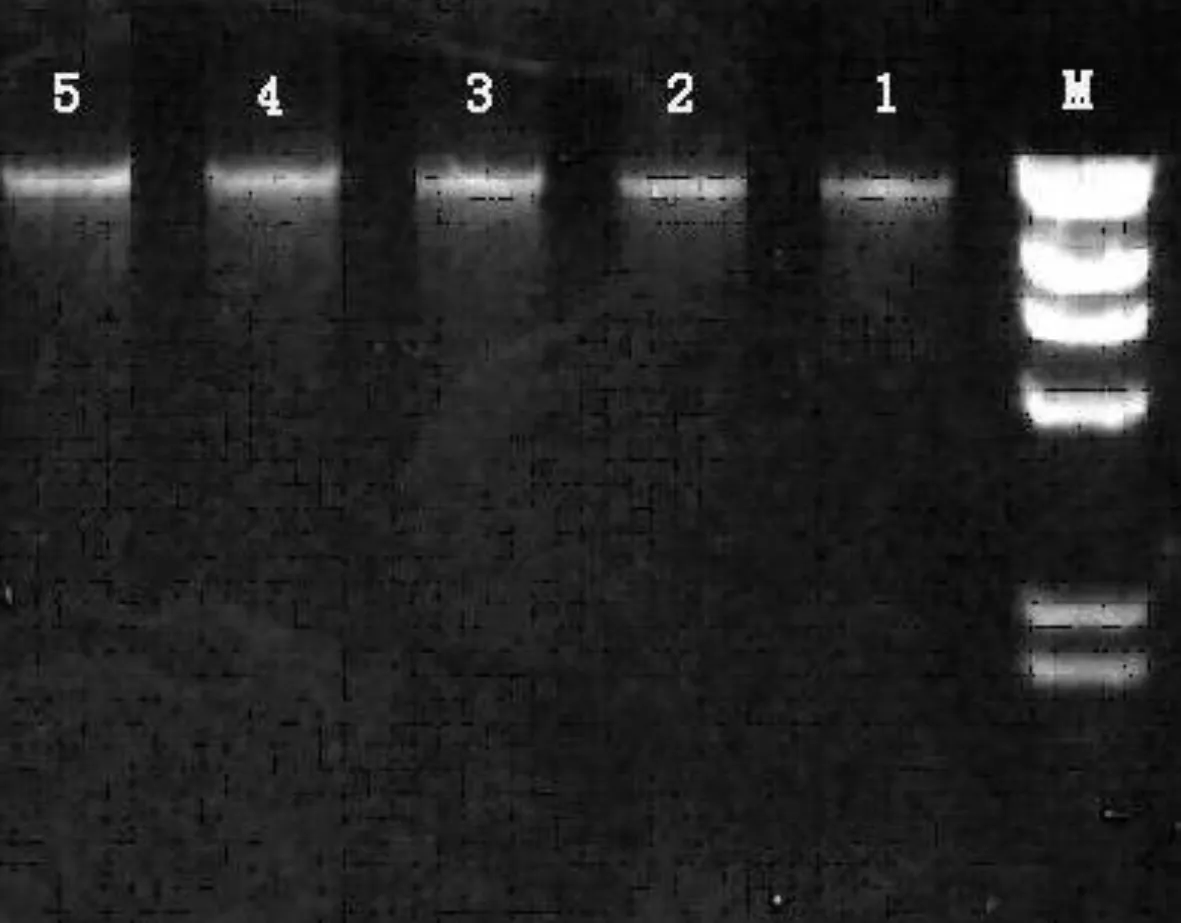
图1 大豆基因组DNA的提取(1-5为样品,M为分子量标准)
2.3 PCR扩增结果
图2、图3是用该改良方法所提模板DNA经SRAP-PCR扩增后,聚丙烯酰胺凝胶电泳的图谱。从图2、图3中可以看出该图谱扩增条带较清晰,结果理想,可以很好地用于SRAP反应体系,并为大豆遗传多样性的研究奠定基础。
3 小结
大豆干种子基因组DNA的提取受蛋白质和酚类的影响较大,特别是大豆种子蛋白含量高达40%。因此,高质量提取大豆DNA并不容易[12-18]。本实验提取的DNA所用时间短,一般在2h左右就可以完成。与此同时,实验的稳定性强,可重复性较高,提取的DNA浓度、纯度比较好,琼脂糖电泳检测以及聚丙烯酰胺凝胶电泳等分子实验都得到了很好的验证。通过该改良方法所提取的DNA,无论从纯度、浓度、琼脂糖电泳检测,还是SRAP-PCR的扩增检测,都证明该DNA达到了SRAP-PCR反应的要求,可用于SRAP分子标记的进一步研究,为今后大豆的SRAP遗传多样性分析以及种质资源等方面的研究奠定了基础。
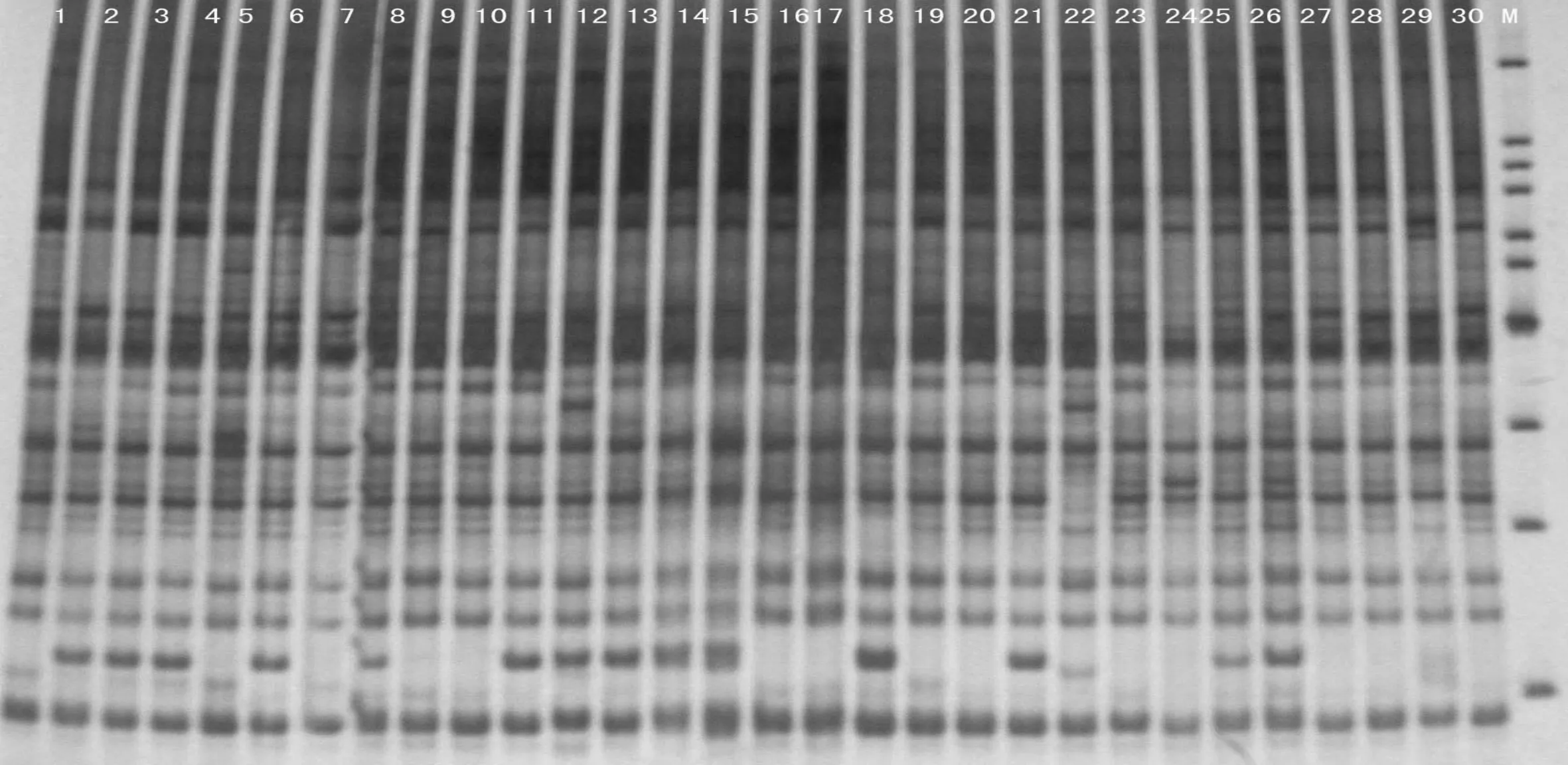
图2 引物me12em12 SRAP的PAGE扩增图谱(1~30为样品编号,M为maeker)
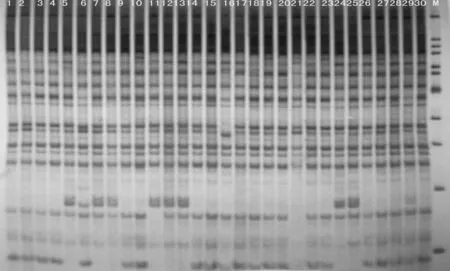
图3 引物me16em17 SRAP的PAGE扩增图谱(1~30为样品编号,M为maeker)
[1]Li G,Quiros C F.Sequence-Related Amplified Polymorphism(SRAP),A new Marker System Based on a Simple PCR Reaction: Its Application to Mapping and Gene Tagging in Brassica[J].Theor Appl Genet, 2001, 103:455-461.
[2]王芳,徐翔,李领川,等.大豆种质资源SRAP分子标记中的引物筛选[J].生物技术通报,2012(7):73-78.
[3]武志朴,杨文香,刘大群,等.小麦基因组SRAP 扩增体系的初步研究[J].河北农业大学学报,2005,28(3):66-69.
[4]刘强,高新学,刘铁山,等.技术在水稻品种鉴定和纯度检测中的应用研究[J].山东农业科学,2008(1):26-28.
[5]王传堂,张建成,杨新道,等.花生序列相关扩增多态性(SRAP)标记的研究[J].花生学报,2005,34(3):11-15.
[6]潘俊松,王刚,李效尊,等.黄瓜SRAP遗传连锁图的构建及始花节位的基因定位[J].自然科学进展,2005,12(2):167-172.
[7]李严,张春庆.西瓜杂交种遗传多态性的SRAP标记分析[J].园艺学报,2005,32(4):643-647.
[8]Espo′sito M A,Martin E A,Cravero V P,et al.Characterization of Pea Accessions by SRAP’s Markers[J]. Scientia HorticuLturae,2007,113:329-33.
[9]吴洁,谭文芳,何俊蓉,等.甘薯SRAP连锁图构建淀粉含量QTL检测[J].分子植物育种,2005,3(6):841-845.
[10]任羽,王得元,张银东,等.辣椒SRAP反应体系的建立与优化[J].分子植物育种,2004,2(5):689-693.
[11]李书粉.基于ISSR和ITS的木犀属植物亲缘关系及系统分类研究[D].河南新乡:河南师范大学,2007.
[12]王芳,李晓静,周延清,等.聚丙烯酰胺凝胶电泳检测大豆SRAP标记[J].中州大学学报,2014(6):125-128.
[13]徐景升,姚伟,余爱丽,等.微量大豆种子基因组DNA的快速制备[J].植物生理学通讯,2004,40(5):595-596.
[14]杨少辉,张丽娟,段会军,等.大豆种子DNA 的提取方法[J].大豆科学,2003,22(2):151-153.
[15]Kamiya M, Kiguchi T. Rapid DNA Extraction Method from Soybean Seeds[J]. Breeding Science,2003,53(3):277-279.
[16]张伟,谢甫绨,宋显军,等.适于SSR分析的大豆干种子中DNA快速提取[J].华北农学报,2007,22(2):133-135.
[17]任良真,张春宝,赵洪锟,等.一种改良的快速高质大豆基因组DNA提取方法[J].中国农学通报,2012,28(9):38-41.
[18]刘春颖,李殿平,孙国伟.适于SSR的大豆DNA经济高效提取方法[J]. 辽宁农业科学,2009(1):49-50.
(责任编辑 姚虹)
Rapid Isolation of Soybean DNA for SRAP Analysis
WANG Fang1, LI Ling-chuan1, ZHOU Yan-qing2
(1.College of Chemical and Food Engineering,Zhengzhou Institute of Technology, Zhengzhou 450044, China;2.College of Life Sciences, Henan Normal University, Xinxiang, Henan 453007, China)
A method of rapid DNA extraction from dry soybean seeds was established based on improved CTAB procedure. Agarose electrophoresis method and SRAP-PCR technology were used to test the DNA. The results showed that the DNA extracted with this method with clear and good quality,applied to SRAP-PCR, and also laid a solid foundation for the research on genetic diversity of soybean.
soybean;SRAP;DNA extraction
2017-03-08
河南省教育厅自然科学研究计划项目(2009B180016)
王芳(1982—),女,河南郑州人,硕士,郑州工程技术学院化工食品学院实验师,主要从事植物遗传研究。
10.13783/j.cnki.cn41-1275/g4.2017.02.026
S565.1
A
1008-3715(2017)02-0113-04
