鸭茅与伴生种不同混播比例对土壤微生物和酶活性的影响
2017-05-17聂中南姜哲浩陈建纲胡新振袁子茹张德罡
李 硕,聂中南,2,姜哲浩,陈建纲,胡新振,袁子茹,任 灵,陈 璐,张德罡
(1.甘肃农业大学 草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070; 2.澳大利亚维多利亚经济发展、就业、交通和资源部)
鸭茅与伴生种不同混播比例对土壤微生物和酶活性的影响
李 硕1,聂中南1,2,姜哲浩1,陈建纲1,胡新振1,袁子茹1,任 灵1,陈 璐1,张德罡1
(1.甘肃农业大学 草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070; 2.澳大利亚维多利亚经济发展、就业、交通和资源部)
采用随机区组设计,设4个单播鸭茅、无芒雀麦(Bromusinermis)、白三叶(Trifoliumrepens)、苜蓿(Medicagosativa)、15个混播处理(9∶1、7∶3、5∶5、3∶7、1∶9)和无牧草播种处理,研究鸭茅与伴生种在不同混播比例下对土壤微生物数量和土壤酶活性的分布影响。结果表明:土壤微生物数量和土壤酶活性随着土层深度的增加而逐渐降低,且表现为0~10 cm >10~20 cm。混播处理相同土层,土壤细菌和放线菌以鸭茅和苜蓿混播时为最多,鸭茅和无芒雀麦混播时次之,鸭茅和白三叶混播时最小。鸭茅和豆科牧草混播时的脲酶活性高于鸭茅和无芒雀麦混播时的活性,鸭茅和苜蓿或无芒雀麦混播时的土壤蔗糖酶和土壤过氧化氢酶高于鸭茅同白三叶混播时的活性。与无牧草播种处理相比,单播和混播处理均提高了土壤蔗糖酶和过氧化氢酶活性。
鸭茅;土壤微生物;土壤酶活性
鸭茅(Dactylisglomerata)是起源于欧洲的一种著名的优良冷季型禾本科牧草,具有适应性强、营养价值高等特点,已经被广泛种植[1]。有研究表明,种植鸭茅能够抑制伴生草种的生长和发育;同时有较少的杂草和自生草。在农业生产中,作物间作所造成的负面影响如产量下降,品质降低,出现病虫害等[2],在很大程度上与土壤微生物有关[3]。土壤微生物在土壤环境中扮演着重要的角色,在土壤有机质降解、营养循环和土壤降解等中是一个重要的因子[4]。土壤微生物的数量和种类受诸多因素的影响,可以直接反映土壤养分的状况。即便在相同的气候条件和土壤类型下,不同植被下的土壤微生物仍然存在较大差异[6]。因此,可以通过选择种植制度和模式来调控土壤微生物,进而改善土壤的肥力[7]。
土壤酶直接决定土壤微生物的代谢需求和营养供应。他们的活性与土壤的理化特性、微生物群落结构、植物、干扰和更替有关[9]。酶是催化活性的蛋白质和催化剂,它能成倍地加速有机体中的化学反应。在水解酶系列中,蔗糖酶参与土壤有机碳循环;脲酶促进土壤中的尿素水解;磷酸酶活性能够促进水解土壤中的磷酸酯[10]。土壤酶是土壤微生物和植物根系的分泌物及动植物残体分解的酶[11]。
分析鸭茅和伴生种不同混播比例下对土壤微生物数量和土壤酶活性的影响,以期为实践中改善混播作物根系的养分竞争、提高产量和适宜混播比例等提供一定的理论依据。
1 材料和方法
1.1 试验样地概况
试验地为甘肃农业大学牧草实训基地(N 36°05′,E 103°41′,1 604 m)。年均温9.1℃,年均降水量250~350 mm,降水多集中在6~8月,占全年降水量的50%~70%。年均日照时数2 446 h,无霜期180 d,土壤有机质9.58 g/kg,pH 6.63,全氮0.99 g/kg,速效磷1.6 mg/kg。
1.2 试验设计
2014年7月初,鸭茅分别与无芒雀麦(Bromusinermis)、白三叶(Trifoliumrepens)和苜蓿(Medicagosativa)进行混播,在播种之前,分别对不同草种的发芽率和千粒质量进行测定,以鸭茅的单播量为基础,鸭茅的播量为4 kg/hm2,鸭茅分别与伴生种按照发芽比例为9∶1、7∶3、5∶5、3∶7和1∶9进行混播,不同草种单播和无牧草播种进行对照。播深1 cm,4次重复。试验采用随机区组设计,在牧草生长初期,直至试验结束采取锄头或人工拔除等方法进行除杂,试验期间无任何措施防治病虫害,统一定量浇水。2014年牧草处于建植期阶段,2015年9月开始进行土壤样品的采集工作(表1)。

表1 不同处理下不同种牧草的播种量、发芽率和千粒质量Table 1 The seed rate/germination/1000-grain weight on different species
1.3 土壤样品的采集
2015年9月中旬,利用土钻分层法(0~10 cm和10~20 cm)进行多点混合取样,3次重复,混合均匀后分成2份,一份土壤置于4℃冰箱低温保存,用于土壤微生物数量的测定;一份带回实验室风干,过筛后测定土壤酶活性。
1.4 测定方法
真菌采用马丁-孟加拉红培养基,以平板表面涂抹法计数[12],放线菌采用改良高氏一号培养基[13]以平板表面涂抹法计数。细菌采用牛肉膏蛋白胨琼脂培养基,以平板表面涂抹法计数[13]。按下列公式计算微生物数量。

土壤蔗糖酶活性(3,5-二硝基水杨酸比色法);土壤脲酶活性(苯酚钠—次氯酸钠比色法);过氧化氢酶活性(高锰酸钾滴定法)。
1.5 统计方法
采用GENSTAT 12.1统计分析软件进行数据统计分析,采用GNOVA法进行多重比较。用Office 2010应用软件处理数据,并制作图表[14]。
2 结果与分析
2.1 不同处理对土壤微生物量的影响
同一土层的不同处理之间,真菌数量的差异性显著(P<0.01)。单播鸭茅处理下的土壤真菌数量最多。鸭茅和无芒雀麦混播比例为9∶1时,0~10 cm和10~ 20 cm真菌数量均最大,分别为1.42×103和0.65×103cfu/g。鸭茅和白三叶混播比例为7∶3时,0~10 cm的真菌数量最大,为0.95×103cfu/g;5∶5时,数量最小(0.47×103)cfu/g。鸭茅和苜蓿混播比例为1∶9时,0~ 10 cm的真菌数量最大,为1.08×103cfu/g,相反,10~20 cm最小,为0.28×103cfu/g。除了单播牧草处理和90%CF+10%B处理的真菌数量高于无牧草播种处理,其余处理的真菌数量均低于无牧草播种的数量(表2)。
不同处理之间,不同土层细菌数量均有显著性差异(P<0.01)。相对于单播鸭茅而言,0~10 cm和10~20 cm的细菌数量分别为2.42×106和0.82×106cfu/g;无牧草播种处理中细菌数量分别为0.88×106和0.45×106cfu/g。鸭茅和无芒雀麦混播时的细菌数量均低于单播无芒雀麦的土壤细菌数量(2.44×106和1.29×106) cfu/g。鸭茅和白三叶混播比例为3∶7时,0~10 cm的细菌数最大(0.77×106)cfu/g,7∶3时,细菌数量最小(表2)。鸭茅和苜蓿混播时,0~10 cm的细菌数量相对比较高,随着鸭茅比例的降低,细菌数量先增加后减少。鸭茅和苜蓿混播时的细菌数量相对较多,其次是鸭茅和无芒雀麦混播的细菌数量;鸭茅和白三叶混播时细菌的数量最小。
不同土层的不同处理之间,放线菌的数量差异性极显著(P<0.01)。在0~10和10~20 cm时,单播鸭茅的放线菌数量最大,分别为6.81×105和4.63×105cfu/g;无牧草播种的放线菌数量分别为1.76×105和0.48×105cfu/g。鸭茅和无芒雀麦混播比例为1∶9时,10~20 cm的放线菌数量高于0~10 cm;同样,处理10%CF+90%WC和10%CF+90%L表现出与处理10%CF+90%B相同的趋势。在鸭茅和白三叶、苜蓿的混播组合中,随着鸭茅所占比例的逐渐减少,0~10 cm的放线菌数量先增加,后减少(表2)。
不同处理之间,真菌、细菌和放线菌所占的总土壤微生物数量(真菌、细菌和放线菌)的比例差异极显著(P<0.01)。单播鸭茅的真菌所占总微生物数量比例最大,为0.13%。无牧草播种时,真菌数量所占比例相对较高,为0.11%。鸭茅和白三叶或苜蓿的混播时,细菌所占比例均高于单播鸭茅、白三叶和苜蓿的细菌比例。与混播白三叶和无芒雀麦相比,鸭茅和苜蓿混播的放线菌所占比例相对较少。70%鸭茅和30%白三叶组合时,所占比例最大,为34.67%;10%鸭茅和90%的苜蓿组合时,放线菌所占比例最小,为10.70%。

表2 不同处理下不同土层土壤微生物数量Table 2 The comparison of soil microorganism on quality among treatments in different soil depths
注:s.e.m表示平均值的标准误,**P< 0.01,ns表示不显著,下同
2.2 不同处理对土壤酶活性的影响
0~10 cm的不同处理之间有显著性差异(P<0.01)。在鸭茅和苜蓿的混播组合中,0~10 cm单播苜蓿的蔗糖酶活性高于混播的;其单播蔗糖酶活性为14.67 mg/(g soil·24 h),混播蔗糖酶活性为10.83~13.69 mg/(g soil· 24 h)。0~10 cm无牧草播种处理的蔗糖酶活性为10.96 mg/(g soil·24 h)。
在10~20 cm土层,不同处理之间的蔗糖酶活性无显著性差异(P>0.05)。50%鸭茅和50%无芒雀麦蔗糖酶活性最高,为12.74 mg/(g soil.·24 h)(表3)。0~10 cm鸭茅和无芒雀麦混播的蔗糖酶活性高于鸭茅同苜蓿或白三叶混播的酶活性。0~10 cm与10~20 cm不同土层土壤蔗糖酶活性比值之间无显著性差异(P>0.05)。无牧草播种处理的土壤蔗糖酶活性比值最低,为1.02。
不同土层各处理之间脲酶活性差异极显著(P<0.01)。且随着土层深度的增加,土壤脲酶活性逐渐降低,表现为0~10 cm>10~20 cm。与单播无芒雀麦、苜蓿和白三叶相比,单播鸭茅的脲酶活性最低(表3)。不同土层脲酶活性的比值之间,有一个极显著性的差异(P<0.01)。无牧草播种处理的比值最大,为1.48。鸭茅与无芒雀麦、白三叶和苜蓿混播时的比例均低于单播无芒雀麦、白三叶和苜蓿(表3)。
0~10 cm土层的过氧化氢酶活性之间差异极显著(P<0.01);0~10 cm过氧化氢酶活性为单播鸭茅>单播无芒雀麦>单播苜蓿>单播白三叶;鸭茅和无芒雀麦或苜蓿混播时的过氧化氢酶活性较高,鸭茅和白三叶混播组合中过氧化氢酶活性较低。10~20 cm的过氧化氢酶活性之间无显著性差异(P>0.05)。不同土层的过氧化氢活性比值之间,鸭茅与无芒雀麦混播时的过氧化氢活性比值低于单播无芒雀麦过氧化氢酶活性的比值;相反,鸭茅和白三叶混播时的比值高于单播白三叶的比值;除了10%CF+90%处理之外,鸭茅和苜蓿混播的过氧化氢活性比例最高(表3)。
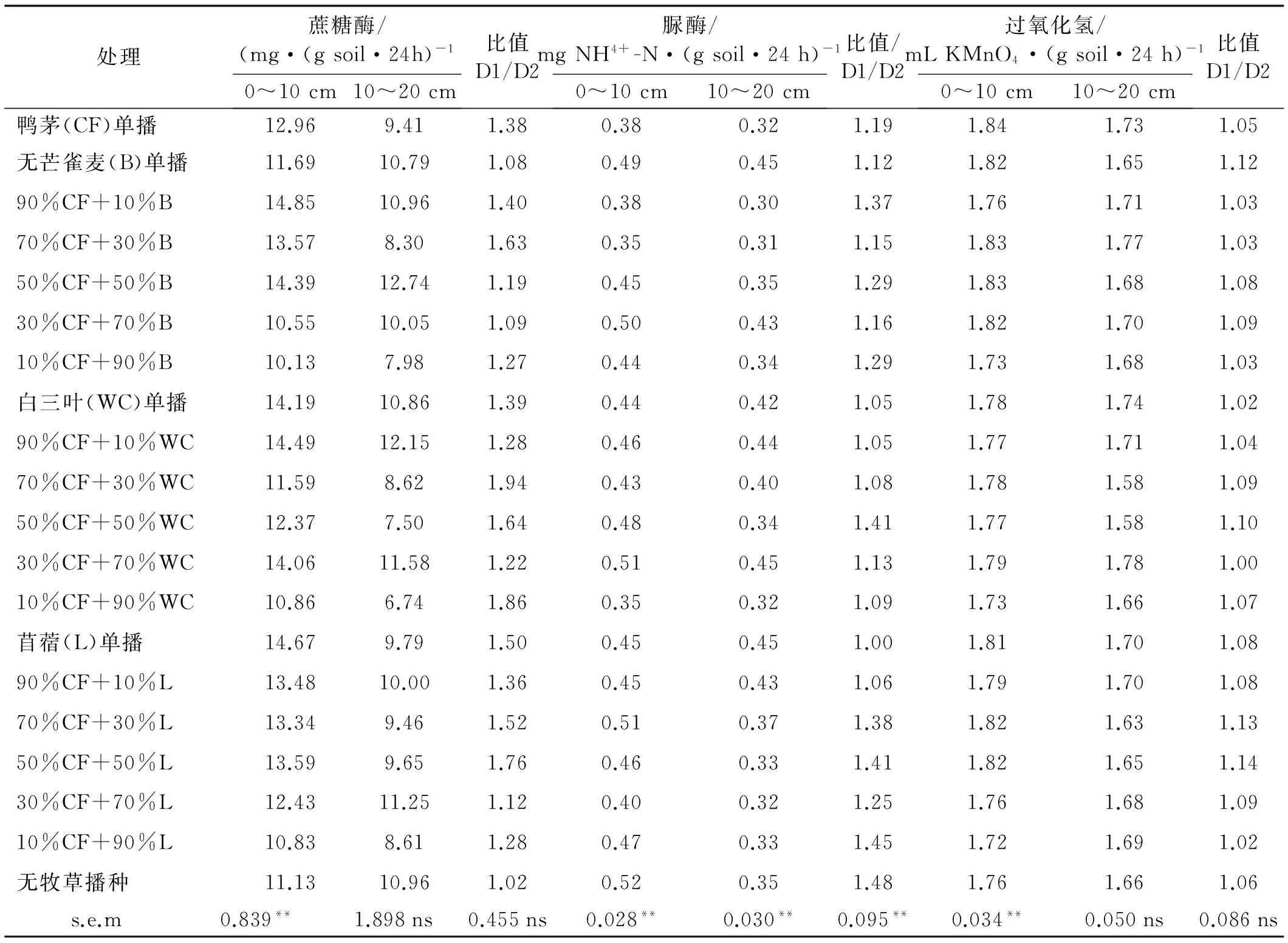
表3 不同土层下不同处理之间土壤酶活性Table 3 The comparison of soil enzyme activity among treatments in different soil depths
3 讨论
土壤微生物群落的结构和组成是土壤生物活性的重要指标[15]。3类微生物数量均以细菌占绝大多数(65.41%~89.25%),其次是放线菌(10.70%~34.67%),真菌(少于0.2%)相对较少。龙妍等[16]对葡萄园行间种植白三叶草、紫花苜蓿、高羊茅的研究表明,葡萄园行间生草使土壤微生物数量明显高于清耕,且在各处理中微生物数量随着土层深度的增加而降低。细菌最多,放线菌次之,纤维素分解菌最少。研究中土壤细菌和放线菌数量占土壤微生物总数的99%以上,对植物营养的转化起着重要作用[17]。试验结果表明土壤细菌数量最高,土壤放线菌数量较低,土壤真菌数量最小;且表现为0~10 cm>10~20 cm。
土壤微生物主要包括真菌、细菌和放线菌,尽管真菌数量不及细菌,甚至比放线菌还少,但真菌是构成土壤微生物生物量的主要来源,具有分解有机质,为植物提供养分的功能,是生态系统健康的指示物[18]。鸭茅和苜蓿混播的土壤真菌数量低于单播鸭茅和苜蓿的土壤真菌数量。土壤中细菌和放线菌数量增加,真菌数量降低,有利于植物生长[19]。
鸭茅和白三叶或苜蓿的混播组合中,细菌的数量均高于单播鸭茅、白三叶和苜蓿的数量;鸭茅和无芒雀麦混播的土壤细菌数量高于单播鸭茅的数量,低于单播无芒雀麦的数量;据Goodfellow和Haynes[20]报道,迄今为止用现有的方法分离到的放线菌仅占自然界总数的10%。鸭茅和苜蓿混播的放线菌数量均低于单播鸭茅和苜蓿的数量;鸭茅和无芒雀麦混播的放线菌数量高于单播无芒雀麦的数量,低于单播鸭茅的数量。因此,放线菌仍然有很大的研究和应用空间。放线菌大量的分布在土壤中,土壤是放线菌的天然存在场所[21]。
林桂志等[22]在种植百喜草的研究结果表明,裸露地(对照)的土壤细菌、放线菌、真菌数量较少,微生物总数也较少;种植百喜草后,荔枝园的土壤细菌、放线菌、真菌数量均有明显增加,其土壤微生物总数高于裸露地的数量。Whitelaw-Weckert等[23]在澳大利亚葡萄园的研究也表明,在葡萄园种植永久性生草与清耕相比,可以极大提高土壤微生物数量。试验表明,无牧草播种处理的土壤微生物数量低于单播牧草处理的数量。郑仲登等[24]通过比较套种和不套种牧草对土壤微生物数量影响,结果表明,与不套种牧草相比,套种明显提高果园土壤中微生物的数量,尤其是对细菌和固氮菌的影响更大。
土壤酶作为一种指示剂,可以来评价土壤肥力和微生物活性[25]。在间作混播模式下,两作物共生调节了其根系的生理活动,促进了根系分泌物和腐解物的作用,继而促进了土壤微生物活动,使多种酶活性处于较高水平[26]。土壤脲酶在氮循环中起着重要的作用,来源于植物[27-28]。有研究表明,土壤酶活性随着土层深度的增加而逐渐减少[29-31]。葡萄园行间种植牧草后,白三叶和紫花苜蓿提高了土壤蔗糖酶和脲酶活性,这与大多数人的研究结果一致[32-34]。0~10 cm鸭茅和苜蓿混播时的土壤蔗糖酶和过氧化氢酶高于鸭茅同无芒雀麦混播时活性,惠竹梅等[35]在西北葡萄园进行的研究结果表明,豆科牧草紫花苜蓿和白三叶提高土壤微生物数量、酶活性及土壤肥力的效果优于禾本科的高羊茅。过氧化氢是生物呼吸过程和有机物的生物化学氧化反应的产物,对生物和土壤均有毒害[36],过氧化氧酶能促使过氧化氢分解为水和氧,解除过氧化氢对植物的毒害,可以用来表征土壤的生化活性[37]。土壤蔗糖酶与土壤中有机质、氮、磷含量,微生物数量及土壤呼吸强度有关,其酶促作用产物直接关系到作物的生长[38]。与无牧草播种相比,0~10 cm单播的豆科和禾本科牧草均提高了土壤的蔗糖酶和过氧化氢酶活性;除了10%CF+90%B,10%CF+90%WC和10%CF+90%L处理之外,其他混播牧草的酶活性均高于无牧草播种。根系大量分泌有机物质,刺激土壤中的微生物活动及生化反应,使酶活性增强[39]。
4 结论
土壤微生物数量和土壤酶活性随着土层深度的增加而逐渐降低,且表现为0~10 cm>10~20 cm。鸭茅和苜蓿混播时的土壤细菌和放线菌数量最多,鸭茅和无芒雀麦混播处理次之,试验中鸭茅和白三叶混播处理最小。
鸭茅和豆科牧草混播处理的脲酶活性高于鸭茅和禾本科混播处理的活性。鸭茅和苜蓿或无芒雀麦混播处理时的土壤蔗糖酶和过氧化氢酶活性明显高于鸭茅和白三叶混播时的活性。与无牧草播种处理相比,单播和混播处理均对土壤的蔗糖酶活性和过氧化氢酶活性有所提高。
[1] Harris C A,Clark S G,Reed K F M,etal.NovelFestucaarundinaceaShreb.AndDactylisglomerataL.germplasm to improve adaptation for marginal environments[J].Australian Journal of Experimental Agriculture,2008,48(4):436-448.
[2] 郑军辉,叶素芬,喻景权.蔬菜作物连作障碍产生原因及生物防治[J].中国蔬菜,2004(3):56-58.
[3] Roy S,Singh J S.Consequences of Habitat Heterogeneity for Availability of Nutrients in a Dry Tropical Forest [J].Journal of Ecology,1994,82(3):503-509.
[4] Larkin R P.Characterization of soil microbial communities under different potato cropping systems by microbial population dynamics,substrate utilization,and fatty acid profiles [J].Soil Biology & Biochemistry,2003,35(11):1451-1466.
[5] LI Y,CHEN Y L,LI M,etal.Effects of arbuscular mycorrhizal fungi communities on soil quality and the growth of cucumber seedlings in a greenhouse soil of continuously planting cucumber [J].Pedosphere,2012,22(1):79-87.
[6] Wardle D A.A Comparative assessment of factors which influence microbial biomass carbon and nitrogen levels in soil[J].Biological Reviews,1992,67(3):321-358.
[7] Bucher A E,Lanyon L E.Evaluating soil management with microbial community-level physiological profiles [J].Applied Soil Ecology,2005,29(1):59-71.
[8] 田慧,谭周进,屠乃美,等.少免耕的土壤生态学效应研究进展[J].耕作与栽培,2006(5):10-12.
[9] Caldwell B A.Enzyme activities as a component of soil biodiversity:A review [J].Pedobiologia,2005(6):637-644.
[10] Fliebach A,Mäder P.Microbial biomass and size-density fractions differ between soils of organic and conventional agricultural systems[J].Soil Biology & Biochemistry,2000,32(6):757-768.
[11] 谈嫣蓉,蒲小鹏,张德罡,等.不同退化程度高寒草地土壤酶活性的研究[J].草原与草坪,2006(3):20-22.
[12] Pk G.Growth,yield,competition and economics of groundnut/cereal fodder intercropping systems in the semi-arid tropics of India [J].Field Crops Research,2004(2-3):227-237.
[13] 金晶,曹致中,曹毅.人工恢复沙化草地的土壤微生物和酶活性的研究[J].草原与草坪,2011,31(1):84-88.
[14] 李硕,聂中南,陈伟,等.干旱和盐胁迫对鸭茅叶绿素荧光动力学参数的影响[J].草原与草坪,2015,35(5):23-27.
[15] Edmeades D C.The long-term effects of manures and fertilisers on soil productivity and quality:a review [J].Nutrient Cycling in Agroecosystems,2003,66(2):165-180.
[16] 龙妍.行间生草条件下葡萄园土壤微生物、酶活性、养分的动态变化及相关性分析[D].兰州:甘肃农业大学,2007:6.
[17] Workneh F,Bruggen A H C V.Microbial density,composition,and diversity in organically and conventionally managed rhizosphere soil in relation to suppression of corky root of tomatoes[J].Applied Soil Ecology,1994,1(3):219-230.
[18] 张晶,张惠文,李新宇.土壤真菌多样性及分子生态学研究进展[J].应用生态学报,2004,15(10):1958-1962.
[19] 葛红莲,陈龙,张军令.长期污水灌溉对小麦根际土壤微生物区系的影响[J].节水灌溉,2009(5):14-15.
[20] Duraipandiyan V,Sasi A H,Islam V I H,etal.Antimicrobial properties of actinomycetes from the soil of Himalaya [J].Journal De Mycologie Médicale,2010,20(1):15-20.
[21] Katsifas E A,Giannoutsou E P,Karagouni A D.Diversity of streptomycetes among specific Greek terrestrial ecosystemsb [J].Lett Appl Microbial,1999,29:48-51.
[22] 林桂志,丁光敏,许木土,等.幼龄荔枝园种植百喜草改良土壤效果的研究[J].亚热带水土保持,2006,18(4):4-8.
[23] Whitelaw-Weckert M A,Rahman L,Hutton R J,etal.Permanent swards increase soil microbial counts in two Australian vineyards [J].Applied soil Ecology,2007,36(3):224-232.
[24] 郑仲登,黄毅斌,翁伯琦.福建山地综合开发中红壤保育研究[J].中国生态农业学报,2003,12(3):149-151.
[25] Badiane N N Y,Chotte J L,Pate E.Use of soil enzyme activities to monitor soil quality in natural and improved fallows in semi-arid tropical regions [J].Applied Soil Ecology,2001,18(3):229-238.
[26] Niemi R M,Vepsäläinen M,Wallenius K,etal.Temporal and soil depth-related variation in soil enzyme activities and in root growth of red clover (Trifoliumpratense) and timothy (Phleumpratense) in the field[J].Applied Soil Ecology,2005,30(2):113-125.
[27] Vepsäläinen M,Erkomaa K,Kukkonen S,etal.The impact of crop plant cultivation and peat amendment on soil microbial activity and structure [J].Plant & Soil,2004,264(1-2):273-286.
[28] Jc P.Nitrogen Metabolism in Soybean Tissue Culture:II.Urea Utilization and Urease Synthesis Require Ni[J].Plant Physiology,1977(5):827-830.
[29] Polacco J C.Is nickel a universal component of plant ureases[J].Plant Science Letters,1977,2(3):249-255.
[30] Polacco J C.Nitrogen-metabolism in soybean Tissue-culture.2.Urea utilization and urease synthesis require Ni2+[J].Plant physiology,1977(5):827-830.
[31] Spears J D H,Lajtha K,Caldwell B A.Species effects of Ceanothus velutinus versus Pseudotsuga menziesii,Douglas-fir,on soil phosphorus and nitrogen properties in the Oregon cascades [J].Forest Ecology & Management,2001,149(1):205-216.
[32] Taylor J P,Wilson B,Mills M S.Comparison of microbial numbers and enzymatic activities in surface soils and subsoils using various techniques [J].Soil Biology & Biochemistry,2002,34(3):387-401.
[33] Burger J A,Kelting D L.Using soil quality indicators to assess forest stand management [J].Forest Ecology & Management,1999,122(1-2):155-166.
[34] 李发林,傅金辉,刘长全,等.果园生草、套种绿肥对红壤幼龄果园土壤酶活性变化的研究[J].福建热作科技,1999,24(4):1-7.
[35] 惠竹梅,岳泰新,张瑾,等.西北半干旱区葡萄园生草体系中土壤生物学特性与土壤养分的关系[J].中国农业科学,2011,44(11):2310-2317.
[36] 邱现奎,董元杰,万勇善,等.不同施肥处理对土壤养分含量及土壤酶活性的影响[J].土壤,2010,42(02):249-255.
[37] 张国坤,邓伟,宋开山,等.新开河流域土地利用格局变化及其生态学意义[J].生态学报,2006,26(9):3025-3034.
[38] 曹慧,孙辉,杨浩,等.土壤酶活性及其对土壤质量的指示研究进展[J].应用与环境生物学报,2003,9(1):105-109.
[39] 李发林,黄炎和,刘长全,等.土壤管理模式对幼龄果园根际土壤养分和酶活性影响初探[J].福建农业学报,2002,17(2):112-115.
Effect of cocksfoot (Dactylisglomerata) on soil microorganism and enzyme activity
LI Shuo1,NIE Zhong-nan1,2,JIANG Zhe-hao1,CHEN Jian-gang1,HU Xin-zhen1,YUAN Zi-ru1,REN Ling1,CHEN Lu1,ZHANG De-gang1
(1.CollegeofPrataculturalScience,GansuAgriculturalUniversity/KeyLaboratoryofGrasslandEcosystem,MinistryofEducation/PrataculturalEngineeringLaboratoryofGansuProvince/Sino-U.S.CentersforGrazinglandEcosystemSustainability,Lanzhou730070,China;2.DepartmentofEconomicDevelopment,Jobs,TransportandResources,PrivateBag105,HamiltonVIC3300,Australia)
The experiment was conducted to quantify the distribution of soil microorganism and enzyme activity under different mixture ratios between cocksfoot (Dactylisglomerata) and companion grasses and legumes by using a randomized complete block with 4 replicates.4 monoculture treatments [cocksfoot;brome (Bromusinermis);white clover (Trifoliumrepens);lucerne (Medicagosativa)],15 mixtures between cocksfoot and brome/white clover/lucerne in 5 mixtures ratios and no pasture sown were designed.The result indicated that soil microorganism and enzyme activity gradually decreased with increasing soil depths,in terms of soil microorganism,the quality of soil microorganism was highest under different mixture sown proportions between cocksfoot and lucerne,followed by the mixture sown between cocksfoot and brome,the quality was lowest under different mixture ratios between cocksfoot and white clover.Soil urease activity of mixture treatments between cocksfoot and legumes species (white clover or lucerne) was higher than mixture treatments between cocksfoot and brome.Soil invertase and catalase activity of mixture treatments between cocksfoot and companion species (lucerne or brome) was higher than mixtures between cocksfoot and white clover.In comparison to no pasture sown treatment,soil invertase and catalase activity were improved among monoculture and mixture sown treatments.
cocksfoot;soil microorganisms;soil enzyme activity
2016-03-01;
2016-03-09
农业部全国畜牧总站“草地生态系统关键产品与服务实物量测度研究”项目资助。
李硕(1989-),男,甘肃庆阳人。 E-mail:lishuo858@foxmail.com
S 154.3
A
1009-5500(2017)02-0012-08
张德罡为通讯作者。
