不同品系小鼠腹腔巨噬细胞对LPS的反应性初步比较研究
2017-05-17张腾腾李艳茹李太元
陈 伟, 马 瑞, 张腾腾, 张 涵, 李艳茹, 李太元
(延边大学农学院,吉林 延吉 133002)
不同品系小鼠腹腔巨噬细胞对LPS的反应性初步比较研究
陈 伟, 马 瑞, 张腾腾, 张 涵, 李艳茹, 李太元*
(延边大学农学院,吉林 延吉 133002)
为初步探究不同品系小鼠腹腔巨噬细胞对LPS的反应性区别,通过对C57BL/6小鼠、BALB/C小鼠和昆明小鼠腹腔注射硫乙醇酸盐(Thioglycollate,TG)以诱导巨噬细胞聚集。4 d后收集细胞,计数并培养。使用脂多糖(LPS)分别刺激3种细胞,测定并对比炎症因子的分泌情况。结果表明:腹腔注射TG后,C57BL/6小鼠诱导率最高;LPS刺激细胞后,C57BL/6小鼠的腹腔巨噬细胞分泌的TNF-α、IL-6、iNOS和COX-2的分泌量均较其他2种小鼠高。
硫乙醇酸盐;腹腔巨噬细胞;炎症因子;C57BL/6小鼠;BALB/C小鼠;昆明鼠
炎症(inflammation)是机体在组织损伤或试图对抗潜在的有害刺激时发生的一种自身防御性反应,通常情况下对机体是有利的,但过度的炎症反应则会导致机体释放过多的炎性介质,导致局部或全身的炎症性疾病,引起2次病理损伤,如类风湿性关节炎、动脉粥样硬化、哮喘、肺纤维化等[1-3]。
巨噬细胞(macrophages)源于体内的单核细胞,主要功能为吞噬异物(如细胞残片、病原体)和激活其他免疫细胞。当机体受到病原体的攻击时,会诱导巨噬细胞活化并向感染部位募集,并引起炎症反应[4-6]。因此,巨噬细胞的数量在一定程度上反映了炎性反应强度。
随着体外分离培养细胞技术的发展,巨噬细胞的提取方法有多种,细胞来源有猪、兔、大鼠、小鼠等。但由于研究目的不同,在体内提取细胞的部位也各不相同,如提取肺血管巨噬细胞、肾小球巨噬细胞,骨髓基质巨噬细胞、腹腔巨噬细胞等[7]。通过提取腹腔巨噬细胞,建立稳定的原代细胞模型对实验研究具有重大意义[8-9],但目前对不同品系小鼠腹腔提取的巨噬细胞对LPS引发的炎症相关因子的差异尚无报道。本研究选择3种不同品系小鼠,通过腹腔注射TG溶液形成无菌性炎症[10],随后收集腹腔巨噬细胞,进行功能检测,从而比较不同品系小鼠腹腔巨噬细胞募集数量及炎症相关指标的差异,为体外细胞模型的建立提供一定的参考依据。
1 材料与方法
1.1 材料
1.1.1 动物
雌性昆明小鼠,8周龄,购自延边大学实验动物中心;雌性BALB/c 小鼠、雌性C57BL/6 小鼠,8周龄,购自长春市亿斯实验动物技术有限责任公司。饲喂于标准饮食,充足水源,保持12 h 昼夜交替环境下。
1.1.2 试剂
硫乙醇酸盐(Thioglycollate,TG),购自上海碧迪医疗器械公司;脂多糖(LPS)、ATP,购自Sigma公司;ELISA试剂盒,购自BD公司;胎牛血清(FBS)、抗生素、DMEM培养基、opti-MEM培养基,购自Gibco公司。iNOS抗体、COX-2抗体,购自Santa Cruz生物有限公司。
1.2 方法
1.2.1 TG制备
称取20 g TG固体颗粒,溶于少量蒸馏水中,充分溶解后煮沸30 min,室温冷却后定容至500 mL,在121 ℃条件下灭菌15 min后,避光保存备用。
1.2.2 小鼠腹腔巨噬细胞的诱导及收集
取不同品系的8周龄小鼠,每只小鼠腹腔注射3 mL TG溶液后,正常饲养。4 d后处死小鼠,无菌条件下抽取5 mL 预冷PBS缓冲液灌洗腹腔,回收腹腔细胞悬液[11]。台盼蓝染色进行细胞计数,使用DMEM细胞培养液(含10% FBS)将细胞过夜培养于37 ℃,5% CO2条件下。
1.2.3 一氧化氮浓度检测
将腹腔巨噬细胞接种于48孔板中,根据处理时间将3种细胞分别分为空白组和LPS(100 ng/mL)处理12、18、24 h 3组。收集细胞上清液,按1∶1比例加入Griess试剂,使用酶标仪在550 nm波长处测定OD值。根据一氧化氮标准液制作标准曲线,并计算一氧化氮浓度。
1.2.4 TNF-α、IL-6和IL-1β的浓度检测
将腹腔巨噬细胞接种于48孔板中,并分为空白组、TNF-α、IL-6和IL-1β 4组。其中,TNF-α和IL-6组分别加入LPS(100 ng/mL)处理4 h;IL-1β组先加LPS处理3 h后,替换无FBS的Opti-MEM后,加入ATP(5 mmol/L)处理1 h。收集细胞上清液,参照ELISA试剂盒方法处理,使用酶标仪在450 nm波长处测定OD值。根据TNF-α、IL-6和IL-1β标准液作出标准曲线,计算TNF-α、IL-6和IL-1β的浓度。
1.2.5 iNOS和COX-2分泌量检测
将腹腔巨噬细胞接种于6孔板,并分为空白组和LPS(100 ng/mL)处理组。处理24 h后弃上清,使用RIPA裂解液裂解细胞。将裂解液在15 000 r/min离心15 min,获取上清液,蛋白质经10% SDS-PAGE电泳分离后,转移至PVDF膜。经脱脂奶封闭后,用iNOS和COX-2抗体孵育过夜。使用ECL化学发光法检测iNOS和COX-2的分泌量。
1.2.6 统计学方法
使用GraphPad Prism 5进行t-检验统计学分析,采用双尾分布,P<0.05表示具有显著性差异,P<0.01表示具有极显著性差异,P<0.001表示具有极其显著差异。
2 结果与分析
2.1 腹腔巨噬细胞的诱导率比较
腹腔注射TG 4 d后,3种品系小鼠巨噬细胞均被募集至腹腔。
由图1可知,C57BL/6小鼠诱导率最高,为3.3×107cells,较BALB/c小鼠和昆明鼠均有极其明显差异。
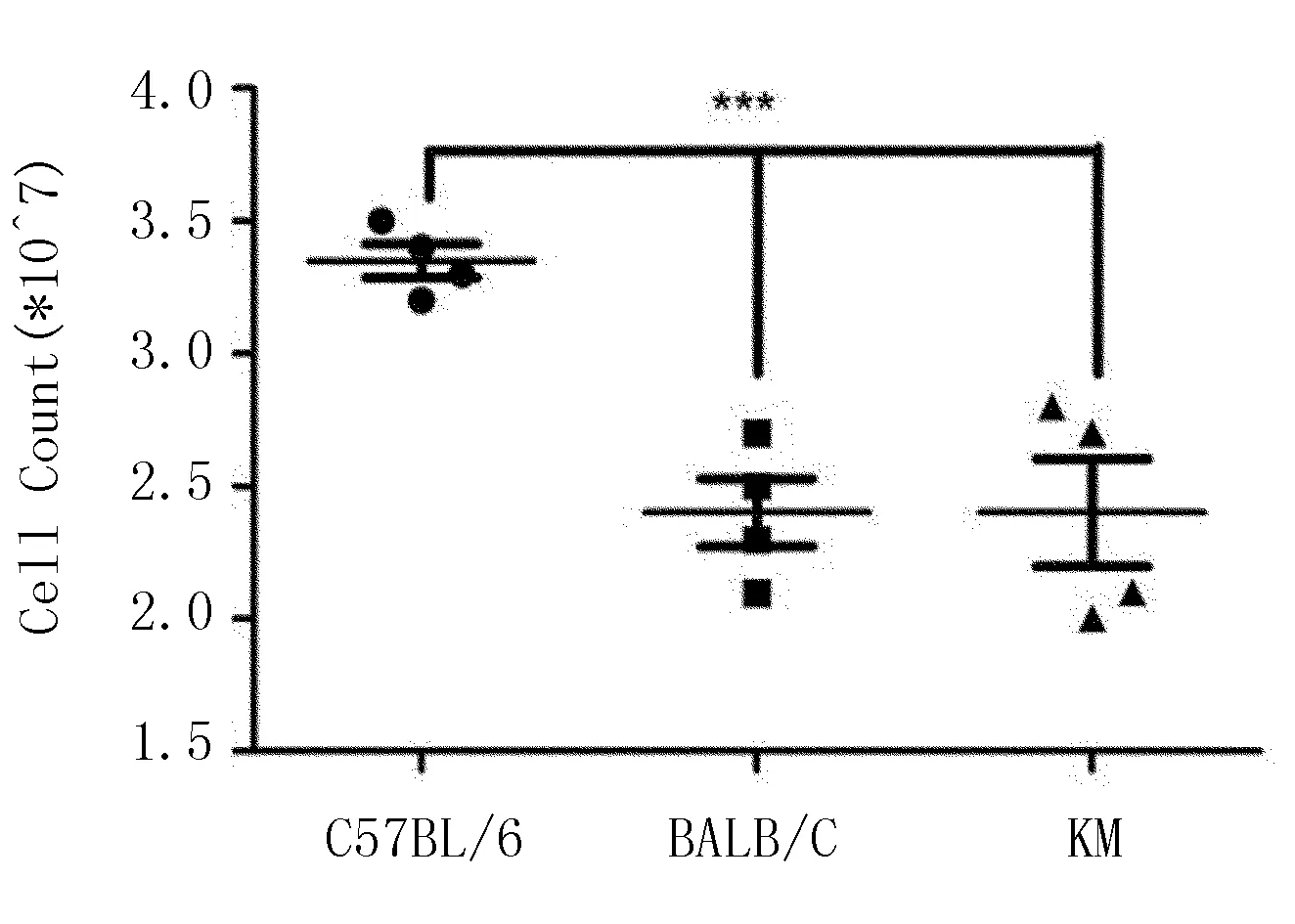
***表示C57BL/6与BALB/C和昆明鼠相比P<0.001
2.2 一氧化氮的产生量比较
为了验证3种小鼠巨噬细胞经LPS诱导后,其细胞炎症反应是否具有差异。将3种小鼠腹腔巨噬细胞分别使用LPS预处理不同时间段后,检测其NO产量。由图2可知,LPS刺激后3种小鼠腹腔巨噬细胞产生NO的含量具有一定的时间依赖性,即处理时间越长,NO产量越高。其中,18 h处理组中,C57BL/6小鼠腹腔巨噬细胞的NO产量较其他2种小鼠呈明显差异,24 h处理组,则呈极其显著差异。
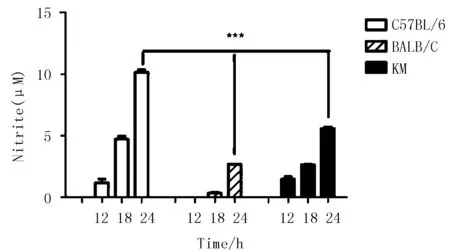
***表示C57BL/6与BALB/C和昆明鼠相比P<0.001
图2 LPS诱导后3种品系小鼠一氧化氮产量
Fig.2 The production of nitric oxide after LPS induction in three strains of mice
2.3 小鼠腹腔巨噬细胞炎症因子分泌量比较
为更进一步了解3种小鼠腹腔巨噬细胞对炎症相关因子表达是否具有差异,检测了TNF-α、IL-6、IL-1β以及iNOS和COX-2的表达。由图3可知,LPS刺激后,C57BL/6小鼠IL-1β分泌量低于其他2种小鼠。而BALB/C小鼠与C57BL/6小鼠TNF-α及IL-6分泌量无明显差异,但均高于昆明鼠且差异显著。在相关炎症信号通路中,C57BL/6小鼠iNOS和COX-2的表达水平明显强于其他2种小鼠。

图3 LPS诱导后炎症因子分泌量测定
3 讨论与结论
巨噬细胞作为一种非常重要的免疫细胞,其在炎症的发生和发展过程中的作用不言而喻。先前研究发现,巨噬细胞多游离于腹水中,容易获得,因此在许多实验室中要进行药物的抗炎机制研究时,往往选用小鼠腹腔巨噬细胞为研究对象[12-13]。而获得数量多、纯度高的原代巨噬细胞,则是建立稳定、标准的体外模型的基础。目前国内外已经发现了多种方法可以分离出小鼠腹腔巨噬细胞,采用预先注入巨噬细胞诱导剂,以诱导大量的巨噬细胞聚集到腹腔,通过灌洗腹腔获得大量腹腔巨噬细胞[14]。TG作为一种肉汤培养基,不仅能够培养厌氧微生物,使其生长良好,还能通过腹腔注射,引起非感染性炎症刺激,促进巨噬细胞聚集到腹腔中[2,10]。本试验选用C57BL/6、BALB/C和昆明鼠3种不同品系的小鼠,使用TG作为诱导剂募集巨噬细胞,从而获得大量的腹腔巨噬细胞。通过比对诱导率发现,C57BL/6小鼠的诱导率最高,达3.3×107cells/只。并且由C57BL/6小鼠获得的巨噬细胞数目稳定,较其他2种小鼠种间差异性小。
脂多糖(Lipopolysaccharides,LPS)是革兰氏阴性细菌细胞壁的主要成分,也是炎症刺激因子的一种。巨噬细胞经过 LPS刺激后,MyD88和TRIF信号通路调控的MAPK级联反应被激活,进而激活下游核转录调控因子NF-κB亚基P50和P65进入细胞核,发挥转录调控作用,促进诱导型一氧化氮合成酶(iNOS)、COX-2、IL-1β、IL-6和TNF-α等mRNA表达,生成相应炎症介质[15-16]。巨噬细胞内存在的iNOS被LPS诱导产生并产生NO,起到杀伤多种病原体及肿瘤细胞的作用,参与巨噬细胞的非接触性细胞杀伤过程[17-18]。通过对3种小鼠腹腔巨噬细胞预处理不同时间段LPS发现,其NO生成量均随时间增加呈梯度上升,且相同时间下C57BL/6小鼠产生NO的量远高于C57BL/6小鼠和昆明鼠。通过比较细胞因子及炎症信号因子分泌量发现,虽然C57BL/6小鼠IL-1β的分泌量与其他2种小鼠相比较低,但TNF-α、IL-6的水平以及其在核内信号通路中iNOS和COX-2的表达水平均比其他2种小鼠高。
综上所述,C57BL/6小鼠在炎症相关因子及细胞信号通路表达上,整体呈现较高水平。该试验通过对3种品系小鼠巨噬细胞进行对比,筛选出较适合进行炎症相关体外试验的原代巨噬细胞,为后期的实验研究提供一定的理论依据。
[1] Denburg J A, Inman M D, Sehmi R, et al. Hemopoietic mechanisms in allergic airway inflammation[J]. International Archives of Allergy and Immunology, 1998,117(03):155-159.
[2] Kaminska B. MAPK signaling pathways as molecular targets for antiinflammatory therapy-from molecular mechanisms to therapeutic benefits[J]. Biochimica et Biophysica Acta,2005(1754):253-262.
[3] 何健.雪胆素甲对脂多糖活化的巨噬细胞RAW264.7的炎症反应的影响及其机制研究[D].广州:暨南大学,2013.
[4] 尹美珍,李世普,袁琳,等.小鼠腹腔巨噬细胞的分离培养与鉴定[J].武汉大学学报 (医学版),2006 ,27(02):203-205.
[5] 满媛,王宇翔,朱舒燕,等.靛玉红对 ATP 引起的巨噬细胞吞噬抑制、ROS 产生和细胞死亡的影响[J].药学学报,2012,47(01):45-50.
[6] 李苏楠.IL-21对LPS诱导的小鼠腹腔巨噬细胞分泌功能的影响及机制[D].长春:吉林大学,2013.
[7] 张淑莉,张琪,景晓红.小鼠腹腔巨噬细胞的提取与鉴定[J].国际检验医学杂志,2015,6(02):174-178.
[8] 孔德新,陈雪红,谢靖,等.狭鳕鱼皮胶原蛋白肽对大鼠关节炎模型中氧化应激和炎症因子的影响[J].安徽农业科学,2015,43(26):132-134.
[9] 穆晓琨,毕 琳.NLRP3/ASC/caspase-1/IL-1β/IL-18轴在大鼠脓毒症急性肾损伤中的作用[J].安徽农业科学,2015,43(32):93-95,159.
[10] Weinrauch Y, Katz S S, Munford R S, et al. Deacylation of purified lipopolysaccharides by cellular and extracellular components of a sterile rabbit peritoneal inflammatory exudate[J]. Infection and Immunity,1999,67(07): 3376-3382.
[11] 尹伟,陶阿丽,戴一,等.桂花多糖体外免疫活性的研究[J].赤峰学院学报(自然科学版),2015,31(11):16-18.
[12] 李艳云,史秋梅,王晓珊,等.紫锥菊多糖对内毒素血症小鼠炎症的保护作用[J].河北科技师范学院学报,2015,29(03):8-11.
[13] 刘思洋,章雷,顾健,等.波棱瓜子对免疫性肝损伤的免疫炎症调节作用[J].西南民族大学学报(自然科学版),2015,41(05):555-560.
[14] 黎庶,汪正清.LPS诱导巨噬细胞凋亡的研究[J].中华微生物学和免疫志,2003(07):49-52.
[15] 徐霄龙.安石榴苷通过诱导小鼠巨噬细胞型分化抑制急性炎症反应[D].北京:中国农业大学,2015.
[16] Jiang J, Kang T B, Shim D W, et al. Indole-3-carbinol inhibits LPS-induced inflammatory response by blocking TRIF-dependent signaling pathway in macrophages[J]. Food and Chemical Toxicology,2013(57):256-261.
[17] 徐远义,黄允宁.多抗甲素诱导大鼠腹腔巨噬细胞对癌细胞杀伤增强机制的研究[J].天津医药,2003,31(06):384-386.
[18] 仇燕.长春碱对RAW264.7细胞增殖和分泌一氧化氮的影响[J].中国药房,2010,21(09):808-810.
Preliminary comparative study of LPS reactivity on the peritoneal macrophages from different strains of mice
CHEN Wei, MA Rui, ZHANG Tengteng, ZHANG Han, LI Yanru, LI Taiyuan*
(AgriculturalCollegeofYanbianUniversity,YanjiJilin133002,China)
In order to explore the difference of the responses of LPS-induced macrophages from different strains of mice, we injected thioglycollate (TG) into C57BL/6 mice, BALB/C mice and Kunming mice intraperitoneally to induce macrophage aggregation. After 4 days, the cells were collected, counted and cultured. We used lipopolysaccharide (LPS) to stimulated three cells respectively, then measured and compared the secretion of inflammatory cytokines. The results showed that C57BL/6 mice had the highest induction rate after induced by TG. After LPS stimulation, the secretions of TNF-α, IL-6, iNOS and COX-2 from peritoneal macrophages of C57BL/6 mice were higher than the other two strains of mice.
Thioglycollate; peritoneal macrophages; inflammatory cytokines; C57BL/6 mice; BALB/C mice;Kunming mice
2017-01-07
陈伟(1989—),男,陕西咸阳人,在读硕士,研究方向为动物微生物与免疫学。李太元为通信作者,E-mail:tyli@ybu.edu.cn
1004-7999(2017)01-0079-04
10.13478/j.cnki.jasyu.2017.01.014
R459.7
A
