牛皮杜鹃组织培养初步研究
2017-05-17丁洪玲李美善许明子刘宪虎
丁洪玲, 宫 宇, 李美善, 许明子, 刘宪虎*
(1.延边农业科学院作物所,吉林 龙井 133400;2.延边大学农学院,吉林 延吉 133002)
丁洪玲1, 宫 宇2, 李美善2, 许明子2, 刘宪虎2*
(1.延边农业科学院作物所,吉林 龙井 133400;2.延边大学农学院,吉林 延吉 133002)
以牛皮杜鹃无菌苗为材料,分别对愈伤组织诱导培养基、生根壮苗培养基和移栽基质进行了筛选。结果表明:愈伤组织诱导效果最好的培养基为WPM +3 mg/L IBA+8 mg/L ZT(pH值5.2),白糖20 g/L;最佳生根壮苗培养基为WPM +0.1 mg/L NAA+1 g/L AC +0.4 mg/L IBA;筛选出的最好移栽基质为苔藓土,成活率达94%。
牛皮杜鹃;组织培养;培养基;诱导
牛皮杜鹃(RhododendronchrysanthumPall.)别名黄花杜鹃、牛皮茶,属常绿无鳞杜鹃花亚属、常绿无鳞杜鹃花组、长序杜鹃花亚组[1-2]。它是常绿小灌木,花冠漏斗状,花淡黄色或白色,在我国分布狭窄,主要生于长白山岳桦林下和高山苔原上,辽宁桓仁老秃顶山、吉林大秃顶山、黑龙江尚志县、俄罗斯的西伯利亚、朝鲜北部和日本也有一些分布[3],是水土保持的好植物,对维持生态平衡起重要作用。牛皮杜鹃的野生资源极其有限,且近年来人为破坏较严重,现已被列为国家三级保护渐危种。牛皮杜鹃通过种子有性繁殖,但出苗率低,植株生长较慢,而通过组培快繁方法则应能如同杜鹃迅速大量的获得再生植株。我国从20世纪80年代开始进行杜鹃组织培养的研究,1982年首先报道了杜鹃的组织培养繁殖[4],随后多人发表了一些学术价值较高的研究报告[5-10]。但目前对牛皮杜鹃组织培养的研究鲜有报道。
该试验在参考前人对杜鹃花组织培养研究的基础上,重点探究牛皮杜鹃的组织培养技术,为今后能够快速繁殖提供依据。
1 材料与方法
1.1 材料
采用长白山北坡采集的野生牛皮杜鹃种子经无菌培养长成的无菌苗的叶片和茎段做为供试材料。
1.2 方法
1.2.1 牛皮杜鹃种子发芽最适温度的筛选
将牛皮杜鹃种子用纱布包好(流水冲洗4 h后),均匀平铺在培养皿基床上(双层纱布铺成),分别置于4个不同温度(15、20、25、30 ℃)恒温培养箱中进行发芽试验。每个处理500粒种子,重复3次,试验过程中保持种子湿润,并观察和记录发芽情况。
1.2.2 GA3对牛皮杜鹃种子发芽的影响
将用蒸馏水浸湿的牛皮杜鹃种子浸泡在5种不同浓度(0、200、400、600、800 mg/L)的赤霉素溶液中,经过24 h浸泡后,均匀平铺在培养皿基床中(20 ℃下恒温培养)。每个处理300粒种子,3次重复。试验过程中保持种子湿润,并观察和记录发芽情况。
1.2.3 无菌苗的培养
将牛皮杜鹃种子用600 mg/L GA3浸泡24 h后,进行无菌发芽。1) 种子消毒:用3层纱布将牛皮杜鹃种子包好,在无菌条件下用70%酒精漂洗20 s之后,用无菌水冲洗2次,再用0.1%HgCl2溶液消毒5 min,用无菌水冲洗5次,每次冲洗3 min并不断搅拌,冲洗后置于无菌培养皿中准备播种;2) 播种用培养基:WPM培养基(蔗糖30 g/L,琼脂粉6 g/L,pH值5.4);3) 培养条件:温度(25±2) ℃,光照强度1 500~2 000 lx,光照时间恒定12 h/d。播种后30~50 d,小苗生长到2 cm时进行愈伤组织诱导试验。
1.2.4 最佳诱导培养基的筛选
无菌苗的叶片作外植体,采用WPM培养基,附加不同浓度的ZT和IBA,确定最佳生长调节剂浓度组合。
1.2.5 pH值对愈伤组织诱导和丛生苗分化的影响
本试验设定6个pH值梯度(pH=4.8、5.0、5.2、5.4、5.6和5.8),取无菌苗上端展开的1~3片叶,长度在5 mm左右的茎段为培养材料。每组接种10个外植体,重复3次。40 d后调查记录愈伤组织诱导率和丛生苗分化率。
1.2.6 不同碳源对愈伤组织诱导的影响
无菌苗的叶片作外植体,用1.2.4筛选确定的最佳诱导培养基,分别设置蔗糖、白糖、葡萄糖浓度 20, 30, 40 g/L 9个处理。每组接种10个外植体,重复3次。40 d后调查记录愈伤组织诱导率。
1.2.7 最佳生根壮苗培养基的筛选
当继代培养所获得的幼苗苗高达到2 cm以上时,将幼苗从基部切下,接种到不同生长调节剂配比的生根壮苗培养基中(表1),进行生根培养,每个处理接种5个幼苗,重复3次。

表1 生根壮苗培养基试验方案
1.2.8 炼苗移栽
牛皮杜鹃组培苗株高达3 cm以上时,进行炼苗移栽。炼苗过程在恒温培养室内进行,第1天将培养瓶口的铝箔纸打开1/4,第2天打开1/2,第3天全部打开,第4天进行移栽。从培养瓶中取出组培苗,洗掉根部的琼脂,移栽到不同的基质中。浇足水后用塑料薄膜覆盖,保持其相对湿度。7 d后逐渐揭去塑料薄膜,并做遮阴处理。炼苗期间每3 d施用0.1%的WPM培养液。30 d后调查记录成活苗数。
2 结果与分析
2.1 牛皮杜鹃种子发芽的最适温度
发芽开始的第2~4天绝大部分种子明显吸水膨胀,从第11天开始萌发,17~22 d发芽的种子最多。20 ℃的发芽率最高,15和30 ℃的发芽率显著下降,且发芽时间推后(表2,结果为3次重复的平均值)。15 ℃时芽(苗)生长细长;20和25 ℃时发芽速度快,且子叶平展,芽(苗)生长量大;30 ℃时的芽(苗)生长受抑制。因此,20 ℃是牛皮杜鹃种子萌发的最佳温度。

表2 不同温度对牛皮杜鹃种子发芽的影响
2.2 GA3对牛皮杜鹃种子发芽率的影响
用GA3处理过的牛皮杜鹃种子进行发芽试验,6 d 后发现部分种子开始发芽,露出白色胚根,14 d时部分种子2片子叶已展开。到持续观测连续5 d 不再有种子萌发为止,计算发芽率(表3,结果为3次重复的平均值)。

表3 不同浓度GA3处理对牛皮杜鹃种子发芽的影响
不使用GA3处理的牛皮杜鹃种子发芽率低,使用适宜浓度的GA3作前处理能明显的促进发芽。GA3浓度增加时发芽率也升高,当GA3浓度达到600 ppm时,牛皮杜鹃种子的发芽率最高,且发芽整齐,800 ppm时,发芽率则下降。
2.3 最佳愈伤组织诱导培养基的筛选
将叶片从无菌苗上切下接种到不同诱导培养基中,接种2 d后可以观察到切口开始萎蔫。接种5 d后,部分叶片出现弯曲膨大现象,14 d时部分叶片切口处开始长出愈伤组织。40 d后统计结果发现,3、4、5号培养基上愈伤组织的诱导率较高(91.7%~95.8%),2、3、4号培养基上愈伤组织平均质量较高(16~18.2 mg)。处理3的诱导率(95.8%)和愈伤组织平均质量(18.2 mg)均达到最高值,所以本试验认为最佳诱导培养基为3号培养基(WPM+3 mg/L IBA +8 mg/L ZT)(表4)。

表4 不同生长调节剂浓度组合对愈伤组织诱导的影响
2.4 pH值对愈伤组织诱导和丛生苗分化的影响
茎段的出愈时间早于叶片,接种约15 d后长出愈伤组织,而叶片在接种约20 d后长出愈伤组织。试验结果表明,随着pH值的增大,愈伤组织诱导率总体趋势是先升高后降低,当pH值为5.2时,其诱导率最高(93.33%),分化率达到100%;而当pH值为5.8时,未见分化现象。pH值为5.2时,叶或茎的诱导率和分化率都明显高于其他处理。所以,该试验认为pH值5.2是牛皮杜鹃组织培养的最适酸度值(表5)。

表5 pH值对愈伤组织的诱导和分化的影响
2.5 不同碳源对愈伤组织诱导的影响
牛皮杜鹃叶片在添加了不同种类和剂量碳源的培养基上进行培养,愈伤组织诱导的效果差别比较明显(表6)。
目前,蔗糖是培养基中最常用的碳源,葡萄糖和果糖也可以促进组织生长[11]。3种碳源都可以使牛皮杜鹃诱导出愈伤组织(表6),尤其是在30 g/L蔗糖和20 g/L白糖时,愈伤组织诱导率较高,综合考虑使用量和价格等方面,白糖是最佳碳源(浓度为20 g/L)。
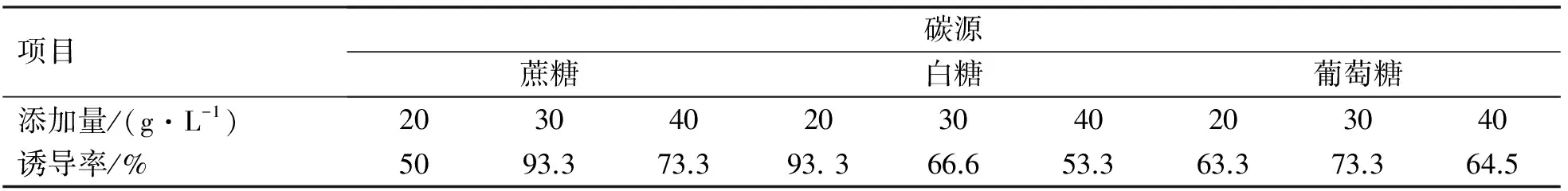
表6 碳源对愈伤组织诱导的影响
2.6 牛皮杜鹃最佳生根壮苗培养基的筛选
小植株接种到生根培养基中进行生根培养60 d,待所有处理都长成完整的植株且生长趋于稳定后,调查小苗的根长、根数和茎生长量(表7)。
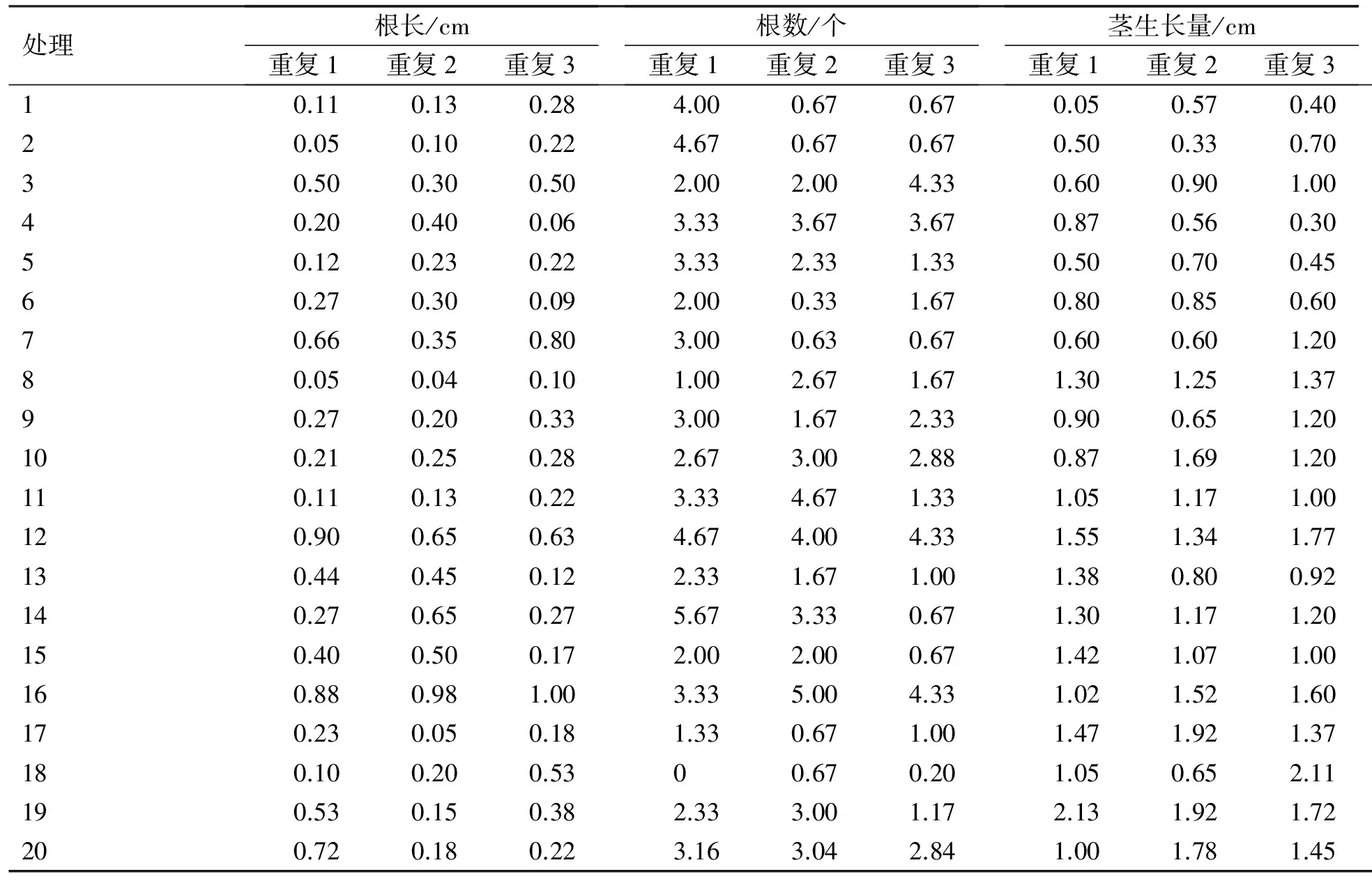
表7 牛皮杜鹃生根壮苗培养试验结果
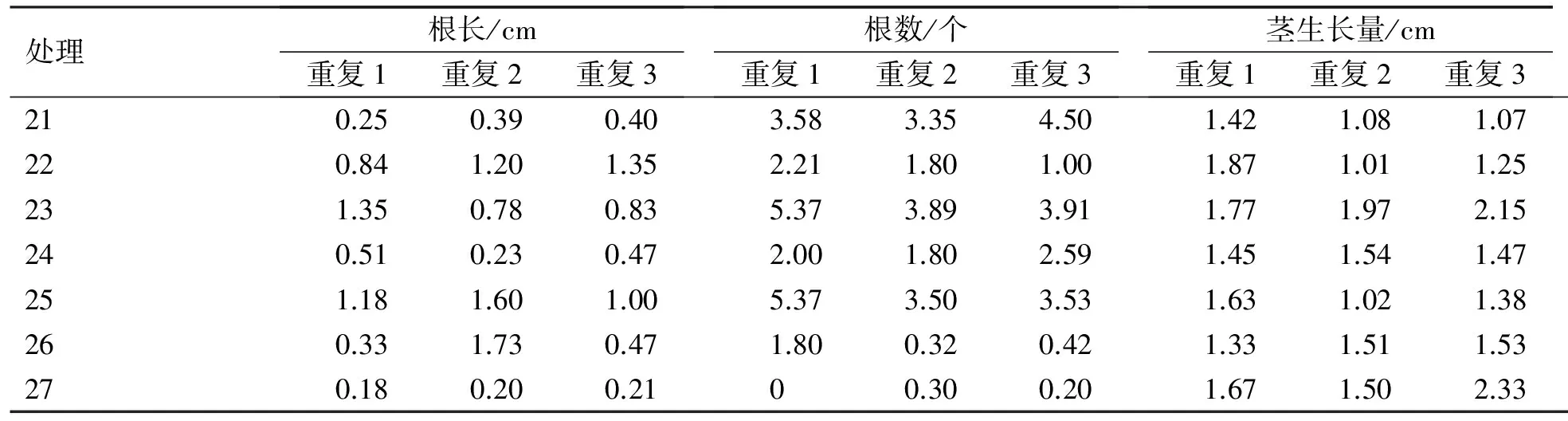
续表7 牛皮杜鹃生根壮苗培养试验结果
根据表7分别对根长、根数和茎生长量进行方差分析。
对根长的F检验表明,A(AC)、B(IBA)、C(NAA)各因素达到极显著水平,说明各因素各水平对根长有极显著影响,各因素各水平多重比较结果表明:A因素的3水平间差异显著,且水平1和水平3之间差异极显著,水平3(AC 1 g/L)根长平均值最大;B因素内水平2、3和水平1差异显著,且水平2和水平3差异不显著,水平3(IBA 0.4 mg/L)平均值最大;C因素内水平2、3和水平1之间差异显著,且水平2和水平3之间差异不显著,水平1(NAA 0.1 mg/L)平均值大。
对根数的F检验表明,只有B因素(IBA)水平间差异显著,表明B因素对生根数有较大影响。对B因素(IBA)进行多重比较,结果表明:B因素内水平2和水平3差异不显著,水平1和水平3差异极显著,而水平3(IBA 0.4 mg/L)根数平均值最大。
对茎生长量的F检验表明,因素A和因素B水平间差异显著,多重比较结果表明:A因素3水平间差异极显著,而水平3(AC 1 g/L)的平均值最大;B因素内水平2、1与水平3之间差异显著,且水平1和水平2差异不显著,而水平3(IBA 0.4 mg/L)的平均值最大。
综合上述,认为适合牛皮杜鹃生根壮苗培养的最适培养基为:WPM+0.1mg/L NAA+1 g/L AC+0.4 mg/L IBA。
2.7 牛皮杜鹃最佳炼苗移栽基质
牛皮杜鹃组培幼苗在腐蚀土(100%)和腐蚀土∶珍珠岩=1∶1的2种移栽基质上成活率仅为68%和58%,叶片发黄,植株不健壮。而在苔藓(100%)和苔藓∶腐殖土=1∶1的2种移栽基质中牛皮杜鹃组培幼苗的成活率可达90%以上,苔藓为移栽基质时的成活率达到94%,比苔藓∶腐殖土=1∶1的要高些,而且叶色绿,生长状态良好。所以认为最合适移栽炼苗的基质为苔藓土(表8)。

表8 不同基质对移栽苗成活率的影响。
3 讨论与结论
3.1 前处理与牛皮杜鹃种子发芽
牛皮杜鹃生长在寒冷高山地带,具有独特的生理特性和强大的生存能力。本试验研究发现,野外采集的牛皮杜鹃种子虽不一定都能萌发,但均表现出吸胀现象,说明水分可以浸透种皮,但其发芽率较低,出芽不整齐,类似于黄毛杜鹃的发芽[12]。在恒温15和30 ℃条件下发芽率很低,在恒温20和25 ℃条件下发芽率有所提高,且20 ℃时更为明显,说明适宜低温可以促进牛皮杜鹃种子发芽。另外,适宜浓度赤霉素处理可以有效提高牛皮杜鹃种子的发芽率和发芽势,似乎暗示牛皮杜鹃种子内部或种皮上可能存在抑制种子萌发的物质。
3.2 pH值与牛皮杜鹃组织培养
在组织培养中,pH值是影响杜鹃生长的重要因素。资料表明,杜鹃适于生长在偏酸性土壤中,pH值为5.0~5.4时生长较好,pH值超过6.0后杜鹃的芽增殖、生根率和生根数量急剧下降[13]。Economou(1986年)等将培养基的pH值设为4.0、4.5、5.0、5.5、6.0作对照试验,结果发现pH值为5.0时对茎尖的增殖与生长效果较好。
本试验研究表明:当pH值为5.2时愈伤组织的诱导和分化效果较好,这与前人在培养其他杜鹃品种使用的pH值是较一致的。
3.3 活性炭在牛皮杜鹃组培中的作用
活性炭具有大量小孔、巨大的表面积、吸附能力强的特性[14]。在生根培养基中,活性炭起到促进不定根发生、提高生根率、增加根长和生根数的作用[15],原因是活性炭一方面吸附了外植体在培养过程中产生的有害物质[16-18];另一方面为生根提供了一个黑暗的环境,促进了生根[19]。
本试验研究表明:不同浓度的AC对牛皮杜鹃的生根数影响不明显,但对根长及苗的生长有显著影响。当AC浓度提高时,生根苗的根长显著增加且幼苗生长迅速,原因是AC吸附了培养基中的有害物质,并提供了黑暗环境,对培养材料的生根壮苗起到促进作用。
[1] 祝廷成,严仲铠,周守标.中国长白山植物[M].北京:科学出版社,1999.
[2] 陈俊愉.中国花卉品种分类学[M].北京:科学出版社,2001.
[3] 刘初钿.中国珍惜野生花卉[M].北京:中国林业出版社,2001.
[4] 王荃,胡宝忠.杜鹃花组织培养技术研究[J].东北农业大学学报,2003,34(04):459-464.
[5] 王蔚琼,肖建忠,李志斌,等. 高山杜鹃花苞组织培养和优化体系的建立[J].河北科技师范学院学报,2012,26(02):17-22.
[6] 钟宇,张健,罗承德,等.西洋杜鹃组织培养技术体系研究(Ⅰ)[J].四川农业大学学报,2001,19(01):37-38.
[7] 钟宇,张健,罗承德,等.西洋杜鹃组织培养技术体系研究(Ⅱ)[J].四川农业大学学报,2001,19(01):141-143.
[8] 邓百万,陈文强.比利时杜鹃的组织培养的研究[J].氨基酸和生物资源,2002,18(03):65-67.
[9] 姜秋丰,白玉霞. 蒙药杜鹃花及杜鹃属植物的研究进展[J].内蒙古民族大学学报(自然科学版),2014,29(01):68-70.
[10] 顾地周,从小力, 姜海智,等.牛皮杜鹃组织培养与快速繁殖[J].植物生理学通讯,2008,44(02):300.
[11] 李畅,苏家乐,刘晓青,等.一种促进短果杜鹃种子萌发的前处理方法—二次浸种法[J].安徽农业科学,2014,42(34):12068-12070.
[12] 杨元武,孙海群,张志和.黄毛杜鹃种子发芽率的研究[J].青海大学学报(自然科学版),1997,15(04):17-19.
[13] Economou A S, Read P E. Influence of pH and medium composition on rooting of hardy deciduous azalea microcuttings[J].Amer Soc Hortic Sci,1986,111(02):181-184.
[14] Broome OC,Zimmerman RH.In vitro propagation of lackberry[J].Hort Sci,1978,16:151-153.
[15] 周丽艳,郭振清, 秦子禹,等. 白玉兰组织培养中的褐化控制[J]. 河北科技师范学院学报,2008,22(04):19-22.
[16] 刘根林.活性炭在事物组织培养中的作用概述[J].江苏林业科技,2001,28 (05): 46- 48.
[17] 刘振林,潘玉霞,杨盼盼,等. 人工合成除草剂2,4-D在植物组织培养中的应用进展[J].河北科技师范学院学报,2013,27(02):43-47.
[18] Redei G P.fructose effect in higher plants[J].Ann Bot,1974(38):187- 197.
[19] 刘用生.植物组织培养中活性炭的使用[J].植物生理学通讯,1994,30(03): 214-217.
A preliminary study on tissue culture ofRhododendronChrysanthumPall
DING Hongling1, GONG Yu2, LI Meishan2, XU Mingzi2, LIU Xianhu2*
(1.CropInstitute,AgriculturalSciencesAcademyofYanbian,LongjingJilin133400,China;2.AgriculturalCollegeofYanbianUniversity,YanjiJilin133002,China)
Sterile seedling ofRhodoendronchrysanthumpallwere used as explants to screen callus induction medium and strawberry propagation rooting and transplanting medium. The results showed that WPM+8 mg/L ZT+3 mg/L IBA+20g/L Sugar (pH=5.2)was best induction medium;WPM+0.4 mg/L IBA+0.1 mg/L NAA+1g/L AC was best medium of strawberry propagation rooting;Bryophyta of soil was the best transplanting medium, transplanting survival rate was 94%.
RhododendronChrysanthumPall.; tissue culture; medium; induction
2016-11-07
丁洪玲(1982—),女,吉林抚松人,硕士,助理研究员,研究方向为植物遗传育种。刘宪虎为通信作者,E-mail:liuxh@ybu.edu.cn
1004-7999(2017)01-0049-06
10.13478/j.cnki.jasyu.2017.01.008
S685.21
A
