秋水仙素浸泡法对黑果腺肋花楸多倍体的诱导及初步鉴定
2017-05-17李建勋吴荣哲
李建勋, 巴 蕾, 于 欢, 于 敏, 刘 冰, 吴荣哲
(延边大学农学院,吉林 延吉 133002)
秋水仙素浸泡法对黑果腺肋花楸多倍体的诱导及初步鉴定
李建勋, 巴 蕾, 于 欢, 于 敏, 刘 冰, 吴荣哲*
(延边大学农学院,吉林 延吉 133002)
以黑果腺肋花楸组培苗茎尖、叶片和继代愈伤组织为材料,探索秋水仙素不同浓度和不同处理时间对不同外植体诱导的愈伤组织的存活率、再生芽数、增殖系数和多倍体发生的影响;并对秋水仙素处理后不同外植体诱导产生的再生植株,经3次继代培养后生长30 d的植株的染色体倍性进行镜检。结果表明:不同外植体的存活率和出芽率随秋水仙素浓度的增高和处理时间延长而降低;其中,黑果腺肋花楸愈伤组织的存活率高于茎尖和叶片。经秋水仙素处理后,3种外植体均能诱导多倍体发生;处理浓度和时间的增加有利于提高染色体加倍率,但外植体的死亡率随之增加。当愈伤组织在秋水仙素浓度为2 000 mg/L,处理24 h时,叶片愈伤组织增殖系数为2.4,存活率为52%。以植株矮化和茎秆粗壮为依据筛选的再生植株中鉴定出47株假定多倍体,但大多为混倍体(嵌合体)。叶片诱导的愈伤组织,经1 500 mg/L秋水仙素浸泡处理24 h后,诱导再生的生根植株中获得1株整株均一加倍的四倍体植株。
黑果腺肋花楸;多倍体;秋水仙素;浸泡法
黑果腺肋花楸(AroniamelanocarpaElliot)系蔷薇科腺肋花楸属多年生落叶灌木[1];该树种在食用、药用、园林和生态等领域均有普遍应用。其果实含有1%~2%的花青素、0.25%~0.35%的黄酮类物质、1%~2%的多酚,各种功能性物质含量丰富,对人体的各个器官都有良好的保护作用,具有多种保健功效[2-3]。近年来,随着人们对黑果腺肋花楸认识的增加,需求量也逐年增加。然而,由于黑果腺肋花楸果实小且有籽,仅依靠常规栽培手段很难满足市场需求。
人工诱导多倍体的研究开始于20世纪初[4]。开始时,多数采用物理方法,诱变率低。直到1937年,Blakes和Avery发现秋水仙素能够诱导曼佗罗染色体加倍,在技术上解决了细胞染色体加倍的问题,大大推动了人工诱导多倍体的研究,使之成为植物育种的重要手段[5]。目前,多倍体诱导的难点在于多倍体鉴定,关于多倍体鉴定主要有染色体鉴定法,包括染色体制片法、流式细胞仪鉴定、染色中心直径和异染色质数目鉴定法。其中,染色体制片法是进行细胞倍性鉴定最直接、最可靠的方法,计数准确,而且不需要复杂的实验仪器,是目前应用最多的鉴定方法[6]。
由于多倍体不仅使植株器官和细胞体积增大,而且基因剂量和细胞内代谢活动也随染色体倍性的增加而提高,各种代谢产物的含量也增加。若能育出黑果腺肋花楸多倍体品种,不仅有利于改善其果实的品质,而且将有利于大幅度提高其果实花青素等活性物质的含量。本试验采用化学方法结合组织培养技术进行黑果腺肋花楸多倍体诱导,以期获得产量高、药用活性物质增加的多倍体植株,尽而探究诱导过程中黑果腺肋花楸倍性调控机制,为我国培育优良品种提供种质资源,这对扩大黑果腺肋花楸种植面积、满足市场需求具有一定的意义和价值。
1 材料与方法
1.1 材料
以取自延边大学农学院有机型无土栽培实验室的黑果腺肋花楸组培苗茎尖、叶片、愈伤组织为材料,诱导多倍体发生和植株再生。
1.2 方法
1.2.1 黑果腺肋花楸多倍体诱导
1) 以组培苗茎尖为外植体诱导 无菌条件下,选取长势相同的幼嫩植株茎尖1 cm,浸泡于不同浓度、经高压灭菌的秋水仙素溶液中;浓度梯度设置为500、1 000、1 500和2 000 mg/L,并加入二甲基亚砜1 mL/L;浸泡时间分别为12、24、36和48 h。每个处理分别编号。培养30 d后,统计平均再生芽数和存活率。
2) 以组培苗叶片为外植体诱导 选取黑果腺肋花楸组培苗顶端叶片,浸泡于添加有二甲基亚砜1 mL/L的500、1 000、1 500和2 000 mg/L的秋水仙素溶液中;浸泡时间分别为12、24、36和48 h。处理样品同1)。培养30 d后,统计愈伤组织形成率、平均再生芽数和存活率。
3) 以愈伤组织为外植体诱导 将材料切成4 mm×4 mm大小,放入不同浓度遮光处理的秋水仙素溶液中;浓度分别为500、1 000、1 500、2 000 mg/L,并添加二甲基亚砜1 mL/L;处理时间为12、24、36和48 h;在恒速震荡培养箱中,以100 r/min速度震荡;处理样品同1)。30 d后统计增殖系数以及存活率。
1.2.2 黑果腺肋花楸多倍体初步鉴定
1) 再生植株形态鉴定法 将黑果腺肋花楸茎尖处理所诱导的再生植株接种于MS + BA 0.5 mg/L+NAA 0.3 mg/L+蔗糖30 g/L+琼脂8 g/L[7]的培养基中,经过3次继代生长30 d后测量株高、茎粗、节间长度,叶长和叶宽则采用扫描仪LC 2400P扫描,经winfolia 2012a for leaf anailsis分析,初步确定变异植株的出现范围。
2) 再生植株细胞学鉴定法 在显微镜16×10(mm)的视野下记录气孔数目并鉴定叶片气孔的密度;用目镜测微尺测量保卫细胞的大小(包括长度和宽度);在16×10(mm)的视野下记录保卫细胞中叶绿体数目,并计算变异率。
变异率(%)=(保卫细胞叶绿体数12个以上的细胞个数/保卫细胞总观测个数)×100%
3) 根尖染色体计数法 将变异体接种于1/2MS+IBA 0.6 mg/L+蔗糖30 g/L+琼脂8 g/L[8]培养基,待 2 周后生长到3 cm时,早晨9:30 取根尖、编号,浸泡于冰水中。用刘迎春[9]方法进行镜检染色体数目。
1.3 数据分析
试验采用完全随机设计法,数据采用 Excel 2007和 SPSS 16.0软件的Duncan检验和方差分析进行差异显著性分析,显著水平P≤0.05。
2 结果与分析
2.1 黑果腺肋花楸多倍体的诱导
2.1.1 黑果腺肋花楸组培苗茎尖多倍体诱导
从秋水仙素浸泡浓度和时间对黑果腺肋花楸组培苗茎尖生长的影响来看,不同的处理浓度和处理时间对组培苗的存活率具有一定影响,外植体的存活率随秋水仙素浓度的增高和处理时间延长而逐渐降低(表1)。
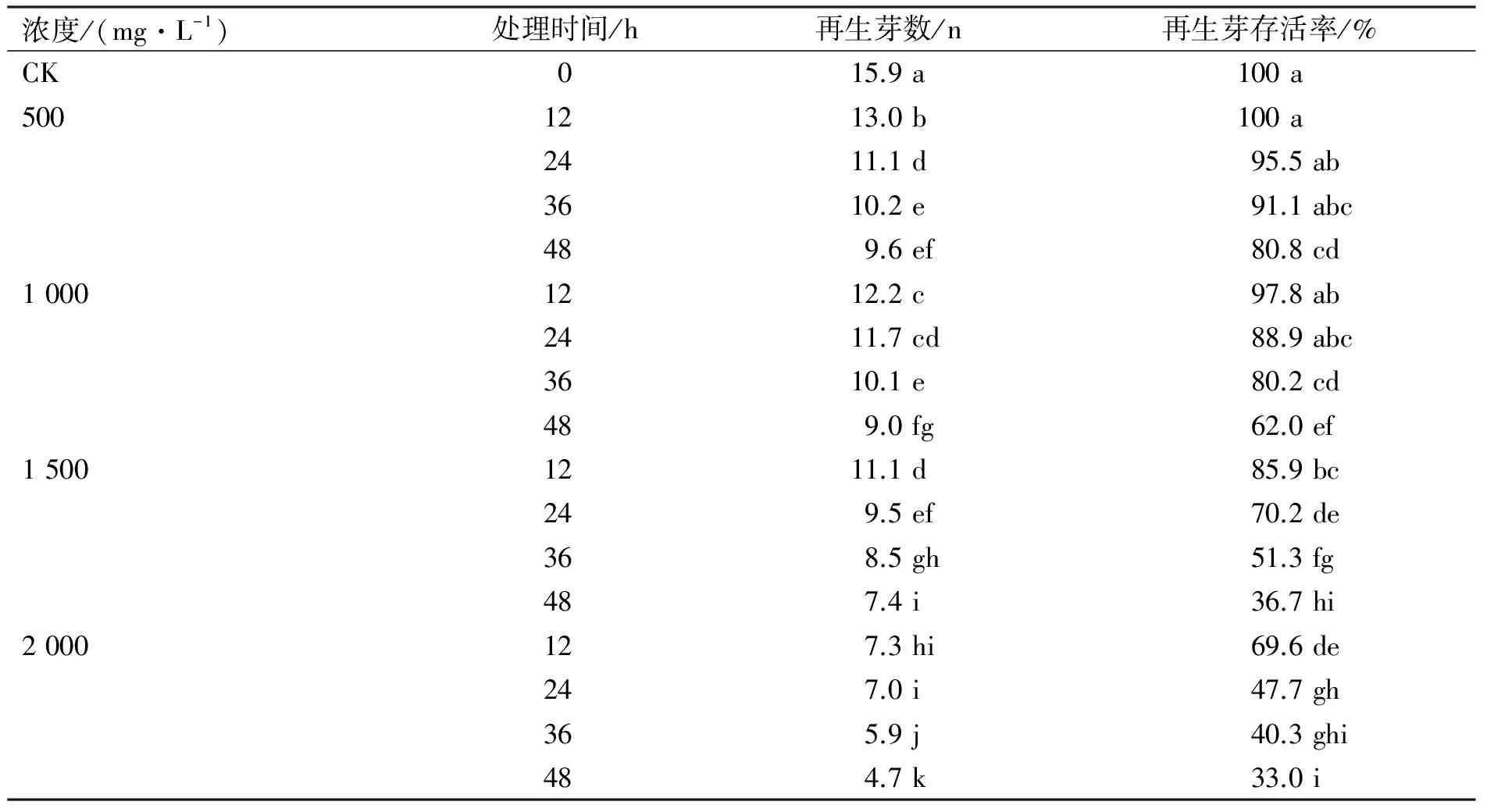
表1 秋水仙素浸泡浓度和时间对黑果腺肋花楸组培苗茎尖生长的影响
注:表中数字后面的小写字母表示在0.05水平下差异显著性,下同。
当处理浓度为500 mg/L时,组培苗存活率均大于80%;当浓度上升到 2 000 mg/L时,组培苗茎尖有部分变为褐色,且存活率明显降低。秋水仙素处理的时间超过30 h时,组培苗茎尖长势普遍降低,且当时间达到48 h时,外植体处于停止生长状态。当秋水仙素浓度为1 500 mg/L、处理时间为36 h时,平均再生芽数为8.5个,存活率为51.3%,接近于半致死剂量。
2.1.2 黑果腺肋花楸组培苗幼嫩叶片多倍体诱导
当诱导材料为植株顶端幼嫩叶片时,秋水仙素浸泡对叶片的生长有一定影响(表 2)。随着秋水仙素浓度和处理时间的增加,黑果腺肋花楸叶片存活率呈现显著下降趋势,经处理的存活叶片较大一部分会形成愈伤组织,且能分化出芽。当浓度为2 000 mg/L,浸泡48 h时,叶片愈伤组织形成率、存活率均最低。经秋水仙素浸泡处理后的叶片诱导的愈伤组织均呈褐化。当浓度1 000 mg/L,浸泡36 h时,愈伤组织形成率为53.3%,平均再生芽数为1.1,存活率为50.4%,达到了半致死剂量。

表2 秋水仙素浸泡浓度和时间对黑果腺肋花楸组培苗叶片诱导的愈伤组织及再生芽生长的影响
2.1.3 黑果腺肋花楸愈伤组织多倍体诱导
秋水仙素浸泡浓度和时间对黑果腺肋花楸愈伤组织生长的影响见表3。

表3 秋水仙素浸泡浓度和时间对黑果腺肋花楸愈伤组织生长的影响
由表3可知,用秋水仙素浸泡诱导愈伤组织,当浸泡浓度为500和1 000 mg/L时,愈伤组织的存活率均高于50%。当浸泡浓度为1 500 mg/L、处理时间为48 h和浸泡浓度为2 000 mg/L、处理时间为36、48 h时,才小于50%。当浸泡浓度为2 000 mg/L、时间24 h时,叶片愈伤组织增殖系数为2.4,存活率为52%,达到半致死剂量。
2.2 黑果腺肋花楸诱导植株初步鉴定
2.2.1 再生植株的形态学鉴定鉴定
用秋水仙素浸泡处理黑果腺肋花楸茎尖后诱导再生的植株(表4,图1),株高均低于正常植株。对于茎粗来讲,处理浓度为500、1 000和1 500 mg/L、处理时间少于24 h时,茎粗大于正常植株。由表4可以看出,处理时间越长,株高越矮、茎粗、节间长度、叶长、叶宽越小;且秋水仙素浓度越高,株高越矮,茎粗、节间长度、叶长、叶宽越小。当浓度为2 000 mg/L,处理时间为48 h时,植株处于死亡状态。

表4 秋水仙素浸泡诱导再生植株外部形态的测定

图1 不同秋水仙素浸泡浓度和时间对
2.2.2 再生植株的细胞学鉴定法
通常经染色体加倍后获得的多倍体植株,株高变矮、节间长度变小。故本试验中将株高和节间长度显著低于对照组的再生植株作为假定的多倍体,再经过3次继代培养之后,对再生植株叶片的保卫细胞及保卫细胞中的叶绿体数目进行镜检。结果表明,经秋水仙素浸泡法处理的再生植株叶片的气孔密度均显著低于对照组,变异植株叶片镜检单位视野中气孔数量小于对照植株。变异株叶片保卫细胞长度和宽度均与对照植株差异显著(表5)。为确保能够获得真实的染色体加倍体,试验将保卫细胞中叶绿体数量大于12的个体假定为多倍体(图2),并将叶绿体数多于12的细胞个数与观测的总细胞数进行比较从而获得叶绿体变异率。结果表明,所得再生植株叶片中叶绿体变异率最高的处理为浸泡浓度 1 500 mg/L、处理时间36 h时,其叶绿体变异率达到33.3%(表5)。

表5 秋水仙素浸泡诱导再生植株气孔保卫细胞和叶绿体数的测定
注:-表示未测定。
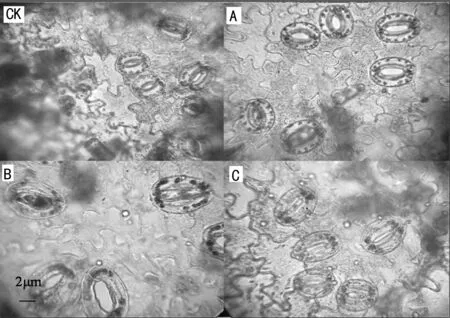
A:秋水仙素浓度1 000 mg/L,处理36 h;B:秋水仙素浓度1 500 mg/L,处理24 h;C:秋水仙素浓度1500 mg/L,处理36 h。
图2 不同秋水仙素浸泡浓度和时间诱导再生植株叶片气孔保卫细胞叶绿体(16×40)
Fig.2 Chloroplasts in leaf stomatal guard cells of regenerated plantlets induced by treatments with different concentrations and soaking time of colchicine(16×40)
2.2.3 多倍体植株染色体数目的鉴定
经秋水仙素浸泡法诱导的黑果腺肋花楸多倍体初步鉴定出47株假定多倍体;经生根培养,成功生根7株,占总数约14.9%。检测生根变异植株的染色体数目,发现所得的7株生根变异植株均为二倍体(2n=2x=34±2)与四倍体(2n=4x=68±4)的混倍体,即嵌合体,其四倍体细胞所占比例最高可达12.5%(表6,图3)。将所得嵌合体再进行秋水仙素施入处理后,嵌合体细胞数量最高达到45.8%。未成功生根的植株进行加大生根激素处理后,再检测染色体数目,发现在经1 500 mg/L秋水仙素浸泡处理24 h后诱导并获得生根的再生植株中,出现1株为四倍体。试验中,暂时未发现六倍体及以上的细胞。

表6 不同处理再生植株的染色体倍性
注:诱变率=多倍体数/变异数。

A:二倍体细胞;B:四倍体细胞。
2.2.4 多倍体植株与对照植株外观形态的比较
初步鉴定的植株经3次继代培养后,所得再生植株经培养30 d后检测植株形态(表7,图4)。结果表明,多倍体植株平均株高为3.7 cm,比对照植株矮1.4 cm;多倍体植株茎粗大于对照植株、茎段长度小于对照植株,而多倍体植株的叶长和叶宽则明显大于对照植株。

表7 多倍体植株与对照植株外观形态的比较
3 讨论与结论
多倍体植物在自然界中普遍存在,多倍化研究已经成为当前进化生物学、遗传学和基因组学领域的研究热点。自然界中存在的多倍体均由自然加倍而来,但自然加倍的频率低,而且许多自然加倍的多倍体在自然条件下不能正常生长而死亡。1937年Blakeslee 等用秋水仙碱对曼陀罗等植物的染色体数进行加倍获得了成功[10]。之后,秋水仙素被广泛应用于培育植物新品种。

注:顶端第2片叶
图4 多倍体植株与对照植株的生长比较
Fig.4 Comparison of the polyploid plant with the normal diploid plant (CK) ofAroniamelanocarpaElliot
秋水仙素通过作用于有丝分裂中期使染色体加倍[11];但不同植物品种、外植体类型和植物生长时期对秋水仙素的敏感度不同。一般认为,诱变处理浓度为半致死率时,可获得较高的诱导率;当浓度一定时,植株的死亡率随处理时间的延长而升高[12]。处理时间过短,分生组织的有丝分裂不能同步进行,易得嵌合体[13]。通常,不同植物所选择的诱导多倍体发生的外植体材料不同,如种子[14]、茎段[15]、离体组织[16]、丛生芽[17]、愈伤组织[18]等,以及秋水仙素处理浓度的不同,诱导效果均有所差异;一般来讲,分裂越旺盛诱导的成功率越高。本试验中采用黑果腺肋花楸组培苗茎尖、组培苗叶片以及愈伤组织为外植体作为多倍体诱导材料,并通过设置4个浓度(500、1 000、1 500和2 000 mg/L)和5个处理时间(0、12、24、36和48 h)诱导黑果腺肋花楸多倍体发生。结果表明,黑果腺肋花楸多倍体发生,受限于不同处理下的外植体存活率;在各种处理中,愈伤组织的存活率高于茎尖、叶片。用2 000 mg/L秋水仙素处理愈伤组织24 h时,叶片愈伤组织增殖系数为2.4,存活率为52 %,接近于半致死剂量。
前人的研究结果表明,多倍体植株的株高会下降,节间长度会变小,可以作为判断多倍体植株的依据[19];这一点在本试验中进一步得到了验证。在本试验过程中将节间长度显著低于对照组的作为假定的多倍体,对其进行3次继代培养后,再对其染色体倍性检测。结果在各处理中诱导再生的黑果腺肋花楸再生植株中,有7株为多倍体植株。然而,细胞学检测表明,试验中所获得的多倍体植株,大多为不同倍性细胞的混倍体或倍性嵌合体;不同倍性植株中,四倍体细胞所占比例最高达到12.5%。仅在1 500 mg/L秋水仙素浸泡处理24 h后诱导产生的生根的再生植株中出现了1株完整的四倍体植株。可见,虽然不同浓度的秋水仙素结合不同的处理时间,均可诱导多倍体发生,但因染色体的多倍性发生于再生植株的不同的组织器官中,多倍体细胞混合存在。说明在多倍体的诱导中,还需通过进一步继代培养并通过染色体数目镜检以便分离整株均一加倍的多倍体植株。
另外,从试验结果来看,虽然多倍体发生和获得完整的多倍体植株的概率较低,但从假定的多倍体中经3次继代后筛选出的四倍体黑果腺肋花楸植株,呈现出“巨大性”,特征非常明显;与正常二倍体植株相比较(表7,图4),多倍体植株矮小、节间变短、茎干粗壮、叶片长宽变大(叶片更大),明显区别于正常二倍体植株。总之,黑果腺肋花楸多倍体的诱导以愈伤组织为最佳材料;当秋水仙素浓度为2 000 mg/L,处理时间为24 h时,增殖系数最高,而且成功诱导并获得了四倍体黑果腺肋花楸植株,这项工作将有利于黑果腺肋花楸倍性化植株的研究,为黑果腺肋花楸多倍体的诱导和鉴定奠定了理论与实践基础。
[1] 孔繁轼.黑果腺肋花楸的开发与栽培[J].中国花卉园艺,2006(10):38-39.
[2] 尹艳廷.黑果腺肋花楸在太原地区的引种栽培初探[J].防护林科技,2008,9(05):133-134.
[3] 王鹏,姜镇荣,张平,等.黑果腺肋花楸果实的经济价值及其开发前景[J].农产品加工,2009(09):55-57.
[4] 陶抵辉,刘明月,肖君泽,等.生物体多倍体诱导方法研究进展[J].生命科学研究, 2007,11(04):6-13.
[5] 于盱,李维林,梁呈元,等.组织培养中多倍体诱导育种研究进展[C].中国植物学会植物结构与生殖生物学专业委员会、江苏省植物学会2007年学术年会学术报告及研究论文集,2007,198-201.
[6] 张红亮,姚先玲,李霞,等.浅谈植物多倍体鉴定方法[J].种子科技, 2012(10):25-27.
[7] 高晔华,郭朋伟,吴荣哲.黑果腺肋花楸组培苗增殖的初步研究[J].北方园艺,2012(17):119-121.
[8] 高晔华,郭朋伟,高日,等.黑果腺肋花楸组培苗生根培养及驯化的研究[J].北方园艺, 2013(09):105-108.
[9] 刘迎春,胡勇.3种引进禾本科牧草的染色体核型研究[J].四川草原,2002(04): 40-42.
[10] 蔡旭.植物遗传育种[M].北京: 科学出版社,1988.
[11] 周慧文,冯斗,严华兵.秋水仙素离体诱导多倍体研究进展[J].核农学报,2015,29(07):1307-0315.
[12] 王长泉,张文胜,李雅志,等.苹果叶片离体培养中秋水仙素加倍效应的研究[J].果树科学,1999,16(02):104-109.
[13] 卢炳芝,查堡莶,于向荣,等.诱变葡萄体细胞胚获得同质四倍体植株的研究[J].果树科学,1997,14(03):145-148.
[14] 李步勋,陶抵辉,阮万辉.西瓜离体组织细胞染色体加倍技术的研究和应用[J].陕西农业科学,1999(03):21-23.
[15] 杨晓明.组织培养中秋水仙素诱导葡萄多倍体研究[D].兰州:甘肃农业大学, 2003.
[16] 陈绪中,罗正荣.鄂柿1号离体叶片秋水仙素诱导和再生植株倍性鉴定[J].果树学报,2005,22(05):554-556.
[17] 张兴翠,周昌些,殷家明.药用百合的多倍体诱导及快速繁殖[J].西南农业大学学报,2003,25(01):14-17.
[18] 王强,兰利琼,傅华龙.秋水仙素诱导川贝母(FritillariacirrhosaD. Don)愈伤组织多倍体的研究[J].武汉植物学研究,2002,20(06):449-452.
[19] 罗耀武,乔子靖,朱子英,等.人工诱变获得四倍体玫瑰香葡萄的研究[J].园艺学报,1997,24(02):125-128.
Polypoid induction ofAroniamelanocarpaElliot by soaking with colchicine and its preliminary identification
LI Jianxun, BA Lei, YU Huan, YU Min, LIU Bing, WU Rongzhe*
(AgriculturalCollegeofYanbianUniversity,YanjiJilin133002,China)
In this experiment, shoot tips, leaves and callus ofAroniamelanocarpaElliot tissue culture as materials, influences of different colchicine concentration and treatment times on callus survival rate, regenerated bud number, regeneration ratio and polypoid occurrence were determined. After 30 days of growth, chromosome ploidy of the plants subcultured 3 times was examined by microscope, which regenerated from different explants treated by colchicine. The results showed that the survival rate and budding rate of different explants decreased with the increase of colchicine concentration and treating time. Among these, the survival rate of Aronia melanocarpa Ellio callus was higher than shoot tip and leaves. After treatment with colchicine, all three explants were able to induce the occurrence of polyploidy. The increase of concentration and treating time was better for increasing of chromosome doubling, but the death rate of explants was increased. When the callus induced from leaves was treated for 24 h by 2 000 mg/L of colchicine, its regeneration index was 2.4, survival rate was 52%. Based on plant dwarfing height and stem stoutness, 47 putative polyploid plants were screened out, but most of the plants were mixoploids (chimeric ploidy). From rooting plants regenerated from the leaf callus soaking in 1 500 mg/L colchicine for 24 h, only one plant was identified as whole plant tetraploid.
AroniamelanocarpaElliot; polyploid; colchicine; soaking method
2016-09-27 基金项目:吉林省科技厅自然基金重点项目(20140101218JC)
李建勋(1992—),男,吉林吉林人,在读硕士,研究方向为园艺植物生物技术及生理。吴荣哲为通信作者,E-mail:wurzh@ybu.edu.cn
1004-7999(2017)01-0001-08
10.13478/j.cnki.jasyu.2017.01.001
S663.9
A
