丹红注射液7种药效物质基础的人血浆蛋白结合率
2017-05-17戴国梁居文政郭建明孙冰婷何书芬段金廒
张 倩,戴国梁,居文政,郭建明,孙冰婷,宗 阳,何书芬,段金廒
(1.南京中医药大学附属医院,江苏 南京 210029;2. 南京中医药大学江苏省中药资源产业化过程协同创新中心,江苏省方剂高技术研究重点实验室,中药资源产业化与方剂创新药物国家地方联合工程研究中心, 江苏 南京 210046)
丹红注射液7种药效物质基础的人血浆蛋白结合率
张 倩1,2,戴国梁1,居文政1,郭建明2,孙冰婷1,宗 阳1,何书芬1,段金廒2
(1.南京中医药大学附属医院,江苏 南京 210029;2. 南京中医药大学江苏省中药资源产业化过程协同创新中心,江苏省方剂高技术研究重点实验室,中药资源产业化与方剂创新药物国家地方联合工程研究中心, 江苏 南京 210046)
目的 建立同时测定丹红注射液中7种主要药效物质基础丹参素、原儿茶醛等体外人血浆蛋白结合率的方法,并将结果与同等浓度条件下每个单体化合物的人血浆蛋白结合率进行比较,以考察两者是否存在显著性差异,由此推测多组分之间是否存在血浆蛋白竞争性结合。为丹红注射液主要药效物质基础的体内药动学,及其在临床联合用药时的体内药动学相互作用研究提供参考依据。方法 采用平衡透析法测定血浆蛋白结合率,HPLC测定丹红注射液中7种成分,及每种成分单独透析平衡时的血药浓度及游离药物浓度。结果 在3种浓度的丹红注射液中,丹参素、原儿茶醛、p-香豆酸、丹酚酸D、迷迭香酸、紫草酸和丹酚酸B的人血浆蛋白结合率分别为(11.88±0.58)%、(78.35±1.72)%、(63.48±2.17)%、(87.72±0.78)%、(82.77±2.83)%、(71.59 ± 0.81)%和(70.55±1.34)%;而同等浓度条件下,这7种单体化合物的人血浆蛋白结合率分别为(23.34±1.06)%、(79.32±1.41)%、(78.97±0.08)%、(92.37±0.66)%、(84.95±0.38)%、(79.15±5.47)%和(75.49±0.75)%。与单体化合物的血浆蛋白结合率相比,丹参素、p-香豆酸和紫草酸在丹红注射液样品中的人血浆蛋白结合率差异有显著性;在本实验的药物浓度范围内,只有紫草酸的人血浆蛋白结合率与浓度呈线性;原儿茶醛、丹酚酸D、迷迭香酸和丹酚酸B的人血浆蛋白结合率差异没有显著性。结论 该测定方法简便易行,准确度、稳定性均较好。实验条件下,原儿茶醛、p-香豆酸、丹酚酸D、迷迭香酸、紫草酸和丹酚酸B的人血浆蛋白结合率均>60%,且在样品体系中这7种成分的血浆蛋白结合率均比单独给药的血浆蛋白结合率低,组分之间可能存在竞争性结合,但竞争影响可能较弱。考察血浆蛋白竞争性结合对该药的药物相互作用影响时,其组分间的相互竞争影响较小。
丹红注射液;酚酸类化合物;人血浆蛋白结合率;多组分竞争性结合;药物相互作用;平衡透析法
丹红注射液(Danhong injection, DHI)由活血药对丹参、红花组成,临床被广泛应用于治疗心肌梗死、心绞痛、脑梗死等心脑血管疾病,疗效确切[1-3]。大数据统计显示,该品种为临床应用最多的活血化瘀类中药注射剂之一[4],已有较深入的药效物质基础及其体内过程研究,其中含量较高者为来自丹参中的儿茶酚类化合物丹参素、原儿茶醛、阿魏酸、p-香豆酸、丹酚酸D、迷迭香酸、紫草酸、丹酚酸B和丹酚酸A[5-6]。但目前尚未见报道DHI中这些药效物质基础的血浆蛋白结合率。血浆蛋白结合率作为药代动力学的重要参数,影响药物的体内暴露量,血浆蛋白结合率较高的药物临床更易发生相互作用[7]。目前,已有部分研究报道丹参和红花中主要物质基础的血浆蛋白结合率,如丹酚酸B与羟基红花黄色素A等[8-9],血浆蛋白结合率均较高。在中药复杂体系中,这些药效物质基础之间可能会竞争结合血浆蛋白,从而改变体内游离药物浓度,进一步影响药效发挥。因此,研究这类药效物质基础在DHI中的血浆蛋白结合率,将为深入研究DHI药物体内相互作用提供参考依据。
本课题组在前期研究基础上,拟运用平衡透析法测定DHI中7种主要药效物质基础的人血浆蛋白结合率[10],并与同等浓度条件下单用这7种化合物的人血浆蛋白结合率进行比较,考察两组之间人血浆蛋白结合率的差异,以推测多组分之间是否存在血浆蛋白竞争性结合。
1 材料
Agilent 1100高效液相色谱仪(Agilent, USA);Agilent G1314A可变波长紫外检测器;Satorius电子天平(Satorius,Germany);CentriVap离心浓缩系统(Labconco, USA);Micro-17R型冷冻离心机(Thermo, USA);透析袋(14000 D,压平宽度25 mm,Union Carbide, USA);Direct-Q5超纯水机(Millipore, USA)。
丹红注射液(山东丹红制药有限公司,批号15081038);丹参素、原儿茶醛、p-香豆酸、丹酚酸D、迷迭香酸、紫草酸、丹酚酸B标准品(南京元宝山色谱有限公司,批号20151128,含量均≥98%);乙腈、甲醇和甲酸均为色谱纯;超纯水由纯水制备系统Direct-Q5制备;磷酸二氢钾、磷酸氢二钾、氯化钠均为分析纯;病毒灭活冰冻人血浆(由南京中医药大学附属医院血库提供,批号:D6641000)。
2 方法
2.1 色谱条件 Agilent Zorbax SB-C18色谱柱(250 mm×4.6 mm, 5 μm);柱温35℃;流速1.0 mL·min-1;检测波长0~20 min 280 nm,20~40 min 326 nm,45~60 min 280 nm。进样量10 μL。流动相乙腈(A)-0.5%甲酸水溶液(B),梯度洗脱:0~10 min(A:5%~5%),10~15 min(A:5%~16%),15~20 min(A:16%~20%),20~25 min(A:20%~20%),25~27 min(A:20%~22%),27~35 min(A:22%~22%),35~40 min(A:22%~90%),40~45 min(A:90%~5%); 45~60 min(A:5%~5%)。
2.2 溶液配制 空白透析液:按文献方法[8]配制0.01 mol·L-1磷酸缓冲液(PBS),调节pH至7.4。
标准品溶液:分别精密称定丹参素、原儿茶醛、p-香豆酸、丹酚酸D、迷迭香酸、紫草酸、丹酚酸 B 对照品4.91、5.30、1.07、1.57、2.05、1.55、2.37 mg,置于1 mL棕色量瓶中,20%乙腈-0.5%甲酸水溶液溶解,稀释至刻度后摇匀,制成相应浓度的各标准品储备液,4℃避光保存。分别移取相应的标准品储备液适量,配制7个系列浓度的混合标准品溶液。
透析外液标准品溶液:分别取混合标准品溶液20 μL,40℃氮气吹干,加入空白pH 7.4 PBS 100 μL溶解、混匀,得透析外液标准品溶液。
透析内液标准品溶液:分取混合标准品溶液20 μL,加入空白人血浆100 μL,按“2.3”项下方法处理样品,得透析内液标准品溶液。
透析外液样品溶液:分别向20 mL PBS溶液加入100、200、500 μL DHI,混匀,得3个浓度的透析外液样品溶液。
透析外液单体化合物样品溶液:根据本课题组前期含量测定结果,计算得出DHI中7种药效物质基础的含量,分别向20 mL PBS溶液中加入对应浓度等量的单体化合物标准品储备液,混匀,得对应3个浓度的透析外液单体化合物样品溶液。
2.3 样品处理
2.3.1 透析内液样品处理[10-11]精密移取透析内液样品100 μL,加入20%三氯乙酸20 μL,涡旋30 s,混匀,加入乙酸乙酯200 μL,涡旋3 min,12 000 r·min-1离心10 min,吸取上清液150 μL,乙酸乙酯重复萃取2次,合并上清液。沉淀加入甲醇200 μL,涡旋30 s,混匀,12 000 r·min-1离心10 min,吸取上清液150 μL。合并上清液,40℃ N2吹干后,用100 μL 20%乙腈-0.5%甲酸水溶液复溶,涡旋30 s,混匀,12 000 r·min-1离心10 min,取上清液10 μL进样分析。
2.3.2 透析外液样品 取透析外液100 μL,12 000 r·min-1离心10 min,取上清液10 μL直接进样分析。2.3.3 血浆蛋白结合率的测定[12]管状透析袋预处理后,一端用棉线结扎,精密移取1 mL人血浆于袋内,袋内保留少量空气,另一端棉线系牢,使其悬浮在盛有20 mL含DHI PBS溶液的广口瓶中,调节透析袋内液面高度,使之与外液保持同一水平,避免透析袋贴壁,用封口膜封住瓶口,同样操作9份,置于4℃冰箱冷藏平衡。待透析液内、外液平衡时,用10%高氯酸检查透析外液是否有蛋白漏出,漏出者作废。分别从未漏出蛋白的样品中精密吸取透析内液样本和透析外液样本100 μL,按“2.3.1”与“2.3.2”项下操作,测定各组分浓度,按公式[13]计算蛋白结合率,其中C0为透析袋内药物质量浓度,C1为透析外液药物质量浓度。
3 结果
3.1 方法学考察
3.1.1专属性 在“2.1色谱条件”下,丹参素、原儿茶醛、p-香豆酸、丹酚酸D、迷迭香酸、紫草酸和丹酚酸 B的保留时间分别约为9.20、16.90、22.46、25.82、28.25、29.89和32.10 min,内源性物质及其他成分对测定无干扰,见Fig 1。
3.1.2 线性关系
3.1.2.1 透析内液标准曲线 分别精密吸取7个系列浓度的标准品混合溶液20 μL,加入空白血浆100 μL,涡旋混匀后按“2.3.1 ”项下方法处理样品,取10 μL进样分析。以各成分峰面积对质量浓度进行线性回归,得标准曲线方程,见Tab 1。
3.1.2.2 透析外液标准曲线 精密吸取7个不同浓度的混合标准品溶液20 μL,40℃ N2吹干溶剂,加入空白透析液100 μL复溶,按“2.3.2”项下方法处理样品,取10 μL进样分析。以各成分峰面积对质量浓度进行线性回归,得标准曲线方程,见Tab 1。
3.1.3 准确度与精密度 按“3.1.2”项下配制低、中、高3个质量浓度的质量控制样品:透析内液中丹参素血浆质量浓度分别为5.25、14.03、56.11 mg·L-1;原儿茶醛血浆质量浓度分别为1.89、15.14、60.57 mg·L-1;p-香豆酸血浆质量浓度分别为0.39、6.11、24.46 mg·L-1;丹酚酸D血浆质量浓度分别为0.63、8.97、35.89 mg·L-1;迷迭香酸血浆质量浓度分别为2.19、11.71、46.86 mg·L-1;紫草酸血浆质量浓度分别为1.65、4.43、17.71 mg·L-1;丹酚酸 B的血浆质量浓度分别为2.55、6.77、27.09 mg·L-1;透析外液中7种成分的血浆质量浓度分别为5.25、14.03、56.11 mg·L-1;1.89、6.06、24.23 mg·L-1;0.39、3.06、12.23 mg·L-1;0.09、1.50、5.98 mg·L-1;0.81、5.86、23.43 mg·L-1;0.33、1.77、7.09 mg·L-1;2.55、6.77、27.09 mg·L-1。考察准确度和精密度,结果见Tab 2。7种成分日内精密度RSD<12.74%,日间精密度RSD<13.54%,符合生物样品分析要求。
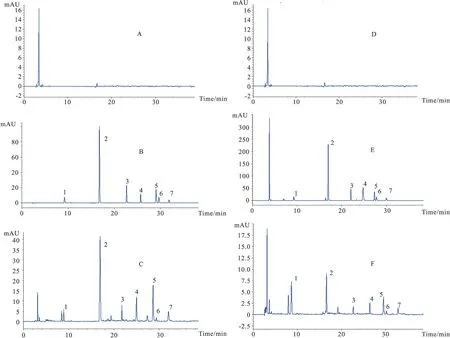
Fig 1 The HPLC chromatography picture of Danhong injection in and out of dialysate
A: Blank dialysate;B: Blank dialysate+mixed standard products;C: The sample out of dialysate;D: Blank human plasma;E: Blank human plasma+mixed standard products;F: The sample in dialysate. 1:Tanshinol;2:Protocatechuic aldehyde;3:p-Coumaric acid;4:Salvianolic acid D;5:Rosmarinic acid;6:Lithospermic acid;7:Salvianolic acid B
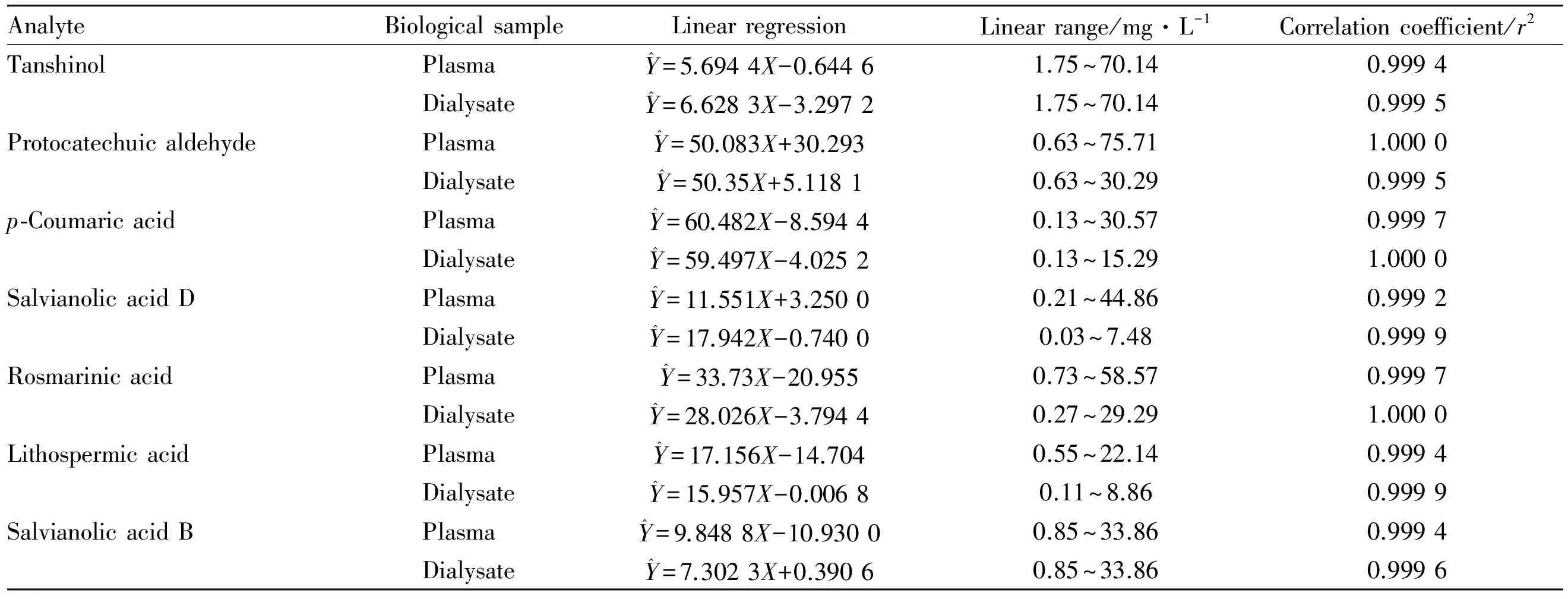
Tab 1 Standard curves of seven components in Danhong injection
3.1.4 样品提取回收率 精密吸取空白血浆100 μL,按“3.1.3”项下配制成低、中、高3种不同质量浓度的质控样品,按“2.3.1”项下操作后,进样分析;另取相应的低、中、高3个不同质量浓度对照品混合溶液各20 μL,40℃ N2吹干,100 μL 20%乙腈复溶,12 000 r·min-1离心10 min,取上清液10 μL进样分析。计算提取回收率,结果见Tab 2。
3.1.5 稳定性 按“3.1.3”项下配制的低、中、高3种浓度的质控样品,分别考察室温0、12、24 h,4℃冷藏保存24、48、72 h和-20℃冷冻保存7 d的稳定性。以当日标准曲线计算,各浓度样品RSD均<12%,表明该样品在室温24 h、4℃冷藏72 h和-20℃冷冻保存7 d均稳定。
3.1.6 平衡时间与平衡温度的考察 以空白透析液代替血浆,按血浆蛋白结合率的测定方法,分别于4℃和37℃放置8、12、24、48、72 h,考察3个浓度DHI的透析实验平衡温度和平衡时间。结果置于37 ℃的DHI 12 h后成分含量即发生变化,而放于4℃的样品各成分均在24 h袋内外质量浓度达到平衡,故设定平衡温度和时间为4℃和24 h。
3.1.7 透析袋吸附性考察 以空白PBS溶液代替血浆,根据公式[13]计算5、10、25 mL·L-13个浓度DHI样品的透析袋吸附率。结果表明透析袋对药物的吸附率小于4%,吸附微弱,且与浓度无相关性,对血浆蛋白结合率测定无明显影响。
3.2 血浆蛋白结合率测定 根据公式[13]计算DHI中7种药效物质基础的人血浆蛋白结合率,结果见Tab 3。在低、中、高3种浓度条件下,丹参素等7种药效物质基础在DHI中及单独给药时的人血浆蛋白结合率见Fig 2。
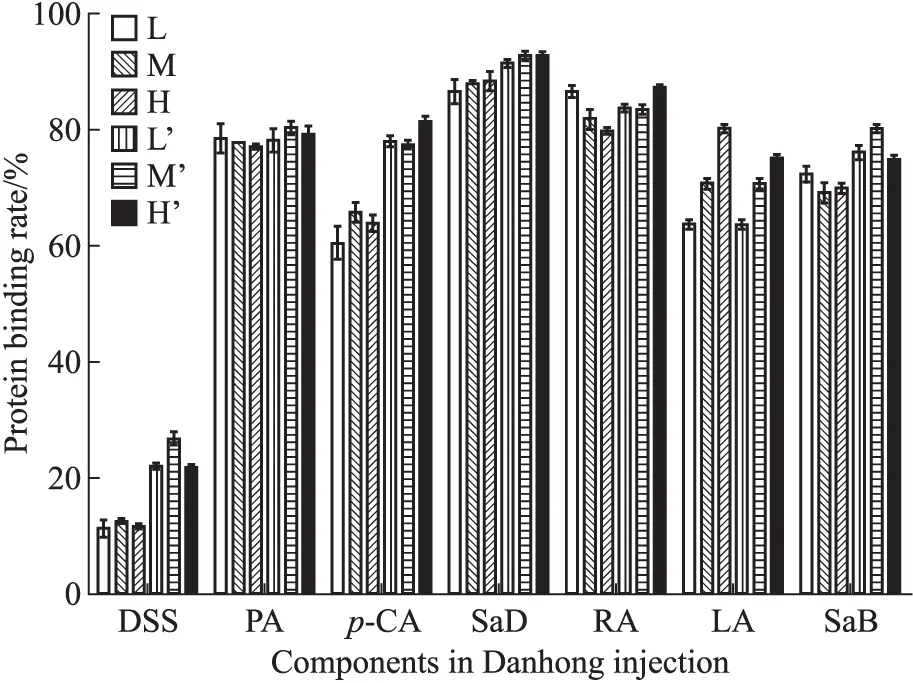
Fig 2 The binding rates of human plasma of seven components in Danhong injection and alone
L,M,H:The samples of DHI in low, middle and high concentrations;L′,M′,H′:The samples of compounds alone in low, middle and high concentrations;DSS:Tanshinol;PA:Protocatechuic aldehyde;p-CA:p-Coumaric acid;SaD:Salvianolic acid D;RA:Rosmarinic acid;LA:Lithospermic acid;SaB:Salvianolic acid B.
4 讨论
尽管临床鲜有报道由血浆蛋白结合率发生变化而导致药物相互作用,相较而言,代谢酶和转运体导致的药物相互作用研究更占主流,但是对于血浆蛋白结合率较高的药物,尤其是治疗窗较窄的药物,用于治疗肝肾功能损伤的患者,该参数的变化可能改变药物体内代谢过程,应予以重视[7]。据我院2013~2014年临床数据统计,96.65%的DHI应用患者年龄超过40岁[14],该类患者机体功能相对减弱,并发疾病较多,联合用药现象十分普遍,发生药物相互作用的几率相对较高。DHI前期药效物质基础研究已经明确,通过静脉给药,样品成分直接入血。本实验研究DHI中含量较高的7种药效物质基础的人血浆蛋白结合率,并对比相应浓度单体化合物的人血浆蛋白结合率,结果显示在样品体系中各成分的血浆蛋白结合率更低,该结论与文献[15]运用荧光淬灭法研究丹酚酸B在DHI中与单用时与牛血清白蛋白结合的差异结果相似。但只有丹参素和p-香豆酸的血浆蛋白结合率在两种给药环境中差异存在显著性,这提示样品体系内可能存在竞争性结合,但竞争并不明显。
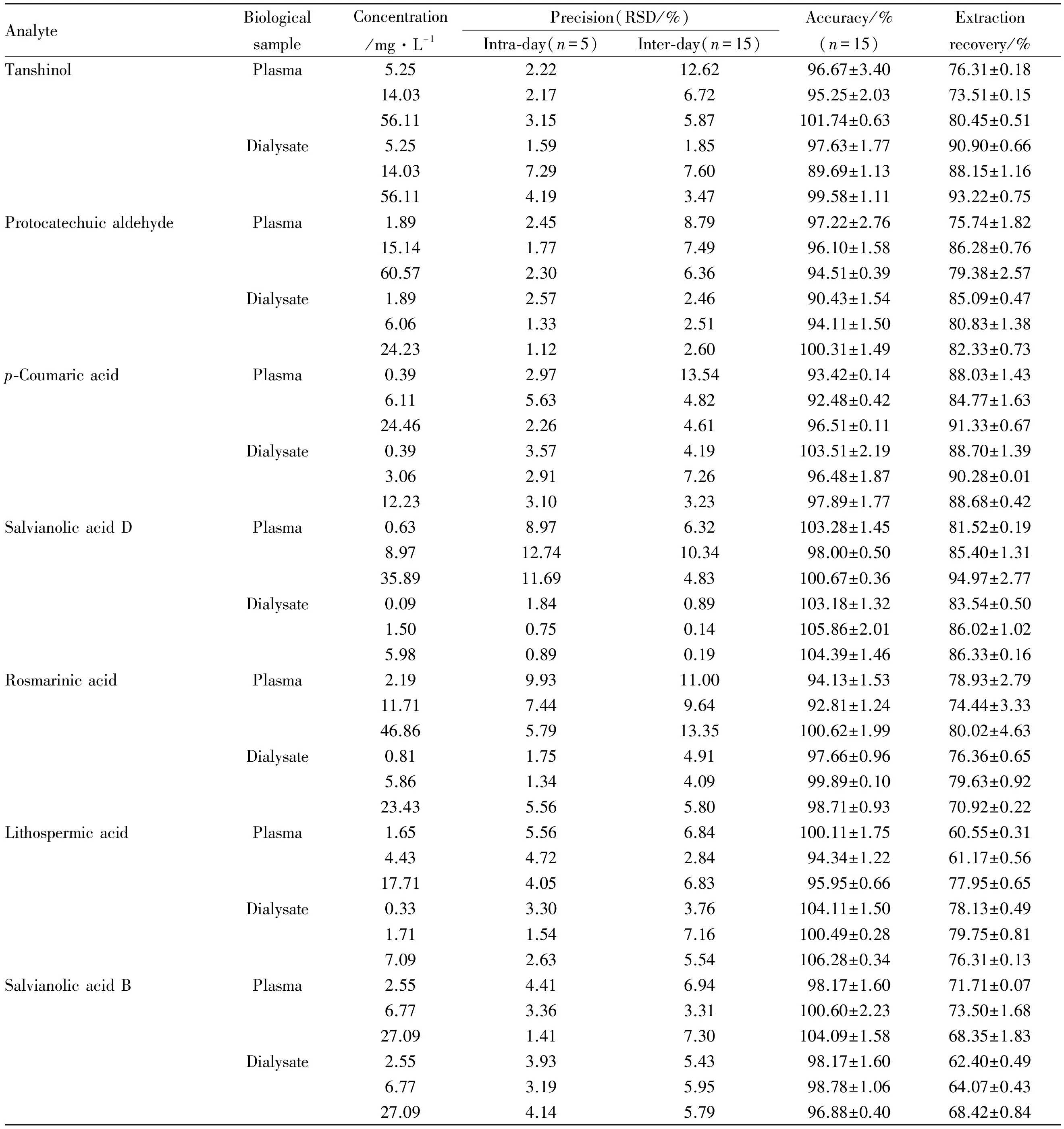
Tab 2 Methodology of seven compounds in Danhong injection

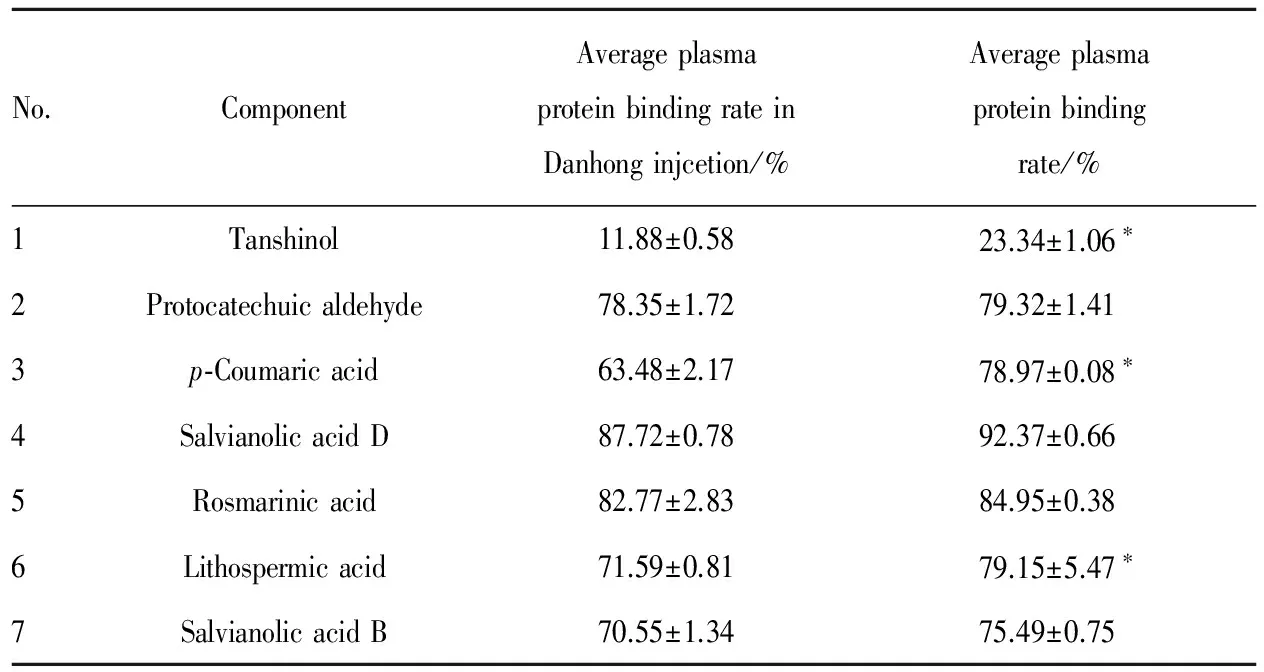
No.ComponentAverageplasmaproteinbindingrateinDanhonginjcetion/%Averageplasmaproteinbindingrate/%1Tanshinol11.88±0.5823.34±1.06∗2Protocatechuicaldehyde78.35±1.7279.32±1.413p⁃Coumaricacid63.48±2.1778.97±0.08∗4SalvianolicacidD87.72±0.7892.37±0.665Rosmarinicacid82.77±2.8384.95±0.386Lithospermicacid71.59±0.8179.15±5.47∗7SalvianolicacidB70.55±1.3475.49±0.75
*P<0.05vsDHI group
平衡透析法作为体外测定血浆蛋白结合率的经典方法,简便易行,结果可靠,重现性高,适用于测定结构较稳定的化合物[16];HPLC测定含量较高的物质基础稳定性与重现性均较为理想,故本实验采用此两种方法进行测定。因丹酚酸A结构不稳定,在平衡体系中24 h即发生变化,经考察后本实验放弃同时测定丹酚酸A在样品体系中的血浆蛋白结合率。实验结果显示,除丹参素外,原儿茶醛、p-香豆酸、丹酚酸D、迷迭香酸、紫草酸和丹酚酸B的人血浆蛋白结合率均>60%,属于中强型结合,与文献报道相近。故在联合用药时可能会发生血浆蛋白竞争性结合,在联合使用治疗窗较窄的药物如美托洛尔,或用于肝肾功能有损伤患者时,临床应予以及时关注。
[1] Liao P, Wang L, Guo L, et al. Danhong injection(a traditional Chinese patent medicine) for acute myocardial infarction: a systematic review and meta-analysis[J].EvidBasedComplementAlternatMed,2015,2015:646530.
[2] Zhang X, Wang H, Chang Y, et al. An overview of meta-analyses of Danhong injection for unstable angina[J].EvidBasedComplementAlternatMed,2015,2015:358028.
[3] Li B, Wang Y, Lu J, et al. Evaluating the effects of Danhong injection in treatment of acute ischemic stroke: study protocol for a multicenter randomized controlled trial[J].Trials,2015,16:561.
[4] 李贵华, 姜红岩, 谢雁鸣,等. 基于大数据84 697例冠心病中医证候及其中西药使用分析[J]. 中国中药杂志, 2014, 39(18): 3462-8.
[4] Li G H, Jiang H Y, Xie Y M, et al. Analysis of traditional Chinese medicine syndrome, traditional Chinese medicine and western medicine in 84 697 patients with coronary heart disease based on big data[J].ChinaJChinMaterMed, 2014, 39(18): 3462-8.
[5] Xie Y Y, Xiao X, Luo J M, et al. Integrating qualitative and quantitative characterization of traditional Chinese medicine injection by high-performance liquid chromatography with diode arraydetection and tandem mass spectrometry[J].JSepSci,2014,37:1438-47.
[6] Li M J, Wang F Q, Huang Y H, et al. Systemic exposure to and disposition of catechols derived fromSalviamiltiorrhizaRoots (Danshen) after intravenous dosing Danhong injection in human subjects, rats, and dogs[J].DrugMetabDispos, 2015, 43(5): 679-90.
[7] Hochman J, Tang C, Prueksaritanont T.Drug-drug interactions related to altered absorption and plasma protein binding: theoretical and regulatory considerations, and an industry perspective[J].JPharmSci, 2015, 104(3): 916-29.
[8] 景春杰, 陈晓辉, 刘 璇, 等. 丹酚酸B与大鼠血浆蛋白结合率的测定[J]. 药学学报, 2010, 45(3): 343-6.
[8] Jing C J, Chen X H, Liu X, et al. Determination of the binding rate of rat plasma protein with salvianolic acid B[J].ActaPharmSin, 2010, 45(3): 343-6.
[9] 王建明, 邹 恬, 张媛媛, 等. 红花黄色素粉针剂中羟基红花黄色素A血浆蛋白结合率的研究[J]. 中成药, 2011, 33(6): 947-9.
[9] Wang J M, Zou T, Zhang Y Y, et al. Study on plasma protein binding rate of hydroxysafflor yellow A in Safflor Yellow Powder Injection[J].ChinTraditPatMed, 2011, 33(6): 947-9.
[10]周 玲, 居文政, 刘子修, 等.灯盏细辛注射液多成分血浆蛋白结合率测定[J]. 中国药理学通报, 2011, 27(5): 719-22.
[10]Zhou L, Ju W Z, Liu Z X, et al. Determination of plasma protein binding rate of multicomponent in Dengzhanxixin injection[J].ChinPharmacolBull, 2011, 27(5): 719-22.
[11]冯健男, 杜守颖, 白 洁, 等. 生物样品前处理的研究进展[J]. 中国中药杂志, 2014, 39(21): 4143-8.
[11]Feng J N, Du S Y, Bai J, et al. Research progress of pretreatment of biological samples[J].ChinaJChinMaterMed,2014, 39(21): 4143-8.
[12]Talbi A, Zhao D, Liu Q, et al. Pharmacokinetics, tissue distribution, excretion and plasma protein binding studies of wogonin in rats[J].Molecules,2014,19(5):5538-49.
[13]刘 颖, 陈志强, 陶蓓蕾, 等. 蟾毒灵血浆蛋白结合率的测定[J]. 中国中药杂志, 2009, 34(21): 2817-20.
[13]Liu Y, Chen Z Q, Tao B L, et al. Determination of plasma protein binding rate of bufalin[J].ChinaJChinMaterMed, 2009, 34(21): 2817-20.
[14]张 倩, 居文政, 郭建明, 等.2013~2014年南京中医药大学附属医院丹红注射液临床用药合理性分析[J].中国中药杂志, 2016, 41(5): 28-34.
[14]Zhang Q, Ju W Z, Guo J M, et al. Rationality analysis of clinical application of Danhong injection in Affiliated Hospital of Nanjing University of Chinese Medicine from 2013 to 2014[J].ChinaJChinMaterMed,2016, 41(5): 28-34.
[15]Hao J, Zhang Y Y, Wang X R, et al.Interaction between the natural components in Danhong injection(DHI) with serum albumin (SA) and the influence of the coexisting multi-components on the SaB-BSA binding system: fluorescence and molecular docking studies[J].PLoSOne, 2015, 10(6): e0128919.
[16]Bohnert T, Gan L S. Plasma protein binding: from discovery to development[J].JPharmSci, 2013, 102(9): 2953-94.
Determination of binding rates of human plasma protein with seven bioactive components in Danhong injection
ZHANG Qian1,2,DAI Guo-liang1, JU Wen-zheng1, GUO Jian-ming2, SUN Bing-ting1, ZONG Yang1, HE Shu-fen1, DUAN Jin-ao2
(1.AffiliatedHospitalofNanjingUniversityofChineseMedicine,Nanjing210029,China; 2.JiangsuCollaborativeInnovationCenterofChineseMedicinalResourcesIndustrialization,JiangsuKeyLaboratoryforHighTechnologyResearchofTCMFormulae,NanjingUniversityofTraditionalChineseMedicine,NationalandLocalCollaborativeEngineeringCenterofChineseMedicinalResourcesIndustrializationandFormulaeInnovativeMedicine,Nanjing210046,China)
Aim To establish the method of simultaneous determination of the human plasma protein binding ratesinvitroof seven major pharmacodynamic substances in Danhong injection with HPLC. And to confirm whether the competitive effects of the multi-components exist or not through the comparasion of the plasma protein binding rates in the same concentration in or out of the Danhong injection, so as to provide the reference for the pharmacokinetics of the main bioactive substances of Danhong injection and its pharmacokinetics combined with other drugsinvivo.Methods Equilibrium dialysis method was carried out to calculate the protein binding rates in human plasma of tanshinol, protocatechuic aldehyde,p-coumaric acid, salvianolic acid D, rosmarinic acid, lithospermic acid and salvianolic acid B in Danhong injection or alone. A simple HPLC method for the determination of the concentrations of seven compounds both in inner and outer dialysis was established.Results Linear relationship, precision and accuracy, extraction recovery and stability of the seven compounds all complied with the methodology requirements.Within the low, middle and high concentration(5, 10, 25 mL·L-1) of Danhong injection, the human plasma protein binding rates of tanshinol, protocatechuic aldehyde,p-coumaric acid,salvianolic acid D, rosmarinic acid, lithospermic acid and salvianolic acid B were(11.88±0.58)%, (78.35±1.72)%, (63.48±2.17)%, (87.72±0.78)%, (82.77±2.83)%, (71.59±0.81)% and (70.55±1.34)%, respectively. While in the same concentration, the protein binding rates of the seven components were(23.34±1.06)%, (79.32±1.41)%, (78.97±0.08)%,(92.37±0.66)%, (84.95±0.38)%, (79.15±5.47)% and (75.49±0.75)%,respectively in the groups of dosed alone.There exist significant differences between the two groups of tanshinol,p-coumaric acid and lithospermic acid through thet-test, in which only the lithospermic acid depended on the concentration in this investigation.While the rest had no significant differences.Conclusions The method is simple, reliable and stable. The plasma protein binding rates of protocatechuic aldehyde,p-coumaric acid, salvianolic acid D, rosmarinic acid, lithospermic acid and salvianolic acid B are above 60% on the experimental condition. And those in the Danhong injection are lower than dosed alone. There may exist weak competitive effects of binding to human plasma protein within the multi-components in the Danhong injection. The competitive effects in multi-components can be neglected when the drug-drug interactions are influenced by the binding of plasma protein.
Danhong injection;phenolic acids; binding rate of human plasma protein; competitive binding effects of multi-components; drug-drug interactions; equilibrium dialysis method
2016-12-08,
2017-01-06
国家科技部“重大新药创制”科技重大专项资助项目(No 2015ZX09501004001006);江苏省中药资源产业化过程协同创新中心重点项目(No ZDXM-2-2);江苏省高等学校大学生创新创业训练计划省级项目(No 201510315064Y)
张 倩(1985-),女,博士生,主管中药师,研究方向:药物相互作用,E-mail:wednesday0515@163.com; 段金廒(1956-),男,博士,教授,博士生导师,研究方向:中药资源化学与方剂功效物质基础,通讯作者,E-mail:dja@njutcm.edu.cn
时间:2017-4-24 11:20
http://kns.cnki.net/kcms/detail/34.1086.R.20170424.1120.048.html
10.3969/j.issn.1001-1978.2017.05.024
A
1001-1978(2017)05-0712-07
R282.71;R284.1;R977.6
