非T细胞结合肽(FNS007)对小鼠胶原性关节炎的抑制作用及其机制
2017-05-17李立萍解丽君李国风黄丽晶闫少峰许晓红张勤增李兰芳张建新
李立萍,解丽君,郝 娜,李国风,刘 超,黄丽晶,葛 兰,闫少峰,许晓红,张勤增,姜 红,李兰芳,张建新
(1.河北省疾病预防控制中心药物研究所,河北 石家庄 050021;2.河北菲尼斯生物技术有限公司,河北 石家庄 050035)
◇论 著◇
非T细胞结合肽(FNS007)对小鼠胶原性关节炎的抑制作用及其机制
李立萍1,解丽君1,郝 娜1,李国风1,刘 超2,黄丽晶2,葛 兰2,闫少峰2,许晓红2,张勤增1,姜 红1,李兰芳1,张建新1
(1.河北省疾病预防控制中心药物研究所,河北 石家庄 050021;2.河北菲尼斯生物技术有限公司,河北 石家庄 050035)
目的 研究非T细胞结合肽(FNS007,又称NTAP)对小鼠Ⅱ型胶原(CⅡ)诱导的关节炎(CIA)的抑制作用及其机制。方法 牛CⅡ加弗氏佐剂诱导小鼠胶原性关节炎动物模型。发病小鼠随机分为6组:空白对照组、模型组、阳性药(阿巴西普)组、FNS007 低剂量(1.2 mg·kg-1)、中剂量(2.4 mg·kg-1)和高剂量(4.8 mg·kg-1)治疗组,发病入组当天尾静脉注射给药,以后隔天1次,直至治疗结束。给药后d 28处死小鼠。给药期间测量小鼠爪厚度和踝关节宽度;关节评分法检测关节炎发生情况;实验结束后,酶联免疫吸附法(ELISA)测定小鼠血清中干扰素-γ(IFN-γ)、肿瘤坏死因子-α (TNF-α)、白介素-6(IL-6)和抗CⅡ抗体水平;X线分析FNS007对CIA小鼠4爪骨损伤的作用;对小鼠踝关节进行组织病理学检查。结果 与模型组比较,FNS007给药后能明显抑制CIA小鼠的爪厚度和踝关节宽度,明显降低小鼠的关节炎症评分,明显降低血清IFN-γ、IL-6及抗CⅡ抗体水平,小鼠X线评分降低,踝关节的病理损伤明显减轻。结论 FNS007对CⅡ诱导的小鼠胶原性关节炎有明显抑制作用,其机制为竞争抑制T细胞活化,抑制CIA小鼠体内致炎性细胞因子的分泌,抑制抗CⅡ抗体的产生,减轻组织损伤和骨破坏,从而对小鼠CIA发挥治疗作用。
胶原诱导性关节炎;类风湿关节炎;小鼠;炎症因子;抗Ⅱ型胶原抗体;Ⅱ型胶原
类风湿关节炎(rheumatoid arthritis,RA)是一种以慢性破坏性关节炎为主要特征的自身免疫性疾病,其临床表现为局部关节肿胀、疼痛、僵硬、畸形和功能障碍,伴有全身性轻、中度发热等。其病理改变包括自身免疫异常引起的致炎细胞因子和炎症介质等的释放导致的慢性滑膜炎、血管翳形成及软骨和骨破坏等[1-2]。其发病机制认为与多种因素诱发机体产生自身免疫反应有关。目前,研究认为抗原介导的T细胞激活是RA发病的起始环节,在RA的发生和发展中起着至关重要的作用。非T细胞结合肽(FNS007,又称NTAP)是直接针对 T 细胞发生作用的新型生物制剂。在前期研究中,采用细胞系和患者外周血两个体系证实FNS007可以与Ⅱ型胶原(collagen type Ⅱ,CⅡ)原型肽竞争性地结合到RA相关的MHCⅡ类分子上,进而抑制CⅡ原型肽引起的T细胞的增殖。本项目拟在前期研究基础上,通过小鼠胶原性关节炎(collagen-induced arthritis, CIA)模型,进行系统的FNS007药效学研究,旨在整体动物层面研究其作用效果及机制,为其应用在临床提供实验资料和科学依据。
1 材料与方法
1.1 动物与试剂 ♂ DBA/1小鼠,SPF级,7~8周龄,购自北京华阜康生物科技股份有限公司。牛CⅡ、完全弗氏佐剂(complete Freund’s adjuvant, CFA)和不完全弗氏佐剂(incomplete Freund’s adjuvant, IFA)均购自Chondrex公司;FNS007(河北菲尼斯生物技术有限公司);阿巴西普(abatacept)购自美国百时美施贵宝公司;小鼠肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、干扰素-γ(interferon-γ, IFN-γ)、白介素-6(interleukin-6, IL-6)酶联免疫吸附(enzyme-linked immunosorbent assay, ELISA)试剂盒购自RD公司;小鼠抗CⅡ抗体ELISA试剂盒购自Chondrex公司。
1.2 方法
1.2.1 小鼠关节炎的诱导 首次免疫:将牛CⅡ溶液和CFA等体积乳化,将100 μL乳化剂(含100 μg胶原)于小鼠的尾根部皮内注射进行免疫。加强免疫:21 d后,将牛CⅡ溶液和IFA等体积乳化,将100 μL乳化剂(含100 μg胶原)腹腔注射加强免疫[3]。此后每日观察小鼠4爪肿胀程度,小鼠炎症评分为1分[4]时,随机入组给予治疗。
1.2.2 分组与给药 出现关节炎的小鼠随机分为5组,分别为模型组、FNS007低剂量(1.2 mg·kg-1)组、FNS007中剂量(2.4 mg·kg-1)组、FNS007高剂量(4.8 mg·kg-1)组和阳性药(阿巴西普,5 mg·kg-1)[4]组,另设空白组,每组12只动物。发病入组当天给药,治疗组小鼠按10 mL·kg-1的体积尾静脉给予相应药物,模型组和空白组以相同方法注射溶媒,隔天1次,直至治疗结束,于给药后d 28处死小鼠。
1.2.3 爪厚度和踝关节宽度的测定 以游标卡尺测量小鼠后爪的爪厚度和踝关节宽度。从入组当天开始,每3 d测定1次,直至给药结束。
1.2.4 炎症评分的测定 每天1次,直至给药结束。小鼠每个爪子最高评为4分,每只小鼠最高评为16分,具体标准如下[5]:0分=正常;1分=1种类型的关节(如踝关节或腕关节)轻微但明显红肿,或个别足趾(不论受累足趾个数)出现明显的红肿;2分=2个或2个以上类型的关节出现中度红肿;3分=整个爪子,包括足趾出现严重红肿;4分=多个关节出现最大程度的炎症。
1.2.5 细胞因子和CⅡ抗体的测定 治疗结束后,动物摘眼球取血,抗凝,离心得血清,采用双抗体夹心ELISA法,酶标仪测定血清中IFN-γ、TNF-α、IL-6水平以及血清中抗CⅡ抗体的水平。具体测定方法严格按照IFN-γ、TNF-α、IL-6及抗CⅡ抗体ELISA说明书进行。
1.2.6 X线 治疗结束后,处死小鼠,摘取前、后爪,经体积分数0.04甲醛固定,采用柯达多模态小动物活体成像仪进行X线摄像,对所获得的图像进行骨损伤的评价。
同时采用2种评分标准对小鼠进行X线评分,一种是对跖跗/掌腕关节进行评分,具体标准[5]如下:0分=关节间隙正常,骨轮廓完整;1分=1或2个外侧跖骨出现轻微骨侵蚀;2分=第3到第5外侧跖骨出现明显的骨破坏;3分=所有外侧跖骨均出现骨破坏,同时伴有第1、第2内侧跖骨的明显骨侵蚀;4分=所有跖骨均出现明显骨破坏,伴有至少1个内侧的跖骨关节完全毁损,只保留部分骨轮廓;5分=多处畸形毁损,骨轮廓消失。第2种是对跖趾/掌指关节采用另外的标准进行评价,具体标准如下:0分=无损伤;1分=矿物质流失;2分=1或2个关节侵蚀;3分=严重侵蚀;4分=关节完全损毁。
1.2.7 病理学检查 动物处死后留取小鼠踝关节,经脱钙、石蜡包埋、4 μm切片、HE染色后,进行组织损伤评价,具体评分标准[6]如下:0分=正常滑膜组织;1分=滑膜增生,炎性细胞浸润;2分=血管翳形成,软骨侵蚀;3分=大部分软骨破坏伴软骨下骨侵蚀;4分=关节完整性丧失,关节强直。
2 结果
2.1 FNS007对CIA小鼠爪厚度的影响 与空白组比较,模型组小鼠的爪厚度在发病d 4~27明显升高(P<0.05或P<0.01)。与模型组比较,阿巴西普组的爪厚度在发病d 7~27明显降低(P<0.01);FNS007高剂量组爪厚度在发病d 7~27明显降低(P<0.05或P<0.01)。
2.2 FNS007对CIA小鼠踝关节宽度的影响 与空白组比较,模型组小鼠的踝关节宽度在发病d 4~27明显升高(P<0.01);与模型组比较,阿巴西普组的踝关节宽度在发病d 4~27明显降低(P<0.01);FNS007高剂量组踝关节宽度在发病d 4~27明显降低(P<0.05,P<0.01)。见Fig 1。

Fig 1 Effect of FNS007 on ankle joint width in CIA mice
##P<0.01vscontrol group;*P<0.05,**P<0.01vsmodel group
2.3 FNS007对CIA小鼠炎症评分的影响 与空白组比较,模型组小鼠的炎症评分在发病d 1~27明显升高(P<0.01)。FNS007低剂量组的炎症评分在发病d 4~10明显降低(P<0.05,P<0.01),中剂量组在发病d 2、4~27明显降低(P<0.05,P<0.01),高剂量组的炎症评分在发病d 2~27明显降低(P<0.05,P<0.01)(Fig 2)。
2.4 FNS007对CIA小鼠血清TNF-α水平的影响 ELISA法定量检测血清中TNF-α水平(Fig 3),与空白组比较,模型组小鼠的TNF-α水平有所升高,但统计学处理差异无显著性。与模型组比较,FNS007中、高剂量组的TNF-α水平有所降低,但统计学处理差异无显著性。
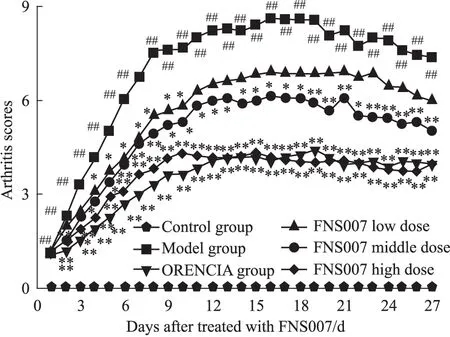
Fig 2 Effect of FNS007 on arthritis scores of CIA mice
##P<0.01vscontrol group;*P<0.05,**P<0.01vsmodel group
2.5 FNS007对CIA小鼠血清IFN-γ水平的影响 ELISA测定小鼠血清中IFN-γ水平,结果如Fig 3所示:与空白组比较,模型组小鼠的IFN-γ水平明显升高(P<0.05)。与模型组比较,阿巴西普组及FNS007低、中、高剂量组的IFN-γ水平明显降低(P<0.05,P<0.01)。
2.6 FNS007对CIA小鼠血清IL-6水平的影响 ELISA测定小鼠血清中IL-6水平,结果如Fig 3所示:与空白组比较,模型组小鼠的IL-6水平明显升高(P<0.01)。与模型组比较,阿巴西普组及FNS007中、高剂量组的IL-6水平明显降低(P<0.05,P<0.01)。
2.7 FNS007对CIA小鼠血清抗CⅡ抗体水平的影响 小鼠血清中的抗CⅡ抗体水平如Fig 4所示:与空白组比较,模型组小鼠的抗CⅡ抗体水平明显升高(P<0.01)。与模型组比较,阿巴西普和FNS007高剂量组的抗CⅡ抗体水平明显降低(P<0.05,P<0.01)。
2.8 FNS007对CIA小鼠X线评分的影响 治疗结束后,经小动物X线摄片获得小鼠前爪及后爪X线图像。经评价,结果如Tab 1所示:与空白组比较,模型组小鼠的X线评分明显升高(P<0.01)。FNS007高、中和低剂量组X线评分呈剂量依赖性降低(P<0.05,P<0.01)。
2.9 FNS007对CIA小鼠关节组织病理学损伤的影响 如 Fig 5所示,正常组小鼠踝关节软骨表面光滑,关节滑膜细胞排列整齐,滑膜结构清晰;CIA模型组小鼠关节滑膜细胞增生变厚排列紊乱,有大量炎性细胞浸润,滑膜毛细血管增生, 血管翳形成,滑膜组织伸入关节腔内,导致关节腔狭窄乃至闭塞,部分关节软骨坏死; FNS007高剂量组滑膜组织接近正常,软骨下骨质破坏明显减轻,未见关节腔闭锁和关节强直;FNS007中剂量组滑膜炎性细胞浸润和血管增生明显减轻,踝关节结构损伤程度较模型组明显减轻;FNS007低剂量组滑膜组织增生和软骨下骨质破坏较模型组有所减轻。

Fig 3 Effect of FNS007 on secretion of inflammatory factors in serum of CIA mice
A:Control;B:Model;C:ORENCIA;D:FNS007 low dose;E:FNS007 middle dose;F:FNS007 high dose.#P<0.05,##P<0.01vscontrol;*P<0.05,**P<0.01vsmodel


GroupDose/mg·kg-1RadiologicscoresHistopathologyscoresControl—0.00±0.000.00±0.00Model—20.27±3.96##3.85±0.38##ORENCIA5.08.50±5.97∗∗1.92±0.95∗∗Lowdose1.214.92±5.91∗2.85±1.21∗Middledose2.414.73±8.09∗2.54±1.27∗∗Highdose4.88.96±4.36∗∗1.77±1.17∗∗
##P<0.01vscontrol;*P<0.05,**P<0.01vsmodel

Fig 4 Effect of FNS007 on anti-CⅡ antibody in serum of CIA mice
A:Control;B:Model;C:ORENCIA;D:FNS007 low dose;E:FNS007 middle dose;F:FNS007 high dose.##P<0.01vscontrol;*P<0.05,**P<0.01vsmodel
CIA小鼠后爪踝关节组织病理学评分结果如Tab 1所示:与空白组比较,模型组小鼠的组织病理学评分明显升高,统计学处理差异有显著性(P<0.01)。与模型组比较, FNS007高、中、低剂量组CIA小鼠的病理学评分呈剂量依赖性降低(P<0.05,P<0.01)。
3 讨论
胶原诱导的CIA模型与人 RA 在临床表现、病理学、免疫学改变和发病机制等方面有许多相似的特点,已逐渐成为研究RA病理机制和评价治疗RA药物的较理想动物模型[7-8]。DBA/1小鼠对CIA的遗传易感性强,发病率高,与人RA的病理改变类似[9],且♂小鼠发病率和严重程度高于♀小鼠,因此被广泛用于建立RA模型。本实验采用牛CⅡ诱导♂ DBA/1小鼠CIA 模型,动物表现为关节肿胀,炎性细胞浸润,滑膜组织增生, 血管翳产生,骨侵蚀及关节结构破坏等,提示CIA模型制备成功。
FNS007是直接针对T细胞发生作用的新型生物制剂。本研究结果显示,FNS007 可降低CIA小鼠的爪厚度、踝关节宽度和关节炎症状,表明FNS007有抗关节炎作用,可抑制CIA小鼠关节炎症发展。X线评分和病理学结果显示,FNS007剂量依赖性地降低CIA小鼠关节滑膜组织增生、炎性细胞浸润、软组织损伤及后期骨侵蚀破坏,进一步表明了该药对CIA的治疗效果。

Fig 5 Effect of FNS007 on ankle joint histopathologic examination(HE,×200)
A:Control; B:Model; C:FNS007 low dose; D:FNS007 middle dose; E:FNS007 high dose
目前研究认为Th1细胞及其分泌的细胞因子的过量在RA发病机制中起着重要作用[10], TNF-α和IL-6的异常表达和失调是 RA 的典型特征之一[11-12]。TNF-α可诱导促炎症介质的合成,诱导成纤维细胞增殖,同时,TNF-α的大量产生可以促进破骨细胞的生成,提高破骨细胞的活性,直接造成关节破坏[13]。 IL-6在关节病变中能促进活化 B 细胞增殖,促进多种炎症介质的产生,增强促炎因子的效应,加重关节病变[14]。因此,检测RA患者IL-6的水平可以做为临床衡量药物疗效的有用指标。IFN-γ可以通过刺激单核巨噬细胞释放TNF-α、IL-1等炎性细胞因子,间接地发挥促炎作用。本研究结果显示,FNS007可有效抑制CIA小鼠血清致炎性细胞因子TNF-α、IL-6和IFN-γ的分泌,这可能是FNS007阻止滑膜炎症、骨质破坏的机制之一。抗 CⅡ抗体是致病因素,也是病程进展的表现,在RA发病中起着重要作用。本研究结果显示,FNS007明显降低了CIA小鼠血清抗CⅡ抗体的产生。
抗原介导的T细胞激活是RA发病的起始环节,需要两个信号协同作用。“T细胞受体(TCR)-抗原肽-人类白细胞DR抗原(HLA-DR)”三分子复合物的形成是第一信号,在RA发病的启动环节,致病抗原被抗原提呈细胞的HLA-DR分子提呈到细胞表面,结合T细胞受体形成TCR-抗原肽-HLA-DR三分子复合物,从而活化致病性T细胞,激活下游细胞因子。因此,阻断抗原肽-HLA-TCR的结合就可能从发病上游阻断RA病理免疫应答,达到治疗疾病的目的。FNS007的设计理念就是针对T细胞激活的第一信号,将CⅡ中与T细胞受体结合的氨基酸替换,特异性结合HLA-DRβ1,竞争性抑制自身抗原与HLA-DRβ1的结合,从而抑制由HLA-DRβ1介导的T细胞激活及自身免疫反应,以及由此引起的炎症介质释放等病理过程, 达到从源头上治疗RA的目的。阿巴西普是针对T细胞激活第二信号的免疫类新药,其作用于共刺激分子CD28和CD80/CD86,抑制 T 细胞活化,与FNS007有相近的作用机制,因此在本研究中用作阳性药。
基于此, FNS007可通过抑制T 细胞激活,下调自身抗体和炎症性细胞因子水平,从而抑制胶原性关节炎的发生发展, 达到治疗类风湿关节炎及其他T细胞介导的自身免疫病的目的。
[1] Bax M, van Heemst J,Huizinga T,et al. Genetics of rheumatoid arthritis: what have we learned?[J].Immunogenetics,2011,63(8): 459-66.
[2] 滕英华. 类风湿性关节炎中医论治[J].中医临床研究,2013,20(5): 45-6.
[2] Teng Y H. TCM syndrome of rheumatoid arthritis treatment[J].ClinResChinMed, 2013,20(5): 45-6.
[3] Brand D D, Kang A H,Rosloniec E F. The mouse model of collagen-induced arthritis[J].MethodsMolMed, 2004,102:295-312.
[4] Webb L M, Walmsley M J,Feldmann M. Prevention and amelioration of collagen-induced arthritis by blockade of the CD28 co-stimulatory pathway: requirement for both B7-1 and B7-2[J].EurJImmunol, 1996, 26(10): 2320-8.
[5] Lin H S, Hu C Y,Chan H Y, et al.Anti-rheumatic activities of histone deacetylase(HDAC) inhibitorsinvivoin collagen-induced arthritis in rodents[J].BrJPharmacol, 2007, 150(7): 862-72.
[6] Nishikawa M, M youi A, Tom ita T, et al. Prevention of the onset and progression of collagen-induced arthritis in rats by the potent p38 mitogen-activated protein kinase inhibitor FR167653[J].ArthritisRheum, 2003, 48(9): 2670-81.
[7] Gupta A, Singh S. Evaluation of anti-inflammatory effect of Withania somnifera root on collagen-induced arthritis in rats[J].PharmBiol,2014,52(3):308-20.
[8] 宋珊珊,张玲玲,魏 伟. 实验性关节炎动物模型建立及病理机制研究进展[J]. 中国药理学通报,2012,27(12):1648-53.
[8] Song S S, Zhang L L, Wei W. Progress in animal models and their pathogenesis of experimental arthritis[J].ChinPharmacolBull,2012,27(12):1648-53.
[9] 张玲玲, 刘云洁, 童 彤, 等. DBA/1 小鼠胶原性关节炎模型建立方法及评价指标[J].中国药理学通报,2010, 26(8):1108-11.
[9] Zhang L L,Liu Y J,Tong T, et al. Establishing method and evaluation indexes of collagen-induced arthritis model in DBA/1 mice[J].ChinPharmacolBull,2010, 26(8):1108-11.
[10]郭 明,封桂英,郭亚春,等 . Th1 型细胞因子在胶原蛋白诱导性关节炎小鼠血清中的动态变化[J].细胞与分子免疫学杂志,2014,30(3):250-3.
[10]Guo M, Feng G Y, Guo Y C, et al. Dynamic changes of Th1 cytokines in the serum of collagen-induced arthritis in mice[J].ChinJCellMolImmunol,2014,30(3):250-3.
[11]Akira H,Takashi Y,Ken T,et al. Mammalian clock gene cryptochrome regulates arthritis via proinflammatory cytokine TNF-α[J].JImmunol,2010,184(3): 1560-5.
[12]褚春民,张洪泉,卜 平.薯蓣皂苷对大鼠胶原性关节炎治疗作用的实验研究[J].中国药理学通报,2012, 28(10):1464-7.
[12]Chu C M,Zhang H Q, Bu P. Experimental study on the therapeutic effect of dioscin on rats with collagen-induced arthritis[J].ChinPharmacolBull,2012, 28(10):1464-7.
[13]van Schouwenburg P A,Rispens T,Wolbink G J. Immunogenicity of anti-TNF biologic therapies for rheumatoid arthritis[J].NatRevRheumatol,2013, 9(3):164-72.
[14]Hashizume M,Mihara M. The roles of interleukin-6 in the pathogenesis of rheumatoid arthritis[J].Arthritis,2011,2011:765624.
Inhibition and mechanisms of non-T cell binding peptide(FNS007)in collagen Ⅱ-induced arthritis mice models
LI Li-ping1,XIE Li-jun1,HAO Na1,LI Guo-feng1,LIU Chao2,HUANG Li-jing2,GE Lan2,YAN Shao-feng2,XU Xiao-hong2,ZHANG Qin-zeng1,JIANG Hong1,LI Lan-fang1,ZHANG Jian-xin1
[1.InstituteofMateriaMedica,HebeiCentersforDiseaseControlandPrevention,Shijiazhuang050021,China;2.Feinisi(Hebei)BiotechnologyCo.Ltd,Shijiazhuang050035,China]
Aim To investigate the effect of non-T cell binding peptide(FNS007) on collagen type Ⅱ-induced arthritis(CIA) in mice and the possible mechanisms.Methods The CIA model was induced by intradermal injection of bovine CⅡ+Freunds adjuvant. At the clinical onset of CIA, mice were randomly divided into 6 groups: blank control group(Control), model group, ORENCIA (abatacept) group, FNS007 low dose(1.2 mg·kg-1) group,FNS007 middle dose(2.4 mg·kg-1) group and FNS007 high dose(4.8 mg·kg-1) group. FNS007 was given by intravenous injection on the first day of arthritis and every other day until the study was terminated on d 28 after injection of the drug.The paw thickness and the ankle joint width were measured, and the arthritis scores were recorded. At termination, interferon-γ(IFN-γ), tumor necrosis factor-α(TNF-α), interleukin-6(IL-6) and level of anti-CⅡ antibody in serum were examined by enzyme-linked immunosorbent assay(ELISA). Bone injury was analyzed by X-ray imaging, and HE staining was conducted to observe the histopathologic changes and pathological score of ankle tissues.Results CIA models were successfully induced.Compared with CIA group,FNS007 high dose significantly reduced the paw thickness and the ankle joint left-right diameter, lowered arthritis scores in CIA mice, reduced serum concentrations of IFN-γ, IL-6 and anti-CⅡ antibodies, and lowered the radiographic and histologic scores. Compared with CIA group,FNS007 middle dose group showed marked reduction in the arthritis scores, IL-6 content in serum, and inhibion in the radiographic and histologic scores. The arthritis scores, concentration of IFN-γ, the radiographic and histologic scores were significantly reduced in FNS007 low dose group compared with those in model group. Conclusion FNS007 can effectively inhibit the progression of CIA through inhibiting T-cell activation and reducing inflammatory cytokines, anti-CⅡ antibodies, and histoclasia and bone destruction.
collagen-induced arthritis;rheumatoid arthritis;mice;inflammatory factors;anti-CⅡantibody;type Ⅱ collagen
2017-02-23,
2017-03-20
河北省重大医学科研课题资助项目(No zd2013069);河北省科技支撑计划项目(No 14272608D)
李立萍(1975-),女,博士, 副研究员,研究方向:心脑肺血管和抗炎免疫药理学,E-mail: lilip2006@163.com; 张建新(1952-),男,博士, 教授, 博士生导师, 研究方向:心脑肺血管和抗炎免疫药理学,通讯作者,E-mail: zhangjx100@163.com
时间:2017-4-24 11:20
http://kns.cnki.net/kcms/detail/34.1086.R.20170424.1120.010.html
10.3969/j.issn.1001-1978.2017.05.005
A
1001-1978(2017)05-0611-06
R-332;R392.11;R392.12;R593.220.5;R684.305;R977.6
