大鼠蛛网膜下腔出血后细胞外调节蛋白激酶1/2 激活介导海马区神经细胞自噬☆
2017-05-17赵雅宁孙竹梅刘俊杰李建民薛承景陈长香
赵雅宁孙竹梅刘俊杰李建民薛承景陈长香
·论 著·
大鼠蛛网膜下腔出血后细胞外调节蛋白激酶1/2 激活介导海马区神经细胞自噬☆
赵雅宁*孙竹梅*刘俊杰*李建民△☆薛承景△陈长香*
目的 探讨大鼠蛛网膜下腔出血(subarachnoid hemorrhage,SAH)后海马区细胞外调节蛋白激酶1/2 (extracellular regulated protein kinases,ERK1/2)激活与神经细胞自噬的关系。方法 120只雄性SD大鼠随机分成假手术组、SAH组、ERK1/2抑制剂U0126组、自噬诱导剂雷帕霉素(rapamycin,Rap)组。采用枕大池二次注血法制作SAH大鼠模型;U0126组和Rap组分别于造模前30min侧脑室注射U0126(5μg/μL)和Rap(10nmol/μL)。光镜观察海马区神经细胞形态结构;免疫组化法和实时荧光定量PCR法检测海马区磷酸化ERK1/2(p-ERK1/2)、ERK1/2 mRNA和自噬标志蛋白(Beclin-1和Beclin-1mRNA、LC3-Ⅱ和LC3mRNA)表达水平。结果 与假手术组比较,SAH组神经细胞死亡率增加(14.9%±5.7%,28.3%±9.8%,44.2%±10.9%)(q值依次为27.56、35.65、44.81;均P<0.05),ERK1/2 mRNA、Beclin-1 mRNA和LC3 mRNA水平增加(1.83±0.01,2.82±0.06,1.34±0.04;1.46±0.02,1.76±0.02,1.35±0.02;1.52±0.04,1.89±0.01,1.31±0.04)(q值依次为42.99、60.66、48.08,71.26、72.46、49.50,48.49、82.40、41.18;均P<0.05),p-ERK1/2、Beclin-1和LC3–II蛋白水平增加(均P<0.05);与SAH组比较,U0126组神经细胞死亡率增加(19.6±6.5%,36.2±7.7%,58.2±12.7%)(q值依次为9.59、10.43、14.66;均P<0.05),U0126组ERK1/2 mRNA、Beclin-1 mRNA和LC3 mRNA表达降低(1.23±0.02,1.40±0.02,1.12±0.02;1.22± 0.04,1.48±0.06,1.24±0.03;1.34±0.04,1.33±0.02,1.14±0.04)(q值依次为 75.66、65.35、31.11,37.18、26.70、15.56,16.79、51.85、22.58;P<0.05),p-ERK1/2、Beclin-1和LC3–II蛋白水平降低(P<0.05);与SAH组比较,Rap组神经细胞死亡率降低(9.1%±4.6%,18.8%±8.6%,28.21%±9.2%)(q值依次为11.86、12.54、16.74;均P<0.05),Rap组 Beclin-1mRNA和LC3mRNA增加(1.78±0.02,2.27±0.05,1.86±0.04;1.97±0.06,2.31±0.08,1.85± 0.00)(q值依次为49.57、48.63、72.12、41.96、38.88、71.73;P<0.05),Beclin-1和LC3–II蛋白增加(P<0.05),ERK1/2 mRNA变化差异无统计学意义 (q值依次为2.63、2.65、2.83,P>0.05),p-ERK1/2蛋白变化差异无统计学意义(P>0.05)。结论 SAH后激活的ERK1/2激活,可促进Beclin-1和LC3-Ⅱ表达介导神经细胞丢失。
蛛网膜下腔出血 细胞外调节蛋白激酶1/2 自噬 微管相关蛋白-1
自噬是真核细胞产生的一种细胞防御机制。应激状态下自噬的程度对维持细胞内环境平衡起到不可忽视的作用。研究显示蛛网膜下腔出血(subarachnoid hemorrhage,SAH)病理过程中伴随自噬的发生,进一步诱导自噬可减低SAH后早期脑损伤(early brain injury,EBI)的神经细胞凋亡,改善神经功能损伤[1],但SAH后自噬发生的机制尚未明确。细胞外调节蛋白激酶1/2(extracellular regulated protein kinases,ERK1/2)是有丝分裂原活化蛋白激酶 (mitogen-activated protein kinases,MAPKs)家族重要成员之一;已证实ERK1/2信号活化在多种中枢神经疾病如脑卒中、脑创伤、阿尔茨海默病等等病理过程中具有关键作用,是神经细胞存活调控靶点之一[2-3]。那么,SAH后神经细胞自噬是否与ERK1/2信号活化有关,目前报道甚少。因此,本研究通过建立大鼠SAH,分别应用ERK1/2抑制剂和自噬诱导剂进行干预,观察海马区ERK1/2激活、自噬关键因子Beclin-1和微管相关蛋白1(轻链LC3-Ⅱ)表达以及神经细胞丢失情况,探讨SAH后神经细胞自噬与ERK1/2信号活化的关系,为SAH后EBI的早期救治提供理论依据。
1 材料与方法
1.1 研究对象 清洁级雄性SD大鼠120只,体质量350~450g购置于北京维通利华实验动物技术有限公司,合格证号SCXK(京)2009-003。按照随机数字表法,将大鼠分为假手术(Sham)组、SAH组、ERK1/2抑制剂U0126组、自噬诱导剂Rap组。每组又分6、24、72h 3个时间。
1.2 动物模型制作 采用自体血二次枕大池注血法[4]制备大鼠SAH模型。Sham组向枕大池2次注入0.3 mL等渗盐水,余操作均与SAH组一致。U0126组和Rap组分别于造模前30min侧脑室注射U0126(5μg/μL)和Rap(10nmol/μL),然后再制备SAH模型。模型判定标准:①当行第二次枕大池注血时,可见少量血性脑脊液在穿刺部位渗出,说明穿刺针位置准确;②剥离脑部时肉眼可以见到极其显眼的血性液体散在分布于脑底基底池部位,或光镜下见到蛛网膜下腔有明显血性液体(图1)。模型制作过程中,SAH组死亡7只,1只模型不符合标准被剔除;U0126组和Rap组分别死亡6只,各组有2只模型不符合标准被剔除;上述被剔除动物依次补齐,最终各组30只动物纳入统计学分析。
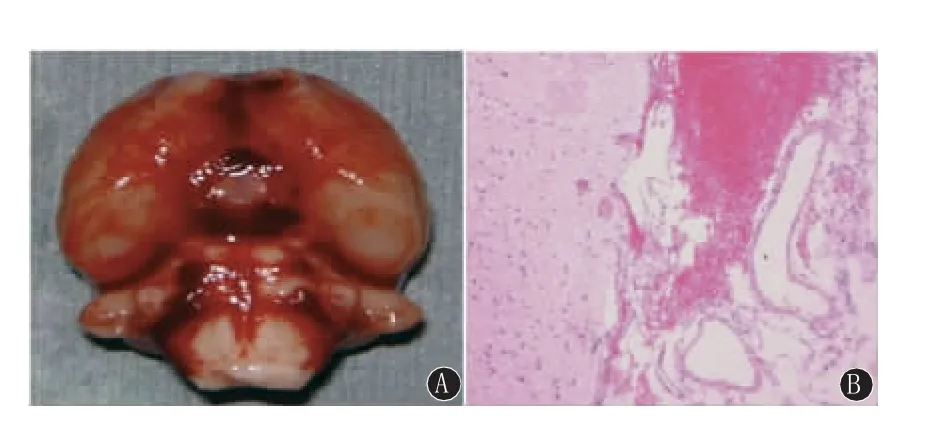
图1 SAH动物模型的判定。A:肉眼见到血性液体分布于脑底基底池部位;B:光镜下见到蛛网膜下腔有明显血性液体。
1.3 脑组织海马区形态结构观察 各组各时间点取5只动物,常规麻醉后处死;用4%多聚甲醛灌注固定后,截取视交叉平面至大脑横裂脑组织。经石蜡包埋、冠状切片(片厚5 μm)、HE染色。参照文献[5]在有测微尺的光学显微镜(400×)下观察海马CA1区神经元形态变化;应用Motic-6.0图像采集和分析系统计算每个视野的死亡神经细胞数量(每只动物取5张海马区切片,每张切片选取4个不重复的视野,即每组各100个视野),以视野下神经细胞平均死亡百分率(CA1区死亡细胞数量与总细胞数量比值百分数)表示。
1.4 实时荧光定量PCR法检测 ERK1/2、Be
clin-1、LC3mRNA各组各时间点取5只大鼠,动物按照规定的时间点处死,快速断头取脑,用冰箱中预冷的器械在冰上分离出双侧海马组织,称量0.6 g,加入1mL RNAiso Plus溶液后匀浆,室温(26℃)静置5min后,12000r/min 4℃离心5min,取上清移至新的1.5mL离心管内,加入1/5RNAiso Plus溶液体积的氯仿,震荡混匀后室温静置5min,12000 r/min4℃离心15min,将上清液转移至新离心管中,加入0.5~1倍RNAiso Plus溶液体积的异丙醇,室温静置10min,12000 r/min4℃离心10min,弃掉上清液,用与RNAiso Plus溶液等量的75%乙醇清晰沉淀,7500 r/min4℃离心5min,弃上清保留沉淀,干燥(不可加热),溶解于30μL DEPC处理水中,测量OD260/280值,根据OD260计算RNA浓度,-80℃保存。
ERK1/2序列:5’-GCCGCCGCCGCCGCCAT-3’;ERK1 Forward primer:5’-TACACGCAGTTGCA GTACATCG-3’;ERK1 Reverse primer:5’-CGCAG GATCTGGTAGAGGAAGT-3’;ERK2Forwardprimer:5’-GGAGCTTGTGGAAATACCTTGG -3’;ERK2 Reverse primer:GACGCAGTGTGGAAATACCTTGG-3’;Beclin1序列:Forward primer:CTCTCGTCAAGGCGTCACTTC;Reverse primer:CCTTAGACCCCTCCATTCCTCA。 LC3序 列 :Forward primer:ACCCTCTACGATGCTGGTGA Reverse primer:GCTGTCCTCAATGTCCTTCTG(上海生工生物技术有限公司合成)。进行Real Time One Step实时荧光定量PCR反应:Satge 1、2(反转录反应),Reps,1,42℃5min,95℃10s;Stage3(PCR反应),Reps,40,95℃5s,60℃31s;Stage4(融解曲线分析),Dissociation Protocol。
1.5 免疫组织化学法检测磷酸化ERK1/2、Beclin-1、LC3-II阳性表达 标本采集同HE染色,切片常规脱蜡至去离子水、滴加复合消化液、37℃温箱孵育20 min,PBS洗涤3次,每次5 min,用3%过氧化氢封闭内源性过氧化物酶15 min,PBS洗涤、滴加兔抗鼠p-ERK1/2、Beclin-1和LC3-II多克隆抗体(1:200,1:250,1:250),置于冰箱保鲜层4℃过夜;37℃复温45 min,PBS洗涤、滴加生物素化二抗,37℃孵育40 min,PBS洗涤,DAB显色,苏木精轻度复染、脱水透明、封片。阳性率的定量分析:每只动物取5张海马区切片,将每张切片的CA1区平均分为3个等份,每个等份选取一个相同部位的4个视野(100个视野),应用Motic-6.0图像采集及图像分析系统分析各组阳性细胞进行吸光度(absorbance,A)。
1.6 统计学处理 应用SPSS17.0对数据进行数据处理,组间分析采用单因素方差分析,两组间比较的SNK-q(Student-Newman-keuls)检验,数据以均值±标准差(±s)表示,检验水准α=0.05。
2 结果
2.1 组织病理学结果 Sham组海马区神经细胞排列整齐、细胞形态结构正常,神经元胞体较大,胞核大而圆,核仁清晰。SAH组海马区可见神经细胞变性水肿,细胞轮廓模糊;亦可见死亡神经细胞,表现为细胞出现核溶解、核碎裂或核消失结构不清。多组间神经细胞死亡率有统计学意义(各时间点 F为 156.60、193.50、151.13,均 P<0.05)。与Sham组比较,SAH组各时间点神经细胞死亡率均明显增加(q值依次为27.56、35.65、44.81;均P<0.05);U0126组神经细胞形态结构损伤进一步加重,视野中死亡神经细胞增多,与SAH组比较,各时间点神经细胞死亡率均明显增多(q值依次为9.59、10.43、14.66;均P<0.05);Rap组神经细胞形态结构损伤减轻,视野中死亡的神经细胞减少,与SAH组比较,各时间点神经细胞死亡率均明显降低(q值依次为11.86、12.54、16.74;均P<0.05)。见图2、表1。
表1 各组海马区神经细胞死亡率比较(n=15,±s)
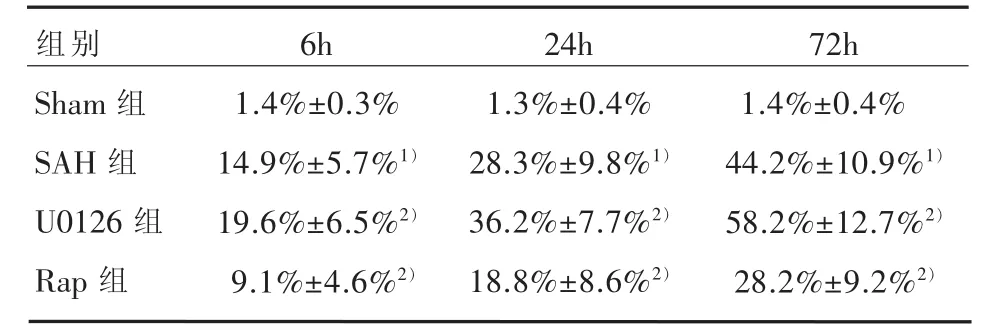
表1 各组海马区神经细胞死亡率比较(n=15,±s)
1)与Sham组比较,P<0.05;2)与SAH比较,P<0.05
组别Sham组SAH组U0126组Rap组6h 1.4%±0.3% 14.9%±5.7%1)19.6%±6.5%2)9.1%±4.6%2)24h 1.3%±0.4% 28.3%±9.8%1)36.2%±7.7%2)18.8%±8.6%2)72h 1.4%±0.4% 44.2%±10.9%1)58.2%±12.7%2)28.2%±9.2%2)
2.2 实时荧光定量PCR法检测结果 用实时定量PCR检测ERK1/2 mRNA、Beclin-1 mRNA和LC3 mRNA的表达,以GAPDH为内参基因,以Sham 组ERK1/2 mRNA、Beclin-1 mRNA和LC3 mRNA表达为1,计算各组ERK1/2 mRNA、Beclin-1 mRNA和LC3 mRNA的Ct值(公式(△Ct=目的基因平均Ct值‐管家基因平均Ct值,△△Ct=实验组△Ct‐对照组△Ct,相对表达量=2-△△Ct)。与Sham组比较,SAH组各时间点ERK1/2 mRNA、Beclin-1 mRNA和 LC3 mRNA水平上调 (q值依次为42.99、60.66、48.08,71.26、72.46、49.50,48.49、82.40、41.18;均P<0.05);与SAH组比较,U0126组中各时间ERK1/2 mRNA、Beclin-1 mRNA和LC3 mRNA持续减少 (q值依次为75.66、65.35、31.11,37.18、26.70、15.56,16.79、51.85、22.58;P<0.05);与SAH组比较,Rap组中ERK1/2 mRNA差异无统计学意义 (q值依次为2.63、2.65、2.83,P>0.05);Beclin-1 mRNA和LC3mRNA水平显著上调 (q值依次为49.57、48.63、72.12、41.96、38.88、71.73;P<0.05),见表2。
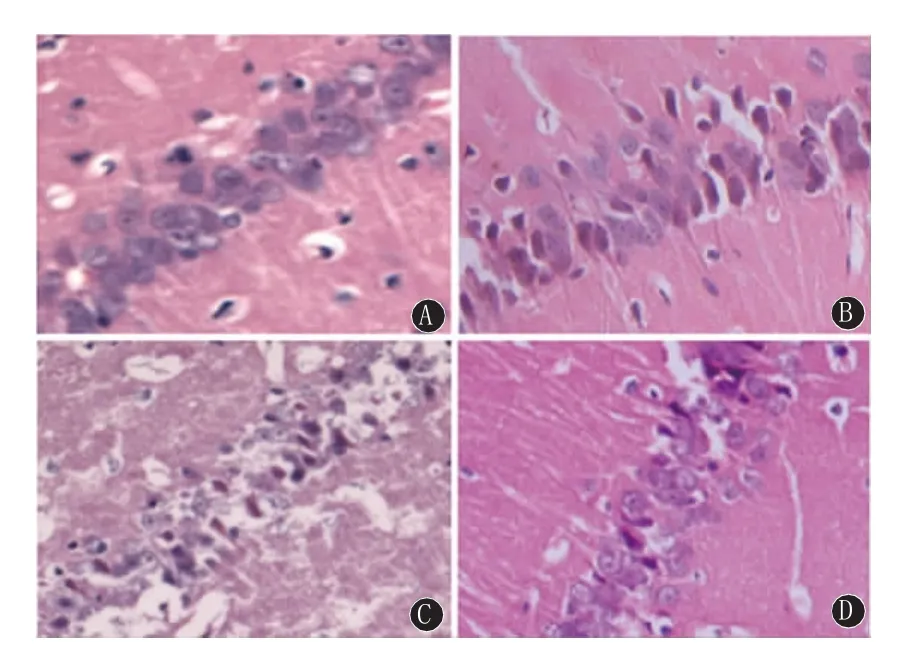
图2 各组大鼠72 h海马区组织病理形态的变化。A~D分别为sham组、SAH模型组、U0126组、Rap组海马区神经元形态结构变化(H E染色,40×10)
表2 各组海马区ERK1/2、Beclin-1、LC3-ⅡmRNA表达水平比较(n=15,±s)数
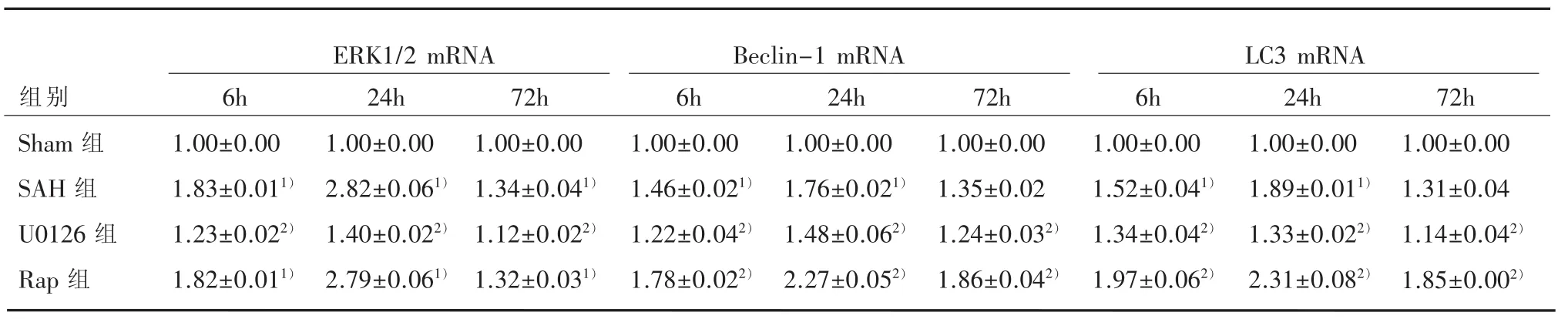
表2 各组海马区ERK1/2、Beclin-1、LC3-ⅡmRNA表达水平比较(n=15,±s)数
1)与Sham组比较,P<0.05;2)与SAH比较,P<0.05
组别Sham组SAH组U0126组Rap组6h 1.00±0.00 1.83±0.011)1.23±0.022)1.82±0.011)ERK1/2 mRNA Beclin-1 mRNA LC3 mRNA 24h 1.00±0.00 2.82±0.061)1.40±0.022)2.79±0.061)72h 1.00±0.00 1.34±0.041)1.12±0.022)1.32±0.031)6h 1.00±0.00 1.46±0.021)1.22±0.042)1.78±0.022)24h 1.00±0.00 1.76±0.021)1.48±0.062)2.27±0.052)72h 1.00±0.00 1.35±0.02 1.24±0.032)1.86±0.042)6h 1.00±0.00 1.52±0.041)1.34±0.042)1.97±0.062)24h 1.00±0.00 1.89±0.011)1.33±0.022)2.31±0.082)72h 1.00±0.00 1.31±0.04 1.14±0.042)1.85±0.002)
表3 各组海马区p-ERK1/2、Beclin-1、LC3-Ⅱ蛋白表达水平比较(n=15,±s)
表3 各组海马区p-ERK1/2、Beclin-1、LC3-Ⅱ蛋白表达水平比较(n=15,±s)
与Sham组比较,P<0.05;2)与SAH比较,P<0.05
组别Sham组SAH组U0126组Rap组p-ERK1/2 Beclin-1 LC3-II 6h 2.48±0.49 9.48±2.561)6.33±2.112)8.96±2.631)24h 2.52±0.55 16.68±4.561)8.52±2.232)15.72±4.701)72h 2.48±0.52 14.60±2.291)7.44±2.112)14.06±2.411)6h 2.49±0.70 9.41±2.581)5.08±2.152)11.24±3.882)24h 2.50±0.67 18.98±3.721)7.44±2.222)22.89±4.552)72h 2.52±0.69 14.22±4.441)10.36±2.962)17.12±4.322)6h 2.44±0.69 7.82±2.331)4.88±1.842)11.88±3.012)24h 2.33±0.63 15.39±4.221)5.77±2.112)19.12±4.442)72h 2.44±0.65 12.25±3.991)9.22±2.772)17.01±3.992)
2.3 各组免疫组织化学检测结果 磷酸化ERK1/2、Beclin-1、LC3-II阳性表达主要位于细胞核,阳性细胞的胞核可见细小的棕黄色颗粒(图3)。与Sham组比较,SAH组各时间点p-ERK1/2、Beclin-1和LC3-II水平上调 (q值依次为32.85、40.81、61.03,26.72、52.17、33.91,25.12、40.13、31.05,均P<0.05);与 SAH组比较,U0126组中各时间 p-ERK1/2、Beclin-1和LC3-II持续减少(q值依次为14.78、23.52、36.05、16.72、36.53、11.19、13.73、29.56、9.59,P<0.05);与SAH组比较,Rap组中p-ERK1/ 2差异无统计学意义(q值依次为2.44、2.77、2.72,P>0.05);Beclin-1和LC3-II水平显著上调 (q值依次为 7.07、12.38、8.41,18.96、11.46、15.06,P<0.05),见表3。
3 讨论
脑损伤状态下,适度自噬激活能够清除细胞内异常蛋白质及受损细胞器,调节能量代谢,减轻细胞损伤程度,降低神经细胞死亡的发生率;但过度的自噬可以促进Caspase-3裂解,加重神经细胞死亡[5]。ZHAO等[6]通过改良的颅内动脉穿刺法建立蛛网膜下腔出血模型,应用自噬抑制剂3-甲基腺嘌呤进行预处理处理,发现脑组织含水量和血脑屏障渗透率进一步加剧及神经细胞凋亡,神经功能评分下降。本研究应用自噬诱导剂Rap进行预处理,结果显示该组自噬蛋白分子Beclin-1、LC3-II表达显著增加,同时该组神经细胞死亡率显著降低,提示SAH早期自噬激活有利于神经细胞的存活,与目前报道结果相似。
ERK1/2信号激活在脑损伤中的作用一直存有争议。Zhao[7]等在糖尿病大鼠脑缺血模型中观察到,ERK1/2活性降低伴随DNA依赖蛋白激酶Ku70表达持续减少,神经细胞死亡增多现象,有学者指出,ERK1/2活化是神经细胞耐受缺血缺氧应激损伤的核心。但亦有研究指出ERK1/2活化可通过转录调控炎症因子如肿瘤坏死因子-α,白细胞介素1β表达水平,加重脑缺血缺氧造成的炎症反应和脑水肿[8]。本研究结果显示与SAH组比较,U0126组ERK1/2mRNA、Beclin-1mRNA、LC3mRNA减少、磷酸化ERK1/2、Beclin-1、LC3-II免疫阳性染色降低,神经细胞死亡率增加;而Rap组ERK1/2变化不明显,这一方面说明SAH早期ERK1/2活化对神经细胞具有保护作用,同时也提示作为自噬激活的上游通路,ERK1/2活化可调控自噬的激活,ERK1/2活性降低导致神经细胞自噬不足,而导致神经细胞丢失严重。目前关于ERK1/ 2信号和自噬关系的研究主要来自体外的实验研究,如用氧化应激诱导剂VK3诱导Hela细胞自噬,ERK1/2激活,U0126可阻断该过程中LC3-II的表达[9]。近期李冉[10]等采用非开颅血管内穿线法制备小鼠SAH模型,观察到代谢型谷氨酸受体1选择性拮抗剂可降低海马区Beclin-1、LC3-II表达,且这种变化过程中伴随ERK1/2活性的改变,亦从侧面提示SAH后ERK1/2信号激活与神经细胞自噬有关。
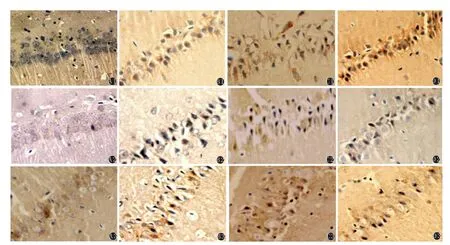
图3 各组大鼠24h海马磷酸化ERK1/2、Becl i n-1和LC3-II免疫组织化学结果。A1~D1:分别为sham组、SAH组、U0126组、Rap组海马区磷酸化ERK1/2免疫组织化学结果(40×10);A2~D2:分别为sham组、SAH组、U0126组、Rap组海马区Becl i n-1免疫组织化学结果(40×10);A3~D3:分别为sham组、SAH组、U0126组、Rap组海马区LC3-II免疫组织化学结果(40×10)
综上所述,SAH后ERK1/2信号通路激活,激活的ERK1/2可通过诱导Beclin-1和LC3-Ⅱ表达从而参与神经细胞丢失。ERK1/2信号通路是连接大多数细胞外信号与膜受体、转录因子和各基因调节的中央信号通路之一,本研究从神经细胞自噬的角度阐明了其在SAH后EBI神经细胞丢失的关键作用,为SAH后EBI的早期干预提供了一定的理论依据。
[1]石晓勇,王中,陈罡,等.自噬在大鼠蛛网膜下腔出血后早期脑损伤中作用的实验研究 [J].临床神经外科杂志,2015,12 (6):449-452.
[2]YU X,GUAN PP,GUO JW,et al.By suppressing the expression of anterior pharynx-defective-1α and-1β and inhibiting the aggregation of β-amyloid protein,magnesium ions inhibit the cognitive decline of amyloid precursor protein/presenilin 1 transgenic mice[J].FASEB J,2015,29(12):5044-5058.
[3]FU P,HU Q.3,4-Dihydroxyphenylethanol alleviates early brain injury by modulating oxidative stress and Akt and nuclear factor-κB pathways in a rat model of subarachnoid hemorrhage [J].Exp Ther Med,2016,11(5):1999-2004.
[4]黄伟,朱继,熊海兵,等.脑源性神经营养因子经Akt/eNOS通路在大鼠蛛网膜下腔出血后早期脑损伤中的表达[J].中国神经精神疾病杂志,2013,39(5):300-303.
[5]CAO J,XIE H,SUN Y,et al.Sevoflurane post-conditioning reduces rat myocardial ischemia reperfusion injury through an increase in NOS and a decrease in phopshorylated NHE1 levels [J].Int J Mol Med,2015,36(6):1529-1537.
[6]ZHAO H,JI Z,TANG D,et al.Role of autophagy in early brain injury after subarachnoid hemorrhage in rats[J].Mol Biol Rep, 2013,40(2):819-827.
[7]ZHAO Y,LI J,TANG Q,et al.Regulation of extracellular signal-regulated kinase 1/2 influences hippocampal neuronal survival in a rat[J].Neural Regen Res,2014,9(7):749-756.
[8]KONG L,LIU J,WANG J,et al.Icariin inhibits TNF-α/IFN-γ induced inflammatory response via inhibition of the substance P and p38-MAPK signaling pathway in human keratinocytes[J]. Int Immunopharmacol,2015,29(2):401-407.
[9]于春艳,刘希,于春荣,等.维生素K3诱导氧化应激经ERK信号途径介导HeLa细胞发生自噬[J].吉林大学学报(医学版),2014,40(2):229-232.
[10]李冉,刘江,徐爱军,等.小鼠蛛网膜下腔出血后海马CA1区mGluR1和ERK1/2的表达变化[J].神经解剖学杂志,2012,28 (1):49-54.
The activation of extracellular regulated protein kinase 1/2 induces neuron autophagy in the hippocampousin a rat model of subarachnoid hemorrhage.
ZHAO Yaning,SUN Zhumei,LIU Junjie,LI Janmin,XUE Chengjing,CHEN Changxiang.The North China University of science and technology,college of Nursing and Rehabilitation,Hebei 063000,China.Tel:0315-3725385
Objective To investigate the relationship of extracellular regulated protein kinases activation and neural cells autophagy in rats after subarachnoid hemorrhage.Methods One hundred twenty male SD rats were ran-domly divided into sham operated group,SAH group,ERK1/2 inhibitor U0126 group,autophagy inducer rapamycin (Rap)group.The animal models were established by injecting the autologous blood into cisterna magna twice.U0126 (5μg/μL)and Rap (10nmol/μL)were injected into lateral ventricles in U0126 group and Rap group 30min before SAH.The morphology of hippocampal nerve cells were examined by using light microscopy.The expression levels of phosphorylated ERK1/2(p-ERK1/2),ERK1/2mRNA and autophagy markers(Beclin-1and Beclin-1 mRNA、LC3-Ⅱand LC3mRNA)in the hippocampus were detected by using immunohistochemistry and real-time fluorescence quantitative PCR.Result Compared with sham group,the rate of dead nerve cells,the mRNA levels of ERK1/2,Beclin-1 and LC3 as well as the levels of the p-ERK1/2,Beclin-1 and LC3-II increased in SAH group(P<0.05).Compared with SAH group,the rate of dead nerve cells increased(P<0.05),the ERK1/2 mRNA,Beclin-1 mRNA and LC3 mRNA,and p-ERK1/2,Beclin-1andLC3-II in U0126 group decreased(P<0.05);the rate of dead nerve cells decreased (P<0.05),the Beclin-1 mRNA and LC3 mRNA,the Beclin-1and LC3-II level increased in Rap group(P<0.05),but ERK1/2 mRNA and p-ERK1/2 remained unchanged(P>0.05).Conclusion Activation of the ERK1/2 signaling pathway after SAH,can induce nerve cells death by increasing Beclin-1 and LC3-II expressions.
Subarachnoid hemorrhage Extracellular regulated protein kinases Autophagy Microtubule-associated protein 1
R651.1
A
2016-11-16)
(责任编辑:甘章平)
10.3969/j.issn.1002-0152.2017.02.010
☆河北省卫生厅重点医学项目(编号:zd2013087);唐山市科技局课题(编号:14130220B)
* 华北理工大学护理与康复学院(唐山 063000)
△华北理工大学附属医院神经外科
