精神分裂症和抗结核药物所致肝损伤共同致病基因的筛选与验证
2017-05-17琚明亮黄涛刘成林潘晓欧贺林陈文忠蔡雷
琚明亮黄涛刘成林潘晓欧贺林陈文忠蔡雷
·论 著·
精神分裂症和抗结核药物所致肝损伤共同致病基因的筛选与验证
琚明亮*黄涛△刘成林※潘晓欧*贺林*陈文忠*蔡雷*
目的 筛选并验证抗结核药物所致肝损伤(anti-tuberculosis drug-induced hepatotoxicity,ATDH)与精神分裂症(schizophrenia,SCZ)之间可能的共同致病基因。 方法 通过查询基因数据库及文献,分别确定ATDH 和SCZ的致病基因,利用重启动随机游走(integrating network random walk with restart,RWR)、基因富集分析(gene set enrichment analysis,GSEA)和超几何检验等生物信息学分析技术筛选出两种疾病的可能共同致病基因,建立定期更新的两种疾病共同致病基因在线数据库(www.bio-x.cn/atdh-sczgenes.html),查阅文献以进一步筛选与ATDH和SCZ都有关的基因;利用meta分析等方法验证候选基因,以最终确定共同致病基因。 结果经信息学分析技术筛选,共获得500个候选共同致病基因。进一步经文献检索,得到GSTM1和GSTT1基因为候选共同致病基因并纳入meta分析。Meta分析显示,GSTM1基因同ATDH(P=0.01)和SCZ(P<0.01)相关均有统计学意义;而GSTT1基因同ATDH和SCZ的发病风险关系均无统计学意义(P>0.05)。结论 GSTM1基因为ATDH 和SCZ的共同致病基因。
精神分裂症 抗结核药物所致肝损伤 基因 Meta分析
精神分裂症(schizophrenia,SCZ)目前病因不明,但家系调查、双生子流行病学研究已经证实,SCZ是一种多基因遗传病[1]。肺结核是由结核分枝杆菌引起的通过呼吸道传播的传染性疾病。前期研究显示,SCZ和肺结核病之间存在分子上的关联[2-3];且SCZ会增加肺结核的发病风险[4-5],精神分裂症患者中肺结核的发病率为2.63%,明显高于同地区普通人群。在接受抗结核治疗时,33%的患者会出现抗结核药物所致肝损伤(anti-tuberculosis drug-induced hepatotoxicity,ATDH)[5]。另外,抗结核药物也会引起神经精神方面副作用,导致患者出现精神症状或SCZ复发[6]。这提示ATDH 和SCZ之间可能存在某种联系。有研究显示,精神分裂症和ATDH之间,存在分子遗传学的关联[7]。为进一步探索其关联,本研究通过从GenBank数据库查阅已知致病基因,应用人类蛋白质相互作用网络分析方法(protein-protein interaction network-based analysis pipeline,PPI),在人类蛋白质相互作用网络(STRING,http://www.string-db.org/)对已知的疾病基因进行标注,并利用重启动随机游走(integrating network random walk with restart,RWR)、基因富集分析(gene set enrichment analysis,GSEA)、超几何检验等生物信息学算法,筛选SCZ和ATDH可能共同致病基因,然后利用meta分析等方法对候选基因进行验证。
1 关键技术及方法
1.1 重启动随机游走(RWR)“随机游走”(random walk)是指基于过去的表现,无法预测将来的发展步骤和方向。根据网络拓扑结构特征及计算网络中节点间的相似性,RWR从特定疾病已知致病基因开始,按一定概率向邻居节点游走,且每步游走有一重启过程,即从种子节点开始重启动游走一直进行[8]。
本研究分别将文献报道的ATDH和SCZ相关基因作为种子基因映射到人类蛋白质相互作用网络(STRING)上,其中要求置信度>0.900[9],共包括8823个基因。然后,这些种子基因在网络上按随机游走方法扩展[10-11]。通过网络扩展,为网络上的所有基因计算其作为疾病相关基因的概率[12-13]。1.2基因富集分析(GSEA) GSEA是分析基因表达信息的一种方法,富集是指将基因按照先验知识,也就是基因组注释信息,进行分类。基因表达谱数据通常包括上万条基因的测量值。基因富集分析的目的是筛选出两组或多组间表达水平有差异的基因集[14]。筛选出两组基因的重合基因进行接下来的分析,这些基因反映两种疾病共有的基因特征[15]。
1.3 超几何检验 使用超几何分布检验筛选连接两种疾病的关键因子,这种关键因子本身及其邻接基因被显著性富集在扩展基因集的重叠基因中[16]。进一步通过Benjamini&Hochberg方法校正P值,减少错判率(false discovery rate)[17]。
2 研究过程
研究流程图见图1。
2.1 分别查询ATDH和SCZ的致病基因 在GenBank数据库中以疾病名称查询ATDH和SCZ的致病基因,共查询到和ATDH有关的已知基因有5个,分别为CYP2E1、GSTM1、GSTT1、NAT2、UGT1A6,和SCZ有关的已知基因有1305个。
2.2 利用生物信息学技术寻找候选共同致病基因根据PPI方法,在人类基因网络数据库中标注上一步查阅到的ATDH和SCZ致病基因,最终成功标注5个和ATDH有关的基因及1079个和SCZ有关的基因[18]。
假设相邻基因具有相似作用,且共同对特定疾病的发病起到特殊作用[19]。首先利用RWR技术,扩大ATDH和SCZ的候选相关基因,获得ATDH候选相关基因1458个,SCZ候选相关基因3045个;经GSEA,获得878个可能和两疾病都有关的重叠基因;再利用超几何测试技术,最终筛选得到500个候选的共同致病基因。
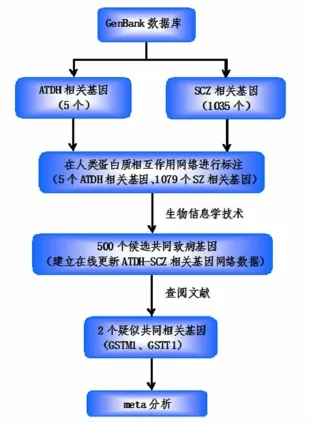
图1 研究流程图
2.3 查阅文献以确定共同致病基因 通过大量查阅文献,根据候选基因和两疾病的关系,对筛选出的500个候选共同致病基因进行逐一比对分析。根据现有文献报道,在这500个候选基因中,只有GSTM1、GSTT1、CYP2E1基因有文献报道同时与ATDH和SCZ都有关,而其他候选基因仅和其中单个疾病有关或同两疾病都不相关。
2.4 利用meta分析验证共同致病基因 由于只有1项病例对照研究证实CYP2E1和SCZ有关,因此不能采用meta分析方法验证CYP2E1与SCZ的关系。对于GSTM1、GSTT1基因,采用meta分析方法来探讨其与SCZ和ATDH的关系。
3 Meta分析
3.1 材料与方法
3.1.1 文献检索 在 PubMed、Scopus、ISI Web of Science、EMBASE数据库查阅2000年1月至2016 年3月所有已经发表的有关精神分裂症致病基因、抗结核药物所致肝损伤致病基因的病例对照研究英文文献。检索词为“药物性肝损伤”“抗结核药所致肝损伤”“ATDH”“精神分裂症”,分别结合基因名称,如:“谷胱甘肽转移酶”“GST”“GSTM”“GSTM1”“GSTT”“GSTT1”等。
3.1.2 文献纳入与排除标准 纳入标准:①研究设计为随机对照研究;②研究组为ATDH或SCZ患者,对照组为健康对照,至少涉及一种候选基因;③ATDH病例满足ATDH诊断标准;④SCZ病例符合《美国精神障碍诊断与统计手册第四版》(Diagnostic and Statistical Manual of Mental Disorders, Fourth Edition,DSM-Ⅳ)精神分裂症的诊断标准;⑤所有病例无酒精/药物依赖、无神经系统疾病、无其他精神病、无颅脑外伤、无精神发育迟滞;⑥提供详细的基因型分布数据;⑦语种为英文;⑧每种疾病与每种候选基因的相关性研究文献数量不少于3篇。
排除标准:①个案研究;②动物实验;③相同研究重复发表文献仅取数据最齐全的1篇;④研究设计不合理,质量差;⑤存在数据缺失的文献;⑥家系研究;⑦论文摘要。
3.1.3 文献质量评定 根据牛津循证医学中心文献严格评定项目(Oxford Critical Appraisal Skill Program,Oxford CASP,2004)对准备纳入研究的文献质量进行评定。评定内容:①样本量充足;②诊断标准清楚;③有对照;④研究组和对照组具有可比性;⑤基因型检测方法合理,基因型分布符合哈代—温伯格平衡定律(Hardy-Weinberg equilibrium);⑥数据充分。每项计1分,总分≥3分则认为文献质量可靠,总分<3分认为质量差。
3.1.4 数据采集 由2名研究人员进行数据提取,内容主要包括第一作者、出版年份、研究对象所在地区、样本量及研究疾病、研究基因、基因型频率等。遇到不一致情况,讨论解决。
3.1.5 统计学方法 采用Stata 12.0软件和Excel软件进行统计分析。用χ2检验对纳入研究进行异质性检验。当各研究间满足统计学同质性时(P>0.1且I2<50%),采用固定效应模型进行meta分析,合并各文献中患者组和对照组正常基因型和缺失基因型数据,合并效应量为OR及其95%CI;反之,采用随机效应模型。为评估单个研究对结果的影响,每次删除1项研究,然后计算剩余研究的合并OR值,进行敏感性分析。利用Harbord’s检验分别对所有纳入研究文献进行发表偏倚分析。检验水准α=0.05,双侧检验。
3.2 结果
3.2.1 检索结果 通过文献检索,初检出与ATDH有关的研究440项,与SCZ有关的研究48项。和ATDH相关文献中,422项为非GSTM1/GSTT1相关研究,余下15项研究中GSTT1数据不可靠、不符合ATDH诊断标准各1项;和SCZ相关文研究中,29项研究非GSTM1/GSTT1对照研究,余下19项有全文的研究中有2项(GSTT1)数据重叠、1项数据不完整、1项非病例对照研究、3项个案研究、5项文献质量差或数据不可信、2项基于家族研究。最终获得有关GSTM1和ATDH的研究14 项[20-33],累计679例患者和2289名对照;有关GSTT1和ATDH的研究13项[20-24,26-33],累计715例患者和2178名对照,见表1。有关GSTM1和SCZ的研究7项[34-40],累计1469例患者和1605名对照;有关GSTT1和SCZ的研究5项[36,38-41],累计936例患者和971名对照,见表2。
3.2.2 ATDH患者GSTM1、GSTT1基因meta分析
对于GSTM1基因,14项研究间无统计学异质性(I2=36%,P=0.09),利用随机效应模型进行meta分析,GSTM1基因同ATDH发病存在相关(OR= 0.71,95%CI:0.56~0.90,P=0.01),见图2A。对于GSTT1基因,13项研究间不存在统计学异质性(I2=32%,P=0.12),利用固定效应模型进行meta分析,GSTT1基因和ATDH之间关联无统计学意义(OR=0.83,95%CI:0.63~1.09,P=0.18),见图2B。3.2.3 SCZ患者GSTM1、GSTT1基因meta分析 对于GSTM1基因,7项研究间不存在统计学异质性(I2=21%,P=0.27),利用固定效应模型进行meta分析,GSTM1基因同SCZ发病关联有统计学意义(OR=0.78,95%CI:0.66~0.92,P<0.01),见图3A。对于GSTT1基因,5项研究间存在统计学异质性(I2=74%,P<0.01),利用随机效应模型进行meta分析,结果显示GSTT1基因和SCZ之间的关联性没有统计学意义(OR=1.37,95%CI:0.93~2.03,P= 0.11),见图3B。
3.3 敏感性分析和发表偏移分析 敏感性分析显示,删除任何一项研究前后,结果均没有发生显著的改变,表明此meta分析结果具有较强的稳定性。发表偏倚分析显示,SCZ与GSTM1的研究(P= 0.06)、SCZ与GSTT1的研究(P=0.91)、ATDH与GSTM1的研究(P=0.56)、ATDH与GSTT1的研究(P=0.08)经Harbord’s检验结果均无统计学意义,提示无明显发表偏倚。
4 讨论
为寻找共同致病基因,可以将两疾病基因集进行直接进行重叠检验,筛选共同致病基因。但是对于类似SCZ等病因不明的疾病而言,其基因集可能并不完整,直接重叠可能会因某一关键致病基因的缺乏,而得不到有意义的结果;另外,直接重叠也无法反映两种疾病之间复杂的相互调节关系。本研究首次应用人类蛋白质相互作用网络分析(PPI)方法和RWR、GSEA、超几何检验技术等手段,确定500个同ATDH和SCZ有关的候选共同致病基因。由于ATDH病例特殊,难以招募到足够多符合要求的病例,因此难以通过基因检测进行验证。通过文献检索对500个候选基因进行进一步筛选,只有CYP2E1、GSTM1、GSTT1同时和ATDH和SCZ有关,其他基因和两种疾病都没有关联或者仅仅和一种疾病有关。进一步meta分析提示,GSTM1可能是ATDH和SCZ的共同致病基因。这一研究方法,可以广泛应用于探寻多种疾病之间分子生物学的关联,并将会促进将来分子生物学研究的发展[42]。
谷胱甘肽S-转移酶(glutathione S-transferases,GSTs)是一组与肝脏解毒功能有关的酶,其谷胱甘肽和自由基结合,促进有毒物质从体内清除,降低药物潜在毒性,GSTs功能障碍会导致ATDH的发生[43]。GSTM1和GSTT1是GSTs家族中的两个类型,其中,GSTM1基因位于1p13.3染色体,GSTT1基因位于22q11.2染色体[44-45]。由于缺失突变导致GSTM1基因和GSTT1基因在人群中存在正常基因型和缺失突变基因型的分布差异。缺失突变后会改变GSTs的结构和功能,使GSTs特异性组织功能丧失[46],损伤肝脏的解毒功能,致使患者更易发生ATDH。
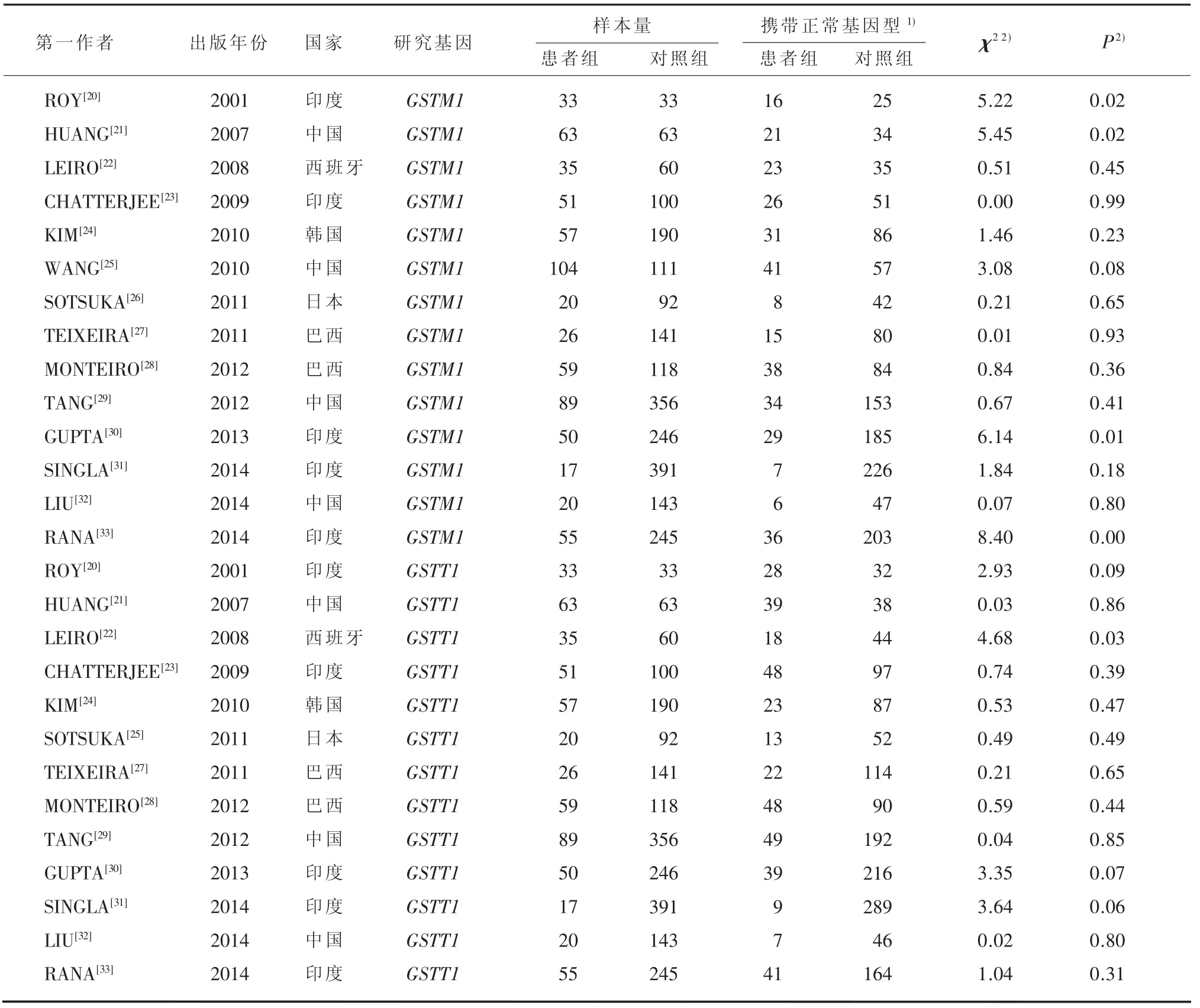
表1 ATDH与GSTM1、GSTT1基因相关文献特征
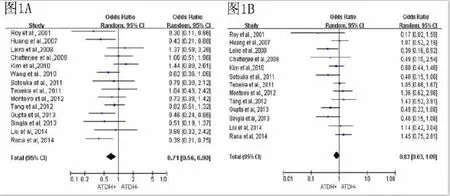
图2 ATDH患者GSTM1、GSTT1基因m et a分析
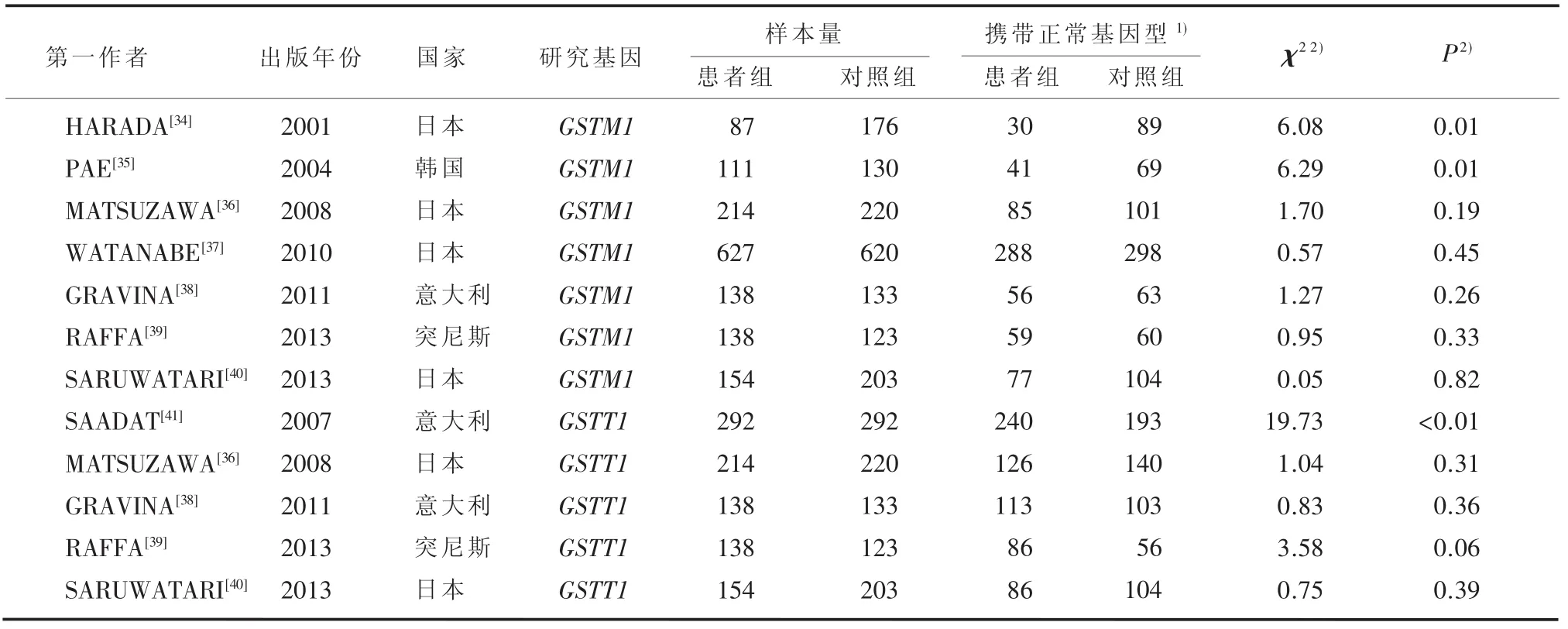
表2 SCZ与GSTM1、GSTT1基因相关文献特征
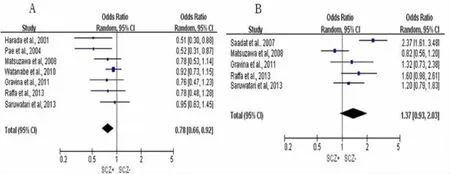
图3 SCZ患者GSTM1、GSTT1基因m et a分析
GSTM1基因主要在肝脏和大脑中表达[47],这一点支持该基因同ATDH和SCZ存在显著关系的结论。GSTM1在肝脏中可以促进肝脏通过CYP2E1酶降解抗结核药物引起的毒副作用;另外,在脑中GSTM1促进谷胱甘肽与氨基色素和多巴胺氧化的代谢产物结合[47],影响大脑线粒体细胞色素氧化酶活性。活性氧在脑中的产生率很高,通过氧化还原机制参与生长管理和神经调节,GSTM1控制着破坏神经的氧化剂和保护神经的抗氧化剂之间平衡[48]。因此,由于GSTM1基因突变导致GSTM1基因失活,不仅会导致肝损伤,也会使有神经保护作用的氧化剂功能失活,并导致后续SCZ的发展。
本研究也有一定的局限性。首先,研究中所使用的人类蛋白质相互作用网络是一个没有方向的功能关联网络。若用当前的研究方法,从定向网络中研究特定疾病,可能会得到更为全面和具体的结论。其次,对SCZ相关基因进行meta分析时,所纳入文献数量相对较少,可能会影响分析结果。另外,到目前为止,由于没有关于ATDH的GWAS研究报道,现有文献中有关ATDH致病基因的报道较少,并且,目前已发现的SCZ相关基因变异对其遗传度的解释度很低,可能尚存在许多未知的相关基因[49],因此只有GSTM1和GSTT1基因得到验证,虽然文献筛查是发现CYP2E1可能为SCZ 和ATDH共同致病基因,但是由于缺乏足够多的文献报道,不能进行meta分析,对于该基因需要更多的进一步研究加以验证。本研究中,虽然GSTM1和GSTT1基因有足够的文献支持可以进行meta分析,并得出GSTM1基因为ATDH和SCZ的共同致病基因结论,但该相关结果尚有待后续研究验证。
[1]XU F,YU T,NIU W,et al.Association study of NOS1 gene polymorphisms with the risk of schizophrenia in Chinese Han origin[J].Psychiatry Res,2016,246:844-845.
[2]CAI L,YANG YH,HE L,et al.Modulation of Cytokine Network in the Comorbidity of Schizophrenia and Tuberculosis[J]. Curr Top Med Chem,2016,16(6):655-665.
[3]HUANG T,LIU CL,LI LL,et al.A new method for identifying causal genes of schizophrenia and anti-tuberculosis drug-induced hepatotoxicity[J].Sci Rep,2016,6:32571.
[4]KUO SC,CHEN YT,LI SY,et al.Incidence and outcome of newly-diagnosed tuberculosis in schizophrenics:a 12-year,nationwide,retrospective longitudinal study [J].BMC Infect Dis, 2013,13(1):351.
[5]许光辉,陈志宇,黄广军.抗结核药物诱导肝损伤的临床分析[J].临床肺科杂志,2009,14(6):742-743.
[6]刘淑勇,李玉枝,杨晓光,等.异烟肼所致精神障碍的临床分析[J].中华精神科杂志,1997,30(4):254-254.
[7]CAI L,CAI MH,WANG MY,et al.Meta-Analysis-Based Preliminary Exploration of the Connection between ATDILI and Schizophrenia by GSTM1/T1 Gene Polymorphisms[J].Plos One, 2015,10(6):e0128643.
[8]张绍武,邵冬冬,张松瑶.基于致病基因网络模块性预测风险致病基因[J].生物物理学报,2014,30(3):227-237.
[9]WACHOLDER S,CHANOCK S,GARCIACLOSAS M,et al. Assessing the Probability That a Positive Report is False:An Approach for Molecular Epidemiology Studies[J].J Natl Cancer Inst,2004,96(22):434-442.
[10]IOANNIDIS JP,NTZANI EE,TRIKALINOS TA.'Racial'differences in genetic effects for complex diseases[J].Nature Genet, 2004,36(12):1312-1318.
[11]LI Y,PATRA JC.Genome-wide inferring gene-phenotype relationship by walking on the heterogeneous network [J].Bioinformatics,2010,26(9):1219-1224.
[12]CHEN X,LIU MX,YAN GY.Drug-target interaction prediction by random walk on the heterogeneous network [J].Molecular Biosystems,2012,8(7):1970-1978.
[13]RUI J,GAN M,PENG H.Constructing a gene semantic similarity network for the inference of disease genes[J].BMC Syst Biol,2011,5 Suppl:S2.
[14]MA’AYAN NRCA.Introduction to Statistical Methods for Analyzing Large Data Sets:Gene-Set Enrichment Analysis[J].Sci Signal,2011,4(190):tr4.
[15]HERT MD,CORRELL CU,BOBES J,et al.Physical illness in patients with severe mental disorders.I.Prevalence,impact of medications and disparities in health care[J].World Psychiatry, 2011,10(1):52-77.
[16]CHEN L,CHU C,KONG X,et al.A Hybrid Computational Method for the Discovery of Novel Reproduction-Related Genes [J].Plos One,2015,10(3):e0117090.
[17]BENJAMINI Y,HOCHBERG Y.Controlling the False Discovery Rate:A Practical and Powerful Approach to Multiple Testing [J].J R Stat Soc Series B Stat Methodol,1995,57(1):289-300. [18]FANG S,ZHANG Y,XU M,et al.Identification of Damaging nsSNVs in HumanERCC2 Gene[J].Chem Biol Drug Des,2016, 88(3):441-450.
[19]JIANG SY,LI LL,YUE J,et al.The effects of SP110's associated genes on fresh cavitary pulmonary tuberculosis in Han Chinese population[J].Clin Exp Med,2016,16(2):219-225.
[20]ROY B,CHOWDHURY A,KUNDU S,et al.Increased risk of antituberculosis drug-induced hepatotoxicity in individuals with glutathione S-transferase M1'null'mutation[J].J Gastroenterol Hepatol,2001,16(9):1033-1037.
[21]HUANG YS.Genetic polymorphisms of drug-metabolizing enzymes and the susceptibility to antituberculosis drug-induced liver injury[J].Expert Opin Drug Metab Toxicol,2007,3(1):1-8. [22]LEIRO V,VALVERDE D,CONSTENLA L,et al.Influence of glutathione S-transferase M1 and T1 homozygous null mutations on the risk of antituberculosis drug-induced hepatotoxicity in a Caucasian population[J].Liver Int,2008,28(6):835-839.
[23]CHATTERJEE S,LYLE N,MANDAL A,et al.GSTT1,and GSTM1,gene deletions are not associated with hepatotoxicity caused by antitubercular drugs[J].J Clin Pharm Ther,2010,35 (4):465-470.
[24]KIM SH,KIM SH,BAHN JW,et al.Genetic polymorphisms of drug-metabolizing enzymes and anti-TB drug-induced hepatitis [J].Pharmacogenomics,2009,10(11):1767-1779.
[25]WANG T,YU HW,PAN YY,et al.Genetic polymorphisms of cytochrome P450 and glutathione S-transferase associated with antituberculosis drug-induced hepatotoxicity in Chinese tuberculosis patients[J].J Int Med Res,2010,38(3):977-986.
[26]SOTSUKA T,SASAKI Y,HIRAI S,et al.Association of isoniazid-metabolizing enzyme genotypes and isoniazid-induced hepatotoxicity in tuberculosis patients [J].In Vivo,2011,25 (25):803-812.
[27]TEIXEIRA RL,MORATO RG,CABELLO PH,et al.Genetic polymorphisms of NAT2,CYP2E1 and GST enzymes and the occurrence of antituberculosis drug-induced hepatitis in Brazilian TB patients [J].Mem Inst Oswaldo Cruz,2011,106(6): 716-724.
[28]MONTEIRO TP,DVM EJ,JEOVANIO-SILVA AL,et al.The roles of GSTM1,and GSTT1,null genotypes and other predictors in anti-tuberculosis drug-induced liver injury [J].J Clin Pharm Ther,2012,37(6):712-718.
[29]TANG SW,LV XZ,ZHANG Y,et al.CYP2E1,GSTM1 and GSTT1 genetic polymorphisms and susceptibility to antituberculosis drug-induced hepatotoxicity:a nested case-control study [J].J Clin Pharm Ther,2012,37(5):588-593.
[30]GUPTA VH,SINGH M,AMARAPURKAR DN,et al.Association of GST null genotypes with anti-tuberculosis drug induced hepatotoxicity in Western Indian population [J].Ann Hepatol, 2013,12(6):959-965.
[31]NEHA SINGLA,DHEERAJ GUPTA,NITI BIRBIAN,et al.Association of NAT2,GST,and CYP2E1,polymorphisms and antituberculosis drug-induced hepatotoxicity[J].Tuberculosis(Edinb),2014,94(3):293-298.
[32]LIU F,JIAO AX,WU XR,et al.Impact of glutathione S-transferase M1 and T1 on anti-tuberculosis drug-induced hepatotoxicity in Chinese pediatric patients [J].Plos One,2014,9(12): e115410-e115410.
[33]RANA SV,SHARMA SK,OLA RP,et al.N-acetyltransferase 2,cytochrome P4502E1 and glutathione S-transferase genotypes in antitubercular treatment-induced hepatotoxicity in North Indians[J].J Clin Pharm Ther,2014,39(1):91.
[34]HARADA S,TACHIKAWA H,KAWANISHI Y.Glutathione S -transferase M1 Gene Deletion May Be Associated with Susceptibility to Certain Forms of Schizophrenia [J].Biochem Biophys Res Commun,2001,281(2):267-271.
[35]PAE C U,YU H S,KIM J J,et al.Glutathione S-transferase M1 polymorphism may contribute to schizophrenia in the Korean population[J].Psychiatric Genetics,2004,14(14):147-150.
[36]MATSUZAWA D,HASHIMOTO K,HASHIMOTO T,et al.Association study between the genetic polymorphisms of glutathione-related enzymes and schizophrenia in a Japanese population [J].Am J Med Genet B Neuropsychiatr Genet,2009, 150B(1):86-94.
[37]WATANABE Y,NUNOKAWA A,KANEKO N,et al.A case–control study and meta-analysis of association between a common copy number variation of the glutathione S-transferase mu 1,(GSTM1)gene and schizophrenia[J].Schizophr Res,2010, 124(1-3):236-237.
[38]GRAVINA P,SPOLETINI I,MASINI S,et al.Genetic polymorphisms of glutathione S-transferases GSTM1,GSTT1,GSTP1 and GSTA1 as risk factors for schizophrenia[J].Psychiatry Res, 2011,187(3):454-456.
[39]RAFFA M,LAKHDAR R,GHACHEM M,et al.Relationship between GSTM1,and GSTT1,polymorphisms and schizophrenia: A case–control study in a Tunisian population[J].Gene,2013, 512(2):282-285.
[40]SARUWATARI J,YASUI-FURUKORI N,KAMIHASHI R,et al.Possible associations between antioxidant enzyme polymorphisms and metabolic abnormalities in patients with schizophrenia[J].Neuropsychiatr Dis Treat,2013,9(9):1683-1698.
[41]SAADAT M,MOBAYEN F,FARRASHBANDI H.Genetic polymorphism of glutathione S-transferase T1:a candidate genetic modifier of individual susceptibility to schizophrenia[J].Psychiatry Res,2007,153(1):87-91.
[42]ZHU Y,CONG Q W,LIU Y,et al.Antithrombin,an Important Inhibitor in Blood Clots[J].Curr Top Med Chem,2016,16(6): 666.
[43]ROY P D,MAJUMDER M,ROY B.Pharmacogenomics of anti-TB drugs-related hepatotoxicity[J].Pharmacogenomics,2008,9 (3):311-321.
[44]WEBB G,VASKA V,COGGAN M,et al.Chromosomal Localization of the Gene for the Human Theta Class Glutathione Transferase(GSTT1)[J].Genomics,1996,33(1):121-123.
[45]PEARSON W R,VORACHEK W R,XU S J,et al.Identification of class-mu glutathione transferase genes GSTM1-GSTM5 on human chromosome 1p13[J].Am J Hum Genet,1993,53(1): 220-233.
[46]ALLEN NC,BAGADE S,MCQUEEN MB,et al.Systematic meta-analyses and field synopsis of genetic association studies in schizophrenia:the SzGene database[J].Nat Genet,2008,40 (7):827-834.
[47]ROWE JD,NIEVES E,LISTOWSKY I.Subunit diversity and tissue distribution of human glutathione S-transferases:interpretations based on electrospray ionization-MS and peptide sequence-specific antisera [J].Biochem J,1997,325(Pt 2)(1): 117-123.
[48]SMYTHIES J.Redox mechanisms at the glutamate synapse and their significance:a review [J].Eur J Pharmacol,1999,370(1): 1-7.
[49]李康,许瑞环,张洪德,等.定量计算已知易感变异对精神分裂症遗传度的解释度 [J].中国神经精神疾病杂志,2014, 40(8):449-453.
Identification and validation of common susceptible genes for ATDH and schizophrenia.
JU Mingliang, HUANG Tao,LIU Chenlin,PAN Xiaoou,CHEN Wenzhong,CAI Lei.Bio-X Institutes,Key Laboratory for the Genetics of Developmental and Neuropsychiatric Disorders(Ministry of Education),Shanghai Key Laboratory of Psychotic Disorders (No.13dz2260500),Division of Mood Disorders,Shanghai Mental Health Center affiliated to School of Medicine,Shanghai Jiao Tong University,Shanghai 200030,China.Tel:021-62932151.
Objective To identify and validate the common susceptible genes for schizophrenia(SCZ)and anti-tuberculosis drug-induced hepatotoxicity (ATDH).Methods ATDH-related genes and SCZ-related genes were identified through seeking GenBank and were confirmed through literature review.A new network-based pipeline was proposed to identify potential common key causal genes that influence the development of these two diseases by integrating network random walk with restart(RWR)algorithm,gene set enrichment analysis(GSEA)and hypergeometric test.Then,a field synopsis or systemic meta-analysis of published studies was conducted to assess these candidate causal genes.Results Five hundred candidate genes were identified as potential common causal genes for both ATDH and SCZ after screening by our proposed method.During validation of these 500 candidate genes,only GSTM1 and GSTT1 were found to be widely studied with a plenty of multi-center study data.Meta-analysis results indicated that the GSTM1 present genotypewas significantly associated with a decreased risk of ATDH (P=0.01)and SCZ (P<0.01).Conclusion GSTM1 may be a causal gene for both ATDH and SCZ.
Schizophrenia Anti-tuberculosis drug-induced hepatotoxicity(ATDH) Genes Meta-analysis
R749.3
A
2016-10-30)
(责任编辑:肖雅妮)
10.3969/j.issn.1002-0152.2017.02.004
* 上海交通大学Bio-X研究院,上海交通大学医学院附属精神卫生中心,“遗传发育与精神神经疾病”教育部重点实验室,上海精神疾病重点实验室(编号:13dz2260500)(上海200030)
△中国科学院上海生命科学研究院,健康科学研究所
※上海交通大学生命科学技术学院
