免疫抑制并铜绿假单胞菌肺炎小鼠Th17细胞功能的变化及人免疫球蛋白治疗对其的影响*
2017-05-16李鋆璐邢丽华陈渟桑袁聪聪赵国强王石磊李晓燕
李鋆璐, 邢丽华△, 陈渟桑, 袁聪聪, 赵国强,徐 岷, 高 景, 王石磊, 李晓燕, 曹 杰
郑州大学第一附属医院 1呼吸ICU(RICU) 3检验科,郑州 4500522郑州大学基础医学院微生物与免疫学教研室,郑州 450001
免疫抑制并铜绿假单胞菌肺炎小鼠Th17细胞功能的变化及人免疫球蛋白治疗对其的影响*
李鋆璐1, 邢丽华1△, 陈渟桑1, 袁聪聪1, 赵国强2,徐 岷3, 高 景1, 王石磊1, 李晓燕1, 曹 杰1
郑州大学第一附属医院1呼吸ICU(RICU)3检验科,郑州 4500522郑州大学基础医学院微生物与免疫学教研室,郑州 450001
目的 探讨辅助性T细胞17(Th17)的转录调节因子——核孤儿受体γt(RORγt)及主要效应分子白细胞介素-17(IL-17)在免疫抑制并铜绿假单胞菌(PA)肺炎中的变化,以此反映Th17细胞功能变化,以及人免疫球蛋白治疗对其的影响。方法 90只BALB/c小鼠分为空白组、PA组、免疫抑制组、免疫抑制并PA组及人免疫球蛋白治疗组(分别记为A、B、C、D、E组),每组18只。各组小鼠于造模成功后的4、8及24 h处死,观察小鼠大体病理改变,进行肺组织病理学评分,反转录-聚合酶链式反应检测肺组织RORγt mRNA表达,酶联免疫法检测外周血中IL-17表达水平。结果 光镜下可见,A、C组小鼠肺组织无明显炎性表现,B、D、E组小鼠肺组织均可见不同程度的组织充血、水肿、炎性细胞浸润、肺泡间隔增宽等炎性改变,均以8 h最重,其中D组小鼠肺组织病理评分明显高于其它各组(均P<0.01);B、D、E组小鼠肺组织中RORγt mRNA表达水平较A、C明显上调(均P<0.01),并均以4 h达峰值;B、D、E组小鼠外周血中IL-17表达水平较A、C组明显升高(均P<0.01),均于8 h达峰值。D组相比于B组,病理评分、RORγt mRNA及IL-17表达水平均增高(均P<0.01),而E组则较B组均降低(均P<0.01)。结论 免疫抑制并铜绿假单胞菌肺炎中Th17细胞过度激活,引起过度炎症反应导致组织器官损伤,而人免疫球蛋白可在一定程度上抑制Th17细胞为主的炎症反应,从而减缓此类疾病病情的发展。
免疫抑制; 铜绿假单胞菌肺炎; Th17细胞; RORγt mRNA; 白细胞介素-17; 人免疫球蛋白
近年来随着脏器移植、恶性肿瘤及自身免疫性疾病患者的增多以及免疫抑制剂、糖皮质激素等广泛应用,免疫抑制/低下患者明显增多。由于机体免疫功能受损,感染发生率达25%~50%[1-2],其中铜绿假单胞菌肺部感染患者可达39.6%,死亡率可高达30%,由于其治疗效果差、死亡率高而成为临床工作中的棘手问题[3]。Th17细胞是新近发现的促炎细胞,在维持机体免疫功能稳态中发挥重要作用,可调节自身免疫性疾病、重症感染等多种疾病的发生发展过程[4]。RORγt是Th17重要的转录调节因子,在细胞分化及效应分子表达过程中起着重要的调控作用[5]。IL-17有促进多种趋化因子、金属蛋白酶及中性粒细胞浸润等多个功能,是Th17细胞发挥促炎作用的基础[6]。免疫球蛋白替代治疗首次于20世纪50年代被用于先天性原发性免疫缺陷病,后被用于炎性疾病及自身免疫性疾病等多种疾病的治疗[7]。而近期研究发现人免疫球蛋白辅助抗生素治疗重症感染,通过调节Th17/Treg细胞比例、促进中性粒细胞吞噬功能、促进病原体清除等多种作用而改善患者病情[8]。本研究通过建立免疫抑制并铜绿假单胞菌肺炎小鼠模型,并给予人免疫球蛋白治疗,检测RORγt mRNA及IL-17表达水平,探讨免疫抑制并PA肺炎治疗前后Th17细胞功能变化,及人免疫球蛋白对此类疾病的治疗作用,以期为免疫抑制并PA肺炎的发生机制及治疗提供依据。
1 材料与方法
1.1 模型建立及分组
8周龄雌性BALB/c小鼠(郑州大学医学院实验动物中心提供)90只,体重25~35 g,分为空白组、PA组、免疫抑制组、免疫抑制并PA组及人免疫球蛋白组等5组(依次命名为A、B、C、D及E组,n=18),所有小鼠均饲养于无菌动物房,给予无菌饲料及无菌饮用水。参照参考文献[9],于实验第1、3、5天腹腔注射环磷酰胺(商品名:安道生,Baxter Oncology GmbH,批号:H20110407)150 mg/kg,建立免疫抑制模型(对照组腹腔注射等量无菌PBS液);于实验第6天每侧鼻孔滴入10 μL PA悬液(109CFU/mL)建立PA肺炎模型(对照组给予等量无菌PBS液);二者结合建立免疫抑制并PA肺炎模型;免疫球蛋白组在免疫抑制并PA肺炎模型建立后立即腹腔注射人丙种球蛋白(华兰生物工程股份有限公司,批号:S10970032)0.4 g/kg。各组小鼠于造模成功后的4、8及24 h分批次处死,每组每个时间点6只动物。
1.2 标本收集
各组各时间点小鼠经过量麻醉处死,经眼眶收集外周血0.8~1 mL,2 000 r/min离心15 min,收集上清液于-80℃保存,用于ELISA检测外周血IL-17水平。取小鼠右肺置于10%多聚甲醛液固定,经过包埋、切片、常规HE染色后于光镜下观察病理学变化。取左上肺置于-80℃保存,用于RT-PCR检测RORγt mRNA表达水平。
1.3 检测指标
1.3.1 病理评分 由病理学专家于光镜下阅片并评分。按照急性肺损伤评分标准[10],从肺内毛细血管淤血、肺泡腔纤维蛋白渗出、中性粒细胞浸润、气道黏膜上皮脱落、肺泡间隔增宽等5方面,按病变程度分为无(0)、可疑(1)、轻度(2)、明显(3)及重度(4)改变等5级评分。
1.3.2 RORγt mRNA表达水平 用Trizol法提取肺组织总RNA,Nanodrop测定RNA浓度及纯度后,用逆转录试剂盒(购自ThermoFisher Scientific)按说明书方法逆转录得肺组织总DNA,再以GAPDH为内参,用ThermoFisher PCR试剂盒(购自ThermoFisher Scientific)在ThermoFisher 7500 PCR仪行PCR。RORγt、GAPDH引物由上海生工生物工程股份有限公司合成,引物序列:GAPDH(138 bp)正向引物:5′-GCACCGTCAAGGCTGAGAAC-3′,负向引物:5′-TGGTGAAGACGCAGTGGA-3′;RORγt(182 bp)正向引物:5′-CTGTCCTGGGCTACCCTAC-3′,负向引物:5′-AGTAGGCCACATTACACTGCT-3′。PCR反应条件:95℃ 3 min,95℃ 35 s、55℃ 35 s、72℃ 40 s,共40个循环,最终72℃延伸5 min,以2-ΔΔCt法得出各组RORγt mRNA相对表达量。
1.3.3 外周血IL-17浓度检测 小鼠外周血常温解冻,以3 000 r/min离心5 min,取上清按IL-17试剂盒(购自达科为生物技术有限公司)说明书检测,每个标本设置3个复孔取平均值,酶标仪读取各孔吸光度值(A),制作标准曲线后得出稀释浓度并乘以稀释倍数得出外周血中IL-17浓度。
1.4 统计学方法
2 结果
2.1 小鼠一般情况及大体表现
空白组及免疫抑制组小鼠活动、饮食、体重、毛色等未见明显变化,PA组、免疫抑制并PA组及人免疫球蛋白组小鼠均出现不同程度的精神萎靡,活动次数减少,进食进水量减少,体重下降,毛色发黄、竖毛等状态。小鼠被处死后,肉眼可见空白组及免疫抑制组小鼠肺组织外观粉红色,无明显异常改变;PA组、免疫抑制并PA组及人免疫球蛋白组小鼠肺外观暗红无光泽,可见散在点状及小片状出血,其中免疫抑制并PA组及人免疫球蛋白组相对较重。
2.2 小鼠肺组织病理学观察
光镜下,空白组及免疫抑制组小鼠肺组织结构完整,未见明显肺损伤表现;PA组、免疫抑制并PA组及人免疫球蛋白组小鼠肺组织可见不同程度炎性改变,均以8 h损伤明显[病理学评分分别为:(10.67±0.82)、(15.17±0.75)、(12.67±0.82)],其中以免疫抑制并PA组最重。PA组小鼠于24 h时肺损伤较前明显减轻(4.67±0.82),而免疫抑制组损伤仍较重(10.17±0.75),人免疫球蛋白组小鼠经治疗后肺损伤较免疫抑制并PA组好转(9.17±0.75)。各组小鼠肺组织病理学改变(8 h)见图1,病理学评分见表1。

A:空白组;B:PA组;C:免疫抑制组;D:免疫抑制并PA组;E:人免疫球蛋白组。A、C组小鼠肺组织结构完整,未见明显炎性表现;B组小鼠肺内少量毛细血管充血,肺泡腔中少许可疑纤维蛋白渗出,小灶状的中性粒细胞浸润,大量肺泡间隔增宽;D组小鼠肺内毛细血管明显淤血,肺泡腔中纤维蛋白渗出较多,中性粒细胞大量浸润,局部气道黏膜上皮细胞脱落,大量肺泡间隔断裂,失去正常肺组织结构;E组小鼠肺内毛细血管淤血,肺泡腔中少量散在纤维蛋白渗出,中性粒细胞浸润仍较明显,可疑气道黏膜上皮细胞脱落,肺泡间隔增宽,部分断裂失去正常肺组织结构图1 各组小鼠肺组织病理学表现(8 h,HE染色,×100)Fig.1 Histological manifestations of lung tissues in each group(8 h,HE staining,×100)
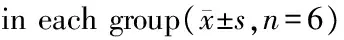

组别4h8h24hF值P值A017±041017±041017±04100001000B283±0751067±082467±0821590350000C017±041033±052017±04102780761D350±0841517±0751017±0753363640000E333±0521267±082917±0752667780000F值45982643464319219P值000000000000
A:空白组;B:PA组;C:免疫抑制组;D:免疫抑制并PA组;E:人免疫球蛋白组
2.3 肺组织中RORγt mRNA相对表达水平
空白组及免疫抑制组于3个时间点均未见RORγt mRNA相对表达水平明显变化[空白组,4 h(0.99±0.07),8 h(1.02±0.06),24 h(1.02±0.11);免疫抑制组,4 h(0.97±0.03),8 h(0.99±0.05),24 h(0.99±0.08)];而PA组、免疫抑制并PA组及人免疫球蛋白组于4 h时已明显增高,其中免疫抑制并PA组变化最大[3组分别为:(2.94±0.08)、(3.17±0.08)、(3.14±0.05)],同时3组于8 h及24 h时均有下调趋势,其中PA组下调幅度较明显,于24 h时已接近正常表达水平,免疫抑制并PA组下调幅度较小,至24 h时仍处于高表达水平,人免疫球蛋白组下调幅度较免疫抑制并PA组增加,但表达水平仍偏高[24 h时3组分别为:(1.24±0.10)、(2.86±0.09)、(1.35±0.048)]。各组小鼠肺组织中RORγt mRNA相对表达水平见表2。

Table 2 The relative expression of RORγt mRNA in lung tissues

A:空白组;B:PA组;C:免疫抑制组;D:免疫抑制并PA组;E:人免疫球蛋白组
2.4 外周血中IL-17浓度
空白组及免疫抑制组小鼠于3个时间点IL-17浓度无明显变化[空白组,4 h(299.68±2.91),8 h(299.39±5.24),24 h(301.00±3.20);免疫抑制组,4 h(298.58±2.84),8 h(300.89±2.97),24 h(301.17±2.02)];PA组、免疫抑制并PA组及人免疫球蛋白组IL-17浓度于3个时间点均较空白组及免疫抑制组增高,并于8 h达高峰,其中免疫抑制并PA组增高最明显[3组8h分别为:(352.99±3.81)、(382.86±6.20)、(360.79±3.39)],在24 h时,PA组及人免疫球蛋白组均有明显下降趋势,而免疫抑制并PA组下降幅度较小[3组24h分别为:(322.81±4.37)、(356.14±4.24)、(339.84±2.67)]。各组小鼠外周血中IL-17表达水平见表3。
Table 3 The serum concentration of IL-17 in mice in
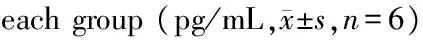

组别4h8h24hF值P值A29968±29129939±52430100±32002880754B31469±44235299±38132281±4371378550000C29858±28430089±29730117±20217340210D30679±33338286±62035614±4243966800000E30614±37936079±33933984±2674152310000F值20443417999299260P值000000000000
A:空白组;B:PA组;C:免疫抑制组;D:免疫抑制并PA组;E:人免疫球蛋白组
3 讨论
Th17细胞于2005年被证实为IL-17特异性来源的淋巴细胞亚群,其通过释放促炎因子参与急慢性感染、自身免疫性疾病等多种疾病进程[11]。在TGF-β及IL-6诱导下CD4+T细胞分化为Th17细胞,其中RORγt作为Th17特异性的转录因子在此过程中起着重要作用。RORγt通过结合其相应受体如RORE、STAT3等,使Jak激酶磷酸化而活化,从而诱导Th17分化,同时可通过RORE与STAT3或RUNX1协同激活IL-17基因启动子而促进IL-17的表达及分泌,还可激活多种生长因子、趋化因子而触发强烈的炎症反应[5,12-13]。IL-17作为Th17细胞特异性细胞分子,通过结合Act1、TRAF6等受体而促进多种趋化因子及基质蛋白分泌,招募大量中性粒细胞聚集,引起炎性反应,导致组织器官的炎性损伤[14-15]。研究已证实在自身免疫性疾病进展过程中,机体存在免疫功能紊乱状态[16],而Th17细胞作为主要炎症细胞,介导炎症反应导致组织器官损伤,从而加重病情[4]。但在肺部感染病程中,被激活的Th17细胞又可及时分泌促炎因子,招募大量中性粒细胞,产生炎症反应而有效清除病原体,减缓病情发展[17]。而过度激活的Th17细胞由于过度分泌多种促炎因子则可导致肺组织及其它器官损伤[18]。但在免疫抑制并肺部感染疾病中,是否存在Th17细胞效应分子过度表达,从而导致此类疾病进展迅速不易控制,尚未见相关报道。
免疫球蛋白自20世纪50年代首次用于免疫缺陷性疾病治疗后,现已被广泛用于自身免疫性疾病、原发性或继发性免疫缺陷性疾病等多种疾病的辅助治疗[7],近年来,免疫球蛋白辅助治疗重症感染也取得较好疗效,但其在免疫抑制并PA肺炎中的治疗作用并不清楚。
本研究发现,相比于免疫功能正常的PA小鼠,免疫抑制并PA组小鼠病情发展迅速且较重,于8 h肺组织损伤严重,而24 h时肺损伤程度仍缓解不明显;RORγt mRNA在4 h时已出现上调,并于8 h及24 h时处于上调状态;IL-17水平也于8 h、24 h持续处于较高水平。在免疫抑制并PA肺炎机体,RORγt mRNA、IL-17出现高表达,Th17细胞过度激活,这可能与PA感染诱导机体免疫应答过度反应有关。一方面抗原提呈细胞活化而诱导CD4+T细胞分化为炎性细胞Th17细胞;同时免疫抑制剂环磷酰胺抑制机体多种免疫细胞功能同时,可能通过抑制免疫耐受相关树突状细胞功能,激活STAT3信号通路及炎性吞噬细胞而促进Th17细胞分化[19],综上,在PA感染时,免疫抑制机体仍可出现Th17细胞过度激活状态,但其确切机制仍不清楚。免疫抑制并PA肺炎机体组织损伤严重可能与RORγt mRNA高表达从而产生过量RORγt,进而促进过度Th17细胞分化及炎症因子IL-17、趋化因子、金属蛋白酶等大量分泌,中性粒细胞大量浸润而造成组织器官炎性损伤有关。而机体接受人免疫球蛋白治疗后,RORγt mRNA、IL-17表达水平较前下降,可能与免疫球蛋白调节Th17细胞功能相关,免疫球蛋白可通过抑制RORγt mRNA表达及STAT3磷酸化而抑制RORγt转录调节功能,从而下调效应因子IL-17、IL-21、IL-22及趋化因子等而抑制Th17细胞功能;同时可促进Treg细胞分化及成熟,Treg细胞特异性转录因子FOXP3表达增强亦可抑制RORγt功能;人免疫球蛋白可通过抑制抗原提呈细胞功能而影响CD4+T细胞向Th17分化过程。另外,研究发现免疫球蛋白还可诱导病原菌聚集而利于中性粒细胞对病原菌的吞噬作用而促进病原菌清除[20-21]。因此人免疫球蛋白治疗后,免疫抑制并PA肺炎机体免疫功能紊乱状态较前缓解,Th17为主的炎症反应受到抑制,组织器官炎性损伤较前减轻,同时中性粒细胞吞噬作用增强促进病原体清除,从而缓解病情。
综上,在免疫抑制并PA肺炎时,机体处于免疫功能紊乱状态,以Th17细胞为主的促炎机制过度激活,释放大量炎性因子,致使器官组织损伤严重且病情不易控制,而经过免疫球蛋白治疗后,Th17细胞功能受到抑制,促炎因子分泌减少,炎症反应减弱,机体免疫功能紊乱状态有所缓解,病情在一定程度上得到减轻。故调节机体免疫功能紊乱状态,下调Th17细胞转录调节因子RORγt mRNA及效应分子IL-17的表达,有望成为此类疾病治疗中的重要方法之一。
[1] Isada C M.Safety issues in vasculitis:infections and immunizations in the immunosuppressed host[J].Cleve Clin J Med,2012,79(Suppl 3):S38-S45.
[2] Migiyama Y,Yanagihara K,Kaku N,et al.Pseudomonas aeruginosa bacteremia among immunocompetent and immunocompromised patients:Relation to initial antibiotic therapy and survival[J].Jpn J Infect Dis,2016,69(2):91-96.
[3] Williams B J,Dehnbostel J,Blackwell T S.Pseudomonas ae-ruginosa:host defence in lung diseases[J].Respirology,2010,15(7):1037-1056.
[4] Noack M,Miossec P.Th17 and regulatory T cell balance in autoimmune and inflammatory diseases[J].Autoimmun Rev,2014,13(6):668-677.
[5] Rutz S,Eidenschenk C,Kiefer J R,et al.Post-translational regulation of RORγt-A therapeutic target for the modulation of interleukin-17-mediated responses in autoimmune diseases[J].Cytokine Growth Factor Rev,2016,30:1-17.
[6] Tsai H C,Velichko S,Hung L Y,et al.IL-17 A and Th17 cells in lung inflammation:an update on the role of Th17 cell differentiation and IL-17R signaling in host defense against infection[J].Clin Dev Immunol,2013,2013:267971.
[7] Schwab I,Nimmerjahn F.Intravenous immunoglobulin therapy:how does IgG modulate the immune system?[J].Nat Rev Immunol,2013,13(3):176-189.
[8] Maddur M S,Vani J,Hegde P,et al.Inhibition of differentiation,amplification,and function of human Th17 cells by intravenous immunoglobulin[J].J Allergy Clin Immunol,2011,127(3):823-830.
[9] Chen T S,Yuan C C,Xing L H.Animal models ofPseudomonasaeruginosapneumonia[J].Int J Respir,2016.36(6):445-447.
[10] Su Z Q,Mo Z Z,Liao J B,et al.Usnic acid protects LPS-induced acute lung injury in mice through attenuating inflammatory responses and oxidative stress[J].Int Immunopharmacol,2014,22(2):371-378.
[11] Miossec P,Korn T,Kuchroo V K.Interleukin-17 and type 17 helper T cells[J].N Engl J Med,2009,361(9):888-898.
[12] Leonard W J,O’Shea J J.Jaks and STATs:biological implications[J].Annu Rev Immunol,1998,16:293-322.
[13] Ono M,Yaguchi H,Ohkura N,et al.Foxp3 controls regulatory T-cell function by interacting with AML1/Runx1[J].Nature,2007,446(7136):685-689.
[14] Liang S C,Long A J,Bennett F,et al.An IL-17F/A heterodimer protein is produced by mouse Th17 cells and induces airway neutrophil recruitment[J].J Immunol,2007,179(11):7791-7799.
[15] Weaver C T,Hatton R D,Mangan P R,et al.IL-17 family cytokines and the expanding diversity of effector T cell lineages[J].Annu Rev Immunol,2007,25:821-852.
[16] Gao J,Zhang L,Zhang X,et al.Levels of serum procalcitonin and C-reactive protein for evaluating pulmonary bacterial infection in patients with lupus erythematosus[J].J Huazhong Univ Sci Technolog Med Sci,2016,36(5):653-658.
[17] Wang Y,Jiang B,Guo Y,et al.Cross-protective mucosal immunity mediated by memory Th17 cells against Streptococcus pneumoniae lung infection[J].Mucosal Immunol,2017,10(1):250-259.
[18] Wang X,Chen X,Tang H,et al.Increased frequency of Th17 cells in children withMycoplasmapneumoniaepneumonia[J].J Clin Lab Anal,2016,30(6):1214-1219.
[19] Viaud S,Flament C,Zoubir M,et al.Cyclophosphamide induces differentiation of Th17 cells in cancer patients[J].Cancer Res,2011,71(3):661-665.
[20] Thomsen K,Christophersen L,Bjarnsholt T,et al.Anti-PseudomonasaeruginosaIgY antibodies induce specific bacterial aggregation and internalization in human polymorphonuclear neutrophils[J].Infect Immun,2015,83(7):2686-2693.
[21] Matsuo H,Itoh H,Kitamura N,et al.Intravenous immunoglobulin enhances the killing activity and autophagy of neutrophils isolated from immunocompromised patients against multidrug-resistant bacteria[J].Biochem Biophys Res Commun,2015,464(1):94-99.
(2016-11-14 收稿)
Changes of Th17 Cell Function and Effects of Human Immunoglobulin inImmunosuppressed Mice withPseudomonasaeruginosaPneumonia
Li Junlu,Xing Lihua△,Chen Tingsangetal
RespiratoryIntensiveCareUnit,TheFirstAffiliatedHospitalofZhengzhouUniversity,Zhengzhou450052,China
Objective To investigate the changes of Th17 cell function by testing the transcription regulative factor RORγt and the main effect factor cytokine interleukin-17(IL-17)of Th17 cells,and the effect of human immunoglobulin on Th17 cell function in immunosuppressed mice withPseudomonasaeruginose(PA)pneumonia.Methods Ninety BALB/c mice were divided into five groups randomly:control group,PA group,immunosuppressed group,immunosuppressed+PA group and human immunoglobulin group(named group A,B,C,D and E,n=18 each).All mice were sacrificed at 4,8 and 24 h after the establishment of the experimental models.Gross examination was performed and the lungs were excised for routine histological analysis.The expression level of RORγt mRNA was detected by reverse-transcriptase polymerase chain reaction(RT-PCR)and the concentration of IL-17 was measured in the peripheral blood by enzyme-linked immune sorbent assay(ELISA).Results Histological findings demonstrated that the lung tissues had no inflammatory changes in group A and C.But inflammatory changes,such as congestion of red blood cells in capillaries,edema,infiltration of many inflammatory cells and enlarged alveolar septum,occurred in group B,D,and E.Such changes were most significant at 8 h.The lung jury score was the highest in group D than in any other groups(P<0.01).The levels of RORγt mRNA in the lung were higher in group B,D and E than in group A and C(P<0.01),and they reached the peak at 4 h.The concentration of IL-17 in the peripheral blood was higher in group B,D and E than in group A and C(P<0.01),and it reached the peak at 8 h.All the observed indexes including the lung injury score,the level of RORγt mRNA and the concentration of IL-17 were much higher in group D than in group B(P<0.01),and they were even lower in group E than in group B(P<0.01).Conclusion The over-stimulation of Th17 cells derived from immunosupressed mice with PA pneumonia leads to excessive inflammatory responses and the organ and tissue injuries.Human immunoglobulin can inhibit the inflammatory reactions caused by Th17 cells,and therefore relieve the deterioration of the disease.
immunosuppression;Pseudomonasaeruginosepneumonia; Th17 cells; RORγt mRNA; interleukine-17; human immunoglobulin
*河南省科技厅基础与前沿技术研究资助项目(No.142300410327);河南省医学科技攻关计划资助项目(No.201403060)
R392.12
10.3870/j.issn.1672-0741.2017.02.014
李鋆璐,女,1992年生,硕士研究生,E-mail:lj1102957@sina.com
△通讯作者,Corresponding author,E-mail:xinglihua95088@163.com
