丝素蛋白/聚己内酯三维支架:生物学性能的初步探索*
2017-05-16李伟豪李阳洋董加洪许艳华
李伟豪, 李阳洋, 董加洪, 邓 婕, 许艳华, 李 松△
昆明医科大学 1口腔医学院 4附属口腔医院正畸科,昆明 6505002贵州省安顺市西秀区人民医院口腔科,安顺 5610003浙江省丽水市中心医院口腔科,丽水 323000
丝素蛋白/聚己内酯三维支架:生物学性能的初步探索*
李伟豪1, 李阳洋2, 董加洪3, 邓 婕4, 许艳华4, 李 松1△
昆明医科大学1口腔医学院4附属口腔医院正畸科,昆明 6505002贵州省安顺市西秀区人民医院口腔科,安顺 5610003浙江省丽水市中心医院口腔科,丽水 323000
目的 研究丝素蛋白/聚己内酯(silk fibroin,SF/polycaprolactone,PCL)制备的三维支架的生物相容性及降解性能。方法 利用高压静电纺丝技术将SF/PCL溶液制备成三维支架式的纤维膜性结构。通过添加下颌骨髁状突软骨细胞(mandibular condylar chondrocytes,MCCs)培养液与无细胞培养液,将SF/PCL三维支架膜分为实验组、对照组。通过观测SF/PCL三维支架膜上软骨细胞的生长情况探索其生物相容性;通过体外降解实验观测1、2、3、4、5、6、7 d SF/PCL三维支架的纤维膜剩余重量,分析其降解性能。结果 扫描电镜(scanning electron microscopy,SEM)下观察显示,12 h时髁突软骨细胞在纤维膜上正常贴壁生长,1 d后逐渐分泌大量胞外基质。体外降解实验结果显示,无细胞添加组的剩余重量随降解时间的变化小于细胞添加组(P<0.05)。结论 SF/PCL三维支架具有良好的生物相容性和可降解性,该研究为进一步研究生物支架修复软骨组织损伤或缺损提供了实验依据。
组织工程支架; 生物相容性; 体外降解; 静电纺丝
由于软骨细胞为终末分化细胞,软骨组织无血管、神经及淋巴供应等,损伤后难以靠自身细胞增殖进行修复[1],严重者可造成关节功能障碍。良好生物相容性及降解性的膜性材料不仅可用于引导性组织再生术(guided bone regeneration,GBR)[2]以防止骨粉或软骨样组织的吸收流失[3],还能作为生物支架应用于组织工程[4-6]。高压静电纺丝不同于传统化学纤维溶液干法纺丝和熔体纺丝,是制造纳米级可吸收纤维膜的理想方法之一。本实验采用高压静电纺丝技术将SF/PCL溶液制备形成膜性三维支架结构并进行体外细胞培养及降解实验,探索研究SF/PCL三维支架的生物相容性及降解性,为新型材料研发提供新的思路,为组织工程学移植修复软骨提供理论依据。
1 材料与方法
1.1 实验动物和试剂
新生24 h SD乳鼠20只,雌雄不限,无特定病原体(specific pathogen free,SPF)级,昆明医科大学实验动物中心提供,许可证号:SCXK(滇)2005-0008。胎牛血清(FBS,杭州四季青公司,中国),0.25%胰蛋白酶(Sigma公司,美国),胶原蛋白酶(Gibco公司,美国),0.01 mol/L磷酸盐缓冲溶液(PBS,pH7.2,福州迈新生物技术开发有限公司,中国),鼠/兔KIT-5020即用型快捷免疫组化MaxVisionTM试剂盒(福州迈新生物技术有限公司,中国),青霉素-链霉素溶液(100×,碧天云生物技术研究所,中国),DMEM培养液(赛默尔公司,中国),4%多聚甲醛固定液、各种浓度的乙醇、蚕丝(中国,成都)、碳酸钠(分析纯,中国天津)、溴化锂(化学纯,中国)、聚乙二醇(分子量20 000,瑞士)、聚己内酯(PCL,分子量70 000~90 000,Sigma公司)、六氟异丙醇(纯度99.5%,中国上海)、SF/PCL支架(由昆明医科大学口腔重点实验室提供)。
1.2 实验方法
1.2.1 丝素蛋白/聚己内酯三维支架制备 将SF/PCL按4∶1的比例调配高分子溶液在高压静电场中产生变形和射流运动,溶剂在运动过程中挥发,聚合物固化,从而获得超细纳米纤维。高压静电纺丝装置通过改变接收器的空间形态[7-8]、利用机械传动方式带动收集板处的电极运动以及引入气流装置的方法,使静电纺丝呈现三维形态的纤维支架结构,如图1所示。

A:高压静电纺丝原理示意图;B:高压静电纺丝纤维;C:丝素蛋白/聚己内酯三维支架高度;D:丝素蛋白/聚己内酯三维支架宽度图1 高压静电纺丝制备SF/PCL三维支架Fig.1 Preparation of the SF/PCL three-dimensional scaffold by high-voltage electrospinning
1.2.2 细胞培养 取新生24 h SD乳鼠下颌骨髁突顶的半透明软骨组织,以生理盐水反复漂洗后剪成约1 mm3大小碎块放入15 mL离心管,0.25%胰蛋白酶37℃恒温振荡消化30 min,含10% FBS的DMEM培养液终止消化,离心,弃上清,再以2% Ⅱ型胶原酶37℃恒温振荡消化1.5 h,200目滤网过滤并离心,将收集到的细胞吹打为单细胞悬液,细胞计数板计数,按4×104个/mL的密度接种于25 cm2细胞培养瓶中,补足DMEM培养液(含10% FBS、100 μg/mL青霉素、100 μg/mL链霉素),调定pH为7.4,置于37℃、5% CO2、饱和湿度恒温培养箱中培养。严格无菌操作,控制细胞培养质量,采用ELISA法为基础的支原体检测,使用针对支原体16S rRNA基因的带标记探针或抗体,Pharmacidal消毒液(BI,REF:IC-110100-L)250 mL进行处理,排除培养物中支原体感染。取部分细胞悬液备用,爬片及免疫组化染色进行细胞鉴定,其余原代细胞按1∶2传代。待细胞传3代,铺满培养瓶80%以上,弃培养瓶内旧培养液,向瓶内加入约2倍体积的0.25%胰蛋白酶液,消化1 min后加入10% FBS的DMEM培养液终止消化,吹打均匀,形成细胞悬液,细胞计数4×105个/L用于接种支架。
1.2.3 细胞鉴定 软骨细胞悬液均匀接种在载玻片上,待细胞铺满70%~80%时取下载玻片,75%乙醇固定,二步法通用型免疫组化染色进行软骨细胞鉴定。
1.2.4 生物支架的生物学性能及降解实验 将传3代的软骨细胞悬液以4×105个/mL的密度均匀接种在SF/PCL电纺支架底层纤维膜上,置于6孔板培养皿中培养,软骨细胞的贴壁时间一般在8~12 h,当培养至12 h、1、3、5、7 d时取下载玻片,乙醇梯度脱水法固定支架纤维膜及表面附着细胞进行固定和电镜扫描观察。参照《GB/T 16886.13-2001聚合物医疗器械的降解产物的定性与定量》部分设计试验方法,设软骨细胞添加组为实验组,对照组为添加细胞,各取SF/PCL纤维支架0.5 g,两组纤维支架浸入50 mL培养液作为降解液,时间点设置为1、2、3、4、5、6、7 d,各4个样品,共个56样品,10个6孔板。放入37 ℃烘箱开始体外降解实验,对材料湿重进行检测,到达时间后取出样品。对应样品数量取定性滤纸若干,并称重记录为m(滤纸重量)。将降解产物及降解液倒入滤纸并过滤,之后放入烘箱真空干燥至恒重,取出称量并记录为M(滤纸及降解产物重量),降解产物剩余重量W=M-m。
1.3 统计学处理
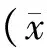
2 结果
2.1 形态学观察
倒置显微镜下可见髁突软骨细胞接种后由小球形渐变为多角形,软骨细胞Ⅱ型胶原免疫组化鉴定如图2所示,Ⅱ型胶原为软骨细胞主要表达的蛋白,免疫组化染色表现为胞质棕黄色,鉴定结果显示所取细胞为软骨细胞。
2.2 生物相容性
扫描电镜观测结果如图3所示,可见髁突软骨细胞贴壁粘附于SF/PCL三维支架的纤维膜上,细胞触角逐渐伸展。1 d时可见软骨细胞分泌少量的基质并相互连接,3 d时可见大量胞外基质。提示SF/PCL可供软骨细胞正常粘附生长,具有良好的生物相容性。

A:12 h MCCs在SF/PCL纤维上的粘附状态(SEM,×2 000);B:1 d MCCs开始相互连接(SEM,× 2 000);C:3 d MCCs分泌大量胞外基质(SEM,×2 000)图3 髁突软骨细胞在SF/PCL三维支架粘附生长Fig.3 The images of MCCs adhering to and growing on SF/PCL scaffolds
2.3 降解性
降解实验温度为37℃,pH为7.4,纤维剩余重量由0.5 g逐渐下降,如图4、表1所示。降解后细胞添加组的材料剩余重量在7 d内由0.5 g逐渐降解至(0.11±0.02)g,无细胞添加组降解后的剩余重量降为(0.10±0.02)g,剩余重量变化结果见表1。随培养时间延长,纤维束逐渐断裂崩解,无细胞添加组的剩余重量小于细胞添加组,Z=-2.371,P=0.018(双侧),可以认为两组纤维束降解的剩余重量变化差异有统计学意义,细胞添加组高于无细胞添加组。体外降解实验表明,SF/PCL静电纺丝纤维材料在体外培养实验中具可降解性,提示SF/PCL制备的三维支架具备在生物体内降解的可能。
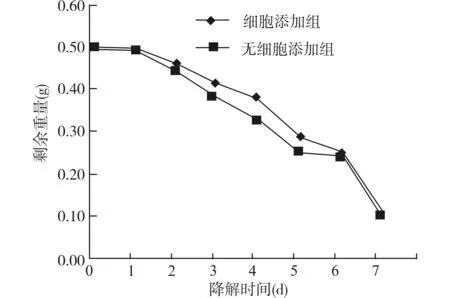
图4 降解实验纤维剩余重量的变化曲线Fig.4 Curves of the residual weight changes of the SF/PCL three-dimensional scaffolds in the degradation test

组别1d2d3d4d5d6d7d无细胞添加组050±001045±003038±012033±004025±002025±002010±001细胞添加组050±001046±002042±012038±002028±001025±002011±001
3 讨论
纳米纤维组织工程支架是目前研究的热点方向,其三维结构可为细胞生长、代谢和基质分泌提供良好的环境[9-10]。理想的组织工程用支架应满足:①仿生天然细胞外基质的结构和生物学功能,②有良好的生物相容性使得细胞可以粘附和增殖,③降解速率与组织再生的速率相匹配,④适当的机械性能,支撑细胞生长,⑤具有较好的显微结构,比如适合的孔尺寸、高孔隙率和相连的孔形态,⑥特定的三维外形,⑦高比表面积和合适的表面理化性质。目前,组织工程支架的制备方法主要包括:纤维粘结、溶剂浇铸/粒子沥滤、乳化/冻干、气体发泡、相分离、自组装、快速成型和静电纺丝。静电纺丝是一种电动力射流技术,到现在己经有70多年的历史。静电纺丝一词来源于英语“electrospinning”[11],国内学者一般简称为“静电纺”或者“电纺丝”。随着纳米加工技术的发展,生物材料可以制成纳米结构模拟机体组织层次结构。物理和化学信号能较好地评价支架材料的再生功效,特别是聚合物纳米纤维矩阵已成功再生多种单一的人体组织,如下肢皮肤、肌腱、韧带、骨骼等。复合支架纳米涂层已被制造出来并投入应用,然而复杂的再生组织、器官或器官系统仍然是一个重大挑战。通过纳米技术整合物理、化学和机械信号将有助于设计合成结构以实现特异性复杂生物组织的再生,也是将来纳米技术和组织工程技术结合发展的趋势[4]。
高压静电纺丝技术可获得纳米级的纤维束,丝素蛋白具有良好的生物相容性[12],是理想的纺丝纤维原料之一[13],但通过前期实验,本课题组发现高压电纺技术所得丝素蛋白静电纺丝纤维的可塑性差,难以形成稳定的三维结构。为解决纺丝纤维的三维支架结构的稳定性,本实验采用以丝素蛋白与聚己内酯按4∶1的浓度配比以增强其结构稳定性。聚己内酯(polycaprolactone,PCL)具有良好的热稳定性、力学性能、药物通过性和生物相容性[14],其降解产物对人体无毒。目前该材料已经获得美国FDA的批准,广泛应用于骨折固定材料、手术缝线、医用敷料、药物控释材料和组织工程支架材料等[15]。此外,本项实验还通过设计特定形态的动态接收器、匀速改变电纺装置电极方向以及预置内部支架的方法,使纺丝纤维束可呈一定规律、方向形成三维立体结构,即具有复杂拓扑结构排列的丝素蛋白/聚己内酯三维电纺纤维支架,从而解决了传统电纺纤维的无序性问题。
实验中通过扫描电镜观察发现软骨细胞贴壁于SF/PCL静电纺丝纤维上并正常粘附生长分泌胞外基质,这与Park等[16]结果相近,提示SF/PCL静电纺丝纤维形成的生物支架结构具有良好的生物相容性。随着培养时间的延长,实验组和对照组的纤维束逐渐分解,实验结果与Horan等[17]体外降解实验结果相近,剩余重量逐渐降低,细胞添加组的剩余重量较无细胞添加组的多且差异有统计学意义,提示可能由于细胞分泌了大量胞外基质,其主要成分为胶原纤维和蛋白形成的网状支架,促进细胞之间的联系和结构的稳定[18]。另一方面,由于三维支架的微孔隙有利于细胞的增殖和活性表达[19-21],进一步促进了胞外基质的分泌,延缓纤维束的降解分离过程。而通过实验观察,培养持续7 d以上,SF/PCL电纺纤维膜出现大面积崩解,剩余重量残留较少,部分纤维膜悬浮于培养液,分析原因可能由于水溶性的丝素蛋白在降解过程中非晶域的丝素蛋白纤维共价键和氢键相互作用,使其构象朝着更无序状态变化。发生水解时,会优先去除无序结构域并增加丝素蛋白纤维的β-折叠构象。当其化学结构中的酰胺基(-CONH2)转化为羧酸根(-COO-)和羧酸(-COOH)后,丝素蛋白失去共价相互作用,其聚合物便丧失了稳定性[22]。其他非水溶性的生物材料如蛛丝蛋白,性能稳定,不易降解,原因在于单晶结构具有稳定的热、化学性能,纤维材料表面会产生高浓度氧和水蒸气屏障以实现疏水性[23]。也有学者认为,是由于可吸收材料的可纺性差,纤维的机械强度过低,易导致生物降解速度过快[24]。本实验是对SF/PCL制备形成三维支架的生物学性能初探,解决了若采用丝素蛋白作为单一原料,在电纺过程中难构建三维结构的难点,同时,也改善了电纺纤维膜的降解性能。
综上所述,通过本实验观察,发现SF/PCL三维支架具有良好的生物相容性和可降解性,为今后深入研究SF/PCL三维支架在动物体内的相关实验奠定了基础,也为进一步探索支架修复软骨损伤的可行性及相关理论提供了依据。
(致谢:感谢原昆明医科大学附属口腔医院修复科李罡副教授的实验组提供相关的电纺设备和材料;感谢云南省研究生学术新人奖资助。)
[1] Duke P J,Daane E L,Montufar-Solis D.Studies of chondrogenesis in rotating systems[J].J Cell Biochem,1993,51(3):274-282.
[2] Lopez M A,Andreasi Bassi M,Confalone L,et al.Clinical outcome of 215 transmucosal implants with a conical connection:a retrospective study after 5-year follow-up[J].J Biol Regul Homeost Agents,2016,30(2 Suppl 1):55-60.
[3] Sheikh Z,Najeeb S,Khurshid Z,et al.Biodegradable materials for bone repair and tissue engineering applications[J].Materials,2015,8(9):5744-5794.
[4] Deng M,James R,Laurencin C T,et al.Nanostructured polymeric scaffolds for orthopaedic regenerative engineering[J].IEEE Trans Nanobioscience,2012,11(1):3-14.
[5] Chen W,Chen S,Morsi Y,et al.superabsorbent 3D scaffold based on electrospun nanofibers for cartilage tissue engineering[J].ACS Appl Mater Interfaces,2016,8(37):24415-24425.
[6] Mandal B B,Grinberg A,Gil E S,et al.High-strength silk protein scaffolds for bone repair[J].Proc Natl Acad Sci U S A,2012,109(20):7699-7704.
[7] Long Y Z,Yu M,Sun B,et al.Recent advances in large-scale assembly of semiconducting inorganic nanowires and nanofibers for electronics,sensors and photovoltaics[J].Chem Soc Rev,2012,41(12):4560-4580.
[8] Jha B S,Colello R J,Bowman J R,et al.Two pole air gap electrospinning:Fabrication of highly aligned,three-dimensional scaffolds for nerve reconstruction[J].Acta Biomater,2011,7(1):203-215.
[9] Langer R,Vacanti J P.Tissue engineering[J].Science,1993,260(5110):920-926.
[10] Stock U A,Vacanti J P.Tissue engineering:current state and prospects[J].Annu Rev Med,2001,52:443-451.
[11] Bhardwaj N,Kundu S C.Electrospinning:a fascinating fiber fabrication technique[J].Biotechnol Adv,2010,28(3):325-347.
[12] Altman G H,Diaz F,Jakuba C,et al.Silk-based biomaterials[J].Biomaterials,2003,24(3):401-416.
[13] Yang Y,Chen X,Ding F,et al.Biocompatibility evaluation of silk broin with peripheral nerve tissues and cellsinvitro[J].Biomaterials,2007,28(9):1643-1652.
[14] Sun H,Mei L,Song C,et al.Theinvivodegradation,absorption and excretion of PCL-based implant[J].Biomaterials,2005,27(9):1735-1740.
[15] Kumari A,Yadav S K,Yadav S C,et al.Biodegradable polymeric nanoparticles based drug delivery systems[J].Colloids Surf B Biointerfaces,2010,75(1):1-18.
[16] Park K,Ju Y M,Son J S,et al.Surface modification of biodegradable electrospun nanofiber scaffolds and their interaction with fibroblasts[J].J Biomate Sci Polym Ed,2007,18(4):369-382.
[17] Horan R L,Antle K,Collette A L,et al.Invitrodegradation of silk fibroin[J].Biomaterials,2005,26(17):3385-3393.
[18] Davidenko N,Schuster C F,Bax D V,et al.Evaluation of cell binding to collagen and gelatin:a study of the effect of 2D and 3D architecture and surface chemistry[J].J Mater Sci Mater Med,2016,27(10):148.
[19] Hejazi F,Mirzadeh H.Novel 3D scaffold with enhanced physical and cell response properties for bone tissue regeneration,fabricated by patterned electrospinning/electrospraying[J].J Mater Sci Mater Med,2016,27(9):143.
[20] Nowicki M A,Castro N J,Plesniak M W,et al.3D printing of novel osteochondral scaffolds with graded microstructure[J].Nanotechnology,2016,27(41):414001.
[21] Davidenko N,Schuster C F,Bax D V,et al.Evaluation of cell binding to collagen and gelatin:a study of the effect of 2D and 3D architecture and surface chemistry[J].J Mater Sci Mater Med,2016,27(10):148.
[22] Pavoni E,Tozzi S,Tsukada M,et al.Structural study on methacrylamide-grafted Tussah silk fibroin fibres[J].Int J Biol Macromol,2016,88:196-205.
[23] Doblhofer E,Schmid J,Riess M,et al.structural insights into water-based spider silk protein-nanoclay composites with excellent gas and water vapor barrier properties[J].ACS Appl Mater Interfaces,2016,8(38):25535-25543.
[24] Yi F,Guo Z X,Zhang L X,et al.Soluble eggshell membrane protein:preparation,characterization and biocompatibility[J].Biomat,2004,25(19):4560-4591.
(2016-10-12 收稿)
Silk Fibroin/Polycaprolactone 3D Scaffold:A Preliminary Study on Its Biological Properties
Li Weihao1,Li Yangyang2,Dong Jiahong3etal
1SchoolofStomatology,KunmingMedicalUniversity,Kunming650500,China2DepartmentofStomatology,XixiuPeople’sHospital,Anshun561000,China3DepartmentofStomatology,LishuiMunicipalCentralHospital,Lishui323000,China
Objective To examine the biocompatibility and degradation of three-dimensional scaffolds prepared by silk fibroin(SF)/polycaprolactone(PCL).Methods High-voltage electrospinning was used to prepare SF/PCL solution into a three-dimensional membranous structure.The SF/PCL three-dimensional scaffolds were divided into the experimental group and control group by adding the culture medium with mandibular condylar chondrocytes(MCCs)and cell-free culture medium,respectively.The growth of MCCs was observed on the membrane to determine the biocompatibility of SF/PCL three-dimensional scaffolds.Invitrodegradation tests were utilized to measure the residual weight of the fibrous membrane at 1,2,3,4,5,6 and 7 d to analyze the degradation of the SF/PCL three-dimensional scaffolds.Results Scanning electron microscopy(SEM)showed that adhering to the SF/PCL scaffold,MCCs grew normally at 12 h,and they began to secret a large amount of extracellular matrix 1 d later.Degradation experiments indicated that the residual weight changed less in non-cell group than in cell-added group(P<0.05).Conclusion The SF/PCL three-dimensional scaffold has excellent biocompatibility and biodegradability,which provides experimental basis for further study on repairing of cartilage injury or defect with the biological scaffold.
tissue engineering scaffolds; biological compatibility;invitrodegradation; electrospinning
*国家自然科学基金资助项目(No.81360163);浙江省医药卫生科技项目(No.2016KYB338)
R783.1
10.3870/j.issn.1672-0741.2017.02.010
李伟豪,男,1988年生,医学硕士,E-mail:121233015@qq.com
△通讯作者,Corresponding author,E-mail:lisong59@sohu.com
