曲古霉素A促进ICR小鼠骨髓间充质干细胞体外分化为肝细胞*
2017-05-16董学君
杨 超, 李 卓△, 康 炜, 田 宇, 董学君
1西安医学院第一附属医院检验科,西安 7100772浙江省绍兴市人民医院临床检验中心,绍兴 312000
曲古霉素A促进ICR小鼠骨髓间充质干细胞体外分化为肝细胞*
杨 超1, 李 卓1△, 康 炜1, 田 宇1, 董学君2
1西安医学院第一附属医院检验科,西安 7100772浙江省绍兴市人民医院临床检验中心,绍兴 312000
目的 探讨曲古霉素A(trichostatin A,TSA)在ICR(Institute of Cancer Research,ICR)小鼠骨髓间充质干细胞(bone marrow mesenchymal stem cells,BM-MSCs)向肝细胞体外分化中的作用。方法 分离培养正常小鼠mBM-MSCs,流式细胞仪检测mBM-MSCs表面抗原,实时荧光定量PCR检测肝细胞特异性基因甲胎蛋白(-fetoprotein,AFP)和白蛋白(albumin,ALB),生化分析仪测定尿素分泌量,高碘酸-希夫反应测定肝细胞合成与储存糖原能力;检测TSA处理前后mBM-MSCs增殖、细胞周期和染色质结构的变化,Western blot测定mBM-MSCs组蛋白3(Histone 3,H3)和组蛋白4(Histone 4,H4)乙酰化程度改变。结果 分离所得mBM-MSCs细胞表面CD44、CD73、SCA-1呈阳性反应,部分细胞CD90、CD105、STRO-1呈阳性反应,CD11b和CD45呈阴性反应;与未添加TSA组比较,诱导7 d后,TSA处理组中AFP明显增高(P<0.05),ALB和尿素分泌量开始增多,继续诱导14和21 d后,TSA处理组中ALB分别为(0.52±0.08)和(0.92±0.08),呈明显升高(均P<0.05),尿素分泌量分别为(0.23±0.02)mmol/L和(0.36±0.03)mmol/L,也呈明显升高(均P<0.05),且细胞储存的糖原更加丰富,而AFP水平逐渐下降;经TSA处理后,TSA浓度越大对mBM-MSCs增殖的抑制效应越强,细胞处于G0/G1期的比例明显增加,细胞核中异染色质的状态由浓缩、密集变为散状、疏松;Western blot结果显示2.0 mmol/L TSA处理后mBM-MSCs组蛋白H3和H4的乙酰化水平显著增加(均P<0.05)。结论 TSA能够阻断mBM-MSCs组蛋白H3和H4的去乙酰化,打破组蛋白乙酰化的平衡状态,解除转录抑制,从而促进转录,提高其向肝细胞分化的效率。
曲古霉素A; 骨髓间充质干细胞; 分化; 肝细胞; 乙酰化
骨髓间充质干细胞(bone marrow mesenchymal stem cells,BM-MSCs)是一类具有高度可塑性和多向分化潜能的成体干细胞[1-4]。近年来,学者们采用多种动物模型和不同分化诱导技术,探讨分化的可能机制过程,证实BM-MSCs体外可以分化为肝样细胞[5-8],但分化诱导效率低,不足以应用到临床。陈烨等[9-10]曾引入组蛋白去乙酰化酶抑制剂丙戊酸诱导骨髓间充质干细胞分化肝细胞,发现可提高其分化效率。而对于另一种去乙酰化酶抑制剂曲古霉素A(Trichostatin A,TSA)引起的组蛋白乙酰化修饰在骨髓间充质干细胞分化肝细胞中的作用机制,报道甚少。本实验研究链霉菌的代谢产物TSA在适宜浓度下,联合成纤维细胞生长因子(FGF4)和肝细胞生长因子(HGF)等诱导mBM-MSCs,使其组蛋白发生乙酰化改变,探讨其变化对分化为肝样细胞的影响。
1 材料与方法
1.1 实验动物、主要试剂及仪器
6~8周龄ICR小鼠,体重(20±2)g,购于西安交通大学医学院实验动物中心。TSA购自上海前尘生物有限公司;抗体购于美国Santa Cruz公司和Abcam公司;SYBR©Premix Ex TaqTMkit试剂盒购于日本TaKaRa公司。流式细胞仪FC500 MCL/MPL、生化分析仪AU5800购于美国Beckman公司。
1.2 ICR小鼠mBM-MSCs的分离、培养和扩增
采取颈椎脱臼法处死ICR小鼠,无菌条件下即刻分离出股骨和胫骨,并剔除脂肪和肌肉。用IMDM培养液冲洗出骨髓腔内骨髓,吹打成悬液,离心收集细胞,用含有10%胎牛血清、100 U/mL青霉素和100 mg/mL链霉素的IMDM培养液重悬细胞,按2×106/mL密度接种,37℃、5% CO2培养箱培养。48 h后倒去培养液,PBS冲洗,弃去未贴壁细胞,再加入新鲜培养液,当培养的细胞覆盖瓶底约90%时,0.25%胰酶消化,有限稀释法接种在96孔板中即为P1代,每3~4天更换培养液,收集生长良好的细胞进行克隆、传代和扩增。
1.3 ICR小鼠mBM-MSCs的免疫表型鉴定
胰酶消化收集mBM-MSCs,室温离心5 min,弃上清;血细胞计数器计数细胞,PBS稀释成5×105/mL浓度;取(1~2)×105个细胞,加入一抗,暗室温孵育20 min;PBS重悬后加入二抗,暗室温孵育40 min;再次PBS冲洗,离心收集细胞;最后用含有0.5%牛血清白蛋白(BSA)的PBS重悬细胞,于流式细胞仪检测。采集1×104以上个细胞样本后,相应软件分析结果并作图。
1.4 TSA预处理mBM-MSCs诱导体系的建立
选取生长良好的P3代mBM-MSCs,采取分步法诱导(图1),分3组,①TSA处理组(TSA+):在诱导开始的前3 d,用不同浓度的TSA预处理细胞,挑选最适宜的TSA浓度值,之后加入含有10 ng/mL FGF4的IMDM培养液诱导3 d,再更换含20 ng/mL HGF的培养液诱导3 d,最后更换含20 ng/mL HGF、10 ng/mL抑瘤素M(OSM)和20 μg/mL地塞米松(Dex)的混合培养液,置37℃,5% CO2培养箱培养,每3天换1次液,分别在诱导的第7、14和21天时在相差显微镜下观察形态变化,同时检测分化能力;②未添加TSA组(TSA-):直接加入含细胞因子的IMDM培养液诱导培养;③ MSC对照组:不添加TSA和细胞因子,仅仅用IMDM培养液培养mBM-MSCs。
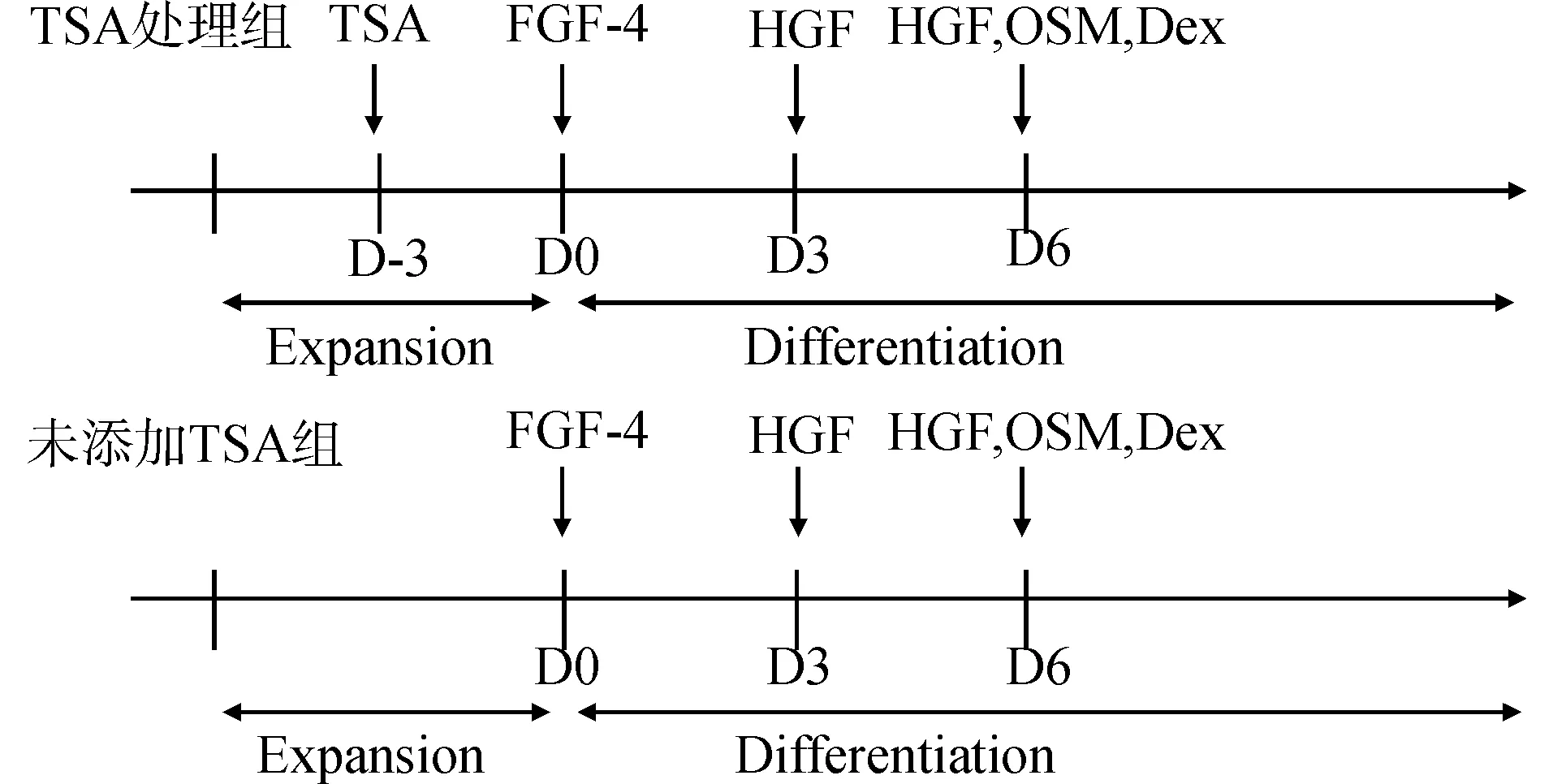
图1 分步法诱导体系Fig.1 Step-wise induction system
1.5 肝样细胞分化的鉴定
1.5.1 形态学观察 在诱导分化的第7天和第21天,相差显微镜下观察细胞形态变化并拍照记录,比较细胞形态上差别。
1.5.2 肝细胞特异性基因的检测 分别选取诱导分化第7、14和21天的细胞,采用Real-time PCR检测肝细胞特异性基因甲胎蛋白(AFP)和白蛋白(ALB):选用SYBR©Premix Ex TaqTMkit试剂盒,在罗氏Lighrtcycler1.5仪上进行;引物序列见表1。所有反应体系均为10 μL,以-actin作为内参基因,实验步骤如下:①两步法循环40次,95℃ 30 s,60℃ 20 s;②Melting curve分析,95℃ 5 s,65℃ 15 s,95℃ 15 s;③冷却,40℃ 30 s;每个样品cDNA用内参基因进行均一化。

表1 PCR扩增引物
1.5.3 肝细胞合成糖原能力的测定 选取诱导21 d的细胞,撤去诱导液,用PBS冲洗,95%乙醇固定细胞10 min,蒸馏水冲洗,再加入1%过碘酸水溶液作用15 min,蒸馏水再次冲洗,加入希夫(Schiff)试剂作用30 min,不间断摇晃,亚硫酸水洗3遍,再用蒸馏水冲洗,相差显微镜下镜检、拍照。
1.5.4 肝细胞分泌尿素能力的检测 选取不同诱导时间点(7、14和21 d)的细胞,撤去诱导液,用PBS冲洗,加入含有5 mmol/L氯化铵(NH4Cl)的IMDM培养液37°C孵育24 h,收集培养液,离心,取上清,生化分析仪AU5800测定尿素含量。
1.6 TSA促进mBM-MSCs分化肝样细胞的机制研究
1.6.1 不同TSA浓度对mBM-MSCs增殖的影响 选取生长旺盛的mBM-MSCs,在培养液中添加不同浓度的TSA,处理3 d,消化收集细胞,用改良牛鲍计数板计数细胞。
1.6.2 TSA处理后细胞周期分析 诱导后细胞消化、收集,2 000 r/min离心10 min,弃上清,洗涤,加入预冷的70%乙醇,4℃固定1~2 h,离心弃去固定液,加入3 mL PBS重悬细胞,离心弃掉PBS,此过程重复1次,用PBS配制1 mL终浓度为100 μg/mL的PI染液染色,4℃避光30 min,400目筛网过滤1次,上机分析(激发光波长488 nm,发射光波长>630 nm)。
1.6.3 TSA处理后染色质变化 取正常培养的mBM-MSCs和TSA处理3 d后的细胞,2.5%戊二醛固定细胞2 h,1% OSO4固定1 h后,用电镜超薄切片技术处理,Philips TECNAL-10电镜观察。
1.6.4 Western blot分析 分离组蛋白,将经胰酶消化收集到的细胞用PBS洗涤2次,用TEB缓冲液(按106/mL密度)悬浮细胞,将溶解的细胞置冰浴10 min,轻轻晃动;4℃离心10 min,弃上清,用TEB洗涤细胞,加0.2 mol/L HCl(按4×106密度)裂解细胞,4℃过夜,次日4℃离心10 min,取上清液,15% SDS-PAGE分离蛋白,电转目的条带至去离子水润湿的硝酸纤维素(NC)膜上,洗去电转缓冲液,用丽春红染色10 s,用含20% BSA的PBST封闭膜,4℃过夜,弃去封闭液,分别按1:1 000和1:8 000稀释度加入抗H3和H4抗体,4℃过夜,用PBST清洗一抗,然后按1:3 000稀释度加二抗孵育液,PBST洗去二抗,NC膜上滴加500 μL发光液,X线夹内曝光20 s,经显影、定影、清洗后观察。
1.7 统计学处理
2 结果
2.1 ICR小鼠mBM-MSCs免疫表型的检测
流式细胞技术检测(图2)显示:分离出的成纤维样细胞100%可表达CD44、CD73、SCA-1等3种表面分子标记,部分表达CD90、CD105、STRO-1等3种表面分子标记,不表达CD11b和CD45。
2.2 TSA能够提高mBM-MSCs向肝细胞分化
2.2.1 TSA处理前后细胞形态学变化 TSA-组诱导7 d后绝大部分细胞仍呈现成纤维样形态(图3A),TSA+组开始出现上皮样的肝样细胞(图3B);继续诱导21 d后,TSA-组细胞形态变化不是很明显(图3C),TSA+则分化得到胞核清晰,胞质颗粒丰富,更均一典型的上皮样细胞群体(图3D)。
2.2.2 TSA处理前后肝细胞分化特异性基因表达 结果如图4所示:TSA+和TSA-组均可测到特异性基因AFP和ALB的表达,但2组表达量有差异。诱导7 d后,TSA+组中AFP表达水平为(0.53±0.05),高于TSA-组(P<0.05)。继续诱导14 d和21 d后,TSA+组AFP mRNA水平逐渐下降(图4A);而其成熟肝细胞标志基因ALB mRNA表达量在14、21 d分别为(0.52±0.08)、(0.92±0.08),明显高于TSA-组(均P<0.05)(图4B)。

图2 mBM-MSCs表面标志物的检测Fig.2 Detection of mBM-MSCs surface markers
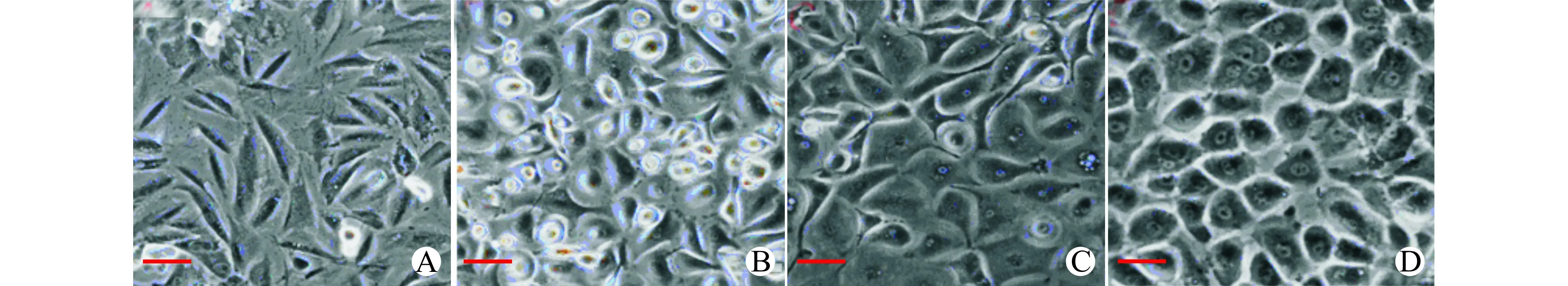
A、B:培养7 d;C、D:培养21 d;A,C:TSA-组;B,D:TSA+组;标尺50μm图3 细胞形态学变化Fig.3 Morphological changes of the cells

A:AFP检测结果分析;B:ALB检测结果分析;与TSA-组比较,*P<0.05图4 肝细胞分化特异性基因检测Fig.4 Detection of hepatocyte-specific genes
2.2.3 肝样细胞合成糖原和分泌尿素量检测 与形态学水平和基因水平结果相对应,经诱导后TSA+组细胞可以储存更加丰富的糖原(图5A、5B)。与TSA-组比较,TSA+组在诱导7 d后,其尿素分泌量开始增多,至14和21 d后,其分泌量分别达(0.23±0.02)mmol/L和(0.36±0.03)mmol/L,较TSA-组明显增高(均P<0.05)(图5C)。

A,B:高碘酸-希夫试剂糖原染色,A:TSA-组;B:TSA+组;标尺20 μm;C:尿素合成分析;与TSA-组比较,*P<0.05图5 糖原合成和尿素分泌量检测Fig.5 Detection of the glycogen synthesis and urea secretion
2.3 TSA处理对mBM-MSCs体外生长和细胞周期变化的影响
不同浓度TSA对细胞体外生长的影响,结果显示随着TSA浓度增加,对mBM-MSCs增殖的抑制逐渐增加(图6A),而且当TSA浓度超过4 mmol/L,绝大部分的细胞死亡,离开培养皿底部。因此,本实验选取2.0 mmol/L TSA预处理mBM-MSCs。细胞周期变化分析显示:经2.0 mmol/L TSA处理后的细胞周期G0/G1区域前没有明显的亚G0/G1峰(图6B),说明此浓度不会引起mBM-MSCs的凋亡,且处于G0/G1期的细胞数明显增加,而反映DNA合成和细胞分裂的S/G2/M期的细胞比例下降(图6B、C)。
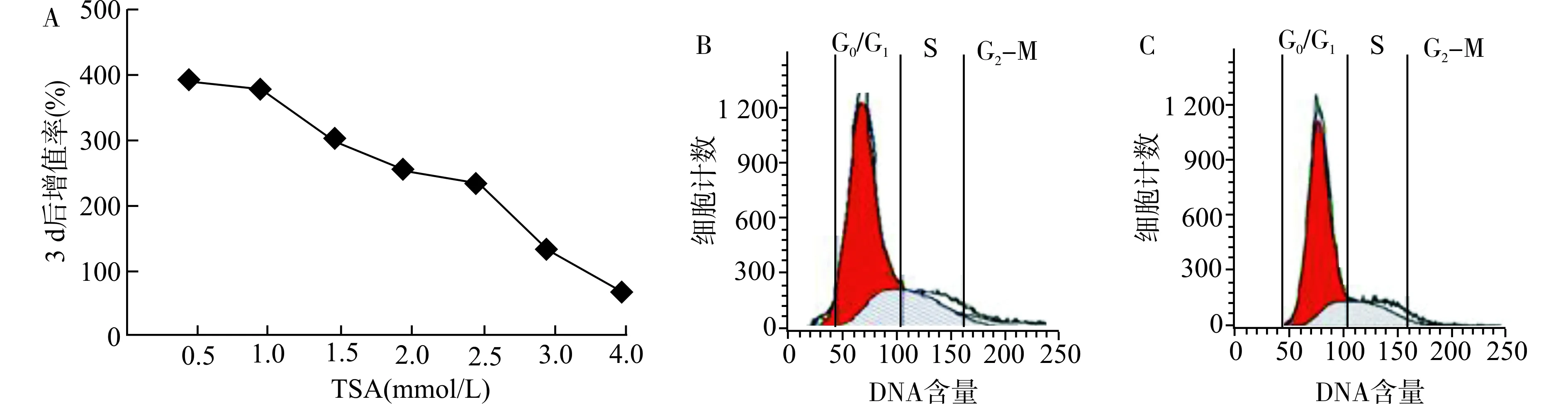
A:不同浓度TSA处理mBM-MSCs的生长状况;B,C:mBM-MSCs的细胞周期分析,B:TSA+组;C:TSA-组图6 TSA处理对mBM-MSCs体外生长和细胞周期变化的影响Fig.6 Effects of the TSA treatment on the growth and cell cycle of mBM-MSCs in vitro
2.4 TSA处理对mBM-MSCs染色质结构的影响
如图7A示,在正常的mBM-MSCs细胞核中可以观察到浓缩的异染色质和密集的核仁;而在TSA处理后mBM-MSCs细胞核中异染色质呈现均匀的散状、疏松状态(图7B)。
2.5 TSA处理对mBM-MSCs组蛋白乙酰化水平的影响
Western blot检测结果显示:2.0 mmol/L的TSA处理后,mBM-MSCs组蛋白H3和H4的杂交信号明显增强,表明H3和H4的乙酰化水平显著增加(图8A)。电泳条带吸光度定量分析示:与未添加TSA组H3(0.78±0.04)和H4(0.45±0.05)比较,2.0 mmol/L的TSA处理组中H3(1.46±0.06)和H4(1.50±0.08)的乙酰化水平明显增加(均P<0.05,图8B)。
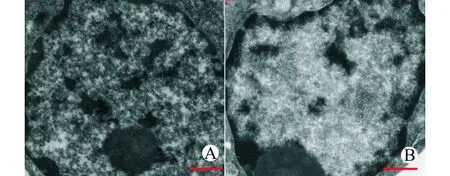
A:TSA-组;B:TSA+组;标尺1 μm图7 mBM-MSCs染色质结构变化Fig.7 Changes of the chromatin structure of mBM-MSCs
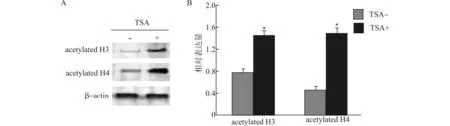
acetylated H3:乙酰化组蛋白3;acetylated H4:乙酰化组蛋白4;与TSA-组比较,*P<0.05图8 mBM-MSCs组蛋白H3和H4乙酰化水平变化Fig.8 Changes of H3 and H4 acetylation levels in mBM-MSCs
3 讨论
研究发现,组蛋白乙酰化和去乙酰化是一类重要的表观遗传修饰,也是最早发现的与转录有关的组蛋白修饰方式之一,在细胞增殖、分化以及凋亡中具有重要功能[11-16]。组蛋白末端的乙酰化状态在组蛋白乙酰转移酶(Histone acetyltransferases,HATs)和组蛋白去乙酰酶(Histone deacetylases,HDACs)的协同作用下保持着动态平衡。这种动态平衡控制着核小体核心组蛋白的乙酰化水平,影响相关基因的转录活性。
本实验选取的去乙酰化酶抑制剂(histone deacetylases inhibitors,HDACi)TSA是一类在转录水平调控基因表达的化合物,通过诱导蛋白过乙酰化可以引起染色体重建、细胞周期停滞、诱导细胞分化和凋亡以及调节转录因子活化和抑制等一系列生物学效应。根据2006年国际细胞治疗协会(ISCT)制定的间充质干细胞的最低鉴定标准[17],其中一条即是细胞表面可表达一些特异性抗原,如CD73等(流式细胞仪检测≥95%),因此本实验采用流式细胞术测定分离细胞的表面分子,鉴定间充质干细胞。在诱导前用合适浓度TSA预处理mBM-MSCs后,结果显示TSA+组细胞的分化效率显著高于TSA-组,肝样细胞的形态更加典型,肝细胞特异性基因表达更加丰富;从ALB表达和尿素合成的结果可知,诱导21 d时TSA+组分化肝细胞的效率可提高50%~62%;以肝细胞早期分化基因AFP的表达为指标,显示TSA+组细胞的分化时间比TSA-组提前约7 d,表明TSA能够显著促进mBM-MSCs向肝细胞的体外跨越分化效率,缩短细胞分化所需的时间;TSA预处理使得mBM-MSCs染色质结构疏松,G0/G1期细胞增加,说明TSA处理可以调控mBM-MSCs的细胞周期,抑制G1期向S期的转换,从而更利于细胞分化;组蛋白H3、H4乙酰化程度增加,表明TSA引起的表观遗传修饰改变了细胞内部结构,抑制基因的转录,使基因的分化趋势增强。
HDACi TSA促进BM-MSCs跨胚层分化为肝细胞的机制可能是通过细胞内信号传导通路如:MAPK、PI3K/AKT、Wnt或Notch等的活化,导致胞内下游某些蛋白分子的激活,影响胞核内某些转录因子的活性,致使染色体上组蛋白呈过乙酰化,进而提高了BM-MSCs分化肝细胞的效率,这种促进干细胞分化的可能机制还需进一步的研究,如具体是哪条通路、哪个蛋白分子起的作用,有待于深入的实验研究证实。
本研究分别从TSA处理mBM-MSCs后诱导分化肝细胞特异性标志物水平变化和细胞本身染色质组蛋白等结构的变化两方面阐述了TSA对mBM-MSCs诱导分化肝细胞的影响,加之BM-MSCs分化肝细胞涉及跨胚层分化是发育生物学研究的一个新命题,同时TSA是一种表观遗传修饰剂,因此,本实验不仅为将来MSCs在肝组织工程、细胞移植治疗等临床应用打下基础,而且也为肝细胞分化发育分子机制(包括表观遗传机制等)的研究提供了新的研究模型。
[1] Jiang Y,Jahagirdar B N,Reinhardt R L,et al.Pluripotency of mesenchymal stem cells derived from adult marrow[J].Nature,2002,418(6893):41-49.
[2] Marquez-Curtis L A,Janowska-Wieczorek A,McGann L E,et al.Mesenchymal stromal cells derived from various tissues:Biological,clinical and cryopreservation aspects[J].Cryobiology,2015,71(2):181-197.
[3] Siegel G,Kluba T,Hermanutz-Klein U,et al.Phenotype,donor age and gender affect function of human bone marrow-derived mesenchymal stromal cells[J].BMC Med,2013,11(1):146.
[4] Zhironkina O A,Shipounova I N,Bigildeev A E,et al.Proliferative potential of multipotent mesenchymal stromal cells from human bone marrow[J].Bull Exp Biol Med,2012,152(4):543-547.
[5] Chen Y,Dong X J,Zhang G R,et al.Transdifferentiation of mouse BM cells into hepatocyte-like cells[J].Cytotherapy,2006,8(4):381-389.
[6] Dong X J,Zhang H,Pan R L,et al.Identification of cytokines involved in hepatic differentiation of mBM-MSCs under liver-injury conditions[J].World J Gastroenterol,2010,16(16):3267-3278.
[7] Lu T,Yang C,Sun H,et al.FGF4 and HGF promote differentiation of mouse bone marrow mesenchymal stem cells into hepatocytes via the MAPK pathway[J].Genet Mol Res.2014,13(1):415-424.
[8] Ayatollahi M,Soleimani M,Tabei S Z,et al.Hepatogenic differentiation of mesenchymal stem cells induced by insulin like growth factor-I[J].World J Stem Cells,2011,3(12):113-121.
[9] Chen Y,Pan R L,Zhang X L,et al.Induction of hepatic differentiation of mouse bone marrow stromal stem cells by the histone deacetylase inhibitor VPA[J].J Cell Mol Med,2009,13(8B):2582-2592.
[10] Dong X,Pan R,Zhang H,et al.Modification of histone acetylation facilitates hepatic differentiation of human bone marrow mesenchymal stem cells[J].PLoS One,2013,8(5):e63405.
[11] Lehrmann H,Pritchard L L,Harel-Bellan A.Histone acetyltransferases and deacetylases in the control of cell proliferation and differentiation[J].Adv Cancer Res,2002,86:41-65.
[12] Dahlin J L,Chen X,Walters M A,et al.Histone-modifying enzymes,histone modifications and histone chaperones in nucleosome assembly:Lessons learned from Rtt109 histone acetyltransferases[J].Crit Rev Biochem Mol Biol,2015,50(1):31-53.
[13] Zammataro M,Sortino M A,Parenti C,et al.HDAC and HAT inhibitors differently affect analgesia mediated by group II metabotropic glutamate receptors[J].Mol Pain,2014,10(1):68.
[14] Bassett S A,Barnett M P.The role of dietary histone deacetylases(HDACs)inhibitors in health and disease[J].Nutrients,2014,6(10):4273-4301.
[15] Ho A S,Turcan S,Chan T A.Epigenetic therapy:use of agents targeting deacetylation and methylation in cancer management[J].Onco Targets Ther,2013,6:223-232.
[16] Bhanu N V,Sidoli S,Garcia B A.Histone modification profiling reveals differential signatures associated with human embryonic stem cell self-renewal and differentiation[J].Proteomics,2016,16(3):448-458.
[17] Dominici M,Le Blanc K,Mueller I,et al.Minimal criteria for defining multipotent mesenchymal stromal cells.The International Society for Cellular Therapy position statement[J].Cytotherapy,2006,8(4):315-317.
(2016-11-09 收稿)
Trichostatin A Promotes the Differentiation of Bone Marrow Mesenchymal StemCells to Hepatocytes in ICR MiceInVitro
Yang Chao,Li Zhuo△,Kang Weietal
DepartmentofLaboratoryMedicine,TheFirstAffiliatedHospitalofXi’anMedicalUniversity,Xi’an710077,China
Objective To investigate the role of the histone deacetylase inhibitor trichostatin A(TSA)in theinvitrodifferentiation of bone marrow mesenchymal stem cells(BM-MSCs)to hepatocytes in ICR mice.Methods The normal BM-MSCs from ICR mice were isolated and cultured.The surface antigens of mBM-MSCs were analyzed by flow cytometry.Hepatocyte-specific genes-fetoprotein(AFP)and albumin(ALB)were detected by real-time fluorescence quantitative PCR,the urea secretion by the biochemical analyzer AU5800 and the capacity of glycogen synthesis and storage of hepatocytes by periodic acid-Schiff reaction.The changes of cell proliferation,cell cycle and chromatin structure of mBM-MSCs were detected before and after the TSA treatment.The changes of histon3(H3) and histon4(H4) acetylation were measured in mBM-MSCs by Western blotting.Results Flow cytometry showed that CD44,CD73 and SCA-1 were positive on the surface of mBM-MSCs.Part of the cells expressed CD90,CD105 and STRO-1,and CD11b and CD45 were negative on some cells.After induction for 7 days by TSA,the AFP value was (0.53±0.05) in TSA-treated group,significantly higher than that in TSA-untreated group(P<0.05).ALB and urea secretion began to increase 7 days after the TSA treatment.The ALB expression was (0.52±0.08) and (0.92±0.08),and the urea secretion was (0.23±0.02)mmol/L and (0.36±0.03)mmol/L,respectively,at 14 and 21 days in TSA-treated group,which were significantly elevated as compared with those in TSA-untreated group(P<0.05).Moreover,the glycogen storage of the cells was increased,but AFP levels gradually declined.After the TSA treatment,the greater the concentration of TSA was,the stronger inhibitory effect on mBM-MSCs proliferation.And the ratio of cells at G0/G1phase was significantly increased.The condensed nuclear heterochromatin became diffuse and loose.Western blotting showed that the levels of H3 and H4 acetylation were significantly increased in mBM-MSCs after 2.0 mmol/L TSA treatment,(P<0.05).Conclusion TSA can increase the differentiation efficacy of mBM-MSCs to hepatocytes by blocking H3 and H4 deacetylation,breaking the equilibrium of histone acetylation,reversing transcription inhibition and therefore promoting the transcription.
trichostatin A; bone marrow mesenchymal stem cells; differentiation; hepatocyte; acetylation
*陕西省教育厅专项科研计划项目(No.12JK0764);西安医学院第一附属医院科研基金资助项目(No.XYFY11-08)
R329.28
10.3870/j.issn.1672-0741.2017.02.005
杨 超,男,1985年生,医学硕士,主管检验师,E-mail:superyang0210@163.com
△通讯作者,Corresponding author,E-mail:lizhuo721@163.com
