昆明市2014—2015年轮状病毒分子流行病学特征
2017-05-16张顺先艾琳周晓农杨景晖
张顺先 艾琳 周晓农 杨景晖
200025 上海,中国疾病预防控制中心寄生虫病预防控制所 卫生部寄生虫病原与媒介生物学重点实验室 世界卫生组织热带病合作中心 国家级热带病国际联合研究中心(张顺先、艾琳、周晓农); 650032 昆明,云南省第一人民医院 昆明理工大学附属昆华医院(杨景晖)
张顺先、艾琳对本文同等贡献
·论著·
昆明市2014—2015年轮状病毒分子流行病学特征
张顺先 艾琳 周晓农 杨景晖
200025 上海,中国疾病预防控制中心寄生虫病预防控制所 卫生部寄生虫病原与媒介生物学重点实验室 世界卫生组织热带病合作中心 国家级热带病国际联合研究中心(张顺先、艾琳、周晓农); 650032 昆明,云南省第一人民医院 昆明理工大学附属昆华医院(杨景晖)
张顺先、艾琳对本文同等贡献
目的 分析2014年7月到2015年6月云南省昆明市全年龄组腹泻人群A组轮状病毒的感染状况及病原学特征,为A组轮状病毒感染的监测、防控及暴发病例的调查及疫苗研发提供基础数据和方法学参考。方法 采集云南省4个监测哨点医院全年龄组腹泻人群的粪便样本1 121份、非腹泻人群的粪便319份。提取样本RNA,逆转录聚合酶链反应(RT-PCR)鉴定A组轮状病毒阳性,对于阳性样本,进一步进行半巢式多重RT-PCR法进行G/P基因分型。结果 1 121份腹泻样本共检出A组轮状病毒244份,总阳性率21.8%。G基因分型:G9(66.4%,n=156)是最主要的基因型,其次是G3(18.7%,n=44)、G1(8.9%,n=21)和G8(1.7%,n=4),P基因分型:P[8](92.8%,n=218)是最主要的基因型,其次是P[4](4.7%,n=11)。在G/P基因型方面,G9P[8](57.0%,n=134)是最主要基因型,其次是G3P[8](18.3%,n=43)和G1P[8](8.9%,n=21)。轮状病毒流行有明显的季节分布特征(χ2=46.3,P<0.001),流行高峰为冬季(31.2%);G9P[8](χ2=27.3,P<0.001)、G3P[8](χ2=10.2,P<0.042)和G1P[8](χ2=8.2,P<0.039)的流行也都有明显的季节趋势,也都集中在冬季。<5岁人群中,阳性率在腹泻病例中高于非腹泻病例的基因型有G9P[8](14.9%,2.9%,χ2=18.1,P<0.001)和G3P[8](4.4%,0.5%, χ2=5.6,P<0.018)。 结论 云南省腹泻人群中存在较高的A组轮状病毒感染率,病原体可分为多种基因型别,G9P[8]为优势型别。
Fund programs: National Key Research and Development Project (No.2016YFC1202000); Yunnan Provincial Health Science and Technology Program (2016NS237)
人感染A组轮状病毒是一种双链RNA病毒,呼肠孤病毒科轮状病毒属,是引起<5岁以下儿童腹泻的主要病原体之一,其通过感染小肠黏膜上皮细胞,造成细胞损伤,引起渗透性腹泻病。A组轮状病毒在每年的秋冬季流行,感染途径为粪—口途径[1],临床表现为急性胃肠炎,可导致呕吐、发热、腹泻、脱水甚至死亡等严重并发症[2]。我国<5岁门诊腹泻儿童中轮状病毒检出率约25.2%,住院腹泻儿童中为29.7%~41.3%[3,4]。
目前根据轮状病毒的主要外壳蛋白 VP7和VP4中和抗原性的差异,迄今为止至少发现26个G型和 35个P型[5,6],但轮状病毒G/P基因型随时间而不断变化。1980—2011年我国<5岁腹泻儿童中G3占所有G分型的39.3%,P[8]占所有P分型的56.2%,G3P[8]占G/P基因型32.1%[7];而2012年以后G9逐步成为主要的G分型[7]。轮状病毒G/P基因型的不断变化,在一定程度上增加了轮状病毒腹泻防治的难度。
为此,本研究尝试揭示云南省昆明市轮状病毒的流行程度及基因型分布特征,为轮状病毒疫苗的引进和推广提供科学依据。
1 材料与方法
1.1 样本来源 选取昆明市4家医院为研究现场,分别为云南省第一人民医院、昆明医科大学第一附属医院、昆明市儿童医院和昆明市普吉社区医院,从这4个医院门诊就诊的患者中选择腹泻病例和非腹泻研究对象。
腹泻病例的纳入标准:2014年7月1日至2015年6月30日期间,在上述4家哨点医院门诊就诊的患者中在过去24 h内腹泻的次数≥3次、粪便形态异常(水样便,血样便,粘液样便和蛋花样便等)且在过去2周内没有出现腹泻症状的患者定义为腹泻病例。
非腹泻研究对象的纳入标准:2014年7月1日至2015年6月30日期间,在上述医院门诊就诊的患者中在过去24 h内排便次数<3次、粪便形态正常、未患有其他消化道疾病或症状且过去2周内没有发生腹泻症状的研究对象定义为非腹泻人群。
1.2 样本采集与保存 在2014年7月1日到2015年6月30日期间,从这4个医院无菌采集腹泻病例和非腹泻人群粪便样本,固体便每份取5~10 g,水样便或稀便每份取5~10 ml,采集的标本放入螺口采样管并将样本置于-70℃保存。
1.3 仪器与试剂 病毒核酸提取试剂盒购自中国台湾Geneaid公司(Viral Nucleic Acid Extraction KitⅡ),SuperScriptⅢ逆转录酶(Superscrip Ⅲ, Invitrogen, carlsbad,CA)购自美国Invitrogen公司,随机引物(Prmegan, Madison, WI)、dNTP MIX、GoTaq DNA 聚合酶购自美国Promega公司,引物由上海生工公司合成,核酸电泳及凝胶成像系统和PCR仪购自美国 Bio-Rad 公司。
1.4 病毒核酸检测和分析 将冻存的粪便样本自然解冻,取0.1 g固体粪便标本或0.1 ml液体粪便,加入0.9 ml生理盐水至1.5 ml EP管中,混匀,制作成10%的便悬液,8 000 rpm离心5 min,取上清待检。
采用试剂盒提取病毒RNA(操作步骤严格按照说明书)。根据文献[8],采用两步法的逆转录聚合酶联反应RT-PCR的方法来确定RVA阳性:通过Superscript Ⅲ逆转录试剂盒和随机引物合成cDNA,反应条件为:42℃ 90 min,99℃ 5 min。然后使用VP6引物[8]确定RVA阳性,反应条为94℃ 5 min;94℃ 1 min,42℃ 1 min,72℃ 1 min(40个循环);72℃,10 min,扩增产物为379 bp,取10 μl PCR扩增产物进行1.5%琼脂糖凝胶电泳(140 V,30 min)。对疑似阳性的产物进行测序,以确定是否为阳性。
对于确定的阳性样本,提取产物参照世界卫生组织(WHO)轮状病毒参比实验室提供的A组轮状病毒G(病毒外壳蛋白VP4)/P(病毒外壳蛋白VP7)基因分型引物序列及试验方案进行,其中G分型包括G1/G2/G3/G4/G8/G9/G10/G11 8条引物,P分型包括P[4]/P[6]/P[8]/P[9]/P[10]/P[11] 6条引物[9-11]。取10 μl PCR扩增产物进行1.5%琼脂糖凝胶电泳(140 V,30 min)。根据特异性核酸条带大小和数目组合判断A组轮状病毒基因类别。
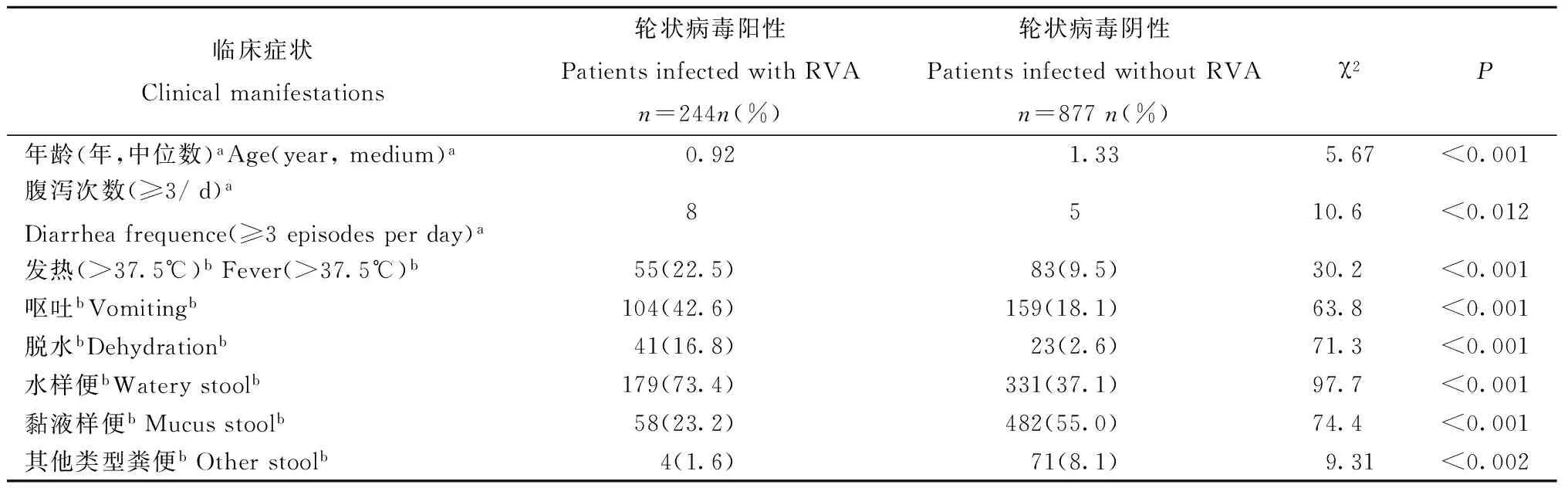
表1 腹泻病例中轮状病毒阳性者的特征分布 Tab.1 Comparison of clinical manifestations between diarrhea cases with and without RVA infection
注:a秩和检验,b卡方检验
Note:aRank-sum test between two data groups;bChi-square tests between two data groups
1.5 统计学方法 使用SPSS19.0软件(SPSS19.0,IBM)进行数据分析,分类资料的构成比、OR值及95%可信区间(CIs)计算使用卡方检验或者Fisher检验法;连续性数据根据数据特征选择t检验、方差分析或K-W秩和检验,判断标准为P<0.05。
1.6 伦理学 中国疾病预防控制中心寄生虫病预防控制所伦理审查委员会对本研究进行了伦理审查(书面函审),并同意开展此研究。
2 结果
2.1 轮状病毒腹泻病例特征 轮状病毒阳性的腹泻病例年龄中位数为0.92岁,轮状病毒阴性的腹泻病例年龄中位数为1.33岁,轮状病毒阳性的腹泻病例的年龄小于轮状病毒阴性的腹泻病例的年龄(χ2=5.67,P<0.001)。轮状病毒阳性者的腹泻次数高于轮状病毒阴性者的次数(8,5,χ2=10.6,P<0.012)。发热在轮状病毒阳性者中高于轮状病毒阴性者(χ2=30.2,P<0.001),呕吐在轮状病毒阳性者中高于轮状病毒阴性者(χ2=63.8,P<0.001),水样便在轮状病毒阳性者中高于轮状病毒阴性者(χ2=97.7,P<0.001)(表1)。
2.2 轮状病毒基因型分布特征
2.2.1 腹泻病例和非腹泻病例轮状病毒基因型构成: 在腹泻病例中检出244株轮状病毒,有 9(3.9%)株没有完全的G/P分型,其中8株有G分型而没有做出P分型,1株有P分型而未能做出G分型。235株轮状病毒同时做出G分型和P分型,这235株轮状病毒共30种基因分型,包括6个G分型和5个P分型。在235株轮状病毒的G分型中,G9(66.4%,n=156)是最主要的基因型,其次是G3(18.7%,n=44)、G1(8.9%,n=21)、G8(1.7%,n=4)、G4(1.7%,n=4)和 G2(1.0%,n=2);在235株轮状病毒的P分型中,P[8](92.8%,n=218)是最主要的基因型,其次是P[4](4.7%,n=11)、P[9](2.1%,n=5)、P[6](1.0%,n=1)。G9、G3和G1基因型占总G分型的90.0%以上,P[8]和P[4]占总P分型的95%以上。在G/P基因型方面,G9P[8](57.0%,n=134)是最主要基因型,其次是G3P[8](18.3%,n=43)和G1P[8](8.9%,n=21);G9P[8]、G3P[8]和G1P[8]这3种基因型占所有基因型的84.2%。
在非腹泻人群中共检出12株轮状病毒,这12株轮状病毒均做出G分型和P分型。G分型有3种基因型,G9(58.7%,n=7)是最主要的基因型,其次是G1(25.0%,n=3)和G3(16.7%,n=2);P分型有2种基因型,P[8](91.7%,n=11)是最主要的基因型,其次是P[6](8.3%,n=1)。这12株轮状病毒有3种G/P基因型组合,G9P[8](50.0%,n=6)是最主要基因型,其次是G1P[8](25.0%,n=3)和G3P[8](16.7%,n=2)。
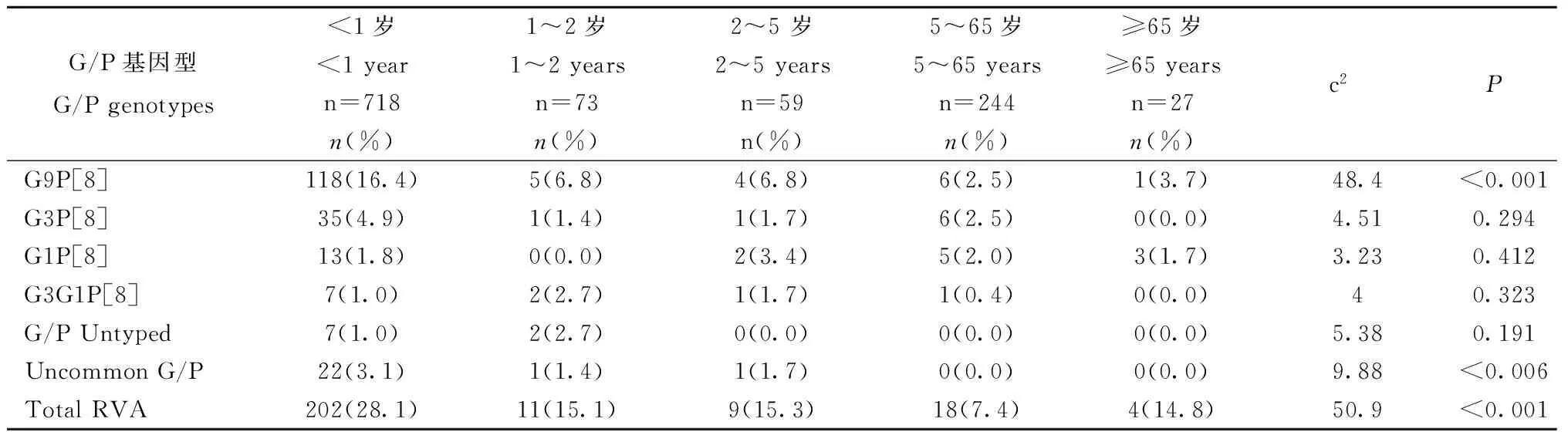
表2 腹泻人群中轮状病毒及基因型年龄分布特征Tab.2 Age distribution of RVA and G/P genotypes in diarrheal patients
Notes:Uncommon G/P genotypes: G9P[6], G9P[4], G8P[9],G4P[8], G4P[6], G3P[9], G2P[8], G2P[4] and G1P[4]
2.2.2 腹泻病例轮状病毒基因型年龄分布特征: 将1 121名腹泻病例分成5个年龄组(<1岁、1~2岁、2~5岁、5~65岁和≥65岁),其中<1岁的腹泻病例有718名、1~2岁有73名、2~5岁有59名、5~65岁有244名,≥65岁有27名。RVA在不同年龄组腹泻病例中阳性率有差异(202/718,11/73,9/59,18/244,4/27;χ2=50.9,P<0.001),其中<1岁腹泻儿童中阳性率最高(28.1%)。G9P[8]基因型在不同年龄组腹泻病例中有差异(118/718,5/73,5/59,6/244,1/27;χ2=48.4,P<0.001),而G3P[8]、G1P[8]和G3G1P[8]的流行在不同年龄段腹泻病例中没有差异(表2)。
2.2.3 腹泻病例轮状病毒及基因型性别分布特征: 全年龄组腹泻人群中,RVA阳性率在男性腹泻病例和女性腹泻病例中没有差异(21.6%,n=121;21.9%,n=123;χ2=0.01,P=0.922)。其中G9P[8]的阳性率在男性腹泻病例和女性腹泻病例中也没有差异(11.4%,n=64;12.5%,n=70;χ2=0.270,P=0.603),其他基因型的阳性率在男性和女性腹泻病例中也都没有差异。
2.2.4 腹泻病例轮状病毒基因型季节分布特征: 根据昆明市气候特征,我们把2—4月定义为春季、5—7月为夏季、8—10月为秋季、11月到次年1月为冬季,分别收集到腹泻病例267例、200例、260例和394例。腹泻病例中RVA的阳性率有明显的季节趋势(45/267,19/200,52/260,126/394,χ2=46.3,P<0.001),流行高峰为冬季(31.2%),低谷为夏季(9.5%)。G9P[8]基因型的阳性率也有明显的季节趋势(26/267,6/200,34/260,68/394,χ2=27.3,P<0.001),流行高峰为冬季(17.3%)。G1P[8]基因型也有明显的季节分布趋势(9/267,7/200,4/260,23/394,χ2=8.22,P<0.039),流行高峰是冬季(5.8%)。G3P[8]基因型也有明显的季节趋势(5/267,0/200,4/260,12/394,χ2=10.2,P<0.042),流行高峰也是冬季(3.0%)(图1)。
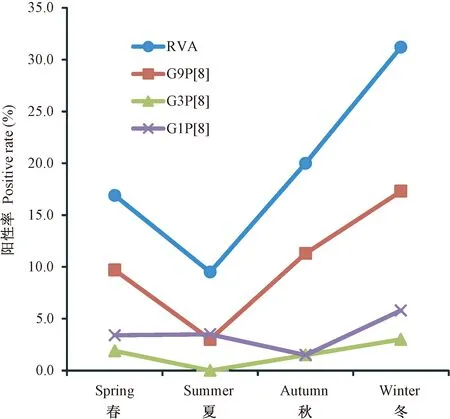
图1 腹泻病例中RVA 及主要基因型季节分布特征Fig.1 The seasonal distribution of RVA and main G/P genotypes in diarrheal patients
2.3 轮状病毒及基因型在腹泻人群和非腹泻人群中的比较 在全年龄组人群中,RVA的阳性率在腹泻病例中高于非腹泻人群(21.8%,3.76%,χ2=55.1,P<0.001)。阳性率在腹泻病例中高于非腹泻病例的基因型有:G9P[8](12.0%,1.9%,χ2=28.7,P<0.001)和G3P[8](3.8%,0.6%,χ2=8.45,P<0.004);阳性率在腹泻病例中和非腹泻病例中没有差异的基因型有:G1P[8](1.9%,0.9%,χ2=1.32,P=0.251)及其他基因型(表3)。
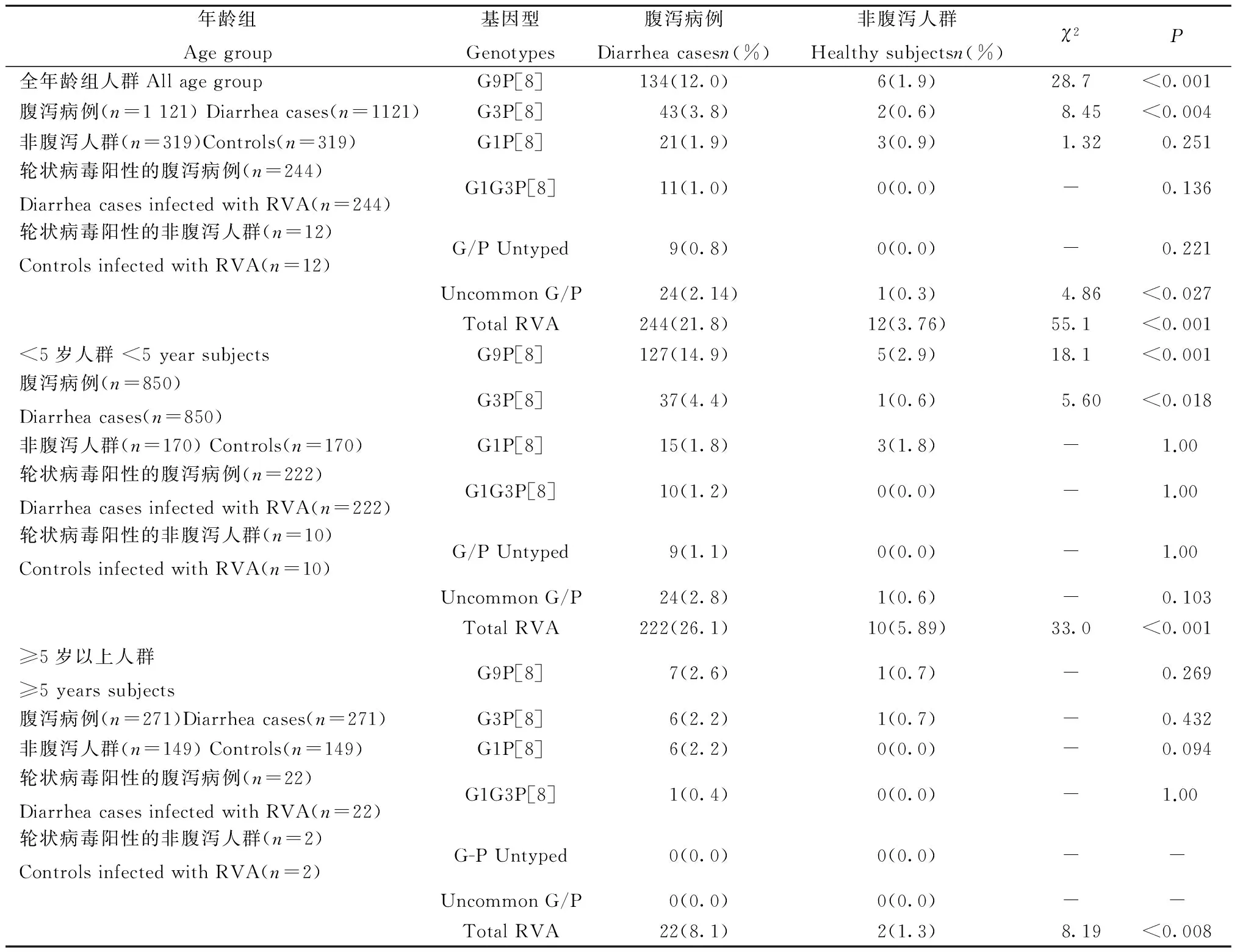
表3 轮状病毒基因型在不同年龄段腹泻和非腹泻人群中阳性率比较Tab.3 The positive rate of RVA and genotypes in diarrhea cases and healthy controls with different age groups
注:“-”:Fisher检验法或无法计算
Notes:Uncommon G/P genotypes: G9P[6], G9P[4], G8P[9],G4P[8], G4P[6], G3P[9], G2P[8], G2P[4] and G1P[4]
<5岁人群中,RVA的阳性率在腹泻病例中高于非腹泻人群(26.1%,5.89%,χ2=33.0,P<0.001)。阳性率在腹泻病例中高于非腹泻病例的基因型有:G9P[8](14.9%,2.9%,χ2=18.1,P<0.001)和G3P[8](4.4%,0.5%,χ2=5.6,P<0.018)。其他基因型的阳性率在腹泻病例和非腹泻研究对象中没有差异(表3)。≥5岁人群中,RVA的阳性率在腹泻病例中高于非腹泻人群(8.1%,1.3%,χ2=8.19,P<0.008)。而各基因型的阳性率在腹泻病例和非腹泻病例中没有差异(表3)。
3 讨论
轮状病毒是<5岁儿童腹泻最重要的病原体[3],迄今为止轮状病毒引起的儿童腹泻依旧是我国重要的公共卫生问题之一[7]。本研究发现轮状病毒流行高峰是冬季,这与我国轮状病毒流行特征相符[1]。同时,本研究发现轮状病毒更易感染<1岁婴幼儿,这可能与婴幼儿胃肠道发育不完善和免疫力相对较弱有关[1]。
本研究发现G9(66.4%)和G3(18.7%)是G分型的两种最重要的基因型,这与我国近年来病毒性腹泻监测的结果相似[7]。轮状病毒的G分型随时间不断变化,2000年以前G1是最主要的G分型(G1占所有G分型的70%以上);2000—2010年G1下降到20%,而G3却成为最重要的G分型;2012年以后G9取代G3而成为有些地区的优势基因型,这可能与轮状病毒基因型的自然变异有关[7]。国外研究表明轮状病毒疫苗的应用也可改变G分型的自然流行规律,如比利时在轮状病毒疫苗使用之前,G1和G4是最重要的G分型,但在疫苗推广使用之后,G1和G4快速下降而G9迅速上升[12]。在我国,无论G亚型怎么变动,G1、G2、G3和G9亚型之和占整个G分型的85%以上,这与一项东南亚地区的研究结果一致(在泰国,G1、G2、G3和G9之和占G分型的94.8%)[13]。
本研究对9株轮状病毒没有进行完全的基因分型,这可能与轮状病毒的分型引物有关,本研究中轮状病毒的分型引物只包括轮状病毒中最重要的几个分型,没有包括一些在腹泻人群中阳性率较低的基因型的引物;同时也有可能是轮状病毒在流行过程中出现了新的基因型,这提示我们在以后的轮状病毒监测工作中要不断提高分型技术和技能[7]、应运新的分型技术(如基因测序技术),以便尽可能分出全部的基因型,为轮状病毒的预防和控制提供科学参考。
近年来我国轮状病毒的流行程度并没有降低[4]。在前疫苗时代,轮状病毒流行程度和基因分型是引进轮状病毒疫苗最关键的参考指标。轮状病毒G/P分型在不断变动,这提示我们对轮状病毒基因型的持续监测可以帮助我们选择有效的轮状病毒疫苗。从2006年以后,两种安全有效的轮状病毒疫苗(RotarixTM,GSKBiologicals;RotaTeqTM,Merck)在40多个国家或地区推广使用,但我国目前并没有引进[2,5,6]。RotarixTM疫苗包括G1P1A[8]成分,RotaTeqTM疫苗包括G1、G2、G3和G4以及P1A[8]成分。尽管这两种疫苗都没有包含G9亚型,但这两种疫苗在G9流行程度较低国家或地区对G9有一定的预防效果,但当G9成为绝对优势亚型时,这两种疫苗是否有效需要进一步严谨的科学验证,因此,在我国需要谨慎评估这两种疫苗的预防效果。
[1] 赵嘉咏, 申晓靖, 张白帆, 等. 河南省2012—2015年儿童A组轮状病毒病原学监测及基因型别分析[J]. 中华实验和临床病毒学杂志, 2016,30(5):430-433.doi: 10.3760/cma.j.issn.1003-9279.2016.05.004.
[2] 刘娜, 马智超, 李苑, 等. 深圳某接种点国产轮状病毒疫苗使用现况分析[J]. 中华实验和临床病毒学杂志, 2015,29(2):151-153.doi:10.3760/cma.j.issn.1003-9279.2015.02.019.
[3] Kawai K, O'Brien M A, Goveia M G, et al. Burden of rotavirus gastroenteritis and distribution of rotavirus strains in Asia: a systematic review[J]. Vaccine, 2012,30(7):1244-1254. doi: 10.1016/j.vaccine.2011.12.092.
[4] Yu J, Jing H, Lai S, et al. Etiology of diarrhea among children under the age five in China: Results from a five-year surveillance[J]. J Infect, 2015,71(1):19-27. doi: 10.1016/j.jinf.2015.03.001.
[5] 孙晓曼, 郭妮君, 李丹地, 等. 轮状病毒疫苗株VP8核心区蛋白的表达和纯化[J]. 中华实验和临床病毒学杂志, 2015,29(6):543-546.doi: 10.3760/cma.j.issn.1003-9279.2015.06.019.
[6] 李丹地,孔翔羽,马鑫,等. 我国人罕见G9P[6]基因型A组轮状病毒LL51695株VP7、VP4、VP6和NSP4编码基因的分子特征[J]. 中华实验和临床病毒学杂志, 2015,29(1):59-61.doi: 10.3760/cma.j.issn.1003-9279.2015.01.020.
[7] Liu N, Xu Z, Li D, et al. Update on the disease burden and circulating strains of rotavirus in China: a systematic review and meta-analysis[J]. Vaccine, 2014,32(35):4369-4375. doi: 10.1016/j.vaccine.2014.06.018.
[8] Zhang S, Yin J, Yang J, et al. Epidemiology and genetic diversity of group A rotavirus in acute diarrhea patients in pre-vaccination era in southwest China[J]. J Med Virol, 2017,89(1):71-78. doi: 10.1002/jmv.24606.
[9] Simmonds M K, Armah G, Asmah R, et al. New oligonucleotide primers for P-typing of rotavirus strains: strategies for typing previously untypeable strains[J]. J Clin Virol, 2008,42(4):368-373. doi: 10.1016/j.jcv.2008.02.011.
[10] Gouvea V, Glass R I, Woods P, et al. Polymerase chain reaction amplification and typing of rotavirus nucleic acid from stool specimens[J]. J Clin Microbiol, 1990,28(2):276-282.
[11] Iturriza-Gomara M, Kang G, Gray J. Rotavirus genotyping: keeping up with an evolving population of human rotaviruses[J]. J Clin Virol, 2004,31(4):259-265.
[12] Zeller M, Rahman M, Heylen E, et al. Rotavirus incidence and genotype distribution before and after national rotavirus vaccine introduction in Belgium[J]. Vaccine, 2010,28(47):7507-7513. doi: 10.1016/j.vaccine.2010.09.004.
[13] Jiraphongsa C, Bresee J S, Pongsuwanna Y, et al. Epidemiology and burden of rotavirus diarrhea in Thailand: results of sentinel surveillance[J]. J Infect Dis, 2005,192(Suppl 1):S87-S93.
(本文编辑:陈培莉)
Rotavirus A pathogen surveillance and gene typing analysis in Kunming city of Yunnan province from July 2014 to June 2015
ZhangShunxian,AiLin,ZhouXiaonong,YangJinghui
NationalInstituteofParasiticDiseases,ChineseCenterforDiseaseControlandPrevention.KeyLaboratoryforParasiteandVectorBiology,MinistryofHealth,People′sRepublicofChina;WHOCollaboratingCenterforTropicalDiseases,NationalCenterforInternationalResearchonTropicalDiseases,Shanghai200025,China(ZhangSX,AiL,ZhouXN);ThefirstPeople′sHospitalofYunnanProvince,KunhuaHospitalAffiliatedtoKunmingUniversityofScienceandTechnology,Kunming650032China(YangJH)
ZhangShunxianandAiLinarethefirstauthorswhocontributedequallytothearticle
YangJinghui,Email:yangjh1029@163.com
Objective To analyze the infectious status and etiological characteristics of rotavirus A (RVA) from children less than five years old in the Kunming city of Yunnan province from July 2014 to June 2015, to provide basic data and methodological references for the disease surveillance, and controling outbreak cases investigations as well as vaccine research and development. Methods Stool samples were collected from 1 121 diarrhea cases and 319 healthy controls in four sentinel hospitals and transported to laboratory. Two-step reverse transcriptional polymerase chain reaction (RT-PCR) was used to detect the presence of RVA in each stool specimen. Suspicious positive specimens of gel electrophoresis was further sequenced to make definite diagnosis of RVA infection. Each RVA positive stool specimen was confirmed with sequencing which was conducted the semi-nested multiplex RT-PCR to detect six G genotypes and six P genotypes. Results Total 244 samples from the 1 212 diarrhea patients were detected positive for RVA and the total positive rate was 21.8%. G typing of group A rotavirus mainly showed G9(66.4%,n=156), G3(18.7%,n=44), G1(8.9%,n=21)and G8(1.7%,n=4). P typing mainly showed P[8](92.8%,n=218)and P[4](4.7%,n=11); G/P combination genotypes were composed mainly of G9P[8](57.0%,n=134), G3P[8](18.3%,n=43) and G1P[8](8.9%,n=21). The detection rate of RVA in diarrhea patients had obvious seasonal distribution (χ2=46.3,P<0.001), with the prevalent peak in winter (31.2%), and the seasonal distribution of G9P[8](χ2=27.3,P<0.001), G1P[8](χ2=8.2,P<0.039)and G3P[8](χ2=10.2,P<0.042) had strong seasonal pattern with a peak in winter equally. In the subjects under five years, the detection rate of G9P[8](14.9%, 2.9%,χ2=18.1,P<0.001) and G3P[8](4.4%, 0.5%,χ2=5.6,P<0.018) from diarrhea cases were higher than that of in healthy controls, respectively. Conclusion There existed rather high infection rate of RVA in acute diarrhea cases in Yunnan province, which can be divided into a variety of genotypes, G9P[8]was the dominant genotype.
Group A rotavirus; Genotype; Kunming city
杨景晖,Email:yangjh1029@163.com
10.3760/cma.j.issn.1003-9279.2017.02.008
国家重点研发计划项目(2016YFC1202000);云南省卫生科技计划项目(2016NS237)
A组轮状病毒; 基因型; 昆明市
2017-01-03)
