原发性肝癌合并HBV感染者的HBV基因特征分析
2017-05-16董绍斌王富珍张爽张国民王锋孟庆玲沈立萍毕胜利
董绍斌 王富珍 张爽 张国民 王锋 孟庆玲 沈立萍 毕胜利
102206 北京,中国疾病预防控制中心病毒病预防控制所 卫生部医学病毒和病毒病重点实验室(董绍斌、张爽、王锋、孟庆玲、沈立萍、毕胜利);100052 北京,中国疾病预防控制中心免疫规划中心(王富珍、张国民)
·论著·
原发性肝癌合并HBV感染者的HBV基因特征分析
董绍斌 王富珍 张爽 张国民 王锋 孟庆玲 沈立萍 毕胜利
102206 北京,中国疾病预防控制中心病毒病预防控制所 卫生部医学病毒和病毒病重点实验室(董绍斌、张爽、王锋、孟庆玲、沈立萍、毕胜利);100052 北京,中国疾病预防控制中心免疫规划中心(王富珍、张国民)
目的 了解原发性肝癌(Hepatocellular carcinoma,HCC)合并乙型肝炎病毒(Hepatitis B Virus,HBV)感染者的HBV基因特征状况及其与肝癌的关系。方法 收集HCC合并HBV感染者作为肝癌组,以急慢性乙型肝炎患者作为对照组,检测样本的HBV感染指标,提取HBV脱氧核糖核酸(Deoxyribonucleic acid,DNA)并用巢氏聚合酶链反应(Polymerase Chain Reaction,PCR)法扩增HBV基因序列,测序后利用MEGA6软件进行序列比对,用BioEdit软件分析样本序列的突变情况。 结果 肝癌组中86例样本和对照组中39例样本成功扩增到目的基因序列HBV S区和基底核心区(Basal core promoter,BCP)/Precore区。肝癌组的PreS缺失突变率、A1762T突变率、A1762T/G1764A双突变率分别为39.53%、74.42%和72.09%,均显著高于对照组的20.51%、53.85%和53.85%;≥50岁年龄组的A1762T、A1762T/G1764A的突变率显著高于<50岁年龄组;基因型C的A1762T、G1764A、A1762T/G1764A的突变率显著高于基因型B,而基因型B的G1896A突变率显著高于基因型C;年龄≥50岁、基因型C、G1896A是肝癌的独立危险因素,年龄≥50岁患肝癌危险性是年龄<50岁的9.349倍,基因型C患肝癌危险性是基因型B的28.875倍。G1896A患肝癌危险性是非突变者的7.648倍。结论 高年龄组和感染基因型C的人群发生A1762T、A1762T/G1764A的可能性更高,年龄≥50岁、基因型C、G1896A是肝癌的独立的危险因素。
Fund programs: Chinese Ministry of Science and Technology Program for Important Infectious Diseases Control and Prevention,Hepatitis B Virus Immunization Prevention New Strategy Research (2012ZX10002001;2012ZX10002001005)
肝细胞癌(Hepatocellular carcinoma,HCC)是全球排第五位的癌症,癌症死亡率排第三的疾病。乙型肝炎病毒(Hepatitis B virus,HBV)感染是HCC发生的主要危险因素之一,据报道全球80%的肝癌发病与HBV持续性感染相关[1]。HBV流行是我国严重公共卫生问题之一,2006年全国HBV血清流行病学调查结果显示1~59岁的HBsAg阳性率为7.18%,约有9 000万人是HBV慢性感染者[2]。同时我国也是原发性肝癌高发区,2012年世界大概有782 000新发肝癌病例,其中一半来自中国。HBV持续性感染导致肝癌的相关因素包括HBeAg状态、HBV DNA水平、HBV基因型、HBV基因变异以及宿主易感性等[3,4]。不同HBV基因型和亚型的疾病进展、抗病毒治疗反应和预后有显著差异,HBV C型与其他HBV基因型相比,有更高的患HCC的风险,是HCC发生的独立的风险因素。也有大量的文献阐述一些HBV突变体,例如Precore/BCP突变、PreS/S缺失突变、HBV X区变异与HCC的发生发展密切相关,但是仍有许多不明之处[5]。为了探讨HBV基因型和基因突变与HCC发生的关系,本研究收集了不同地区HCC患者合并HBV感染者的标本,开展HBV基因型和基因特征的对比分析。
1 材料与方法
1.1 研究对象 2012—2015年本课题组在青海海南藏族自治州、广西隆安县、河北正定县、上海黄浦区、河南开封市和湖南湘潭市建立HCC监测网络,收集HCC患者的基本信息和血清标本。符合HCC合并HBV感染的标本作为研究对象,同时将未患HCC和肝硬化的急慢性乙型肝炎患者作为对照组。疾病的诊断由当地二级以上的医院完成并由省级三甲医院复核,排除了其他可能导致肝炎或HCC的疾病,包括其他病毒性肝炎、药物或酒精性肝炎、自身免疫性肝炎、脂肪肝、肝硬化等。本次调查的内容和研究方案已经中国疾病预防控制中心伦理学委员会审查通过,伦理学编号为IVDC2013第(028)号,研究对象均已提前告知研究内容并签署知情同意书。
1.2 HBV感染指标检测和核酸制备 使用北京万泰生物药业股份有限公司的乙肝病毒血清标志物检测试剂盒(ELISA法)定性检测HBsAg、HBeAg,然后用美国Abbott公司的乙肝病毒血清标志物检测试剂盒(微粒子免疫化学发光法)进行定量复核。使用西安天隆公司的HBV DNA 定量试剂盒对HBV DNA进行定量检测;使用德国Qiagen公司的QIAamp DNA Blood Mini Kit 试剂盒提取上述血清中HBV DNA(硅胶膜柱提吸附法)。严格按照试剂说明书操作步骤进行。提取的DNA标本于-80℃储存待检,避免反复冻融。
1.3 PCR扩增HBV全基因组 采用巢氏PCR法扩增目的序列,阳性产物纯化回收后送北京六合华大基因公司双向测序。第一轮扩增条件:80℃预变性3 min;95℃变性40 s、60℃退火90 s,68℃延伸3 min 36 s,44个循环。第二轮扩增条件:95℃预变性10 min;95℃变性20 s、50℃退火30 s、72℃延伸1 min,30个循环。扩增引物见表1。
1.4 序列分析 利用Seqman软件进行序列拼接,然后从GenBank中选择49株HBV标准株(获取序列号为:AB010290、AB033553、AB033554、AB048704、AB048705、AB049609、AB056513、AB056515、AB073822、AB073854、AB074755、AB076679、AB078032、AB091255、AB117758、AB117759、AB126581、AB166850、AB205123、AB205125、AB205192、AB212625、AB231908、AB241109、AB241116、AB241117、AF090838、AF090841、AF090842、AF121249、AF121250、AF151735、AF223962、AF223963、AF241408、AF280817、AF297621、AF297622、AJ344116、AY090454、D00331、EU410080、L27106、X59795、X72702、X75656、X75665、Y07587、Z35716),分别代表A~I共9个基因型,拼接的序列与上述49株HBV标准株利用MEGA6软件进行比对和同源性分析并构建系统发生树,最后利用BioEdit软件分析序列的突变情况。
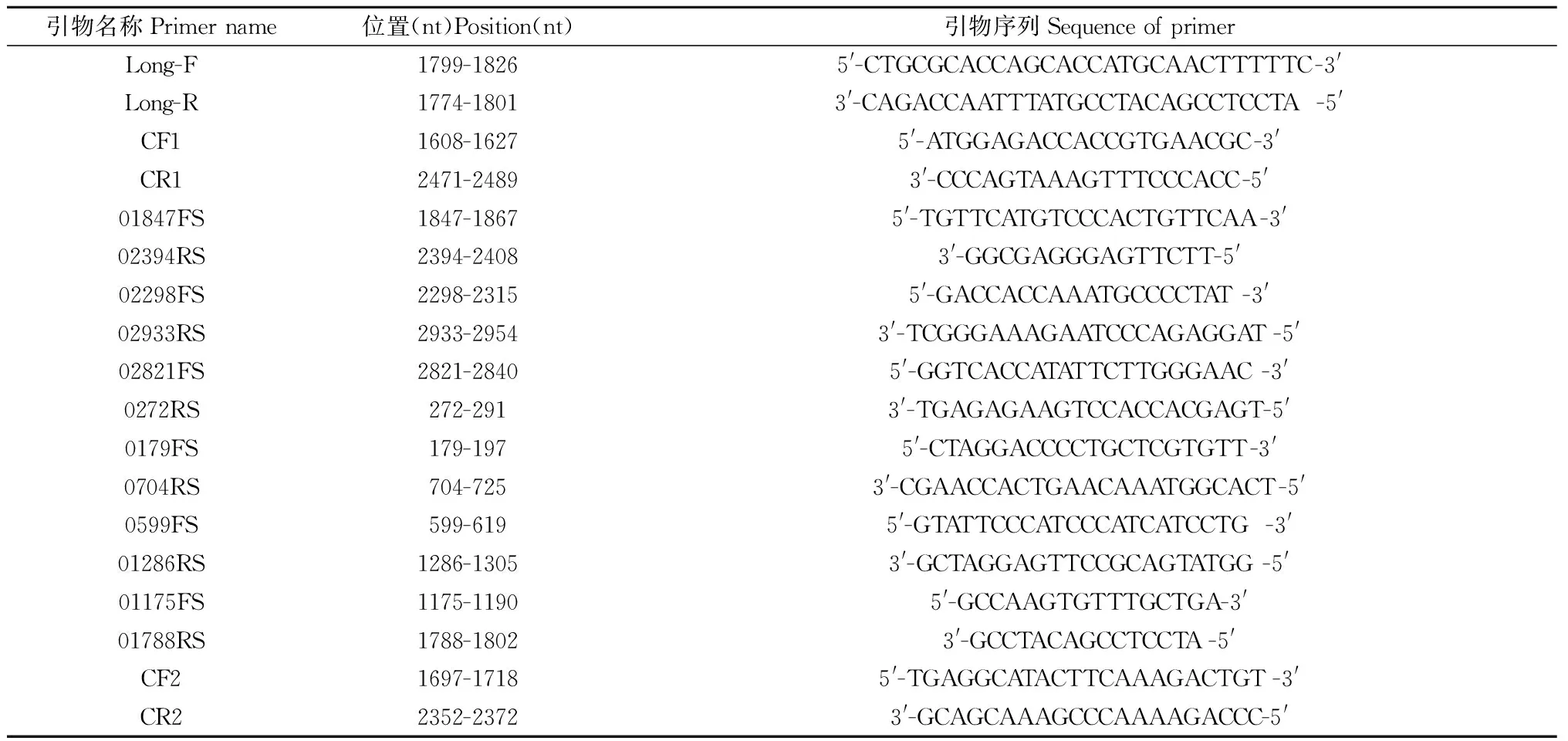
表1 HBV巢氏PCR扩增引物Tab.1 Primers for nested PCR of HBV
1.5 统计学方法 将数据录入SPSS16.0软件进行统计分析。性别、年龄、HBeAg、基因型、各位点突变率等变量采用卡方检验,多分类变量P值采用Bonferroni法校正。多因素分析采用逐步前进法Logistic回归(P纳入=0.10,P排除=0.05)。P值<0.05认为差异有统计学意义,所有统计学检测都是双测检测。
2 结果
2.1 概况 收集到HCC合并HBV感染的血清标本307例(肝癌组),急慢性乙型肝炎患者150例(对照组),肝癌组中86例标本和对照组中39例标本成功扩增到目的序列,肝癌组和对照组中均为男性占大多数(70.00%以上),但组间差异无统计学意义(χ2=0.550,P=0.459);同时将年龄分成<50岁和≥50岁两组,实验组≥50岁占80.23%,而对照组中≥50岁占33.34%,组间差异有统计学意义(χ2=26.153,P=0.000);肝癌组和对照组的HBeAg阳性率分别为22.09%和23.08%,差异无统计学意义(χ2=0.015,P=0.903),HBV DNA 定量检测结果均为阳性;肝癌组的C基因型病例占81.40%,而对照组的C基因型占58.97%,组间差异有统计学意义(χ2=9.961,P=0.002)。详见表2。
2.2 核酸突变 目的序列与标准序列比较发现肝癌组的PreS缺失突变率为39.53%,显著高于对照组的20.51%,差异有统计学意义(χ2=4.350,P=0.037);肝癌组的A1762T突变率为74.42%,对照组的为53.85%,差异有统计学意义(χ2=5.219,P=0.022);进一步分析A1762T/G1764A双突变的情况,结果显示肝癌组的A1762T/G1764A双突变率显著高于对照组(χ2=4.004,P=0.045),未发现两组间G1764A、G1896A、T1753V突变的差异具有统计学意义。详见表2。
2.3 肝癌发生的独立危险因素 将年龄、性别、HBeAg、基因型、G1896A、PreS缺失突变、A1762T、G1764A、T1753V、A1762T/G1764A导入Logistic回归,结果显示和对照组相比,可以认为年龄≥50岁[Adjusted odds ratio(AOR)=9.349,95%CI,3.329-26.257,P=0.000]、基因型C(AOR=28.875、95%CI、4.897-170.258,P=0.000)和G1896A(AOR=7.648、95%CI、1.564-37.4,P=0.012)是肝癌的独立危险因素。年龄≥50岁肝癌危险性是年龄<50岁的9.349倍,基因型C肝癌危险性是基因型B的28.875倍,G1896A患肝癌危险性是非突变者的7.648倍,而尚不能认为性别、HBeAg、PreS缺失突变、A1762T、G1764A、T1753V、G1896A、A1762T/G1764A是肝癌的独立危险因素。
表2 肝癌组和对照组人口学、血清学和HBV基因突变结果
Tab.2 Demographic、seirological characteristics and HBV nucleotide substitutions of HCC and control groups
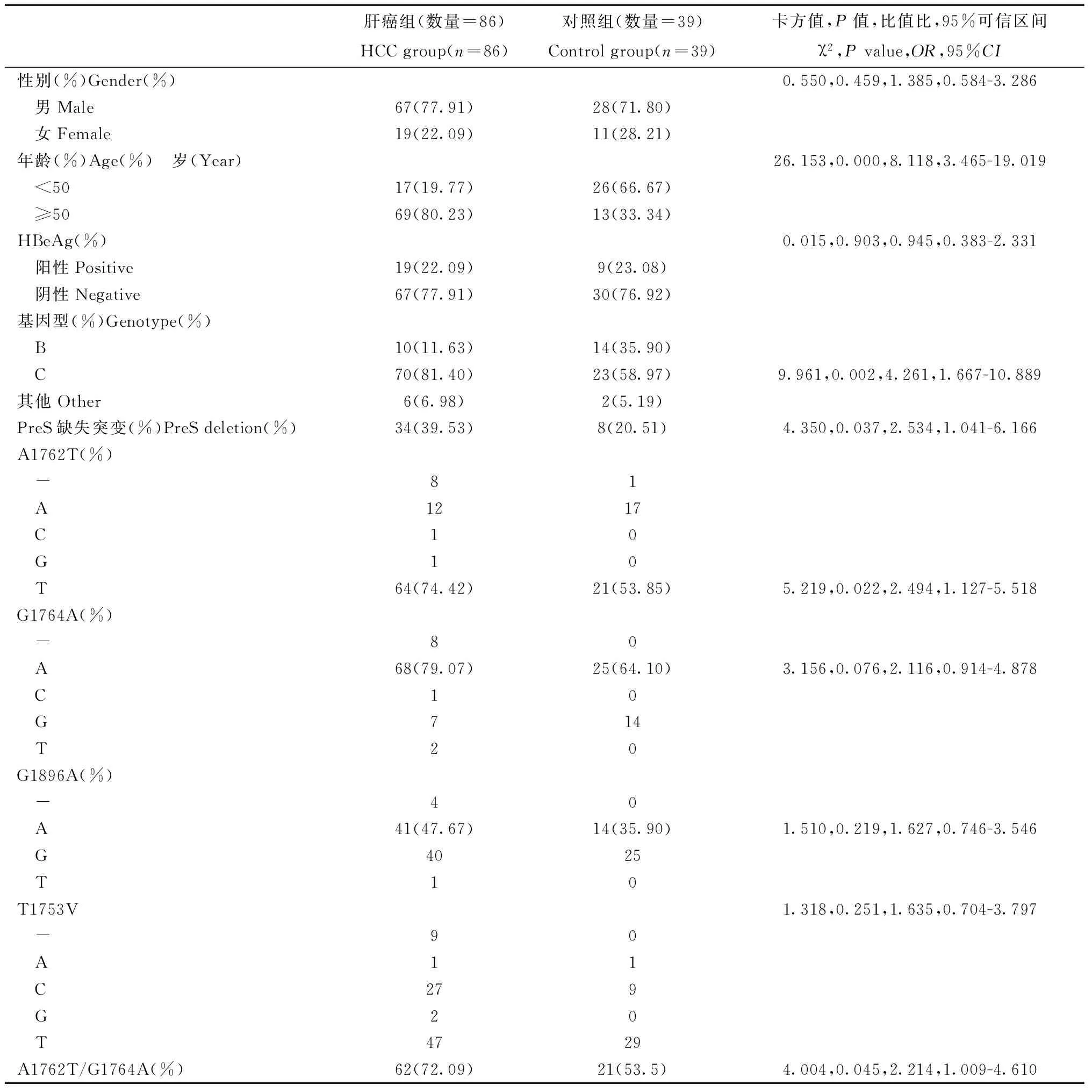
肝癌组(数量=86)HCCgroup(n=86)对照组(数量=39)Controlgroup(n=39)卡方值,P值,比值比,95%可信区间χ2,Pvalue,OR,95%CI性别(%)Gender(%)0.550,0.459,1.385,0.584-3.286 男Male67(77.91)28(71.80) 女Female19(22.09)11(28.21)年龄(%)Age(%) 岁(Year)26.153,0.000,8.118,3.465-19.019 <5017(19.77)26(66.67) ≥5069(80.23)13(33.34)HBeAg(%)0.015,0.903,0.945,0.383-2.331 阳性Positive19(22.09)9(23.08) 阴性Negative67(77.91)30(76.92)基因型(%)Genotype(%) B10(11.63)14(35.90) C70(81.40)23(58.97)9.961,0.002,4.261,1.667-10.889其他Other6(6.98)2(5.19)PreS缺失突变(%)PreSdeletion(%)34(39.53)8(20.51)4.350,0.037,2.534,1.041-6.166A1762T(%) -81 A1217 C10 G10 T64(74.42)21(53.85)5.219,0.022,2.494,1.127-5.518G1764A(%) -80 A68(79.07)25(64.10)3.156,0.076,2.116,0.914-4.878 C10 G714 T20G1896A(%) -40 A41(47.67)14(35.90)1.510,0.219,1.627,0.746-3.546 G4025 T10T1753V1.318,0.251,1.635,0.704-3.797 -90 A11 C279 G20 T4729A1762T/G1764A(%)62(72.09)21(53.5)4.004,0.045,2.214,1.009-4.610
注:“-”表示这个位点的碱基缺失。T1753V表示HBV 1753位点T到C、A 或 G的置换突变
Note:“-”is suggested that the base pair of this position was deleted.T1753V[T-to-V( C or A or G)substitution at nucleotide 1753]
2.4 HBV基因型和年龄与基因位点突变的关系分析 将所有扩增成功的样本分为B和C两个基因型来分析,发现基因型C的A1762T、G1764A、A1762T/G1764A的突变率显著高于基因型B,差异有统计学意义,而基因型B的G1896A突变率高于基因型C,差异有统计学意义;进一步分析发现肝癌组和对照组中B基因型的G1896A突变率均显著高于基因型C,肝癌组中C基因型的G1764A突变率也显著高于基因型B。将所有扩增成功的样本分为<50岁年龄组和≥50岁年龄组来比较,结果发现≥50岁年龄组的A1762T、A1762T/G1764A的突变率显著高于<50岁年龄组,而进一步分析发现肝癌组和对照组中A1762T、A1762T/G1764A突变在<50岁年龄组和≥50岁年龄组中差异无统计学意义。详见表3。

表3 HBV 相关位点突变与基因型和年龄分布的关系Tab.3 Prevalence of HBV mutants according to HBV genotype and age distribution
3 讨论
本研究通过病例对照研究的方法来分析HBV感染者患肝癌的相关危险因素,尤其HBV基因特征方面的危险因素。结果发现年龄≥50岁、基因型C、G1896A是肝癌的独立的危险因素。有研究报道年龄与肝癌密切相关,一般认为随着年龄的增长,肝癌发病率逐渐升高,本研究结果认为年龄≥50岁是肝癌的独立的危险因素,其肝癌危险性是年龄<50岁的9.349倍。本研究也发现在≥50岁人群中,A1762T/G1764A突变率显著高于50岁以下人群,与既往报道一致[6]。
大量研究结果显示基因型C的HBV患者有更高的罹患肝细胞癌的风险,本研究中从回归分析中也得出一致结果。C基因型有更高的发病风险的可能原因是由于基因型C患者HBeAg血清转阴时间更晚,病毒活性更高,BCP区突变率更高,而BCP区突变是公认的肝癌危险因素[7]。本研究结果也显示基因型C的BCP A1762T/G1764A、T1753V突变率显著高于基因型B。
本研究结果显示G1896A突变是肝细胞癌发生的独立危险因素。G1896A突变是前C区中最常见的突变,HBV 1896位G到A突变产生一个终止密码子,阻止了HBeAg的产生,而不干扰感染性病毒颗粒的复制。研究认为HBeAg的存在可促进免疫耐受,干扰人体免疫系统对感染HBV肝细胞的清除,而G1896A突变阻止HBeAg产生,从而增强人体对感染HBV肝细胞的免疫反应,增加肝细胞凋亡和再生,导致肝脏反复损伤,这可能是G1896A突变的HBV患者容易罹患肝癌的主要原因[8]。
有研究表明PreS缺失突变、C1653T、T1753V、A1762T/G1764A从无症状HBsAg携带者、慢性HBV感染到肝硬化或肝癌的过程中发生频率越来越高,推测这些突变发生在肝细胞癌之前,因此,这些突变可以推荐作为生物标记物来预测乙肝患者的预后,尤其是是否会发展为肝癌[1]。本研究的初步分析显示肝癌组的PreS缺失突变率、A1762T突变率和A1762T/G1764A双突变率显著高于对照组,但Logistic回归分析结果显示尚不能认为它们是肝癌的独立的危险因素。PreS缺失突变和肝癌的发生密切相关,可能的致癌机制:一是PreS缺失突变可以引起内质网中HBsAg的过表达和集聚,从而导致内质网腔压力增大,DNA损伤和基因不稳定;二是PreS2基因突变导致II型毛玻璃样细胞的形成,这与肝癌的形成可能有关,也有研究认为PreS2基因突变会抑制抑癌基因p53的表达。有研究表明,不论是否是HCC患者,HBV PreS缺失突变在HBeAg阴性患者更常见,HBV PreS缺失在基因型C患者中更普遍,因此,研究对象HBeAg阴性率的构成比、基因型构成比不同可能会造成结果出现偏倚[9]。
A1762T/G1764A双突变是HBV BCP区最常见的突变,A1762T/G1764A双突变与肝癌密切相关,A1762T/G1764A双突变可以通过提高宿主的免疫应答,增强病毒复制的效率,改变编码X抗原的区域来增强HBV的毒力;A1762T/G1764A双突变同G1896A突变一样也可以减少HBeAg的表达,从而提高宿主的免疫应答,促进肝癌的发生。A1762T/G1764A双突变还可以通过调节HBV前C区和核心RNAs的相对水平或生成肝细胞核因子1转录因子结合位点来增强病毒复制的效率而导致肝癌。A1762T/G1764A双突变和HBV的X抗原编码序列重叠,可能会导致X抗原K130M和V131I的变化,这些氨基酸的变化可能干扰细胞生长控制机制和DNA修复而导致肝癌[8]。本研究发现肝癌组的A1762T/G1764A双突变率显著高于对照组,但在进一步的回归分析未发现它们是独立危险因素,可能原因是对照组的样本量偏小。
总之,本研究发现肝癌组患者的PreS缺失突变、A1762T突变和A1762T/G1764A双突变率均显著高于对照组;年龄>50岁、基因型C及G1896A突变和肝癌风险增加相关,是肝细胞癌发生的独立的风险因素。本研究也存在着一定的局限性。首先,只有HBV S片段和Precore/BCP片段突变被纳入分析,其他重要的位点,如C1653T等突变因缺少资料未被纳入分析,其次是由于多数研究对象服用了抗病毒药物,血清中病毒含量降低,导致PCR实验扩增成功率偏低。下一步的研究将加大样本量,对HBV基因全长进行筛查,做出更全面的分析,为肝癌的防治提供科学依据。
致谢:感谢河北省、河北省正定县、青海省、上海市、湖南省湘潭市、河南省开封市和广西壮族自治区及隆安县疾病预防控制中心在现场组织、资料收集和血样采集等方面给予的帮助。
[1] Liu S, Zhang H, Gu C, et al. Associations between hepatitis B virus mutations and the risk of hepatocellular carcinoma: a meta-analysis[J].J Natl Cancer Inst,2009,101(15):1066-1082.doi:10.1093/jnci/djp180.
[2] Liang X, Bi S, Yang W. Epidemiological serosurvey of Hepatitis B in China—Declining HBV prevalence due to Hepatitis B vaccination[J]. Vaccine,2009,27(47):6550-6557.doi:10.1016/j.vaccine.2009.08.048.
[3] Huang Y, Lok AS. Viral factors and outcomes of chronic HBV infection[J].Am J Gastroenterol,2011,106(1):93-95.doi:10.1038/ajg.2010.404.
[4] 杨可立,关玉娟,杨湛,等. HBV相关性肝细胞癌组织及癌旁组织PDCD1基因拷贝数差异分析[J].中华实验和临床病毒学杂志,2016,30(3):283-285. doi:10.3760/cma.j.issn.1003-9279.2016.03.007.
[5] Yu L, Zhang BF, Cheng ML, et al. Quantitative assessment of mutations in hepatitis B virus genome with liver cirrhosis and hepatocellular carcinoma development[J].Oncotarget,2016,(Epub ahead of print).doi:10.18632/oncotarget.9417.
[6] Yin J, Xie J, Liu S, et al. Association between the various mutations in viral core promoter region to different stages of hepatitis B, ranging of asymptomatic carrier state to hepatocellular carcinoma[J].Am J Gastroenterol,2011,106(1):81-92.doi:10.1038/ajg.2010.399.
[7] Sung JJ, Tsui SK, Tse CH, et al. Genotype-specific genomic markers associated with primary hepatomas, based on complete genomic sequencing of hepatitis B virus[J].J Virol,2008,82(7):3604-3611.doi:10.1128/JVI.01197-07.
[8] Yang HI, Yeh SH, Chen PJ, et al. Associations between hepatitis B virus genotype and mutants and the risk of hepatocellular carcinoma[J].J Natl Cancer Inst,2008,100(16):1134-1143.doi:10.1093/jnci/djn243.
[9] Yeung P, Wong DK, Lai CL, et al. Association of hepatitis B virus pre-S deletions with the development of hepatocellular carcinoma in chronic hepatitis B[J].J Infect Dis,2011,203(5):646-654.doi:10.1093/infdis/jiq096.
(本文编辑:唐浏英)
Sequence analysis of HBV in primary hepatomas patients infected with HBV
DongShaobin,WangFuzhen,ZhangShuang,ZhangGuomin,WangFeng,MengQingling,ShenLiping,BiShengli
KeyLaboratoryforMedicalVirology,MinistryofHealth,NationalInstituteforViralDiseaseControlandPrevention,ChineseCenterforDiseaseControlandPrevention,Beijing102206,China(DongSB,ZhuangS,WangF,MengQL,ShenLP,BiSL);NationalImmunizationProgramme,ChineseCenterforDiseaseControlandPrevention,Beijing100052,China(WangFZ,ZhangGM)
BiShengli,Email:shengli_bi@163.com;ShenLiping,Email:shenlp@ivdc.chinacdc.cn
Objective To study the relationship between the development of hepatocellular carcinoma(HCC) and HBV gene characteristics among the HCC patients with hepatitis B virus (HBV) infection. Methods Some acute and chronic hepatitis B patients were collected as control group and HBV associated HCC patients as HCC group. Serum samples of subjects were tested for HBV serological markers. HBV DNA of those samples had been extracted and nested PCR was used to amplify the sequence of HBV DNA. Furthermore, MEGA 6.0 and Bioedit softwares were used to made phylogenetic trees and analyze the gene mutations. Results The sequences of S region and BCP/Precore region of HBV were amplified from 86 samples in study group and 39 samples in control group. The prevalence of PreS deletion, A1762T and A1762T/G1764A in HCC group were 39.53%, 74.42% and 72.09% respectively, and in control group were 20.51%, 53.85% and 53.85% respectively. The statistical differences of them were significant. The prevalence of A1762T and A1762T/G1764A in ≥ 50 years group were higher than that of < 50 years group. The prevalence of A1762T, G1764A and A1762T/G1764A of subjects who infected genotype C were higher than those infected genotype B. On the contrary, the prevalence of G1896A of subjects who infected genotype C were lower than that of genotype B.It was found that ≥ 50 years, genotype C and G1896A mutation were independently associated with HCC. The risk for suffer from HCC of ≥50 years group, genotype C group and G1896A group were 9.349, 28.875 and 7.648 times compared with < 50 years group genotype B group and without G1896A mutation group, respectively. Conclusions The population of ≥50 years or genotype C had a higher prevalence of A1762T, A1762T/G1764A,≥50years、genotype C、G1896A were independently associated with HCC, as compared with the subjects of the control group.
Hepatocellular carcinoma;Hepatitis B virus; Risk factor; Sequence characteristics
毕胜利,Email: shengli_bi@163.com;沈立萍,Email: shenlp@ivdc.chinacdc.cn
10.3760/cma.j.issn.1003-9279.2017.02.002
国家科技“十二五”重大专项“艾滋病与病毒性肝炎等重大传染病防治”课题“乙型肝炎免疫预防新策略的研究”(2012ZX10002001;2012ZX10002001005)
原发性肝癌;肝炎病毒;乙型;危险因素;基因特征
2016-11-29)
