原癌基因c-met在肝脏离断门静脉分支结扎大鼠术后剩余肝中的表达
2017-05-16安华松李向农杨军丁亮杨勇庄磊韩亚东汪源
安华松, 李向农, 杨军, 丁亮, 杨勇, 庄磊, 韩亚东, 汪源
论 著
原癌基因c-met在肝脏离断门静脉分支结扎大鼠术后剩余肝中的表达
安华松, 李向农, 杨军, 丁亮, 杨勇, 庄磊, 韩亚东, 汪源
目的 观察大鼠肝脏离断+门静脉分支结扎术后剩余肝组织中c-met基因和蛋白的表达及其在术后剩余肝快速再生中的作用。方法 将雄性SD大鼠96只应用计算机产生随机化数字完全随机分为肝脏离断+门静脉分支结扎术组、单纯门静脉分支结扎术组和假手术组。检测术后24 h、72 h、7 d和10 d时各组大鼠剩余肝组织中c-met基因和蛋白的表达。结果 肝脏离断+门静脉分支结扎术组术后剩余肝组织中c-met mRNA和蛋白的表达均增加,并于7(10.09±1.41)d达到峰值,明显高于单纯门静脉分支结扎术组的(3.49±0.94)(P<0.05)。结论 肝脏离断+门静脉分支结扎术后大鼠剩余肝组织中原癌基因c-met表达明显升高。
肝脏离断术; 门静脉分支结扎术; c-met; 肝再生; 大鼠
手术切除仍是目前治疗肝肿瘤的主要方法,但由于患者就诊时肿瘤体积较大或多发,只有不到20%的患者能得到手术切除[1-2]。术后剩余肝 (future liver remnant,FLR) 体积不足是大肝癌手术切除率低的主要原因[3]。2012年,Schnitzbauer等[4]首先报道了联合肝脏离断和门静脉结扎的二步肝切除术(associating liver partition and portal vein ligation for staged hepatectomy, ALPPS)。此法最大优势在于促进残肝快速再生,肝脏离断+门静脉分支结扎(LP+PVL)术后仅6~9天,剩余肝体积即可代偿性再生40%~160%[5-8]。2016年我们成功建立了一种加速剩余肝再生的大鼠模型,并发现LP+PVL术后10天剩余肝体积再生率高达117%、残肝重量/总肝重的比率上升至60%[9]。然而LP+PVL术后剩余肝快速再生的机制并不清楚。
已知HGF/c-met通路是最为重要的肝再生相关信号通路之一,参与启动肝再生并调控肝细胞增殖。HGF与c-met结合后,诱导细胞内级联反应,发挥促肝细胞分裂增殖作用[10]。朱传龙等[11]研究证实,大鼠肝部分切除术后剩余肝中c-met表达明显升高。Huh等[12]通过敲除小鼠c-met基因,发现肝脏缺失c-met基因会影响原代肝细胞的存活和肝组织的修复。因此,我们利用已建立的大鼠模型,探讨c-met基因和蛋白的表达及其在剩余肝快速再生中的作用。
1 资料与方法
1.1 动物分组 健康雄性SD大鼠96只(徐州医科大学实验动物中心提供),250~300 g, SPF级。将大鼠应用计算机产生随机化数字完全随机分为3组,即:LP+PVL组、PVL组和假手术(Sham)组。实验时间为2016年7月至2016年11月。
1.2 模型建立 按照已建立的方法制作大鼠模型[9]。开腹、充分显露大鼠肝脏后,根据正常解剖将其分为A,B两部分。PVL组,游离A部的各肝叶门静脉分支并用5-0丝线分别结扎,于肝左、右中叶之间出现缺血线;LP+PVL组,进一步沿缺血线两侧用7-0带线缝合针缝扎肝实质,显微剪刀剪断肝实质直至下腔静脉前方;肝断面之间填塞可吸收止血纤丝,防止术后肝断面粘连;Sham组,开腹后仅游离A部的门静脉分支,不予结扎。
1.3 标本采集 各组大鼠分别于术后24 h、72 h、7 d和10 d处死,自B部切取2块0.5 cm×0.5 cm×0.5 cm肝组织,分别待行Western blot与Q-PCR检测。
1.4 c-met mRNA表达的检测 使用Trizol试剂(北京天根公司)一步法提取肝组织总RNA,以此为模板进行逆转录得到肝组织总cDNA。采用荧光定量PCR法检测c-met及内参GAPDH mRNA表达水平,两者相比作为c-met mRNA的相对表达水平。c-met上游引物:5’-GTCAACAAAAACAACGGACC3’,下游引物:5’-GTACTCGTCACTGCGCTCTT-3’。GAPDH 上游引物:5’- GACATGCCGCCTGGAGAAAC-3’,下游引物:5’-AGCCCAGGATGCCCTTTAGT-3’。
1.5 Western blot检测c-met蛋白表达 提取大鼠肝组织蛋白质后,BCA法测定蛋白浓度,分别取100 μg蛋白,变性后经SDS-PAGE电泳分离,经湿转仪湿转120 min,将蛋白转于PVDF膜上,脱脂奶粉封闭2 h,加一抗4 ℃过夜;次日37 ℃复温30 min,缓冲液漂洗3次,每次5 min;加入二抗常温孵育2 h后缓冲液漂洗3次,每次5 min。电化学发光(ECL)液显色后拍照,选用GAPDH为内参。
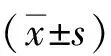
2 结果
2.1 肝脏大体形态改变 术后24 h,LP+PVL组和PVL组大鼠A部肝叶缺血后呈暗红色;B部肝叶红润,呈充血状态;两组肝叶大小无明显差异。术后72 h时,LP+PVL组和PVL组大鼠A部肝叶略有萎缩,7 d萎缩明显,10 d萎缩更加明显;B部术后72 h时明显增大,其后增大缓慢。Sham组A部和B部肝叶均红润,各个时段各肝叶比例无明显变化。各时段剩余肝再生率由高到低依次为LP+PVL组、PVL组、Sham组。术后10 d LP+PVL组的剩余肝再生率高达126.34 %±6.69 %、剩余肝重量/总肝重的比率为60.46 % ± 1.79 %。
2.2 肝组织c-met mRNA表达水平 LP+PVL组、PVL组术后剩余肝组织中c-met mRNA表达均是先下降、后迅速升高,并于术后7 d达到峰值,分别约为Sham组的10倍和3.5倍(表1)。
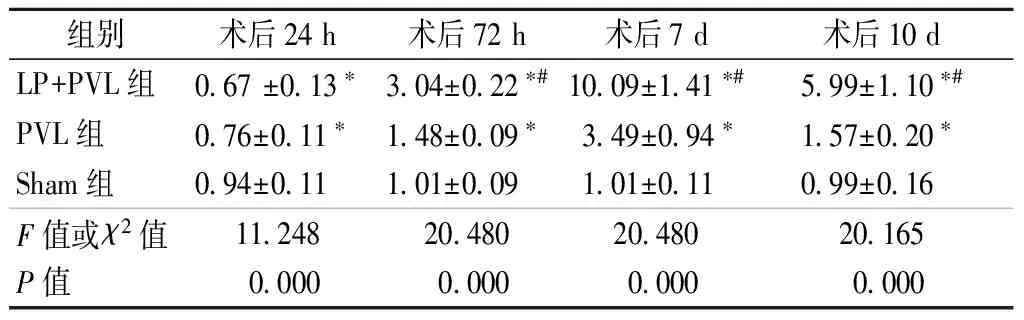
表1 LP+PVL组、PVL组、Sham组不同时间点剩余肝中c-met mRNA的相对表达量
注:*与Sham组比较P<0.05;#与PVL组比较P<0.05
2.3 肝组织c-met蛋白表达水平 与c-met mRNA表达检测结果相似,LP+PVL组、PVL组术后剩余肝组织中c-met蛋白表达也均表现为先下降、后迅速升高,并于术后7 d达到峰值(图1~图4)。
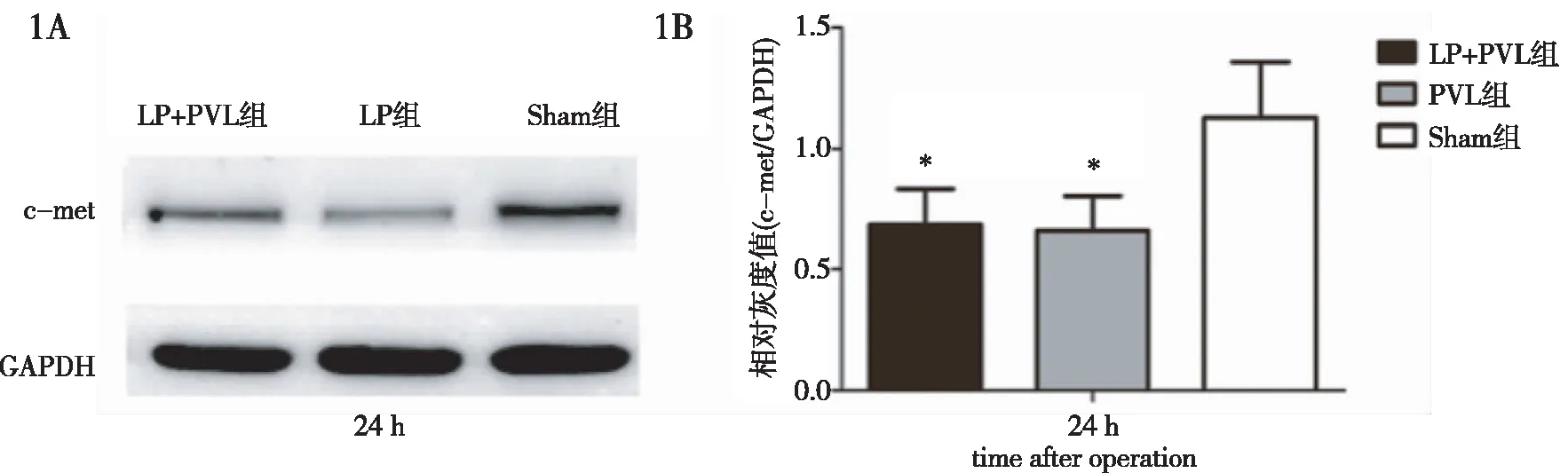
图1 术后24 h LP+PVL组、PVL组、Sham组大鼠c-met蛋白相对表达水平比较。1A:c-met蛋白Western Blot条带;1B:c-met蛋白相对表达水平。*:与Sham组比较P<0.05
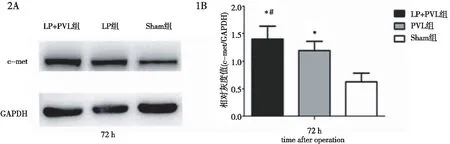
图2 术后72 h LP+PVL组、PVL组、Sham组大鼠c-met蛋白相对表达水平比较。2A:c-met蛋白Western Blot条带;2B:c-met蛋白相对表达水平。*:与Sham组比较P<0.05;#:与PVL组比较P<0.05
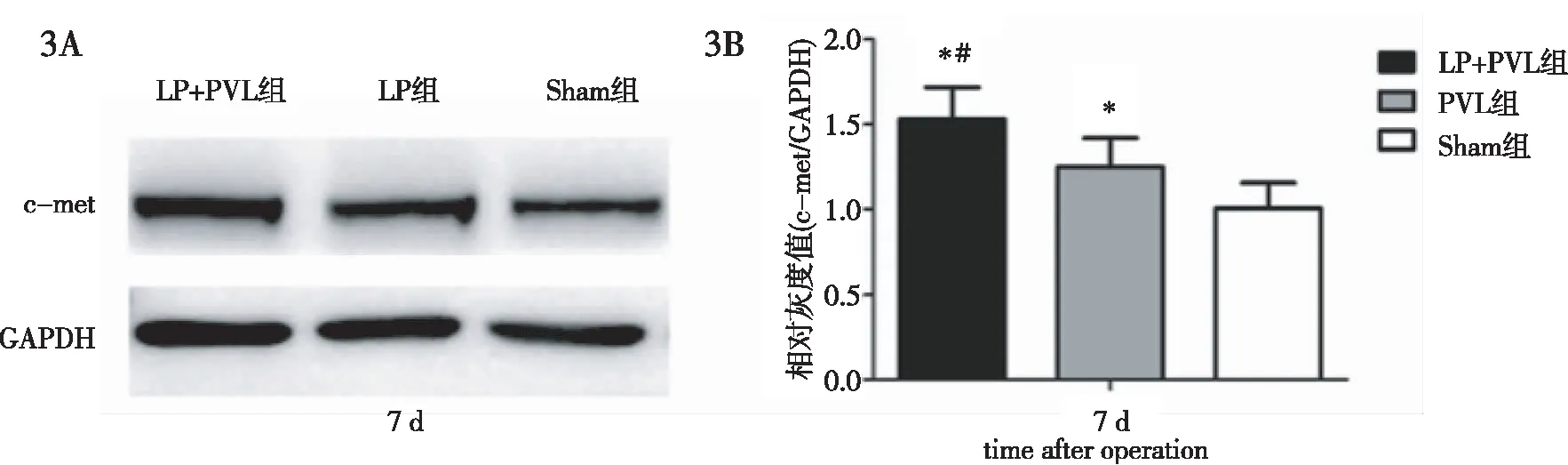
图3 术后7 d LP+PVL组、PV组L、Sham组大鼠c-met蛋白相对表达水平比较。3A:c-met蛋白Western Blot条带;3B:c-met蛋白相对表达水平。*:与Sham组比较P<0.05;#:与PVL组比较P<0.05
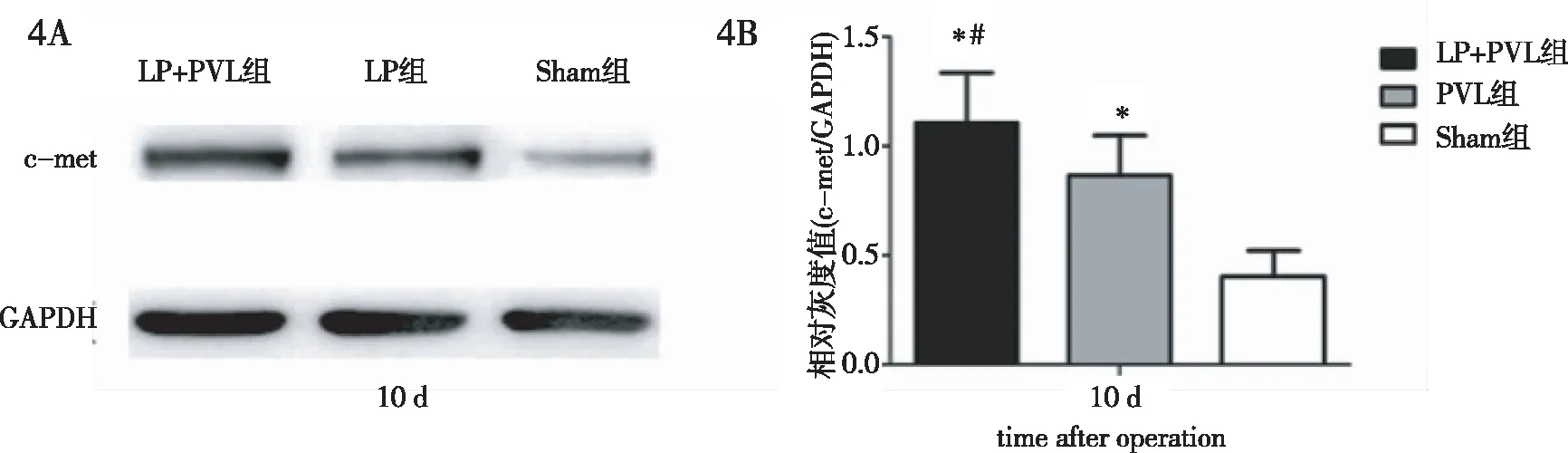
图4 术后10 d LP+PVL组、PVL组、Sham组大鼠c-met蛋白相对表达水平比较。4A:c-met蛋白Western Blot条带;4B:c-met蛋白相对表达水平。*:与Sham组比较P<0.05;#:与PVL组比较P<0.05
3 讨论
本研究采用一种促进剩余肝快速再生的大鼠模型[9],观察肝脏离断+门静脉分支结扎(LP+PVL)术后剩余肝c-met基因和蛋白的表达。结果提示,c-met基因可能与术后剩余肝的快速再生有关。并再次观察到肝脏离断+门静脉分支结扎术能诱导大鼠术后剩余肝的快速再生,说明此模型较稳定、可靠。关于再生机制,可能与门静脉分支结扎后全部门静脉血均流向剩余肝,使其获得更多肝营养因子有关[9,13],同时也可能是肝脏的离断为剩余肝的快速再生提供了足够的刺激。本实验及我们既往研究结果[9]均显示肝脏离断对肝脏造成了较为明显的急性损伤。这一结果与de Santibaes与Madoff等[5,14]的研究结果一致。
目前认为HGF/c-met是肝再生最为重要的信号通路之一[15-16]。该通路的激活能启动Ras/MAPK和P132K/PKB等多条信号传导通路,将增殖信号传至细胞核内,通过调节特定基因的表达而促进肝细胞再生。例如大量肝细胞出现有丝分裂、形态学改变和抗凋亡活性增加,从而在肝脏再生中发挥重要作用[16]。肝部分切除等因素造成的肝脏损伤发生后,HGF/c-met系统表达明显增加,促进肝细胞再生[17]。有研究发现,肝细胞再生取决于肝细胞表面c-met的激活,而非单纯肝细胞生长因子分泌的增多[18]。基于上述理由,我们进行了本实验,设想肝脏离断+门静脉分支结扎术后因肝脏离断造成的急性肝损伤和门静脉分支结扎造成的结扎侧肝脏急性缺血,极有可能通过某种途径激活HGF/c-met通路,从而启动剩余肝的快速再生。结果发现,术后剩余肝c-met基因和蛋白的表达迅速增加,于术后7 d达到峰值,提示c-met基因的激活可能与术后剩余肝的快速再生有关。值得注意的是,术后24 h肝脏离断+门静脉分支结扎术组的剩余肝组织中c-met基因和蛋白的表达均较假手术组有所减少,对此我们推测可能有其他的信号通路也参与了再生调控;同时一周内剩余肝的c-met基因和蛋白表达迅速增加与剩余肝快速再生是否存在因果关系也无法完全确定。以上均有待进一步的研究。
[1] Li J, Huang L, Liu CF, et al. Risk factors and surgical outcomes for spontaneous rupture of BCLC stages A and B hepatocellular carcinoma: a case-control study[J]. World J Gastroenterology, 2014,20(27): 9121-9127.
[2] Li M, Zhou W, Yuan R, et al. ROCK2 promotes HCC proliferation by CEBPD inhibition through phospho-GSK3β/β-catenin signaling[J]. FEBS Lett, 2015, 589(9): 1018-1025.
[3] Mise Y, Sakamoto Y, Ishizawa T, et al. A worldwide survey of the current daily practice in liver surgery[J]. Liver Cancer, 2013, 2(1): 55-66.
[4] Schnitzbauer AA, Lang SA, Goessmann H, et al.Right portal vein ligation combined with in situ splitting induces rapid left lateral liver lobe hypertrophy enabling 2-staged extended right hepatic resection in small-for-size settings[J]. Ann Surg, 2012, 255(3): 405-414.
[6] Tschuor C, Croome KP, Sergeant G, et al.Salvage parenchymal liver transection for patients with insufficient volume increase after portal vein occlusion-An extension of the ALPPS approach[J]. Eur J Surg Oncol, 2013, 39(11): 1230-1235.
[7] Neumann UP, Dejong CH. Split decision[J]. Br J Surg, 2013,100(3): 310-312.
[8] Machado MA, Makdissi FF, Surjan RC. ALPPS procedure with the use of pneumoperitoneum[J]. Ann Surg Oncol, 2013, 20(5): 1491-1493.
[9] 杨勇, 杨军, 丁亮, 等. 建立一种加速剩余肝脏再生的大鼠模型[J]. 中国肿瘤外科杂志, 2016, 8(2): 108-112.
[10] Boost KA,Kim HJ, Engl T,et al.c-met responsiveness of isolatedhepatocytes e-valuated in an in vitro de-differentiation model[J].Int J Mol Med,2006,17(3):475-482.
[11] 朱传龙, 李毓雯, 李文庭, 等. HGF及其受体c-met在肝衰竭与肝部分切除模型中表达差异性研究[J]. 实用肝脏病杂志, 2011, 14(6): 401-403.
[12] Huh CG, Factor VM, Sanchez A, et al. Hepatocyte growth factor/c-met signaling pathway is required for efficient liver regeneration and repair[J]. Proc Natl Acad Sci U S A,2004,101(13): 4477-4482.
[13] Schlegel A, Lesurtel M, Melloul E, et al. ALPPS: from human to mice highlighting accelerated and novel mechanisms of liver regeneration[J]. Ann Surg, 2014,260(5):839-847.
[14] Madoff DC, Hicks ME, Abdalla EK, et al. Portal Vein Embolization with Polyvinyl Alcohol Particles and Coils in Preparation for Major Liver Resection for Hepatobiliary Malignancy: Safety and Effectiveness-Study in 26 Patients[J]. Radiology, 2003, 227(1): 251-260.
[15] Oe S, Fukunaka Y, Hirose T, et al. A trial on regeneration therapy of rat liver cirrhosis by controlled release of hepatocyte growth factor[J]. J Control Release, 2003, 88(2): 193-200.
[16] Borowiak M, Garratt AN, Wüstefeld T, et al. Met provides essential signals for liver regeneration[J]. Proc Natl Acad Sci U S A, 2004, 101(29): 10608-10613.
[17] Kanemura H, limuro Y, Takeuchi M, et al.Hepatocyte growth factor genetransfe-r with naked plasmid DNA ameliorates dimethylnitrosamine-induced liver fibro-sis in rats[J].Hepatol Res,2008,38(9):930-939.
[18] D’Errico A, Fiorentino M, Ponzetto A, et al. Liver hepatocyte growth factor does not always correlate with hepatocellular proliferation in human liver lesions: Its specific receptor c-met does[J]. Hepatology, 1996, 24(1): 60-64.
Expression of proto-oncogene c-met in the future liver remnant after liver partition and portal vein ligation in rats
ANHuasong1,LIXiangnong2,YANGJun2,DINGLiang2,YANGYong2,ZHUANGLei1,HANYadong2,WANGYuan1
(1.TheGraduateSchoolofXuzhouMedicalUniversity,Xuzhou221002,China; 2.DepartmentofGeneralSurgery,TheAffiliatedHospitalofXuzhouMedicalUniversity,Xuzhou221002,China)
Correspondingauthor:LIXiangnong,Email:xnli2002@aliyun.com
Objective To observe the expression of c-met gene and protein in the future liver remnant (FLR) after liver partition and portal vein ligation (LP+PVL) and its role in the rapid regeneration of the remnant liver after operation. Methods A total of 96 male SD rats were randomly divided into 3 groups with 32 rats in each group including the liver partition + portal vein ligation group (the LP+PVL group), the portal vein ligation group (the PVL group) and the sham operation group (the Sham group). The expressions of c-met gene and protein in the future liver remnant (FLR) were measured after 24 h, 72 h, 7 d and 10 d in each group. Results After operation, the expression of c-met mRNA and protein increased, and reached the peak value at 7 (10.09±1.41) d, and was significantly higher than that in the PVL group (3.49±0.94) d (P<0.05). Conclusions The expression of c-met was significantly increased in the future liver remnant after liver partition and portal vein ligation.
Liver partition; Portal vein ligation; c-met; Liver regeneration; Rat
221002 江苏 徐州,徐州医科大学研究生学院(安华松,庄磊,汪源); 221002 江苏 徐州,徐州医科大学附属医院 普外科(李向农,杨军,丁亮,杨勇,韩亚东)
李向农,Email:xnli2002@aliyun.com
10.3969/j.issn.1674-4136.2017.01.004
1674-4136(2017)01-0013-04
2016-07-27][本文编辑:钦嫣]
