血清标志物与急性冠脉综合征的相关性研究
2017-05-15雷蕾
雷蕾
(四川南充川北医学院附属医院心内科,四川 南充 637000)
血清标志物与急性冠脉综合征的相关性研究
雷蕾
(四川南充川北医学院附属医院心内科,四川 南充 637000)
目的探讨急性冠脉综合征患者血清中超敏C-反应蛋白(hsCRP)、同型半胱氨酸(Hcy)、胱抑素(Cys C)浓度的变化。方法将急性冠脉综合征患者分为两组,不稳定心绞痛组和心肌梗死组,分别用酶联免疫法测定两组间hsCRP,Hcy血清浓度,循环酶法测定Cys C血清浓度。结果心肌梗死组hsCRP、胱抑素C的浓度高于不稳定心绞痛组,其中位数和四分位间距分别是:8.59mg/L(3.09~40.88 mg/L);0.82 mg/L(0.65~10.7 mg/L),而不稳定心绞痛组是2.9 mg/L(1.43~5.92 mg/L);11.5 mg/L(9.08~14.70 mg/L),差异具有统计学意义(P<0.05)。心肌梗死组同型半胱氨酸的浓度高于不稳定心绞痛组,分别是11.85 μmol/L(8.27~14.88 μmol/L),11.5 μmol/L(9.08~14.7 μmol/L),差异无统计学意义。心肌梗死组hsCRP与Cys C有相关性(P<0.05)。结论HsCRP、Hcy、Cys C与急性冠脉综合征的发病有关,尤其是心肌梗死。
急性冠脉综合征;超敏C-反应蛋白;同型半胱氨酸;胱抑素C
冠心病是发病率和死亡率高的疾病,严重危害人类健康。目前冠心病的发病原因仍然不清,其中炎症反应、氧化反应,可能是其发病机制之一。本文就急性冠脉综合征患者之间超敏C-反应蛋白、同型半胱氨酸、胱抑素C浓度的变化进行探讨。
1 资料与方法
1.1 临床资料 选取2013年1月~2016年6月在川北医学院附属医院心内科住院的急性冠脉综合征患者722例,年龄65~75岁,平均年龄70岁。其中男449例,女273例。根据内科学第八版冠状动脉粥样硬化性心脏病相关诊断,将患者分为不稳定心绞痛组和心肌梗死组。其中不稳定心绞痛组426例,心肌梗死296例。排除标准:肝、肾疾病(血肌酐>200 μmol/L),自身免疫性疾病、恶性肿瘤等患者。所有试验对象在实验前2周内未服用叶酸、维生素B族及影响 HCY、Cys C代谢的药物(如氨甲喋呤、苯妥因、茶碱等)。
1.2 方法 入选对象均于次日清晨空腹8小时后,经肘静脉抽3mL,加入含有肝素钠预抗凝的真空采血管中,3000r/min离心10 min,1 h内分离血清。以酶联免疫法测定两组间血清hsCRP,Hcy浓度,循环酶法测定血清Cys C浓度。所有试验对象在实验前2周内未服用叶酸、维生素B族及影响 HCY、Cys C代谢的药物(如氨甲喋呤、苯妥因钠、茶碱等)。
1.3 统计学方法 所有数据均用SPSS19.0统计软件处理,计量资料采用“±s”表示,采用t检验,计数资料用率表示,采用卡方检验。属于偏态分布的资料用中位数和四分位数间距表示,采用秩和检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组的临床资料比较 与不稳定心绞痛组相比,心肌梗死组年龄偏大,但无统计学意义。心肌梗死组中男性所占比例高,体重指数偏小,高血压所占的比例更低,差异具有统计学意义。见表1。
2.2 不稳定心绞痛和心肌梗死组血清hsCRP、Hcy、Cys C水平 心肌梗死组hsCRP、Cys C血清浓度高于不稳定心绞痛组,差异具有统计学意义(P<0.05)。血清Cys C浓度两组间差异无统计学意义。见表2。
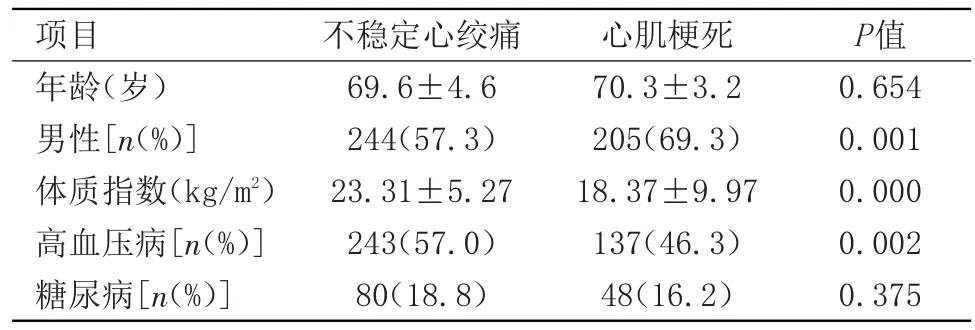
表1 不稳定心绞痛和心肌梗死组的临床资料
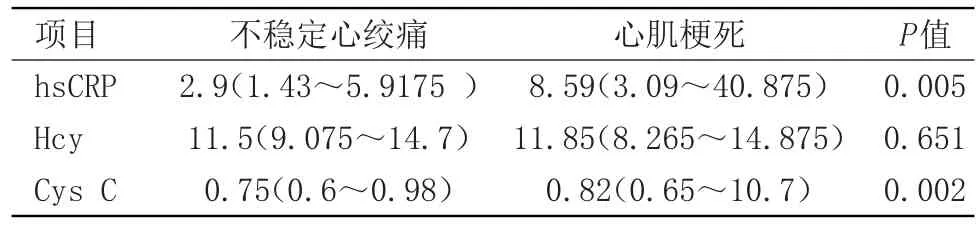
表2 两组血清hsCRP、Hcy、Cys C水平
2.3 不稳定心绞痛和心肌梗死组血清标志物之间相关性心肌梗死组Cys C与hsCRP相关,相关系数0.189(P<0.05)。见表3。

表3 急性冠脉综合征患者血清标志物之间相关性
3 讨论
急性冠脉综合征包括不稳定心绞痛,ST段抬高心肌梗死,非ST段抬高心肌梗死,其共同的病理基础是不稳定的粥样斑块伴发不同程度的继发病理改变。其中炎症反应和氧化应激可能是其发生机制之一。高敏C反应蛋白(high sensitivity C-reactive protein,hs-CRP)是一种炎性反应时相蛋白,主要由肝脏产生,是炎性反应存在及活动的重要指标。高浓度 hs-CRP导致内皮细胞表达ICAM-1和VCAM-1,直接参与局部和全身炎性反应[1],通过损伤血管内皮细胞,促进血管平滑肌异常增生,促进动脉粥样硬化的形成和发展,参与了心血管疾病的形成与发展。高敏C反应蛋白已被认为是冠心病的独立危险因素。有研究表明,hs-CRP与冠心病心肌梗死范围和严重程度具有显著的相关性,与心功能损伤程度密切相关,其含量越高损伤越严重[2-3]。hs-CRP水平的增高反映了冠状动脉粥样硬化的恶化,提示斑块负荷较重。本研究发现,心肌梗死组hs-CRP浓度高于不稳定心绞痛组。提示在临床中心肌梗死病人需要高强度使用他汀抑制炎症反应。同型半胱氨酸(homocysteine,Hcy)是蛋氨酸代谢的中间产物,是一种致血管损伤性氨基酸。高同型半胱氨酸血症也被认为是心血管疾病的一个独立的危险因素[4],其机制[5]是增加氧化应激,抑制血管舒张,刺激血管平滑肌细胞的异常增值,改变血管壁的弹性,以及脂质过氧化等从而增加发生动脉粥样硬化的风险。高Hcy与心肌梗塞病人的预后有关。可以单独引起和促进LDL受体缺乏小鼠的动脉粥样硬化[6]。在小鼠的试验[7]中发现高Hcy血症可以抑制梗死后心肌干细胞在梗死周边区域归巢[8]。一定浓度的Hcy通过调节NF-KB活性调控心肌干细胞的表达,但超过100 mol/L浓度的Hcy却抑制NF-KB活性,抑制心肌干细胞的表达,影响心肌细胞的修复。本研究发现不稳定心绞痛组和心肌梗死组之间同型半胱氨酸浓度没有差异。提示ACS病人需要抗氧化治疗。胱抑素C是一种半胱氨酸蛋白酶抑制剂,以前也被称为-微量蛋白质或γ-白球蛋白,是一种低分子量碱性非糖化蛋白质,由122个氨基酸残基组成,分子量为13.3 KD,广泛存在于各种组织的有核细胞和体液中,产生率恒定,循环中的Cys C仅经肾小球滤过而被清除,因此是一种反映肾小球滤过率变化的内源性标志物。心肌细胞在缺血和缺氧时产生Cys C,依赖半胱氨酸酶活性,通过调节炎症反应及吞噬活性,参与细胞外基质降解等,从而参与心血管疾病的发生[9]。分析其原因可能是:高Cys C血症常合并高血压。Cys C是反映肾功能受损的早期敏感指标,不受性别、年龄及体重指数的影响。肾功能受损本身为冠心病危险因素。可能通过这些因素的综合作用影响心血管系统。新近的研究发现[10],Cys C还与心血管疾病的发生与发展有关,与冠脉狭窄的严重程度有关。在入院诊断为ST段抬高的心肌梗死的患者中,Cys C的浓度与罪犯血管的最初的TIMI血流有关,与ACS病人中冠状动脉疾病的严重程度有关[11]。可以预测心血管事件和死亡。因此Cys C不仅是反映肾功能的良好指标,并可能成为肾功能正常的冠心病患者预测心血管事件的指标,可能用于ACS病人预后分层。本研究发现心肌梗死组比不稳定心绞痛组胱抑素C浓度更高。提示在临床中测定Cys C可以早期筛查危重患者。本研究还发现在心肌梗死病人中,Cys C与hsCRP呈正相关,与以往的研究结果一致[12]。这也证实了Cys C通过炎症反应参与了冠心病的发生发展。
本研究不足之处:没有测定hsCRP, Hcy,Cys C基线值,没有设置正常对照组。入选患者限于老年人,没有对患者进行随访,这将在以后的工作中加以完善。
综上所述,hsCRP,Hcy,Cys C参与了冠心病的发生发展,我们通过测定急性冠脉综合征患者的hsCRP、Hcy、Cys C血清浓度,比较不稳定心绞痛和心肌梗塞组上述指标差异,可以早期对冠心病患者进行危险分层,以更好的指导临床工作。
[1]Jha HC,Divya A,Prasad J,et al.Plasma circulatory markers in male and female patients with coronary artery disease[J].Heart&Lung the Journal of Critical Care,2010,39(4):296-303
[2]VerwoertGC,EliasSmaleSE,RizopoulosD,etal.Does aorti stiffness improve the prediction of coronary heart disease in elderly?The Rottenlam Study[J].Hum Hypertens,2012,26:28-34.
[3]Sokol SI,riniva V,Crandall JP,et al.The effects of vitamin D repletion on endothelial function and inflammation in patients with coronary artery disease[J].Vasc Med,2012,17:394:404.
[4]黄建敏,简崇东,唐雄林,等.老年脑梗死患者高同型半胱氨酸血症和氧化应激及炎性反应的关系研究[J].中华老年心脑血管病杂志,2011(13):249-251.
[5]Ma Y,Li L,Geng XB,et al.Correlation Between Hyperhomocysteinemia and Outcomesof Patients With Acute Myocardial Infarction American[J].Journal of Therapeutics,2014,1-5.
[6]Guo HY,XU FK,LV HT,et al.Hyperhomocysteinemia independently causes and promotes atherosclerosis in LDL receptor-deficient mice[J].Journal of Geriatric Cardiology,2014(11)74-78.
[7]Wan J,Deng YT,Guo JL,et al.Hyperhomocysteinemia inhibited cardiac stem cell homing into the peri-infarcted area post myocardial infarction in rats[J].Experimental and Molecular Pathology,2011,91(1):411–418.
[8]Zhao X,Kuang D,Duan YP,et al.Hyperhomocysteinemia regulated SCF expression in cultured cardiomyocytes via modulation of NF-kB activities[J].Mol Cell Biochem,2015,405:197-203.
[9]Antoniadis AP,Chatzizisis YS,Giannoglou GD.Pathogenetic mechanisms of coronary ectasia[J].Int J Cardiol,2008,130(3):335-343.
[10]Niccoli G,Conte M,Della Bona R,et al.Cystatin C is associated with an increased coronary atherosclerotic burden and a stable plaque phenotype in patients with ischemic heart disease and normal glomerular filtration rate[J].Atherosclerosis,2008,198 (2):373-380.
[11]Abida L,Charfeddine S,Kammoun S,et al.Cystatin C:A prognostic marker after myocardial infarction in patients withoutchronic kidney disease[J].J Saudi Heart Assoc,2016,28(3):144-151.
[12]Zhao R,Li Y,Dai W,et al.Serum Cystatin C and the risk of coronary heart disease in ethnic chinese patients with normal renal Function[J].Lab Medicine, 2016,47(1):13-19.
10.3969/j.issn.1009-4393.2017.14.072
