NSCLC中AEG-1的表达及与临床病理特征和血管生成的关系研究
2017-05-15马志红陈莹蓉董顺利徐旭婷刘进宋鹏涛李鸿伟戴利成
马志红 陈莹蓉 董顺利 徐旭婷 刘进 宋鹏涛 李鸿伟 戴利成
NSCLC中AEG-1的表达及与临床病理特征和血管生成的关系研究
马志红 陈莹蓉 董顺利 徐旭婷 刘进 宋鹏涛 李鸿伟 戴利成
目的 通过分析星形胶质细胞上调基因-1(AEG-1)在非小细胞肺癌(NSCLC)中的表达,探讨其与临床病理特征和血管生成的关系。方法 选取NSCLC患者手术切除标本92例,每例标本均留取肿瘤组织和距肿瘤边缘5 cm以上的配对远端正常组织,采用免疫组织化学染色方法评估AEG-1表达和微血管密度(MVD),比较肿瘤组织AEG-1高表达和低表达患者临床病理特征及肿瘤组织MVD。 结果 NSCLC肿瘤组织AEG-1高表达55例(59.78%),远端正常组织AEG-1高表达7例(7.61%),两者比较差异有统计学意义(P<0.05)。AEG-1高表达患者与AEG-1低表达患者性别、年龄、是否吸烟、肿瘤大小、肿瘤组织类型、肿瘤位置等比较均无统计学差异(均P>0.05),肿瘤TNM分期、分化程度、是否淋巴结转移等比较均有统计学差异(均P<0.05)。肿瘤组织MVD高于远端正常组织(P<0.05)。AEG-1高表达患者肿瘤组织MVD高于低表达患者(P<0.05)。 结论 AEG-1在NSCLC发生、发展中起重要作用,并与肿瘤血管生成密切相关,靶向抑制NSCLC患者AEG-1的表达可能是抗肿瘤治疗的有效途径。
AEG-1 非小细胞肺癌 血管生成 微血管密度 免疫组织化学
肺癌是世界范围内发病率和病死率最高的恶性肿瘤[1]。据统计,2015年我国新发肺癌患者约733 300例,因肺癌致死患者约610 200例[2],其中非小细胞肺癌(NSCLC)占肺癌的80%[3],患者5年生存率低。研究表明,血管生成在NSCLC的发生、发展过程中起重要作用,通过抑制血管生成可明显延缓肿瘤细胞的增殖、扩散和转移。因此,寻找新的抗血管生成治疗靶标是NSCLC靶向治疗的新突破口。星形胶质细胞上调基因-1(AEG-1)在HIV-I感染或TNF-α诱导的人胚胎星形细胞中的表达上调[4],被认为是与肿瘤发生、发展相关的癌基因。本研究采用免疫组织化学方法检测NSCLC肿瘤组织和远端正常组织中AEG-1的表达,分析其与肿瘤临床病理特征和血管生成的关系,现报道如下。
1 对象和方法
1.1 对象 选取2014年1月至2016年12月本院收治的92例原发性NSCLC患者的手术切除标本,每例标本均留取肿瘤组织和距肿瘤边缘5 cm以上的配对远端正常组织,甲醛溶液固定后常规石蜡包埋,4μm连续切片用于组织学检查和免疫组织化学分析。患者均经病理学检查确诊NSCLC,临床资料完整,术前未接受放化疗。本研究经医院医学伦理委员会批准。
1.2 免疫组织化学染色 将组织石蜡切片置于65℃烤箱孵育2 h后常规脱蜡水化,参照Polymer双染检测试剂盒(北京中杉金桥生物技术有限公司,批号DS-0006)说明书进行免疫组织化学操作。切片经3%H2O2室温孵育10min后采用高压修复法进行抗原修复(pH6.0的0.01mol/L枸橼酸盐缓冲液高压3min)。接着,以等比例羊抗人单克隆抗体AEG-1(英国Abcam公司,批号ab124789,1∶300)和兔抗人单克隆抗体CD105(英国Abcam公司,批号ab11414,1∶200)4℃孵育过夜。次日,滴加适量等比例的辣根酶标记山羊抗小鼠IgG聚合物与碱性磷酸酶标记山羊抗兔IgG聚合物的混合液,覆盖组织,孵育30min,最后用DAB和玖红显色剂分别显色5~8min,苏木素复染、脱水、透明后封蜡。
1.3 AEG-1表达评估 根据阳性染色肿瘤细胞的比例和染色强度评估。肿瘤细胞比例:无阳性肿瘤细胞计0分,≤10%计1分,10%~50%计2分,>50%计3分。染色强度:无染色计0分,弱染色(浅黄色)计1分,中等染色(黄棕色)计2分,强染色(棕色)计3分。细胞比例计分×染色强度计分数为总分,总分0~3分视为AEG-1低表达,总分4~9分视为AEG-1高表达。
1.4 微血管密度(MVD)评估 采用血管内皮标记物CD105染色方法评估NSCLC肿瘤组织的MVD。任何与相邻的微血管、肿瘤细胞和结缔组织明显分开的被染成红色的内皮细胞或内皮细胞簇均视为单个计数血管。由2位计数者同时计算200倍放大视野(0.74mm2)下血管最多区域的血管数量,取5个视野的平均值作为MVD。
1.5 统计学处理 应用SPSS 18.0统计软件;计量资料以表示,组间比较采用两独立样本t检验;计数资料以频数和构成比表示,组间比较采用χ2检验。
2 结果
2.1 NSCLC肿瘤组织和远端正常组织中AEG-1表达免疫组织化学染色所见 见图1。
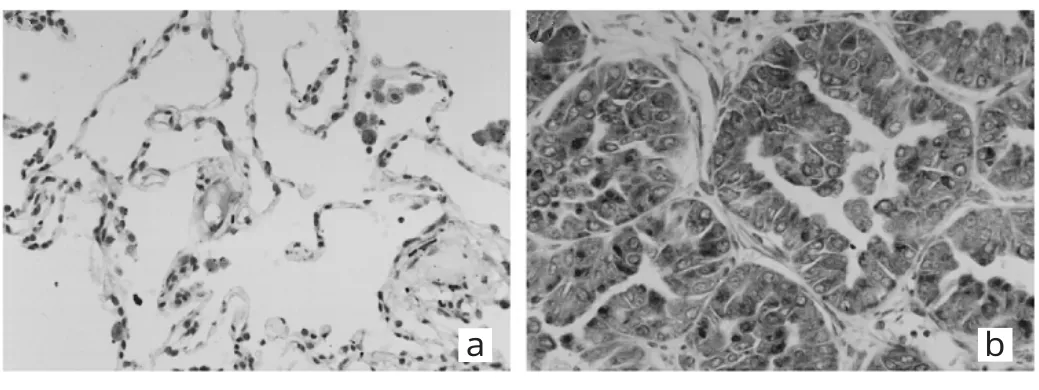
图1 N S C L C肿瘤组织和远端正常组织中A E G-1表达情况免疫组织化学染色所见(a:远端正常组织;b:肿瘤组织;免疫组织化学染色,×2 0 0)
由图1可见,AEG-1阳性染色主要位于细胞质、核膜和细胞连接处。在远端正常组织中AEG-1染色缺失或弱染色;在NSCLC肿瘤组织中AEG-1中等染色,呈黄棕色。NSCLC肿瘤组织 AEG-1高表达 55例(59.78%),远端正常组织AEG-1高表达7例(7.61%),两者比较差异有统计学意义(P<0.05)。
2.2 NSCLC肿瘤组织中AEG-1高表达与低表达患者临床病理特征比较 见表1。
由表1可见,AEG-1高表达患者与AEG-1低表达患者性别、年龄、是否吸烟、肿瘤大小、肿瘤组织类型、肿瘤位置等比较均无统计学差异(均P>0.05),肿瘤TNM分期、分化程度、是否淋巴结转移等比较均有统计学差异(均P<0.05)。
2.3 NSCLC肿瘤组织和远端正常组织中MVD比较见图2。
由图2可见,CD105阳性染色主要位于微血管内皮细胞的细胞质及细胞膜,呈红色。在远端正常组织中CD105表达微弱,MVD为18.59±5.81;在肿瘤组织中CD105阳性表达强烈,MVD为48.39±16.69;两者比较差异有统计学意义(P<0.05)。AEG-1高表达、低表达患者肿瘤组织MVD分别为54.35±16.20、39.54±13.27,两者比较差异有统计学意义(P<0.05)。
3 讨论
AEG-1作为一个致癌基因,在多种恶性肿瘤中高表达[4-8],且其高表达水平与肿瘤的发生、发展、侵袭、转移等密切相关。AEG-1与肿瘤血管生成的研究还未透彻。本研究采用免疫组织化学方法观察NSCLC肿瘤组织中AEG-1的表达,并通过血管内皮标记物CD105探讨AEG-1表达与血管生成的关系。
本研究结果显示,NSCLC肿瘤组织AEG-1高表达率明显高于远端正常组织AEG-1高表达率;AEG-1高表达患者与AEG-1低表达患者性别、年龄、是否吸烟、肿瘤大小、肿瘤组织类型、肿瘤位置等比较均无统计学差异,肿瘤TNM分期、分化程度、是否淋巴结转移等比较均有统计学差异。这表明,AEG-1高表达在NSCLC发生、发展中起重要作用,这与Ke等[9]研究结果相符。
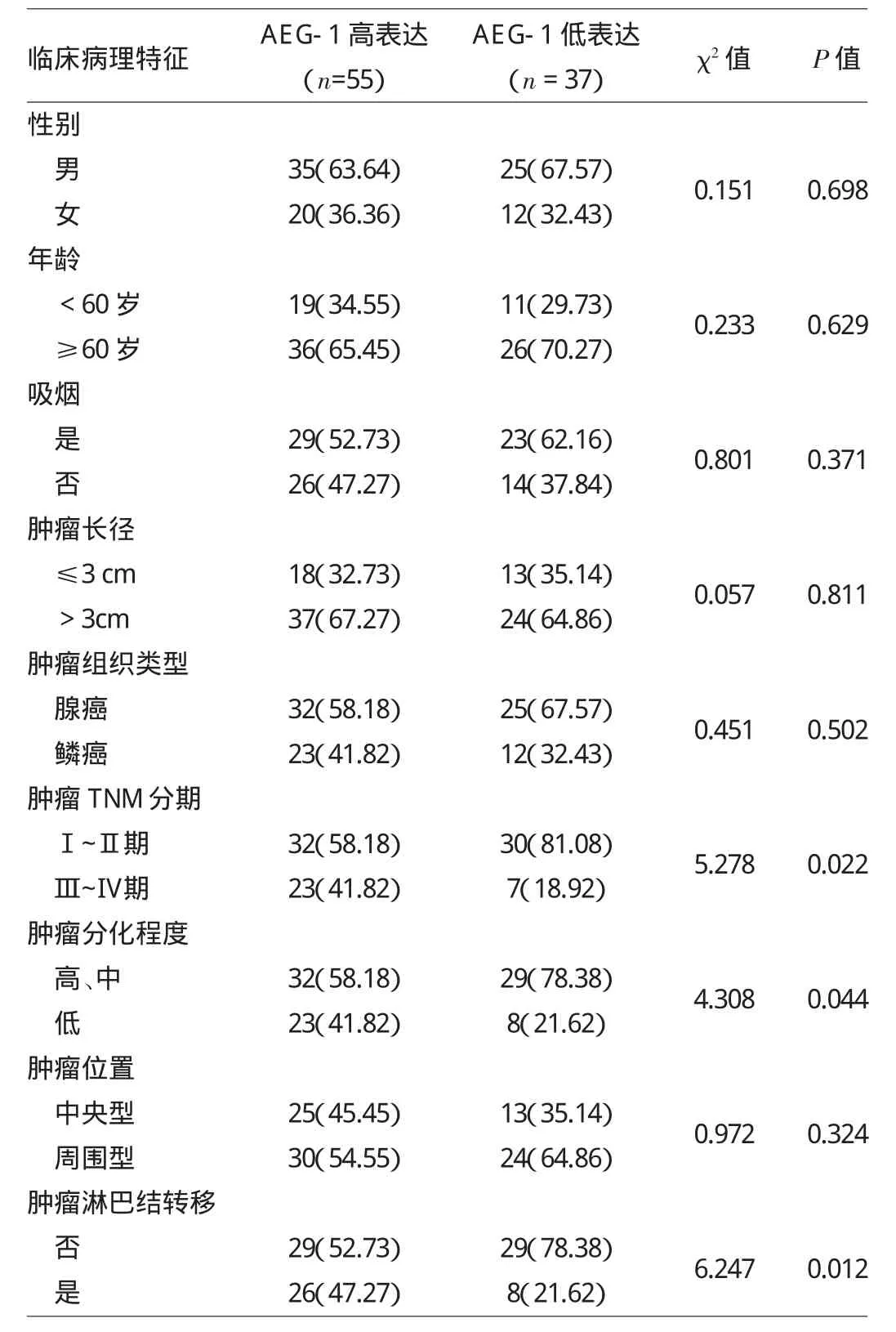
表1 N S C L C肿瘤组织中A E G-1高表达与低表达患者临床病理特征比较[例(%)]
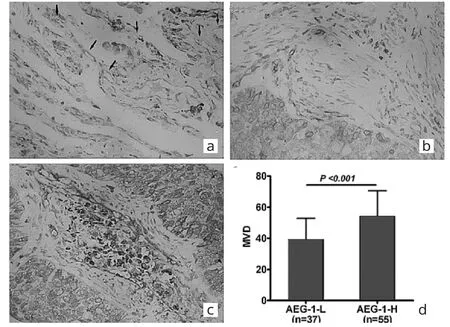
图2 N S C L C肿瘤组织和远端正常组织中M V D比较(a:远端正常组织;b:A E G-1低表达;c:A E G-1高表达;d:A E G-1高表达与低表达比较;C D 1 0 5染色,×2 0 0)
血管生成是指在原有的血管床上生成新血管的过程,主要包括基质降解、内皮细胞增殖、内皮细胞迁移、血管管腔形成及血管重构等步骤,与肿瘤的发生、发展关系非常密切,抑制血管生成是肿瘤防治的有效途径。Zhang等[10]研究发现,相比NSCLC远端正常组织中,肿瘤组织的血管内皮标志物CD34和CD105表达均有明显上调。Minhajat等[11]研究发现,在肺癌组织中CD105高表达。本研究结果显示,在远端正常组织中CD105表达微弱,在肿瘤组织中CD105阳性表达强烈,两者MVD比较差异有统计学意义;AEG-1高表达患者肿瘤组织MVD高于AEG-1低表达患者。这表明,AEG-1可能参与了NSCLC肿瘤组织血管生成的过程。
综上所述,AEG-1在NSCLC发生、发展中起重要作用,并与肿瘤血管生成密切相关,靶向抑制NSCLC患者AEG-1的表达可能是抗肿瘤治疗的有效途径。
[1]Torre L A,Bray F,Siegel R L,et al.Global cancer statistics,2012 [J].CA:a cancer journalfor clinicians,2015,65(2):87-108.
[2]Chen W,Zheng R,Baade P D,et al.Cancer statistics in China, 2015[J].CA:a cancer journalfor clinicians,2016,66(2):115-132.
[3]Devesa S S,Bray F,Vizcaino A P,et al.International lung cancer trends by histologic type:male:female differences diminishing and adenocarcinoma rates rising[J].International journal of cancer,2005,117(2):294-299.
[4]Su Z,Kang D,Chen Y,et al.Identification and cloning of human astrocyte genes displaying elevated expression after infection with HIV-1 or exposure to HIV-1 envelope glycoprotein by rapid subtraction hybridization,RaSH[J].Oncogene,2002,12(22)3592-3602.
[5]Gnosa S,Shen YM,Wang C J,et al.Expression of AEG-1 mRNA and protein in colorectal cancer patients and colon cancer cell lines[J].Journalof translationalmedicine,2012,10(1):1.
[6]Huang K,Li L A,Meng Y,et al.High expression of astrocyte elevated gene-1(AEG-1)is associated with progression of cervical intraepithelial neoplasia and unfavorable prognosis in cervical cancer[J].World journalof surgicaloncology,2013,11(1):1.
[7]Wang Y,Jin X,Song H,et al.aeg-1 as a predictor of sensitivity to neoadjuvant chemotherapy in advanced epithelial ovarian cancer [J].OncoTargets and therapy,2016,9(1):2385.
[8]Lu S,Xu J,Xu X,et al.The expression ofastrocyte elevated gene-1 in human non-small-cell lung cancer and its relationship with postoperative chemotherapy and radiotherapy[J].Histopathology,2015,67(6):817-826.
[9]Ke Z,Mao X,Zeng C,et al.AEG-1 expression characteristics in human non-smallcelllung cancer and its relationship with apoptosis[J].MedicalOncology,2013,30(1):1-9.
[10]Zhang C,Liu Y,Guo S,et al.Different biomarkers in non-small cell lung cancer in blood vessel invasion[J].Cell biochemistry and biophysics,2014,70(2):777-784.
[11]Minhajat R,Mori D,Yamasaki F,et al.Organ‐specific endoglin (CD105)expression in the angiogenesis of human cancers[J]. Pathology international,2006,56(12):717-723.
Expression of AEG-1 in non-small cell lung cancer and its relation to clinicopathological features and angiogenesis
MA Zhihong,
CHEN Yingrong,DONG Shunli,et al.Huzhou Key Laboratory of Molecular Medicine,Huzhou Central Hospital,Huzhou 313000,China
Objective To investigate the expression of astrocyte elevated gene-1(AEG-1)in non-small cell lung cancer (NSCLC)its relation to clinicopathological features and angiogenesis of tumor. Methods Expression of AEG-1,and intratumoral microvessel density (MVD,labeled by CD105)were assessed by immunohistochemistry in 92 NSCLC tissue specimens and corresponding adjacent normal tissue specimens.The relationship of AEG-1 with MVD and clinicopathological features of NSCLC was analyzed. Results The over-expression rate of AEG-1 NSCLC carcinoma tissue was 59.78%(55/92), which was significantly higher than that in adjacent normal tissue(7.61%,7/92)(P<0.05).Upregulated expression of AEG-1 was significantly associated with clinical stage(P<0.05),tumor differentiation(P<0.05),lymph nodes metastasis(P<0.05),and higher MVD (P<0.05)in patients with NSCLC. Conclusion The results suggest that AEG-1 may be involved in malignant transformation and tumor angiogenesis in NSCLC,and targeted inhibition of AEG-1 expression might be a novel strategy for treatment of NSCLC.
Astrocyte elevated gene-1 Non-small cell lung cancer Angiogenesis Intratumoral microvessel density Immunohistochemistry
2 0 1 7-0 2-1 6)
(本文编辑:李媚)
10.12056/j.issn.1006- 2785.2017.39.8.2017- 293
浙江省自然科学基金青年项目(LQ 14H 160015);湖州市公益性技术应用研究一般项目(2013G Y 17,2014G Y B 21)
313000湖州市中心医院分子医学重点实验室(马志红、陈莹蓉、董顺利、徐旭婷、戴利成),病理科(刘进、宋鹏涛),心胸外科(李鸿伟)
戴利成,E- m ail:dlc21@ 126.com
