630~650nm可见光对小鼠创面愈合的影响研究
2017-05-15毛和水江文政王野平仇旭光
毛和水 江文政 王野平 仇旭光
630~650nm可见光对小鼠创面愈合的影响研究
毛和水 江文政 王野平 仇旭光
目的 研究630~650nm可见光对小鼠创面愈合的影响,探讨其调控炎症反应的机制。方法 40只C57BL/6雄性小鼠以脊柱为对称轴,在背部中间两侧对称性制作直径8mm的圆形全层皮肤缺损模型。小鼠左侧创面设为实验侧组,右侧创面设为对照侧组。制模完成后实验侧组创面立即用630~650nm红光治疗仪照射,对照侧组创面用LED台灯照射。观察并比较两组创面不同时点的创面愈合率;采用免疫组化方法检测创面中性粒细胞(PMN)、巨噬细胞(Mφ)等炎性细胞的浸润情况;采用ELISA法检测创面TNF-α、IL-6的表达水平。 结果 制模后3、7、12d,实验侧组创面愈合率均高于对照侧组(均P<0.05)。制模后24h、3d,实验侧组创面PMN、Mφ浸润均较对照侧组减少(均P<0.05)。制模后12、24h,3、7d,实验侧组创面IL-6、TNF-α表达水平均低于对照侧组(均P<0.05)。 结论 630~650nm可见光能适度减少小鼠创面炎性细胞的浸润,抑制炎性因子分泌,在一定程度上降低炎症反应强度,有效促进急性创面的愈合。
630~650nm 可见光 弱激光治疗 创面愈合 炎症反应
1967 年,Mester[1]在研究激光治疗是否有致癌作用时意外发现低强度的红宝石激光(波长690nm)不仅无致癌作用,反而能促进毛发生长。此后众多学者对此进行深入研究,并提出弱激光治疗(LLLT)的概念,即波长在红光至近红外光之间(600~1 000nm),功率密度为0.001~5.000W/cm2的光照射生物组织所致的生物学效应。LLLT过程中局部组织温度不超过36.5℃或正常体温,不会造成不可逆性损伤[2],通过光调节细胞而发挥生物学效应。基于此,本实验通过研究630~650nm可见光对小鼠创面愈合的影响,探讨其调控炎症反应的机制,现报道如下。
1 材料和方法
1.1 材料 (1)实验小鼠:清洁级C57BL/6雄性小鼠40只,体重18~22g,由南京大学模式动物研究所提供[动物许可证号:SYXK(苏)2005-0004]。(2)主要药物、试剂和仪器:S-P免疫组化试剂盒购自上海晶美生物技术有限公司。抗F4/80单克隆抗体、抗Myeloperoxidase单克隆抗体购自英国Abcam公司。柠檬酸缓冲液(pH 6.0)购自上海长岛生物技术有限公司。IL-6酶联免疫检测试剂盒、TNF-α酶联免疫检测试剂盒均购自美国R&D公司。5810R Centrifuge高速低温水平离心机购自德国Eppendorf公司。微量电动组织匀浆器购自美国KIMBLE公司。倒置荧光显微镜摄像系统购自日本Olympus公司。LED台灯购自飞利浦照明投资有限公司,型号酷恩,功率3.6W。红光治疗仪购自深圳普门科技有限公司,型号c a r n a t i o n-6 6,波长(6 4 0±1 0)n m,输出功率5 0 W。
1.2 方法
1.2.1 模型制备和实验分组 3%戊巴比妥钠(50mg/kg)腹腔注射麻醉小鼠,麻醉满意后,背部剃毛;用聚维酮碘消毒溶液消毒皮肤两遍,以脊柱为对称轴,在背部中间两侧对称性制作直径8mm的圆形全层皮肤缺损模型。制模完成后每只小鼠分笼饲养,创面每日拍照记录及换药1次。小鼠左侧创面设为实验侧组,右侧创面设为对照侧组。制模完成后实验侧组创面立即用红光治疗仪照射,能量密度为5J/cm2,时间为200s,1次/d,照射过程中用锡纸遮盖对照侧组创面;对照侧组创面用LED台灯照射,能量密度为0J/cm2,时间为200s,1次/d,照射过程中用锡纸遮盖实验侧组创面。制模后1、12、24h及3、7、12d各随机选取4只小鼠,在距离创缘3mm的范围内切取标本,一分为二,置于Eppondorf管中-80℃冰箱保存,其中1份采用ELISA法检测TNF-α、IL-6的表达,另1份用10%甲醛溶液固定,采用免疫组化方法检测组织中性粒细胞(PMN)、巨噬细胞(Mφ)等炎性细胞的浸润情况。
1.2.2 创面愈合情况评估 肉眼观察到创面完全被上皮组织覆盖即为创面愈合。两组创面均于制模后第3、7、12d应用Image-J分析数码相机拍摄图像,并按以下公式计算创面愈合率。创面愈合率=(初始创面面积-未愈合创面面积)/初始创面面积×100%。
1.2.3 PMN、Mφ检测 标本常规制作石蜡包埋切片,切取厚度为5μm。经免疫组化染色,检测创面组织中PMN、Mφ的浸润情况。PMN免疫组化染色:一抗为兔源性MPO多克隆抗体,细胞质染色提示阳性。Mφ免疫组化染色:一抗为大鼠源性F4/80单克隆抗体,细胞质染色提示阳性。光镜下观察两组创面的炎症细胞浸润情况;400倍显微镜下随机选取6个视野行计算机图像分析计数PMN、Mφ并取平均值。
1.2.4 TNF-α、IL-6检测 采用ELISA法测定两组创面不同时点TNF-α、IL-6蛋白的表达水平,操作按试剂盒说明书进行。预先包被的抗体为单克隆抗体,检测相抗体为多克隆抗体,经生物素标记。组织匀浆,取上清液。样品和生物素标记抗体先后加入酶标板孔反应后,PBS洗涤。随后加入过氧化物酶标记的亲和素反应;经过PBS的彻底洗涤后用底物TMB显色。TMB在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。颜色的深浅和样品中的TNFα、IL-6呈正相关,随后用酶标仪在450nm测定吸光度值。通过绘制标准曲线求出创面组织TNF-α、IL-6蛋白表达水平。
1.3 统计学处理 应用SPSS 13.0统计软件;计量资料以表示,两组比较采用配对t检验。
2 结果
2.1 两组创面各时点愈合情况比较 见图1、表1。

图1 两组创面各时点愈合情况肉眼观察比较

表1 两组创面各时点愈合率比较(%)
由图1可见,制模后3d开始,实验侧组创面较对照侧组创面干燥,创面上皮化明显加快。由表1可见,制模后3、7、12d,实验侧组创面愈合率均高于对照侧组(均P<0.05)。
2.2 两组创面各时点PMN、Mφ浸润情况比较
2.2.1 两组创面各时点PMN浸润情况比较 见图2、表2。
由图2可见,制模后24h,实验侧组创面PMN浸润较对照侧组减少。由表2可见,制模后1h,两组创面PMN浸润比较无统计学差异(P>0.05);制模后12h、24h、3d,实验侧组创面PMN浸润均较对照侧组减少(均P<0.05);制模后7、12d,两组创面PMN浸润比较均无统计学差异(均P>0.05)。
2.2.2 两组创面各时点Mφ浸润情况比较 见图3、表3。
由图3可见,制模后7d,实验侧组创面Mφ浸润较对照侧组减少。由表3可见,制模后1、12h,两组创面Mφ浸润比较均无统计学差异(均P>0.05);制模后24h,3、7、12d,实验侧组创面Mφ浸润均较对照侧组减少(均P<0.05)。
2.3 两组创面各时点IL-6、TNF-α表达水平比较 见表4。

图2 两组创面制模后2 4 h P M N浸润情况比较(a:实验侧组;b:对照侧组;免疫组化染色,×4 0 0)

图3 两组创面制模后7 d M φ浸润情况比较(a:实验侧组;b:对照侧组;免疫组化染色,×4 0 0)
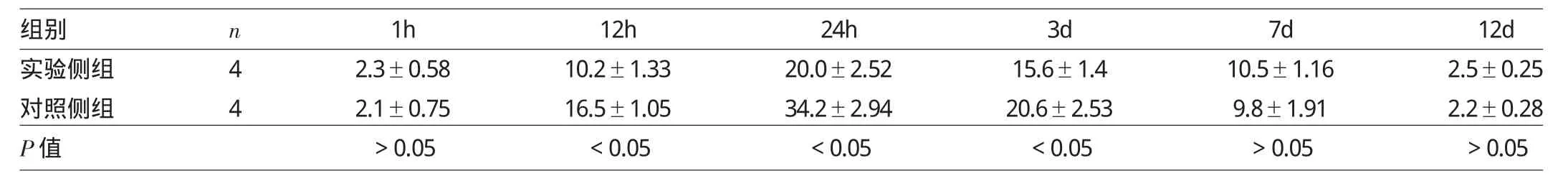
表2 两组创面各时点P M N浸润情况比较(个)

表3 两组创面各时点M φ浸润情况比较(个)

表4 两组创面各时点I L-6、T N F-α表达水平比较
由表4可见,制模后1h,两组创面IL-6、TNF-α表达水平比较均无统计学差异(均P>0.05);制模后12、24h,3、7d,实验侧组创面IL-6、TNF-α表达水平均低于对照侧组(均P<0.05);制模后12d,两组创面IL-6、TNF-α表达水平比较均无统计学差异(均P>0.05)。
3 讨论
正常的创面愈合是复杂而有序的生物学过程,炎症反应从中扮演着重要角色。适度而有序的炎症反应能够有效促进愈合,不足或过激则会影响创面愈合[3]。目前LLLT主要应用于促进创面愈合及组织修复,缓解因急慢性疾病引起的炎症、水肿、疼痛,以及治疗其他神经系统疾病[4]。创面愈合是LLLT较早应用的领域之一。实验研究证明,LLLT对创面愈合的各个环节均有作用[5]:它能促使炎性细胞向创面迁移,并增强其功能;能刺激上皮细胞、内皮细胞、角蛋白形成细胞、成纤维细胞等修复细胞增殖;促进胶原蛋白的合成和沉积,促进血管新生,促进组织重塑。
本实验结果显示,小鼠实验侧组创面在制模后3d愈合开始加速,伤后12d已全部愈合,而对照侧组创面此时仍有部分未愈。这提示LLLT能有效促进急性创面愈合。本实验观察到,在整个创面愈合过程中,尤其是在炎症早期,实验侧组创面PMN、Mφ浸润均较对照侧组减少;在各时点,实验侧组创面IL-6、TNF-α表达水平均低于对照侧组。这表明LLLT在炎症反应阶段能适度减少创面PMN、Mφ的浸润,进而降低炎症反应强度。炎性细胞的的适时、适度浸润,能够启动机体自我防御性保护机制,降解坏死组织和病原体,分泌某些细胞因子(如IL-6、TNF-α、生长因子等)。这些细胞因子既能促进炎性细胞的趋化、浸润又能促进各类修复细胞增殖、分化,形成大量细胞外基质和毛细血管,促进上皮化。后期炎症反应强度的下降避免了过度炎症的不利影响,从而促进创面愈合。研究发现,LLLT通过调控NF-Kb信号通路,调节多种细胞因子、炎症介质和生长因子的合成、分泌,如减少炎性细胞的浸润,减少IL-6、TNF-α等炎性因子的分泌[6];促进血管内皮生长因子、角质细胞生长因子、碱性成纤维细胞生长因子等细胞/生长因子的生成和释放[7],而这些生长因子使得包括上皮细胞、内皮细胞、角化细胞、淋巴细胞、纤维细胞等细胞增殖并促进胶原蛋白的合成、血管新生、肉芽形成,从而加速创面愈合[8]。
综上所述,本实验研究表明630~650nm可见光能适度减少小鼠创面PMN、Mφ的浸润,抑制IL-6、TNF-α等炎性因子分泌,在一定程度上降低炎症反应强度,有效促进急性创面的愈合。
[1]Mester E.The effect of laser beams on the growth of hair in mice [J].RadiobiolRadiother,1968,9(5):621-626.
[2]Shirin Farivar,Talieh Malekshahabi,Reza Shiari,et al.Biological Effects of Low LevelLaser Therapy[J].J Lasers Med Sci,2014,5 (2):58-62.
[3]青春.皮肤局部炎症反应与创面修复[J].创伤外科杂志,2009,11(5): 385-387.
[4]Chung H,Dai T,Sharma S K,et al.The nuts and bolts of low level laser(light)therapy[J].Ann Biomed Eng,2012,40(2):516-533.
[5]Amid R,Kadkhodazadeh M,Ahsaie M G,et al.Effect of low level laser therapy on proliferation and differentiation of the cells contributing in bone regeneration[J].J Laser MedSci,2014,5(4):163-170.
[6]Gupta A,KeshriG K,Yadav A,et al.Superpulsed(Ga-As,904 nm) low-level laser therapy(LLLT)attenuates inflammatory response andenhances healing of burn wounds[J].J Biophotonics,2015,8 (6):489-501.
[7]Kuffler D P.Photobiomodulation in promoting wound healing:a review[J].Regen Med,2016,11(1):107-122.
[8]毛和水,姚敏,方勇.弱激光疗法在创面愈合中的作用研究进展[J].中华烧伤杂志2012,28(6):462-465.
630-650nm visiblelightpromotesacutewound healing in mice
MAO Heshui,JIANG Wenzheng,WANG Yeping,etal.
Department of Burn and Plastic Surgery,Jinhua Central Hospital,Jinhua 321000,China
Objective To investigate the effects of 630-650nm visible light on wound healing in mice. Methods The round full-thickness skin defects of 8mm diameter were symmetrically made in the back of 40 male C57BL/6 mice.The left side of the wound was exposed to 630-650nm visible lights immediately after modeling(study group)and the right side was treated with normal LED light(control group).The wound healing rate at different time points was observed and compared between two groups.The infiltrations of neutrophils(PMN)and macrophages(Mφ)were detected by immunohistochemical staining;and the expression of TNF-a and IL-6 was detected with ELISA. Results The wound healing rate at 3d,7d and 12d after modeling in study group was significantly higher than that in control group(P<0.05).The infiltration of PMN and Mφ was lower in study group than that in control group at 24h and 3d after the modeling (P<0.05).The protein expression of IL-6 and TNF-α was lower in study group than that in control group at 12h,24h,3d and 7d after the modeling(P<0.05). Conclusion 630~650nm visible light can promote the healing of acute wounds in mice,which is associated with the decreased infiltration of inflammatory cells and inhibiting the secretion of inflammatory factors.
630~650nm Visible lightLLLT Wound healing Inflammatory response
2 0 1 7-0 1-1 8)
(本文编辑:李媚)
10.12056/j.issn.1006- 2785.2017.39.8.2017- 140
321000金华市中心医院烧伤整形皮肤外科
仇旭光,E- m ail:qw xg@ sohu.com
