台东苏铁中RNA不同提取方法的比较
2017-05-12沈成才北京师范大学克拉玛依附属学校新疆克拉玛依834000
沈成才 (北京师范大学克拉玛依附属学校 新疆克拉玛依 834000)
苏铁(Cycas revoluteThunb),苏铁科苏铁属,又名凤尾蕉、金代、铁树等,苏铁科植物是世界上最古老的裸子植物,被誉为“植物的活化石”[1]。苏铁对研究种子植物的起源与演化、种子植物的区系和古气候的变迁、基因表达与调控、遗传多样性和亲缘关系等都有重要意义[2]。苏铁RNA的提取对生物学特性和分子生物学的研究至关重要,较高质量的RNA可为Northern杂交、cDNA文库建构、RT-PCR及RNA编辑位点的研究等提供保证。
现阶段植物总RNA的提取技术已经比较成熟,有多种方法可供选择,例如胍盐法、SDS法、CTAB法、苯酚法、LiCl沉淀法、异硫氰酸胍法,商品化试剂盒法等[3]。RNA的提取方法很多,但这些方法在RNA提取材料上都具有一定针对性,适用范围有限,尤其是裸子植物的RNA提取相对较难。由于苏铁中大量的多糖、多酚等次级代谢产物在细胞破碎后会以不同方式干扰RNA的提取,例如:酚类物质氧化后可使RNA活性丧失,多糖可形成难溶胶状物与RNA沉淀,内源RNase及操作体系中的外源RNase的污染[4],加之RNA的不稳定性,使得苏铁中RNA的提取难度加大。
通过阅读大量文献,发现针对苏铁中RNA提取方法的研究较少,李璐等人在常规的CTBA法中,加入硼砂和巯基乙醇提取苏铁叶片中的RNA[5]。现阶段,由于小麦总RNA的提取技术比较成熟[6]。因此,笔者选择小麦做参照,采用异硫氰酸胍法、试剂盒法和CTAB法提取苏铁和小麦RNA,以确定最佳提取方法。
1 材料与方法
1.1 材料
1.1.1 实验材料 台东苏铁(Cycas taitungensis),购买于西安三森市场。
1.1.2 实验试剂 CTAB,PVP,2-巯基乙醇,LiCl,DEPC,Tris-base,EB, 硼酸,EDTA-2Na, 溴酚蓝,十二烷基肌氨酸钠,异硫氰酸胍,柠檬酸钠,水饱和酚酸,亚精胺,植物RNA提取试剂盒,无水乙醇,液氮,氯仿,异戊醇,异丙醇。
GT溶液(4 mol/L异硫氰酸胍,25 mmol/L柠檬酸钠,0.5%十二烷基肌氨酸钠);RNA提取液(20 g/L CTAB,20 g/L PVP,50 mmol/L EDTA,4.0 mol/L NaCl);10×TBE 电泳缓冲液 (108 g Tris;55 g 硼酸;9.3 g EDTA-2Na;1 000 mL;pH 8.0);1%琼脂糖凝胶(0.2 g琼脂糖;1×TBE缓冲液 20 mL;2 μL EB); 3 mol/L NaAc (pH 5.8),2 mol/L NaAc(pH 4.8),4 mol/L LiCl,0.1%DEPC 水。 天根公司植物总RNA提取试剂盒。
1.1.3 实验仪器 DYY-12型电泳仪;PB-10型pH计;BS-124S型电子天平;YDS-30型液氮生物容器;DSX-280A型不锈钢手提式压力蒸汽灭菌锅;JB-3定时恒温磁力搅拌器;DYCP-31DN电泳槽;Centrifuge 5804R型台式冷冻离心机;Centrifuge 5417C型台式高速离心机;AGX-7601型通风橱;精密微量移液器;GDS-8000型凝胶成像系统;UNICAM UV300型紫外分光光度计;HH-2B型数显恒温水浴锅;DW-86L368型超低温冰箱;GZX-9140MBE型数显鼓风干燥箱;PE手套,离心管,枪头。
1.2 方法
1.2.1 异硫氰酸胍法提取植物叶片总RNA
1)称取0.1 g新鲜植物叶片,加入液氮研磨成粉末,移入预冷的1.5 mL Eppendorf管中。
2)加入 300 μL GT 溶液,混匀;加入 30 μL 2 mol/L NaAc(pH 4.8),反复振荡混匀;加入300 μL 酚酸与 100 μL 氯仿,混匀。
3)4℃,8 000 r/min 离心 15 min, 弃沉淀,取上清移至用DEPC水处理过的另一干净离心管中,加入2.5倍体积无水乙醇,-20℃放置5~6 h。(-20℃可放置过夜)
4)4℃,8 000 r/min 离心 15 min, 弃上清液。在沉淀中加入100 μL 4 mol/L LiCl,使沉淀溶解。
5)12 500 r/min 离心 15 min,弃上清液;在沉淀中加入100 μL灭菌后的DEPC水,混匀后再加入 50 μL氯仿,50 μL水饱和酚酸混匀。
6)12 500 r/min离心5 min,吸上清液移至另一DEPC水处理过的1.5 mL Eppendorf管,加入等体积氯仿。
7)12 500 r/min离心5 min。吸上清液移至另一DEPC水处理过的1.5 mL Eppendorf管,加入1/10体积 3 mol/L NaAc(pH 5.8)和 2倍体积无水乙醇,-20℃放置过夜。
8)12 500 r/min离心 5 min,小心吸去上清液,RNA沉淀在室温下稍干燥。
9)加入20 μL DEPC处理过的灭菌水溶解,取5 μL样品经1.0%琼脂糖凝胶电泳检测(100 V,100 mA,20 min)RNA 质量, 并取 2 μL 样品加入498 μL DEPC处理过的水,用紫外分光光度计测定RNA浓度;其余样品-20℃保存备用。
1.2.2 CTAB法提取植物叶片总RNA
1)取不超过50 mg植物叶片于研钵中,加液氮研磨成粉末状;然后转入1.5 mL离心管中。
2)加入 600 μL RNA 提取液(预先在 65℃水浴中保温 1 h),3 μL 亚精氨和 12 μL β-巯基乙醇,混匀。
3)加入等体积的氯仿-异戊醇(24∶1 即 624 μL∶26 μL),混匀,12 000 r/min,4℃离心 10 min。 用移液枪小心吸取上层清液于另一离心管中,重复抽提一次(20 μL β-巯基乙醇)。
4)取上清液于另一支1.5 mL离心管中,加入1/4体积的 10 mol/L LiCl混匀过夜(2 h)。
5)12 000 r/min,4℃离心 20 min。 去上清液,用 100 μL/200 μL DEPC 溶解沉淀。
6)再加上等体积的氯仿-异戊醇抽提,12 000 r/min,4℃ 10 min,然后用移液枪小心吸取上层清液于另一支1.5 mL离心管中,加入2倍体积的无水乙醇沉淀RNA,-20℃,2 h。
7)12 000 r/min,4℃离心 20 min。 去上清液,用 750 mL的乙醇洗涤沉淀,加入20 μL DEPC溶解沉淀,取 5 μL样品经 1.0%琼脂糖凝胶电泳检测(100 V,100 mA,20 min) RNA 质量,并取2 μL样品加入498 μL DEPC处理过的水,用紫外分光光度计测定RNA浓度;其余样品-20℃保存备用。
1.2.3 试剂盒法
1)取不多于0.1 g研磨过的冷冻苏铁叶片,加入0.5 mL提取试剂,振荡至彻底混匀。
2)室温放置5 min。平放离心管使表面积增大。
3)12 000 r/min,4℃离心 1 min。 上清液转入新的1.5 mL离心管中。
4)加入 0.1 mL NaCl,温和混匀。
5)加入0.3 mL氯仿上下颠倒混匀。
6) 12 000 r/min,4℃离心 10 min。 取上层水相于新的1.5 mL离心管中。(重复5、6)
7)加所得水相等体积的异丙醇,混匀,室温放置10 min。
8)12 000 r/min,4℃离心 10 min。 去上清液,加1 mL无水乙醇。
9)12 000 r/min,4℃离心 3 min。倒出液体,室温晾干。
10)加 50 μL DEPC 水,充分溶解,取 5 μL 样品经1.0%琼脂糖凝胶电泳检测(100 V,100 mA,20 min)RNA 质量, 并取 2 μL 样品加入 498 μL DEPC处理过的水,用紫外分光光度计测定RNA浓度;其余样品-20℃保存备用。
2 结果和分析
通过比较3种RNA提取方法的电泳结果,可以看出使用改良的异硫氰酸胍法提取苏铁的RNA,28S RNA和18S RNA条带边缘清晰,DNA含量少(图1);试剂盒法得到的RNA含量很多,但28S RNA和18S RNA条带模糊,拖带较为严重。DNA条带粗而亮,说明对DNA的处理不充分(图2);CTAB法提取的RNA的电泳结果显示,DNA条带较亮,DNA杂质较为明显,且28S RNA和18S RNA条带呈弥散状,表明RNA分解较为明显(图3)。可见,使用改良的异硫氰酸胍法提取苏铁总RNA较为合适。

图1 异硫氰酸胍法提取苏铁总RNA的电泳结果
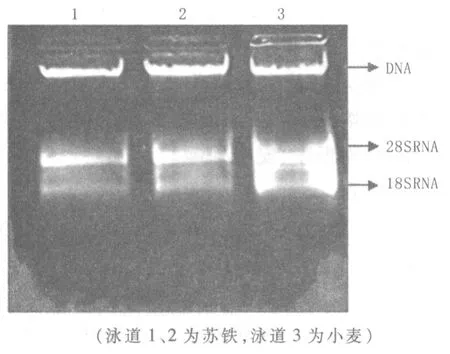
图2 试剂盒法提取苏铁总RNA的电泳结果

图3 CTAB法提取苏铁总RNA的电泳结果
3 讨论与小结
CTBA法中加入的β-巯基乙醇能有效抑制酚类物质的氧化,用氯仿-异戊醇、LiCl沉淀分离出RNA,但效果并不理想,可能并不适合提取台东苏铁的RNA,或有待进一步改进;试剂盒法提取台东苏铁的RNA含量多,但28S RNA和18S RNA的条带边缘弥散,样品中混有较多DNA,降低了产物的纯度和效率。购买的试剂盒价格较高,一次提取材料相对较少,增加了实验成本。
改良的异硫氰酸胍法提取苏铁总RNA的方法中,异硫氰酸胍是一种烈性蛋白变性剂,可抑制RNase的活性,有效解离核蛋白与核酸复合体,加入的LiCl可以选择性沉淀RNA,用酚、氯仿、无水乙醇等有机溶剂纯化RNA。整个提取RNA的过程只需勤换一次性PE手套,谨慎在冰上操作,即可提取出质量很好的RNA。28S RNA和18S RNA条带明亮、清晰,且28S RNA的亮度在18S RNA条带的2倍以上,A260/A280比值在2.0左右。提取的台东苏铁RNA样品,在-20℃保存1个月后仍可用于后续RT-PCR。改良的异硫氰酸胍法不仅可以提取大量材料,还得到了纯度较高的RNA,且样品中混有的DNA也比较少,有利于一系列基因的下游操作[7]。
可见,采用改良的异硫氰酸胍法比较适合提取台东苏铁的总RNA,不仅可以得到用于分子生物学研究的高质量RNA,还节约了实验成本。此方法的研究,为苏铁的分子生物学乃至生物进化等方面的研究提供了良好的技术保证,也为裸子植物的RNA提取方法提供了参考。
[1]Takahiko T, Tatsuya W,Masahiro S.Comparative analysis of RNA editing wites in higher plant chloroplasts.Journal of Molecular Evolution,2001,53(4-5):327.
[2]傅瑞树.苏铁研究的现状及展望.武夷科学,2000(16):187.
[3]E M Moller,G Bahnweg,H Sandermann,et al.A simple and efficient protocol for isolation of high molecular weight DNA from filamentous fungi,fruit bodies,and infected plant tissues.Nucleic Acids Research,1992,20(20):6115.
[4]杨占军,谷守琴,张健.几种植物组织总RNA提取方法的特点及疑难对策.安徽农业科学,2009,37(18):8341.
[5]LI Lu,FU Qiantang,YU Diqiu.An effective protocol for the isolation of RNA from Cycad Leaves.Acta Botanica Yunnanica.2008,30(5):593.
[6]Tadamasa Sasaki,Yasushi Yukawa,Tetsuya Miyamoto,et al.Identification of RNA EditingSites in chloroplast Transcripts from the Maternal and Paternal Progenitors of Tobacco(Nicotiana tabacum):Comparative analysisshows the involvement of distinct trans-factors for ndhB editing.Molecular.Biology and Evolution,2003,20(7):1028.
[7]Wang Jie,Wang Quan,et al.Comparison and analysis of RNA extracting method from different plant tissues.Journal of Beijing University of Agriculture.2015,30(1):76.
(E-mail:2516708405@qq.com)
