紫外线诱导DNA损伤及修复研究的起因与发展
2017-05-12白冠军任衍钢宋玉奇卫红萍
白冠军 任衍钢 宋玉奇 卫红萍
(阳泉师范高等专科学校 山西阳泉 045200)
截至目前,DNA是唯一一种在发生损伤以后可以被完全修复的分子,而其他生物大分子在受到损伤后会被降解和取代。DNA修复的发现首先归结于紫外线诱导DNA突变的研究。早在1890年就有报道,阳光能够杀死细菌,但当时人们并不知道其中的原因。1914年,亨利(V.Henri)发现紫外线能诱导细菌突变,但当时人们并没有从基因水平上探讨[1]。1941年,美国著名科学家霍兰德(Alexander Hollaender)受 穆勒(Herman J.Muller,1946年诺贝尔生理学或医学奖获得者)的启发,重新发现了紫外线能诱导微生物突变[2]。在对紫外线诱导DNA损伤的研究中,科学家发现了DNA的修复现象。对DNA修复现象的研究又揭开了一系列DNA修复的机制。在这些研究中,DNA修复紫外线诱导DNA损伤始终是DNA修复研究的一条主线。
1 DNA直接修复的发现与揭示
DNA修复首先从DNA光修复(enzymatic photoreactivation,EPR)的发现开始。光修复发现于20世纪40年代末,揭开这个序幕的是2位年轻博士后。一位是在美国冷泉港著名科学家德梅雷茨(Milislav Demerec)实验室工作的克拉尔(Albert Kelner),当他正尝试通过紫外线(200~300 nm)照射诱导灰色链霉菌突变体以便产生对细菌更有效的抗体时,意外发现暴露在荧光下琼脂板上的大肠杆菌和灰色链霉菌可减少死亡。著名科学家德尔布吕克(Max Delbruck,1969年诺贝尔生理学和医学奖获得者)了解到这些情况后,建议克拉尔将这一现象命名为光复活(photoreactivation)[4]。 另一位是在伯明顿的印第安纳大学卢里亚(Salvador Luria,1969年诺贝尔生理学或医学奖获得者)实验室工作的杜尔贝科(Renato Dulbecco,1975年诺贝尔生理学或医学奖获得者),他发现放在架子顶部培养噬菌体的琼脂板出现了许多噬菌斑,而在架子下部却不存在,杜尔贝科敏锐地意识到,这是光对DNA复制产生了影响[3],这种现象可能与酶有关,而光是其中一个重要因素。
为什么弱的蓝光能诱导强的紫外光诱变DNA逆转为正常状态?20世纪50年代末这种似乎有悖于物理学规律的特殊现象引起了物理学家鲁伯特(Claud Rupert)的兴趣,他先用大肠杆菌作为实验材料开始研究,但结果并不理想。1960年,鲁伯特改用啤酒酵母粗提取液进行尝试后发现,这种能使紫外线诱变的DNA逆转为正常状态的酶对蓝光特别敏感,故命名这种酶为光复合酶(photoreactivating enzyme)[4]。 同年,荷兰科学家伯凯尔(Rob Beukers)和贝伦茨(Wouter Berends)证实,紫外线引起DNA损伤的原因是DNA上相邻的嘧啶以共价键相互结合形成胸腺嘧啶二聚体[5]。杜尔贝科通过一系列实验证实,这种酶完全符合Michaelis-Menten动力学特征,并在此基础上提出了2个胸腺嘧啶形成的环丁烷嘧啶二聚体可被光恢复的假说。该假说在1962年分别被伍尔夫(Daniel L.Wulff)和塞特卢(Richard B.Setlow)等通过啤酒酵母的实验所证实。光复合酶的发现标志着DNA修复酶学研究的开始,并对后续的DNA修复研究起着重要的推动作用。同年,鲁伯特在光修复化学动力学分析的基础上,指出光修复酶首先在没有可见光的条件下与紫外线照射的DNA形成稳定的复合物,并且该酶促反应受到光强度的制约。此后,赛特卢和库克(J.S.Cook)进一步证实,光修复酶使嘧啶二聚体再分解成2个单体,形成2个正常的胸腺嘧啶,使受损DNA得以修复。由于这个反应涉及到C-C键的断裂,迈纳特(S.Minato)和沃尔宾(H.Werbin)将这种酶重新命名为光裂解酶(photolyase)[4]。受鲁伯特的影响,土耳其学者桑贾尔(A.Sancar)于1973年来到美国攻读鲁伯特的博士生,开始光修复研究,并于1976年成功地鉴定出光裂解酶,此后又在20世纪 70年代末克隆和纯化了这种酶的基因[6]。桑贾尔进一步发现这种酶包含有2种吸收蓝光的发色团:甲川四氢叶酸和黄素(FADH-),他在分析研究的基础上于20世纪80年代末提出了黄素通过将电子转送给嘧啶二聚体并使之恢复成2个单体的推测。1994年,桑贾尔与同事对大肠杆菌光裂解酶的分子结构进行了鉴定,并于1995年在Science上发表了突破性的论文《大肠杆菌DNA光裂解酶的晶体结构》[7],从而揭开了光修复的分子机制[8],在光照下,黄素(FADH-)通过捐出 1 个电子的形式裂解二聚物从而完成了DNA直接修复。但是该假说提出后仍然有一些问题需要解决。恰恰在这期间(1993年),科学家在植物中发现了与光裂解酶具有高同源性但却没有光裂解酶功能的物质——隐花色素(cryptochrome)或称蓝光/紫外光-A受体[9]。1998年,科学家进一步发现隐花色素在动物体内也普遍存在,并且具有参与调控生物钟的功能[10]。这种色素对光敏感,使人们又重新回忆起大肠杆菌光裂解酶的作用机理,并将两者结合起来。2004年,德国卡瑞尔(T.Carell)团队的艾森(L.Essen)等在分析光裂解酶在DNA修复电子转移技术上做出了新突破,他们观察到了光裂解酶与DNA的结合处有胸腺二聚体的存在并发生反转[6]。2011年,华裔科学家仲东平和桑贾尔等在前几年运用飞秒光谱技术分析的基础上进一步发现:从FADH-到胸腺二聚体转移电子需要耗时 250×10-12s,C5-C5′键断裂耗时小于10×10-12s,C6-C6′键断 裂 耗时 90×10-12s[8](如图1所示)。
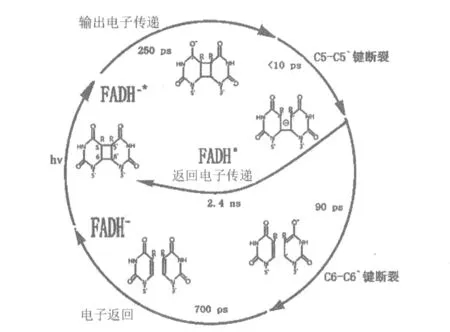
图1 光裂解酶修复胸腺嘧啶二聚体
光修复由于不需要切断和切除部分核苷酸和碱基,故称直接修复。除光修复外,研究人员在20世纪70年代和80年代初还发现了一种不需要光而是在烷基转移酶(alkyltransferases)作用下的直接修复。这种酶的特点是将O6-甲基鸟嘌呤上烷化基团转移到自身,从而消除了对DNA分子的损伤[11]。
2 DNA切除修复的发现与揭示
早在1958年,在多伦多约克角大学工作的科学家希尔(Ruth Hill)就发现,即使不经可见光的照射,大肠杆菌同样能够修复由紫外线造成的损伤。这说明DNA中还存在着暗修复。20世纪60年代科学家开始了暗修复机制的研究。
2.1 核苷酸切除修复(nucleotide excision repair,NER) 1964年,有3篇学术论文首次描述了核苷酸的切除修复[12]。首先是美国国家橡树岭研究所的塞特卢和甘瑞叶(William Carrier)小组及耶鲁大学的霍华德-佛兰德斯(Paul Howard-Flanders)及其博士生博伊斯(Richard Boyce)小组分别发现,紫外线照射下引起大肠杆菌突变形成的胸腺二聚体是以寡核苷酸的形式从DNA中被切除。霍华德-佛兰德和博伊斯还发现,大肠杆菌的3个突变体系中有些突变体只有进行可见光照射后才能修复,有些则不需要[13]。大约在同一时间,哈纳沃特(Philip Hanawalt)和佩蒂约翰(David Pettijohn)通过用5-溴尿嘧啶的追踪实验报道了大肠杆菌会以非半保留复制的形式进行核苷酸的切除修复[14]。核苷酸切除修复如何完成?1983年,桑贾尔等运用克隆DNA基因的方法发现,当受到紫外线照射时,DNA中出现的二聚体会促使细胞产生一种信号,诱导出 UVrA、UVrB、UVrC 3种蛋白,这些蛋白形成复合体(亦叫UVrABC),在损伤的部位双向内切,并将含二聚体的片段切除下来。这3种蛋白分子被美国科学杂志提名为1984年“年度分子”[2]。
2.2 碱基切除修复(base excision repair,BER)20世纪70年代,瑞典科学家林达尔(Tomas Lindahl)在博士后期间便开始关注DNA稳定性的维持及其相关机制问题。他在研究DNA尿嘧啶切除的机制时,发现一种酶能切除含有嘧啶二聚体的一段寡核苷酸,进一步研究发现其作用与核苷酸切除修复不同,而是催化DNA的尿嘧啶-糖键分裂,为此,该酶被命名为糖基化酶。由于这种切除机制发生在碱基上,这种修复被称之为碱基切除修复[15]。1986年,碱基切除修复分子机制的全过程得到揭示。1996年,林达尔成功地在试管中完成了人类DNA的碱基切除修复[16]。
3 DNA的SOS修复
早在 1944年,威特金(Evelyn Witkin)在冷泉港实验室德梅雷茨指导下攻读博士学位时发现,紫外线能诱导出比亲本耐受高100倍的抗紫外线或X线的突变菌株,更为奇怪的是那些被杀死的非突变菌株在死亡之前要生长成通常长度50~100倍的蛇样细丝,而突变体则不受影响,这意味着非突变菌株在紫外线作用下停止细胞分裂[17]。为什么对非突变体会出现这种现象,而对突变体却无此影响?1953年,瑞士科学家韦格尔(Jean Weigle)等用UV照射细菌和λ噬菌体进行了以下更清晰的实验,如表1。

表1
在这4个实验中,实验1是对照实验,实验2说明UV能使突变增加,这都属于正常现象。实验3却有一个奇怪的现象,细菌不仅死亡较少,而且噬菌体突变较多。随后前者被克罗地亚籍的科学家拉德(Miroslav Radman)称为 W-复活(Weigle的首字母,亦叫UV-复活),后者叫W-诱变。实验4的现象更为奇特,照射大肠杆菌不仅使细菌存活而且还导致突变增加[18]。为什么会出现这种现象?研究人员推测在DNA复制中一定存在着一种DNA损伤耐受机制,这种耐受机制是什么?威特金在20世纪60年代通过进一步研究认为,使DNA复制修复并非是UV辐射诱变机制直接作用的结果,而是UV辐射触发了DNA分子上的化学反应,由此导致了阻遏物的抑制,从而使DNA复制得以修复[19]。20世纪60年代末,科学家证实是RecA蛋白和LexA蛋白在该过程中起着关键作用[20]。基于这些对大肠杆菌研究的成就,1970 年,拉德先以书信的形式提出了SOS修复(SOS repair)设想,1974年拉德公开发表了该假说[21]。随后美恩蒂(K.MeEntee)等在1977年检定出rceA基因的产物——RceA蛋白[22]。1982年,利特尔(Little J.W.)和芒特(Mount D.W.)在此基础上完善了该假说,并升华到SOS修复系统的高度。该假说认为,首先是DNA损坏使单链的DNA激活recA基因(重组A基因)产生RecA蛋白,后者消除LexA(正常情况下产生的阻遏蛋白)对recA基因的阻遏,使DNA得以修复。同年,威特金对这一模式作了进一步完善[23]。1986年,比利时女科学家米歇尔(G.Maenhaut-Michel)发现后来(1999年)被称为 DNA聚合酶Ⅳ与SOS修复有关[18]。20世纪80年代末到 90年代初,埃科尔斯(Harrison Echols)又进一步完善和解释了该假说的机制。到20世纪80—90年代,该机制才得到了证实,并被证实是一种跨过突变区的低保真度的DNA旁路修复。SOS修复由于错误较多,又称为错误倾向修复(errerprone repair)。后来还证实这种修复过程在真核生物中也存在[23]。由于真核细胞的复杂性,更为精确的机制仍有待于进一步揭示[3]。 1998—1999年,美国和以色列的2个研究人员发现这种修复是在DNA聚合酶Ⅴ的参与下进行的;到21世纪初,科学家已证实SOS系统至少涉及到40多个基因。2009年时又进一步证实,DNA聚合酶Ⅴ是与RecA蛋白形成复合物共同进行SOS修复过程的[20](如图2所示)。
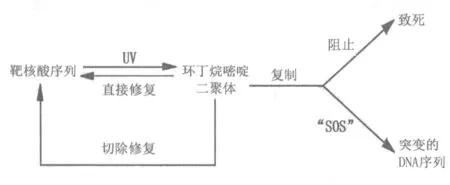
图2 紫外线诱导DNA损伤及修复过程简图
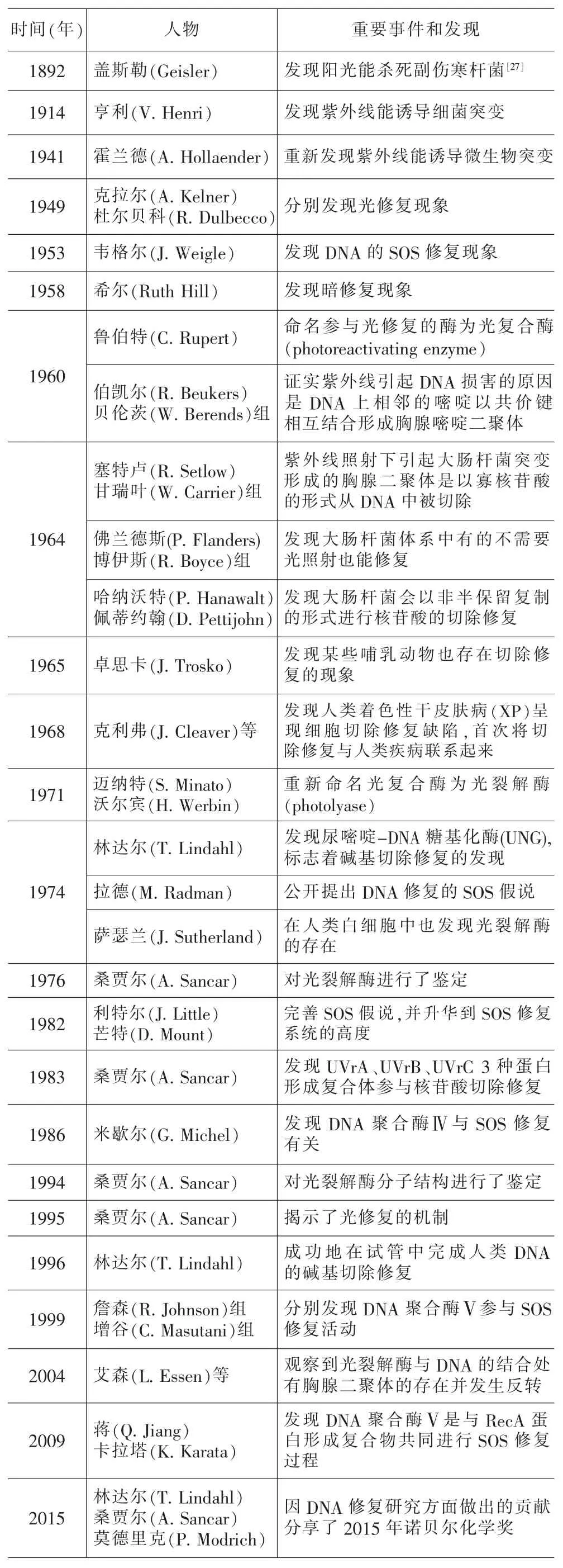
表2 紫外线诱导DNA损伤及修复研究重要事件
林达尔和桑贾尔因在DNA修复研究做出的贡献,与另外一位在DNA错配修复做出贡献的科学家分享了2015年诺贝尔化学奖。同年,美国拉斯克基础医学奖被授予2位DNA修复研究方面的科学家,威特金是其中之一。需要指出的是,虽然有许多该方面研究的科学家没有获得诺奖,但他们功不可没。正如桑贾尔所言,光裂解酶的发现者鲁伯特因其开创性的研究应尊为“DNA修复之父”[5]。 韦格尔、塞特卢、霍华德-佛兰德斯和哈纳沃特同样被公认功绩卓著,韦格尔和塞特卢先后在1968年和2015年故去。
DNA修复的基础性研究虽然主要在大肠杆菌和酵母菌方面,但它对人类疾病的研究有着不可估量的意义。1965年,詹姆斯·卓思卡(James Trosko)等首先用3H胸腺嘧啶的示踪实验发现某些哺乳动物细胞在紫外线照射后可以和细菌一样形成胸腺嘧啶二聚体,而后胸腺嘧啶二聚体会被切除掉。1968年,美国学者克利弗(James J.Cleaver)等在用放射性基因技术和超速离心技术对人皮肤成纤维细胞进行体外研究时发现,着色性干皮肤病(XP)呈现细胞切除修复缺陷,首次将切除修复与人类疾病相联系。1974年,萨瑟兰(J.C.Sutherland)在人类白细胞中也发现光裂解酶的存在,以后又发现存在于成纤维细胞和淋巴细胞中[24]。由于DNA修复对人类疾病尤其是癌症的研究具有重要意义,目前已经成为研究癌症治疗的重要内容。
总之,DNA作为储存与传递遗传信息的重要生物大分子,其分子的完整性对生物体生命活动至关重要。过量的紫外辐射可引起细胞内DNA碱基发生突变、DNA断裂、DNA-DNA交联、DNA-蛋白交联及染色体畸变等损伤。DNA损伤若不能及时修复,细胞将发生癌变或死亡。对紫外线诱导DNA损伤及修复研究的起因与发展进行梳理,不仅对于进一步探讨DNA损伤修复机制,预防某些修复缺陷性疾病的发生及进行生化检测有一定的现实意义,而且对遗传学、肿瘤学、衰老学和毒理学等研究具有重要理论价值。
[1]Philip E Hockberger.History Of Ultraviolet Photobiology.http://photobiology.info/Hockberger.html
[2]PeterStrike.Bacteria and DNA repair: 50 years together.Microbiology Today,2003,30(3):8.
[3]Errol C Friedberg.A brief history of the DNA repair field.Cell Research,2008(18):3.
[4]Gwendolyn B Sancar.Enzymatic photoreactivation:50 years and counting.Mutation Research,2000(451):25.
[5]David Kroll.This Year’s Nobel Prize In Chemistry Sparks Questions About How Winners Are Selected.http://cen.acs.org/articles/93/i45/Years-Nobel-Prize-Chemistry-Sparks.html
[6]Nick Zagorsk.Profile of Aziz Sancar.http://www.ncbi.nlm.nih.gov/pmc/articles/PMC1283445/
[7]Park H W,Kim S T,Sancar A,et al.Crystal structure of DNA photolyase from Escherichia coli.Science,1995,268(5219):1866.
[8]Alexei Stuchebrukhov.Watching DNA repair in real time.PNAS.2011,108(49):19445.
[9]朱春利.植物隐花色素结构与功能研究进展.基因组学与应用生物学,2009,28(1):174.
[10]吕垣澄,吴晓晖.动物隐花色素研究进展.遗传,2014,36(9):864.
[11]陈建敏.O6-烷基甲基鸟嘌呤-DNA烷基转移酶研究进展.国外医学分子生物学册,1991,13(4):154.
[12]W Dean Rupp.Early Days of DNA Repair:Discovery of Nucleotide Excision Repair and Homology-Dependent Recombinational Repair.Yale Journal of Biology and Medicine.2013,86(4):499.
[13]Bennett van Houten.Nucleotide Excision Repair in Escherichia coli.Microbiological reviews,1990,54(1):18.
[14]Nicole Kresge,Robert D Simoni,Robert L Hill.Discovery and Characterization of DNA Excision Repair Pathways:the Work of Philip Courtland Hanawalt.The Journal of Biological Chemistry.2010,285(34):9.
[15]Lindahl,Tomas.My journey to DNA repair.Genomics,Proteomics&Bioinformatics,2013(11):2.
[16]孔璐,丁卫.细胞基因组“维稳”的DNA修复机制:2015年诺贝尔化学奖介绍.首都医科大学学报,2015,36(5):823.
[17]James A Shapiro.Evelyn Witkin,Jean Weigle,The SOS Response and How E.Coli Generates Mutations in Response to UV Irradiation.http://www.huffingtonpost.com/james-a-shapiro/evelyn-witkinjean-weigle_b_1992789.html
[18]周平坤.DNA修复:基因组稳定性保护机制的原创与发现之旅.中国生物化学与分子生物学报,2016,32(1):1.
[19]G B Zavilgelsky.60 Years of SOS Repair.Molecular Biology.2013,47(5):605.
[20]Celina Janion.Inducible SOS Response System of DNA Repair and Mutagenesis in Escherichia coli.International Jaurnal of Biological Science,2008,4(6):338.
[21]K Mc Entee.Protein X is the product of the recA gene of Escherichia coli.PNAS,1977,74(12):5275.
[22]林良斌.SOS修复和突变生产.湘潭师范学院学报.1991,3(6):92.
[23]J C Sutherland,B M Sutherland.Human photoreactivating enzyme action spectrum and safelight conditions.Biophysical Journal,1975(15):435.
[24]Philip E.Hockberger.A History of UltravioletPhotobiology for Humans,Animals and Microorganisms.Photochemistry and Photobiology,2002,76(6):570.
(E-mail:baiguanjun3306565@163.com)
