双酶混合水解玉米皮渣制备阿魏酰低聚糖研究
2017-05-12游雪娇解春艳侯晓强郭红珍吴智艳
杜 娟,游雪娇,解春艳,5,*,侯晓强,5,乔 洁,5,郭红珍,5,吴智艳,5
(1.廊坊师范学院生命科学院,河北廊坊 065000; 2.广东省微生物研究所,广东广州 510000; 3.省部共建华南应用微生物国家重点实验室,广东广州 510000; 4.广东省菌种保藏与应用重点实验室,广东广州 510000; 5.河北省高校食药用真菌应用技术研发中心,河北廊坊 065000)
双酶混合水解玉米皮渣制备阿魏酰低聚糖研究
杜 娟1,游雪娇2,3,4,解春艳1,5,*,侯晓强1,5,乔 洁1,5,郭红珍1,5,吴智艳1,5
(1.廊坊师范学院生命科学院,河北廊坊 065000; 2.广东省微生物研究所,广东广州 510000; 3.省部共建华南应用微生物国家重点实验室,广东广州 510000; 4.广东省菌种保藏与应用重点实验室,广东广州 510000; 5.河北省高校食药用真菌应用技术研发中心,河北廊坊 065000)
以玉米皮渣为原料,采用酶解方法制备阿魏酰低聚糖(Feruloyl oligosaccharides,FOs),通过比较不同酶解条件下阿魏酰低聚糖产量的差异及不同酶解方式下玉米皮渣细胞壁结构的变化,确定酶解阿魏酰低聚糖生成的方法,并优化获得玉米皮渣中阿魏酰低聚糖的最佳酶解条件。结果表明:纤维素酶和木聚糖酶混合酶解可使玉米皮渣细胞壁出现溶洞,可有效提高阿魏酰低聚糖产量;经单因素和响应面实验确定双酶混合酶解的最佳条件为混合酶的添加量为15.7 g/L,混合酶中纤维素酶添加比例为70%,酶解1 h,玉米皮渣底物添加量为100 g/L,在此条件下FOs产量最高,为1008.43 μmol/L。本研究为双酶混合酶解制备玉米皮渣FOs提供理论依据。
玉米皮渣,阿魏酰低聚糖,混合酶解,酶解条件
玉米皮是玉米籽粒的表皮部分,其量可占玉米重量的8%~10%[1]。玉米皮渣是玉米淀粉加工过程中形成的副产物,主要是玉米皮及少量淀粉、蛋白质等,报道称玉米皮渣中含有膳食纤维(52.6%~86.0%)、蛋白质(5.0%~13.0%)、淀粉(4.0%~20.0%)和酚类化合物(2.0%~5.5%)等[2]。玉米皮渣总酚类化合物中,阿魏酸及其聚合物占90%以上[3]。在植物中阿魏酸多以酯键与细胞壁多糖链接[4],水解后可获得阿魏酰低聚糖(Feruloyl oligosaccharides,FOs)。
FOs是阿魏酸(Ferulic acid,FA)与糖的羟基通过酯键连接成的一类重要的功能性低聚糖[1],具有多种生理功效,报道称FOs可增强小鼠免疫力[5]、改善肠道菌群[6]、预防癌症等[7-10]作用。目前阿魏酰低聚糖的研究主要集中在其生物活性方面,也有少量以禾本科植物为原料进行FOs制备的报道[11-12],但研究仅限于制备条件的优化,且研究中多数仅用木聚糖酶酶解,单一酶酶解效率显著低于纤维素酶和木聚糖酶混合酶解[13],推测双酶中酶的添加比例亦会影响产物的生成。本研究以玉米皮渣为原料,采用双酶酶解制备FOs,在确定最佳酶解条件的同时,通过比较不同酶解方式下玉米皮渣细胞壁结构的差异,探讨FOs生成与酶种类及酶组成的关系。研究结果将有助于玉米皮渣的合理利用及FOs的工业生产。
1 材料与方法
1.1 材料与仪器
玉米皮渣 购自河北省沧州市淀粉加工厂;纤维素酶、木聚糖酶 由宁夏夏盛实业集团有限公司提供,酶活分别为600 万μg/min·g和200 万μg/min·g;NaOH、浓HCl、无水乙醇、磷酸等 为国产分析纯,国药集团化学试剂有限公司;乙腈 为国产色谱级,国药集团化学试剂有限公司。
Hitachi S-3000N 扫描式电子显微镜、安捷伦1260高效液相色谱仪 美国Agilent公司;Milli-Q纯水机 美国Merck Millipore公司;MLS-3750全自动立式灭菌锅 日本Sanyo公司;SHZ-82A恒温振荡器 常州朗越仪器制造有限公司;HH-4数显恒温水浴锅 江苏金坛荣华仪器制造有限公司。
1.2 实验方法
1.2.1 FOs的测定
1.2.1.1 FOs含量 阿魏酰低聚糖是阿魏酸与低聚糖以酯键形式连接,经碱解后可释放阿魏酸,现报道的FOs结构中阿魏酸与低聚糖组成比例相同[14],即阿魏酸摩尔含量与FOs摩尔含量相同,故本实验中测定FOs样品液及其碱解液中阿魏酸含量,换算得出FOs的摩尔含量[15]。
1.2.1.2 FOs碱解处理 取玉米皮渣酶解液1 mL于10 mL离心管中,添加1 mL浓度为1 mol/L的氢氧化钠溶液,于100 ℃水解90 min,冷却后用1 mol/L的盐酸溶液中和。
1.2.1.3 阿魏酸的液相色谱测定条件 采用Agilent TC-C18柱(4.6 mm×250 mm,5 μm),25 ℃,进行HPLC分离,检测器为紫外检测器(UV);洗脱液为0.1%磷酸水(V/V)(A)和乙腈(B),两者比例为17∶83,流速为1.0 mL/min,进液量为20 μL,检测波长为320 nm。
1.2.2 酶种类对玉米皮渣FOs生成的影响 以高压蒸煮后的玉米皮渣为原料[12],取一定量的玉米皮渣粉,按底物添加量为100 g/L添加磷酸盐缓冲溶液(50 mmol/L,pH为5.0),再分别添加纤维素酶、木聚糖酶以及两者的复合酶(纤维素和木聚糖酶添加比例为1∶1),添加量为10 g/L,于60 ℃酶解1 h,95 ℃灭酶10 min,4000 r/min离心15 min,分别测定上清液中FOs含量。
高压蒸煮处理方法:取200 g玉米皮渣,添加100 mL蒸馏水,置于500 mL三角瓶中,于高压灭菌锅中,采用121 ℃下处理20 min,温度降至70 ℃时,取出,于60 ℃烘箱中烘干待用。
1.2.3 酶解玉米皮渣制备FOs最佳条件研究 采用单因素和响应面实验对玉米皮渣FOs酶解的最佳条件进行优化。
1.2.3.1 单因素实验 外源酶酶解效果受底物添加量、酶解时间、pH、酶添加量等因素的影响[14],本研究中分别对上述各因素进行单因素实验,找出各因素水平范围。
分别设置底物添加量25、50、75、100和125 g/L,酶添加量分别设定为5、10、15和20 g/L(酶比例为纤维素酶∶木聚糖酶为1∶1),酶解时间分别设定1、2、4、6和8 h,pH分别设定为4.5、5.0、5.5和6.0。按照上述设定方法进行单因素实验,在实验中,后次实验均以上次实验的最佳点作为实验参数,即当底物添加量最佳量确定后,后面均以该浓度为设定浓度,进行实验。
酶解结束后,分别于95 ℃灭酶10 min,4000 r/min离心15 min,测定上清液中FOs含量。
1.2.3.2 响应面实验 为进一步优化混合酶酶解制备FOs最佳条件,在单因素实验基础上以纤维素酶添加比例(纤维素酶占混合酶的比例)、酶解时间、加酶量和底物添加量为变量,以FOs生成量为响应值,选用四因素三水平的Box-Behnken 中心组合设计进行实验,实验设计见表1。通过Design-Expert 8.0设计出如下29组实验。

表1 因素水平表Table 1 The factors and levels graph
1.2.4 玉米皮渣电镜扫描 对不同酶酶解处理过的玉米皮渣进行电子显微镜扫描(scanning electron microscope,SEM),加速电压15.0 kV,放大倍数1500×,通过电镜扫描图观察不同酶酶解前后玉米皮渣原料纵横切面形态的变化。
1.3 统计分析
2 结果与分析
2.1 阿魏酰低聚糖液相分析
如图1所示,FOs原样液液相图谱中在阿魏酸出峰时间内有较小峰出现但碱解后阿魏酸峰面积显著增加,原因是FOs经碱水解后阿魏酸酯碱断裂,释放阿魏酸,依据目前报道的阿魏酰低聚糖的结构可用阿魏酸的摩尔量代替FOs的摩尔量。

图1 酶解获得FOs上清液碱解前后及阿魏酸标品液相图Fig.1 HPLC figures of FOs before and after hydrolysis and HPLC figure of ferulic acid standard注:图中A、B、C分别为阿魏酸标准品、FOs液碱解前和碱解后的液相图。
2.2 酶种类对玉米皮渣FOs生成的影响
以高压蒸煮后的玉米皮渣为原料,采用外源酶处理,测定玉米皮渣经木聚糖酶、纤维素酶和两者1∶1比例混合酶处理后FOs生成量,结果如图2所示。
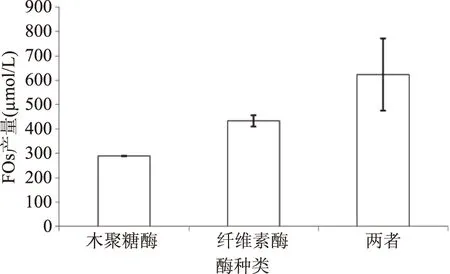
图2 酶种类对FOs生成的影响Fig.2 Effects of enzyme kinds on the production of FOs
由图2可知纤维素酶与木聚糖酶按1∶1比例添加时,玉米皮渣中FOs生成量显著高于单一酶的处理,在单一酶处理中又以纤维素酶处理获得的FOs量较高。其原因是玉米皮渣中细胞壁结构中纤维素与半纤维素及木质素紧密相连[16-17],外源酶进入需打破这种连接,纤维素酶可作用于玉米皮细胞壁,使纤维素降解,进而可促进木聚糖酶作用于玉米皮渣细胞壁,获得FOs;单一酶中又以纤维素酶最佳,分析可能是该酶纯度不高,其中含有木聚糖酶。后续酶解中用两种酶的复合酶进行。
2.3 玉米皮渣经酶处理后细胞壁结构变化

图3 外源酶酶解后玉米皮细胞壁结构图Table 3 SEM of maize bran cell wall treated by different enzyme注:图中A为玉米皮渣原样,B~D分别为纤维素酶、木聚糖酶及两者共同酶解后样品,图中A~D为放大1500倍的效果图。
玉米皮渣经外源酶处理后,其细胞壁结构如图3所示。结果显示玉米皮渣酶解过程中因所用酶的不同而造成其细胞壁结构的差异,与未酶解的玉米皮渣细胞壁结构相比,酶解后结构均出现断裂,且不同酶处理玉米皮渣断裂层不同,这与酶解后FOs生成量的趋势相同;纤维素酶处理后玉米皮渣横纵向出现裂痕,纵向断裂情况明显;木聚糖酶处理后在玉米皮渣内层裂痕明显,纵向未见断裂;经两酶共同处理后,玉米皮渣结构溶解,出现大的空洞,此结果与张暻等[18]采用混合酶处理麦麸后麦麸细胞壁结构变化情况类似。但复合酶处理后玉米皮渣纵向结构变化比单一纤维素酶处理要小,原因是在复合酶中纤维素酶比例为50%与单一纤维素酶相比酶量较少,造成纵向断裂效果不显著,由此推测在复合酶酶解过程中纤维素酶与木聚糖酶比例亦会影响玉米皮渣细胞壁结构的变化,同时造成FOs生成量的差异。
2.4 酶解玉米皮渣制备FOs的条件优化
2.4.1 底物添加量对FOs生成的影响 由图4可知,FOs产量随着底物添加量的增加先上升后保持不变;底物添加量为75 g/L时,FOs产量达到最大值(为886 μmol/L);底物添加量低于75 g/L时,随着底物的增加,FOs产量增加,而超过75 g/L时,底物添加量的增加对FOs产量影响不显著。其原因是在酶添加量一定的情况下,底物增加可增加提供FOs的主体,而当其增大到一定量下,外源酶已不足以使其完全水解获得FOs,致使FOs产量保持不变。
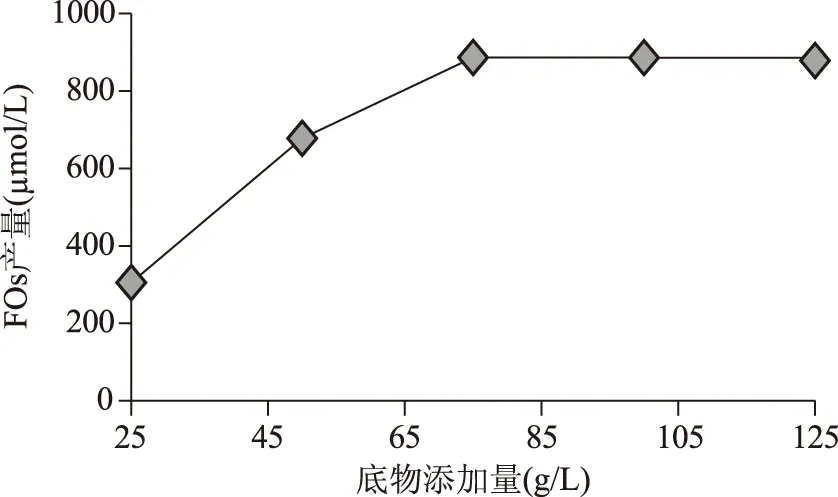
图4 底物添加量对FOs生成含量Fig.4 Effects of substrate addition on the production of FOs
2.4.2 酶添加量对FOs生成的影响 由图5可知,FOs产量随酶添加量的增加先增加后下降,当酶的添加量为15 g/L时FOs产量达到最大值746 μmol/L,原因可能是,当底物添加量一定的情况下,FOs的产量会随着酶的添加量的增加而增加,直至达到最大限度,之后酶再继续添加便会抑制产物的生成,酶中可能有一些物质会使FOs分解,从而使FOs产量下降。

图5 酶添加量对FOs生成的影响Fig.5 Effects of enzyme addition on the production of FOs
2.4.3 酶作用时间对FOs生成的影响 由图6可知,FOs产量随着酶处理时间的延长呈先增加后减小的变化趋势,当酶处理时间是2 h时,FOs的产量达到最大值,之后其值有下降的趋势。其原因是:酶作用于底物需要一定的时间,达到一定时间时FOs的产量最大,时间再延长FOs被分解使其产量下降。所以酶的最适作用时间是2 h。

图6 酶解作用时间对FOs生成含量Fig.6 Effects of enzyme time on the production of FOs
2.4.4 pH对FOs生成的影响 由图7可知,在4.5~6.0范围内,随着pH的升高,FOs产量先增大后减小,在5.0~5.5时,FOs产量最大,原因是所用商品酶中木聚糖酶和纤维素酶的最适pH均为5.0~5.5,由FOs产量比较,FOs制备的最适pH应为5.5。

图7 pH对FOs生成量的影响Fig.7 Effects of pH on the production of FOs
2.5 FOs酶解条件响应面优化研究
在单因素实验基础上,选取纤维素酶添加比例、酶解时间、加酶量和底物添加量四因素,采用响应面优化法对上述四因素生成FOs最佳参数进行优化,实验设计及结果见表2。

表2 响应面实验设计与结果Table 2 Design and results of response surface
利用Design-Expert8.0软件对表2实验数据拟合,得到FOs产量(Y)对纤维素酶比例(A)、酶解时间(B)、酶添加量(C)、底物添加量(D)的二次多项回归模型为:
Y=568.15+144.59A-85.08B+24.02C+170.58D-78.85BD-183.22A2-86.81C2+77.19D2
利用Design-Expert软件对数据进行回归分析,得到方差分析结果见表3。分析可知,模型是极显著的(p<0.01),因素A、B、D(p值分别为<0.001,0.0012和<0.0001)对FOs产量的影响极显著;由实验值与回归方程预测值的相关系数R2=0.9188,可知模型预测值与实际值拟合情况良好,说明采用响应曲面法进行FOs制备条件优化实验设计所得回归方程模型是可行的。
从表3中各因素F值大小分析可知,影响FOs生成的大小顺序依次为D(底物添加量)、A(纤维素酶添加比例)、B(酶解时间)、C(酶添加量),其中纤维素酶添加比例、作用时间和底物添加量达到极显著水平,此结果与前面显微观察推测相同,由此说明在复合酶酶解制备FOs的过程中除了两种酶的添加外,两种酶比例亦是酶解控制的重要参数。此外,底物添加量和酶解时间的交互作用对FOs产量的影响显著。

表3 回归模型方差分析Table 3 Variance analysis of regression model
注:*代表影响显著(p<0.05),**代表影响极显著(p<0.01)。
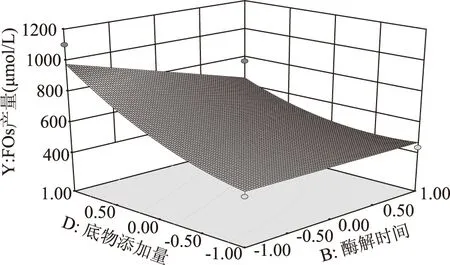
图8 底物添加量和酶解时间对FOs产量的影响Fig.8 Influence of substrate addition and enzyme time on the yield of FOs
对实验数据进行多元回归拟合,得到二次回归方程的响应曲面图,见图8。由图8可知,底物添加量和酶解时间具有交互作用,随着底物添加量的增大FOs的生成量有明显的增加,随着酶解作用时间的增加FOs生成量略有减少。
通过数据分析,双酶混合制备FOs的最佳工艺条件为:纤维素酶添加比例69.73%,混合酶添加量15.68 g/L,酶解时间1.0 h,底物添加量100 g/L,在此条件下,FOs的产量为1010.04 μmol/L。考虑到可操作性,将条件调整为纤维素酶添加比例70%,混合酶添加量15.7 g/L,酶解时间1.0 h,底物添加量100 g/L。进行验证实验得到FOs的产量为1008.43 μmol/L,与理论值基本相符,进一步验证了回归模型的可靠性,因此响应面法对双酶混合制备FOs条件优化是可行的。
3 结论
经酶解FOs生成量的测定及细胞壁结构观察,明确了外源酶酶解制备FOs需要在纤维素酶和木聚糖酶的共同作用下效果最佳,基于此,通过单因素与响应面优化相结合的方法确定了混合酶酶解玉米皮渣制备FOs的最佳条件为混合酶中纤维酶添加比例为70%、酶解时间1 h、酶添加量15.7 g/L和底物添加量100 g/L,在此条件下,FOs产量可达1008.43 μmol/L。
[1]李新华,董海洲. 粮油加工学[M].北京:中国农业大学出版社,2013:122-123.
[2]Rose DL,Inglett GE,Liu SX. Utilisation of corn(Zeamays)bran and corn fiber in the production of food components[J]. Journal of Food Agriculture,2010,90:915-924.
[3]Wang T,Zhu YD,Sun XH. Effect of microfluidisation on antioxidant properties of corn bran[J]. Food Chemistry,2014,152:37-45.
[4]解春艳,吴智艳,杜娟,等. 阿魏酰低聚糖研究进展[J]. 食品科学,2012,33(7):336-340.
[5]Ou JY,Sun Z. Feruloylated oligosaccharides:Structure,metabolism and function[J]. Journal of Functional Foods,2014,7:90-100.
[6]Yuan XP,Wang J,Yao HY. Feruloyl oligosaccharides stimulate growth ofBifidobacteriumbifidum[J]. Anaerobe,2005,11:225-229.
[7]Ou JY,Sun Z. Feruloylated oligosaccharides:Structure,metabolism and function[J]. Journal of Functional Foods,2014,(7):90-100.
[8]Zhang HJ,Wang J,Liu YL,et al. Wheat bran feruloyl oligosaccharides modulate the phase II detoxifying/antioxidant enzymes via Nrf2 signaling[J]. International Journal of Biological Macromolecules,2015,74:150-154.
[9]Wang J,Sun BG,Cao YP,et al. Protection of wheat bran
feruloyl oligosaccharides against free radical-induced oxidative damage in normal human erythrocytes[J]. Food and Chemical Toxicology,2009,47(7):1591-1599.
[10]Zhang HJ,Wang J,Liu YL,et al. Wheat bran feruloyl oligosaccharides modulate the phase II detoxifying/antioxidant enzymes via Nrf2 signaling[J]. International Journal of Biological Macromolecules,2015,74:150-154.
[11]Devin JR,George EI. Production of feruloylated arabinoxylo-oligosaccharides from maize(Zeamays)bran by microwave-assisted autohydrolysis[J]. Food Chemistry,2010,119:1613-1618.
[12]Yuan XP,Wang J,Yao HY. Production of femloyl oligosaccharides from wheat bran insoluble dietary fibre by xylanases fromBacillussubtilis[J]. Food Chemistry,2006,95(3),484-492.
[13]解春艳,游雪娇,侯晓强,等. 物理处理玉米皮渣对酶法提取阿魏酰低聚糖的影响[J].食品工业科技,2016,37(8):272-275.
[14]曾凤彩,王文侠,宋春丽. 酶解玉米麸皮制备阿魏酰低聚糖的研究[J]. 粮食与饲料工业,2011(2):31-35.
[15]Xie CY,Wu ZY,Guo HZ,et al. Release of feruloylated oligosaccharides from wheat bran through submerged fermentation by edible mushrooms[J]. Journal of Basic Microbiology,2014,54(S1):14-20.
[16]Tadashi I. Structure and functions of feruloylated polysaccharides[J]. Plant Science,1997,127:111-127.
[17]张晓民. 禾本科植物细胞壁的木质化和阿魏酰化[J]. 中国野生植物资源,2011,30(6):7-13.
[18]张璟,欧仕益,张宁,等. 酶解麦麸制备阿魏酸和低聚糖的研究[J].食品科学,2003,24(11):63-67.
Study on production of feruloyl oligosaccharides by compound enzymatic hydrolysis from maize bran
DU Juan1,YOU Xue-jiao2,3,4,XIE Chun-yan1,5,*,HOU Xiao-qiang1,5,QIAO Jie1,5,GUO Hong-zhen1,5,WU Zhi-yan1,5
(1.College of Life Sciences,Langfang Teachers University,Langfang 065000,China; 2.Microbiology Institute of Guangdong Province,Guangzhou 510000,China; 3.State Key Laboratory of Applied Microbiology Southern China,Guangzhou 510000,China; 4.Guangdong Provincial Key Laboratory of Microbial Culture Collection and Application,Guangzhou 510000,China; 5.Applied Technology Researcher Center of Medicinal and Edible Mushroom of Higher Education School of Hebei Province,Langfang 065000,China)
Production of feruloyl oligosaccharides by enzymatic hydrolysis form maize bran was investigated in this paper. In order to explore the reason that influenced the yield of feruloyl oligosaccharides,maize bran was hydrolyzed by different enzymes and the cell wall of maize bran was also determined. In the end,the optimal enzyme hydrolysis condition was optimized by single factor and response surface experiment. Results showed that the mixture of cellulase and xylanase could improve maize bran cell wall dissolving,and could improve the yield of feruloyl oligosaccharides. The optimal condition for FOs production was mixture enzyme addition of 15.7 g/L,which was consist with 70% cellulase addition,and the maize bran material addition was at 100 g/L,and hydrolysis for 1 h,under this condition,the yield of FOs was 1008.43 μmol/L. This result provides theoretical basis for FOs production by compound enzymatic hydrolysis from maize bran.
maize bran;feruloyl oligosaccharides;compound enzymatic hydrolysis;hydrolysis condition
2016-09-19
杜娟(1983-),女,硕士,实验师,研究方向:生物化学,E-mail:dujuan0203@163.com。
*通讯作者:解春艳(1983-),女,博士,副教授,研究方向:食品生物技术,E-mail:xcy8046@163.com。
河北省科技计划项目(15222913);河北省教育厅优秀青年基金项目(YQ2013027);河北省高等学校科学技术研究项目(Z2014049);河北省高校食药用菌应用技术研发中心项目(YF201411-321);河北省高等学校遗传学重点发展学科项目(201221);廊坊师范学院微生物学重点学科项目(201501);廊坊师范学院博士基金项目(LSLB201407)。
TS210.1
A
1002-0306(2017)08-0193-06
10.13386/j.issn1002-0306.2017.08.029
