砷和汞在水生蔬菜及其生长环境中的迁移富集
2017-05-12王方园谢晓君徐金玲周卫东
王方园, 谢晓君, 龙 珠, 徐金玲, 周卫东
(1.浙江师范大学 地理与环境科学学院, 浙江 金华 321004;2.兰溪市环境保护监测站,浙江 兰溪 321100;3.金华市地质大队测试中心,浙江 金华 321001)
砷和汞在水生蔬菜及其生长环境中的迁移富集
王方园1, 谢晓君1, 龙 珠1, 徐金玲2, 周卫东3
(1.浙江师范大学 地理与环境科学学院, 浙江 金华 321004;2.兰溪市环境保护监测站,浙江 兰溪 321100;3.金华市地质大队测试中心,浙江 金华 321001)
为研究砷和汞在茭白、菱角植株及其生长环境的迁移富集变化,以“浙911号”茭白品种和“水红菱”为实验材料,采用在土壤中添加砷和汞的处理方法,测定处理后18 d内茭白、菱角器官及水体- 土壤中砷和汞的积累量.结果表明:随栽培时间的延长,水体中砷和汞出现不断向土壤、水生蔬菜迁移的趋势,一段时间后达到动态平衡;当砷和汞共处水环境中时,汞的存在会抑制水体中砷向土壤、水生蔬菜迁移.茭白叶、茎中砷和汞含量呈现先升高后降低的趋势,茎是茭白富集重金属的主要器官之一.菱角中砷和汞含量总体呈现上升趋势,最终逐渐向杆、根迁移富集,叶、根是菱角富集重金属的主要器官.茭白和菱角对水体中砷和汞的富集系数远大于对土壤的富集系数,且对汞的富集能力都大于砷;茭白不同器官富集能力:茎>叶;菱角不同器官富集能力:根>叶(杆).说明砷和汞在水生蔬菜及生长环境中的迁移与富集能力因蔬菜种类、器官类型及重金属种类的不同而存在明显的差异.
砷;汞;茭白;菱角;迁移;富集
工业废水的排放、农药的使用、矿山的开采和金属的冶炼等人为活动常常造成环境中重金属的含量日益升高[1- 2]. 这些重金属经过地表径流、雨水淋溶和废水直排等作用被带到水体中或沉积到水域底部[3],导致了其在水生蔬菜中富集[4].这些重金属不仅对水体、土壤、水生蔬菜生态系统产生危害,导致农产品产量降低和品质下降,还可以通过食物链间接危害人体的健康.如砷是皮肤癌和肺癌的致病物;汞能导致急性肾功能衰竭、脑病等[5].目前,有关重金属对水生蔬菜的生理生化作用已有很多研究[6- 8],但是关于砷和汞在水生蔬菜生长环境、土壤和水体迁移转化的报道还很少.本试验以茭白、菱角为材料,研究了砷和汞在茭白、菱角及其生长环境、水体和土壤中的迁移富集变化,以期为明确茭白和菱角吸收分配重金属的机理奠定理论基础,同时为指导水生蔬菜的安全生产提供一定参考依据.
1 材料与方法
1.1 材料
供试植物:茭白(浙911号品种),菱角(水红菱).
供试重金属离子:As3+(AsCl3),Hg2+[Hg(NO3)2].
1.2 基地选择与蔬菜栽培
试验在浙江省金华市农业科技示范基地进行(基地土壤pH为7.38,总砷含量3.22 mg·kg-1,总汞含量0.31 mg·kg-1;基地水体pH为7.04,总砷含量0.05 mg·L-1,总汞含量0.000 08 mg·L-1,均未超过标准限值).选择长势良好、具有典型种性的茭白株、菱角分别移植到6只栽培缸中,3只缸茭白,3只缸菱角.按土壤与水的总体积为基准设置重金属添加量,并向缸中均匀投放高浓度的Hg(NO3)2、AsCl3母液,并搅拌均匀,每处理3次重复,如表1所示.在栽培过程中,将所有枯叶放入缸中沤烂,以尽量避免重金属损失.培养过程中注意保持栽培缸中的水位.
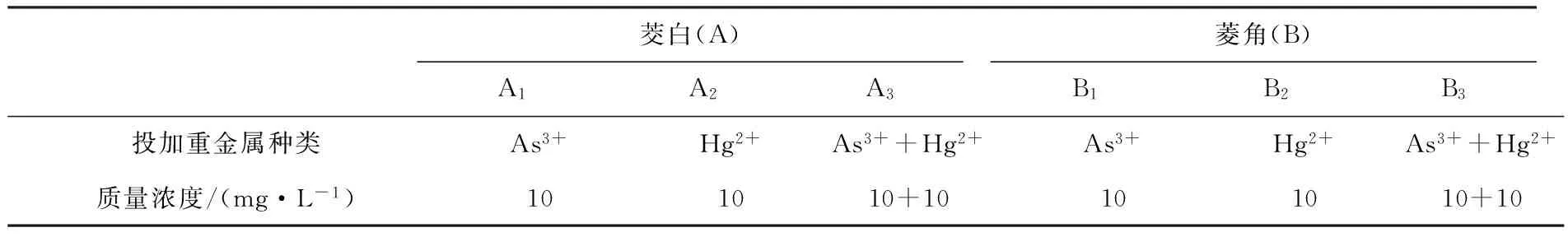
表1 投加重金属方式
注:茭白用A表示;菱角用B表示.下同.
1.3 样品采集及预处理
1.3.1 样品采集
投加砷和汞溶液后每隔2 d采集1批样,共采集7批样(同时采集水、土壤和蔬菜样).
1.3.2 预处理
1)水样的预处理.首先将水样用0.45 μm的滤膜过滤,除去里面的藻类和微生物,过滤后加入硝酸,调节pH至1~2[9].
准确移取50 mL过滤水样于250 mL锥形瓶中,加入10 mL硝酸,进行加热蒸发至1 mL左右.用超纯水将消化液定容于50 mL容量瓶中,并于4 ℃下保存;同样方法做空白试验.
2)土壤样的预处理.将土壤样在室内风干,除去泥土中石块、植物残体及其他杂物;用四分法[10]取部分样品,将其研磨粉碎,并过60目筛,装袋备用.
准确称取研碎后泥土样品0.50 g,置入聚四氟乙烯坩埚,加入10 mL盐酸,进行加热蒸发至3 mL左右,然后加入5 mL硝酸,消解至烟雾殆尽,再加高氯酸5 mL消解至残渣为白色,当溶液剩2 mL左右时,取下冷却,用超纯水(多次冲洗残渣)将消化液定容于50 mL容量瓶中,并于4 ℃下保存,静置后取上清液待测;同样方法做空白试验.
3)植物样的预处理.将植物样用自来水冲洗表面,然后用去离子水反复冲洗,将植物样在105 ℃下杀青30 min,置于75 ℃烘箱中烘至恒重,茭白植株分离出叶、茎;菱角植株分离出叶、杆、根,分别粉碎过筛,保存待测.
准确称取粉碎后样品1.00 g,置于烧杯,加入10 mL混酸(HNO3∶HClO4=4∶ 1),加盖浸泡过夜,然后加热消解(防止灰化).若颜色仍有变棕红色灰化趋势,再加浓硝酸,继续消解至溶液冒浓厚白烟,颜色呈现无色透明状或略带黄色,用超纯水将消化液定容于50 mL容量瓶中,并于4 ℃下保存;同样方法做空白试验.
1.4 测定分析
采用双道原子荧光光谱仪(AFS- 230E 北京海光仪器公司)进行测定[11],检出限(D.L):砷<0.01 μg·L-1,汞<0.001 μg·L-1.
分析过程所用试剂均为优级纯,所用水均为超纯水.
2 结果与分析
2.1 水体重金属含量变化

图1 水体中砷含量随栽培时间的变化 图2 水体中汞含量随栽培时间的变化
水体中砷和汞含量变化趋势如图1和图2所示.从图1可知,随着栽培时间的延长,水体中砷含量总体上呈现下降趋势,一段时间后达到动态平衡,A1,A3,B1,B3缸砷含量分别下降了78.15%,59.48%,74.00%和44.25%.说明水体中砷不断向土壤、水生蔬菜迁移[12];当砷和汞共处水环境中时,水体中砷含量下降率降低,说明汞的存在可能会抑制水体中的砷向土壤、水生蔬菜迁移.
由图2可知,随栽培时间的延长,水体中汞含量总体呈现下降趋势,一段时间后也达到动态平衡, A2,A3,B2,B3缸汞含量分别下降了77.60%,85.60%,85.18%和63.63%.说明水体中汞向土壤、水生蔬菜中的迁移率比砷大;B3缸汞含量变化趋势与其他缸有所差异,说明在迁移过程中很有可能是土壤中汞先溶出向水中迁移,一段时间后,又重新被土壤吸附,同时迁移到水生蔬菜中.
2.2 土壤重金属含量变化
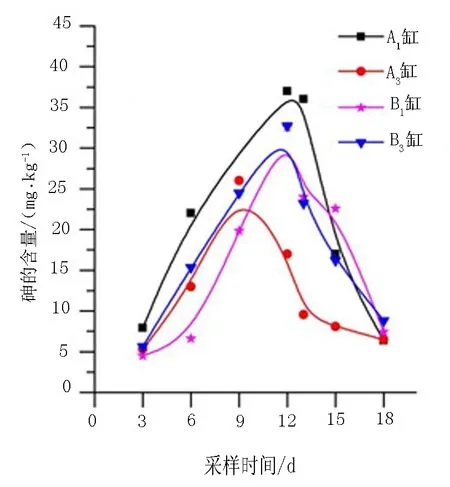
图3 土壤中砷含量随栽培时间的变化 图4 土壤中汞含量随栽培时间的变化
土壤中砷和汞含量变化趋势如图3和图4所示.由图3可以看出,随栽培时间的延长,土壤中砷含量呈现先上升后下降的趋势,在最高点A1,A3,B1,B3缸砷含量分别增加了5.0,4.9,7.1,5.8倍.说明刚开始土壤中砷含量升高主要来源于水体中砷的迁移[13],B1,B3缸砷在土壤中的最大吸附量与A1,A3不同,同时也可以说明水生蔬菜的种类会影响砷在生长环境中的迁移;汞的存在对砷在菱角水环境中的迁移有很大影响,同样说明汞的存在会抑制水体中砷向土壤迁移;栽培第18 d,砷含量分别降到6.35,6.50,7.45,8.80 mg·kg-1,说明砷在水体、土壤和水生蔬菜中迁移较活跃.
由图4可以看出,随着栽培时间的延长,土壤中汞含量变化呈现先上升后缓慢下降的趋势,一段时间后达到动态平衡,在最高点A2,A3,B2,B3缸汞含量分别增长16.8,6.1,10.0,7.8倍.在栽培第12 d,土壤中汞含量平均值大于砷,说明汞比砷更容易在土壤中吸附;同时表明汞向土壤中的迁移显著.
2.3 茭白叶、茎测定结果与分析
对茭白叶、茎中砷和汞含量进行测定分析,结果如图5和图6所示.

图5 茭白叶、茎中砷含量随栽培时间的变化 图6 茭白叶、茎中汞含量随栽培时间的变化
由图5得出,随栽培时间的延长,茭白叶、茎中砷含量呈现先升高后降低趋势,一段时间后达到动态平衡,其中茎中的砷、汞含量变化更为明显.A1,A3缸茎中砷含量分别达到最高值110.00 mg·kg-1,70.00 mg·kg-1,均为叶最高值的8.5,6.0倍,说明茎是茭白富集砷的主要器官之一,茎中会有少量砷向叶中迁移;A1缸中砷含量大于A3缸,同样说明砷和汞共处水环境中时,汞的存在会抑制砷向茭白中迁移.
由图6得出,随栽培时间的延长,茭白叶、茎中汞含量呈现先升高后降低趋势,开始增长缓慢,其中茎中汞含量变化更为明显,A2,A3缸茎中汞含量分别达最高值0.420 mg·kg-1, 0.650 mg·kg-1,是叶最高值的4.5倍与10倍,说明茎是茭白富集汞的主要器官之一,茎中会有少量汞向叶中迁移;也说明汞向茭白叶、茎的迁移量远远小于砷.
2.4 菱角各器官(叶、杆、根)测定结果与分析
对菱角各器官(叶、杆、根)中砷和汞含量进行测定,结果如图7和图8所示.

图7 菱角各器官砷含量随栽培时间的变化 图8 菱角各器官汞含量随栽培时间的变化
由图7可得,随栽培时间的延长,菱角杆、根砷含量呈现上升趋势,叶中砷含量呈现先上升后下降的趋势,栽培起始,叶变化比较陡峭,后来相对平缓;栽培18 d后,B1,B3缸叶、杆、根分别增加了55.00,63.30,90.25 mg·kg-1和29.85,95.40,65.05 mg·kg-1.说明栽培起始,菱角叶会从水体中吸收砷,并向杆、根部迁移富集;在栽培过程中B1缸菱角各器官砷含量总体上均很高,同样说明砷和汞共处水环境中[14],汞的存在会抑制水中砷向菱角迁移.菱角对砷的富集能力要大于茭白.
由图8可得,随栽培时间的延长,菱角各器官中汞含量总体呈现升高趋势.栽培起始,菱角中汞含量变化比较平缓,但后来汞含量上升速率增加.栽培18 d后,B2,B3缸叶、杆、根汞含量分别增加了0.645,0.525,2.200 mg·kg-1和0.340,0.315,1.250 mg·kg-1.说明栽培起始水体中汞很少向菱角中迁移,大部分沉积在土壤中;随时间的延长,土壤中汞又重新溶出向菱角中迁移,导致菱角各器官中汞含量上升,一段时间后,菱角各器官汞含量变化为根>叶>杆,说明根、叶是菱角极易富集重金属的场所.
2.5 茭白和菱角器官对砷和汞的富集系数
生物富集系数(吸收系数,BCF)就是衡量植物对重金属积累能力大小的一个重要指标[15- 16],是指植物体内某种重金属含量与环境中该种重金属含量的比值,富集系数越大,说明富集能力越强[17].
计算了茭白和菱角器官在不同环境中对砷和汞的生物富集系数,结果如表2、表3所示.
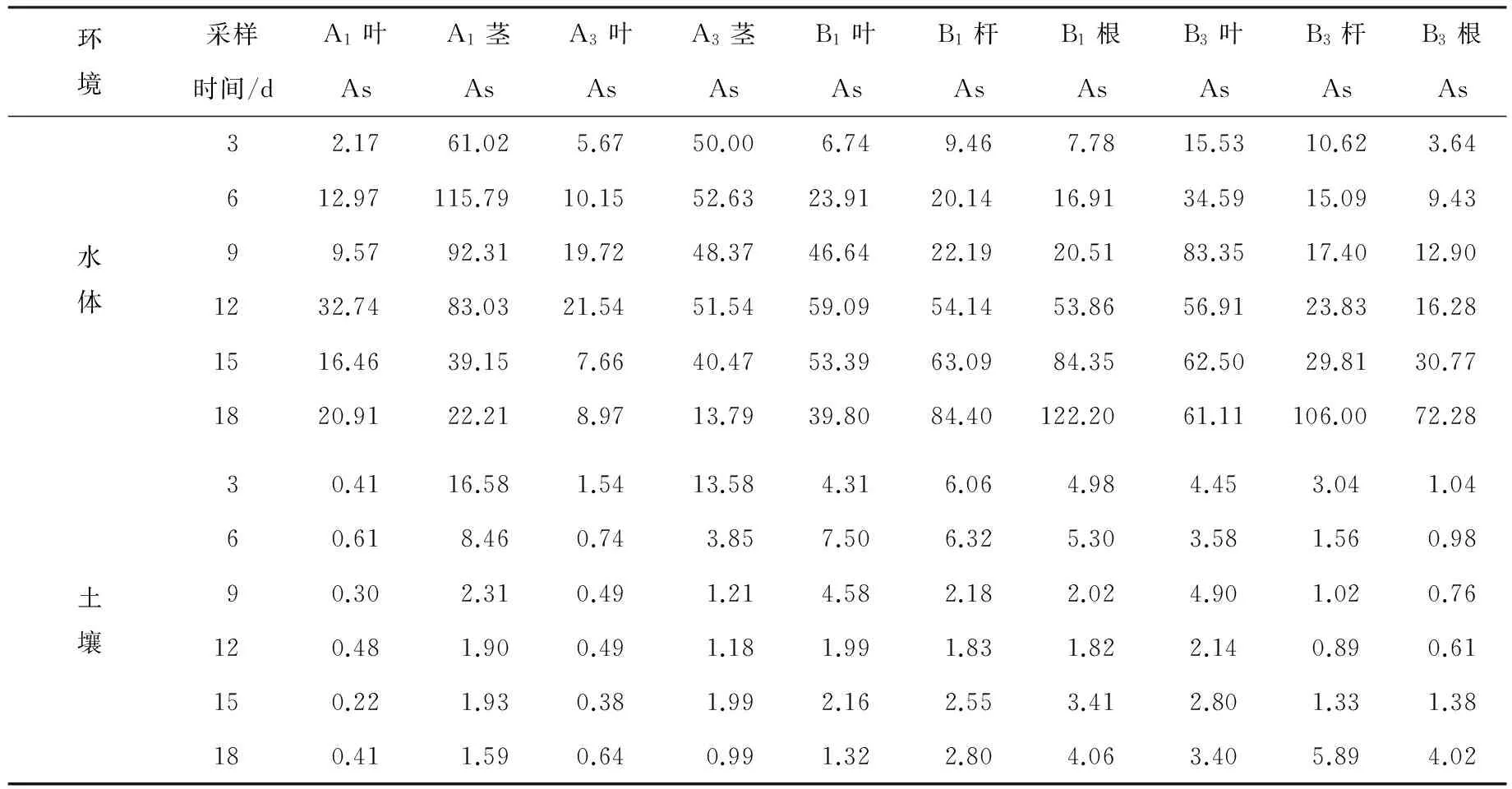
表2 茭白和菱角器官对砷的生物富集系数

表3 茭白和菱角器官对汞的生物富集系数
由表2、表3可以得出,茭白和菱角器官对水体和土壤中砷的富集系数变化范围分别为2.17~115.79,0.22~16.58和3.24~122.20,0.61~7.50,茭白和菱角器官对水体和土壤中汞的富集系数变化范围分别为9.48~2 166.67,0.000 5~0.023 9和1.55~10 416.67,0.000 7~0.065 3.说明水生蔬菜对水体重金属的富集系数远大于水生蔬菜对土壤重金属的富集系数,污染水体中砷和汞含量在达到10 mg·L-1时,植物更容易从水体吸收重金属;生物富集系数随栽培时间、水生蔬菜类型、重金属种类及器官的不同而不同.总体来说,栽培时间越长,生物富集重金属能力越大;茭白和菱角对水体汞的富集能力大于砷,菱角对砷和汞的富集能力大于茭白;茭白不同器官富集能力:茎>叶;菱角不同器官富集能力:根>叶(杆).
3 讨论与结论
1)水体中砷和汞出现不断向土壤、水生蔬菜迁移的趋势,一段时间后达到动态平衡;土壤中砷和汞含量呈现先上升后下降的趋势,砷在水体、土壤和水生蔬菜中迁移较活跃,土壤吸附的砷会重新溶出被植物吸收,而大量的汞被吸附在土壤中.这是因为部分砷和汞由于悬浮物的吸附作用进入土壤和悬浮颗粒物中,另一部分则以离子或络合物形式进入植物体内,这是重金属的吸附过程;土壤和悬浮物中重金属由于盐度、氧化还原条件、pH等原因又被释放到水体中,被植物吸收,这是重金属的释放过程.这2种过程导致重金属不断在水体、土壤、水生蔬菜中迁移转化.
2)当砷和汞共处水环境中时,汞的加入会抑制水体中砷向土壤、水生蔬菜迁移.这是因为汞属于软酸[18],能够亲和蛋白酶中的SH基团,提高某些酶的活性,从而干扰细胞膜的活性与功能.解凯彬等[19]的研究发现,汞的质量浓度为10~30 mg·L-1时,培养24 h后,根部过氧化氢酶活性变化急剧升高,酶活性随受害时间延长呈现升高趋势,又有曾晓敏等[20]发现活性氧(ROS)能起到信号传导作用,一定浓度的汞会刺激ROS的增加,进而增强细胞膜的抵御能力.
3)茭白叶、茎中砷和汞含量呈现先升高后降低趋势,茎中最高点砷和汞含量是相应叶的4.5~10.0倍,茎是茭白富集砷和汞的主要器官之一,少量砷和汞会从茎向叶中迁移;汞向茭白叶、茎中的迁移量比砷小.而菱角的变化完全不同,各器官砷和汞含量总体呈现上升趋势,栽培起始,叶变化趋势明显大于根部和杆部.原因有二:菱角根部细胞外有根套保护,从而抵御过多重金属进入细胞内;菱角属于浮水植物,叶片浮于水面,叶面下表皮可以直接吸附水体中重金属,同时还可以吸收空气中重金属.
4)栽培时间越长,水生蔬菜的生物富集系数越大;茭白和菱角对水体汞的富集能力大于砷,菱角对砷和汞的富集能力大于茭白;茭白不同器官富集能力:茎>叶;菱角不同器官富集能力:根>叶(杆).
从实验结果可看出,砷和汞在水生蔬菜及生长环境中的迁移与富集能力因蔬菜种类、器官类型及重金属种类的不同而存在明显差异.在10 mg·L-1的污染水体中,水生蔬菜生长时间越久,对重金属的积累也越多,而且水生蔬菜对水体的富集能力远远大于土壤,故水生蔬菜的食用安全应引起人们的关注.
[1]Sekhar K C,Chary N S.Fractionation studies and bioaccumulation of sediment- bound heavy metals in Kolleru lake by edible fish[J].Environmental International,2003,29:1001- 1008.
[2]黄永杰,刘登义,王友宝,等.八种水生植物对重金属富集能力的比较研究[J].生态学杂志,2006,25(5):541- 545.
[3]王海东,方凤满,谢宏芳.中国水体重金属污染研究现状与展望[J].广东微量元素科学,2010(1):14- 18.
[4]黄凯丰,江解增.茭白对镉、铅吸收分配的差异研究[J].长江蔬菜,2009(14):45- 48.
[5]熊春晖,卢永恩,欧阳波,等.水生蔬菜重金属污染与防治研究进展[J].长江蔬菜,2012(16):1- 5.
[6]李大辉,施国新,于小余,等.Cd2+、Hg2+对菱角幼苗生长及其超氧化物歧化酶、过氧化物酶活性的影响[J].武汉植物学研究,1999,17(3):206- 210.
[7]Zhang H G,Cui B S,Zhang K J.Heavy metal distribution of natural and reclaimed tidal riparian wetlands in south estuary,China[J].Journal of Environmental Sciences,2011,23(12):1937- 1946.
[8]徐晓光,卢永恩,李汉霞.镉和铅在莲藕各器官中累积规律的研究[J].长江蔬菜,2010(14):53- 56.
[9]艾建超,李宁,王宁.污灌区土壤- 蔬菜系统中镉的生物有效性及迁移特征[J].农业环境科学学报,2013,32(3):491- 497.
[10]竺朝娜,冯英,胡桂仙,等.水稻糙米砷含量及其与土壤砷含量的关系[J].核农学报,2010,24(2):355- 359.
[11]范丽丽,傅春玲,丁薇薇.苏州地产水生蔬菜和太湖水产品总汞含量分析[J].食品科学,2012,33(12):273- 275.
[12]Zhang M Y,Cui L J,Sheng L X,et al.Distribution and enrichment of heavy metals among sediments,water body and plants in Heng shuihu Wetland of Northern China[J].Ecological Engineering,2009,35:563- 569.
[13] 武文飞,南忠仁,王胜利,等.单一与复合胁迫下油菜对镉、铅的吸收效应[J].环境科学,2012,33(9):3253- 3260.
[14]Blaylock M J,Huang J W.Phytoextraction of Metals[C]//Raskin I,Ensley B D.Phytoremediation of Toxic Metals Using Plants to Clean Up the Environment.New York:John Wiley and Sons,2000:53- 70.
[15]Mathieu N K,曾希柏,李莲芳,等.几种叶类蔬菜对砷吸收及累积特性的比较研究[J].农业环境科学学报,2013,32(3):485- 490.
[16]刘本文,杨凯,黄凯丰,等.镉胁迫下茭白各器官对镉的积累差异研究[J].安徽农业科学,2008,36(12):4841- 4842.
[17]赵鲁,朱欣宇,谭晓东,等.大豆和小麦对土壤中汞的吸收与富集研究[J].中国农学通报,2013,29(18):45- 49.
[18]周天泽.软硬酸碱原则在环境科学中的应用[J].环境科学,1981(3):68- 73.
[19]解凯彬,施国新,陈国祥,等.汞污染对芡实、菱根部过氧化物酶活性的影响[J].武汉植物学研究,2000,18(1):70- 72.
[20]曾晓敏,施国新,徐楠,等.汞对慈姑活性氧代谢和染色体的影响[J].植物生理与分子生物学学报,2003,29(3):227- 232.
(责任编辑 杜利民)
Study on migration and enrichment of arsenic and mercury in two aquatic vegetables and their surroundings
WANG Fangyuan1, XIE Xiaojun1, LONG Zhu1, XU Jinling2, ZHOU Weidong3
(1.CollegeofGeographyandEnvironmentalSciences,ZhejiangNormalUnivercity,Jinhua321004,China; 2.LanxiEnvironmentalMonitoringStation,Lanxi321100,China; 3.JinhuaGeologicalBrigadeTestCenter,Jinhua321001,China)
The migration and enrichment of arsenic and mercury in aquatic vegetables, including Zizania latifolia (Zhejiang No. 911), red Water caltrop, and their surroundings were studied. By adding arsenic and mercury solution in the soil, the content was measured in 16 days after treatment. The results showed that: as the growth time increased, there was a trend that arsenic and mercury steadily moved from water to soil and aquatic vegetables, which would reach a dynamic equilibrium after some time. When arsenic and mercury were both in water, mercury added in water inhibited the migration of arsenic from water to soil and aquatic vegetables. For migration of arsenic among water, soil and aquatic vegetables was active, arsenic absorbed by soil, which were re- dissolved, would be absorbed by aquatic vegetables, while a lot of mercury were absorbed into the soil. The content of arsenic and mercury in the leaves and stems of Zizania latifolia showed a trend of first increase and then decrease, and stem was one of the organs accumulating arsenic and mercury. The arsenic and mercury accumulation amounted in Water caltrop showed increasing trend, and leaf was significant organ accumulating arsenic and mercury, moreover, arsenic and mercury in water and soil accumulated in the roots and stems gradually. Bioaccumulation coefficient in water was far more than the soil, and mercury enrichment capacity was greater than arsenic; The enrichment capacity of Zizania latifolia organs was stems > leaves, while that of Water caltrop was roots > leaves (stems). It was concluded that arsenic and mercury migration and accumulation ability varied from vegetable species, aquatic habitat, the type of organ and heavy metal species.
arsenic; mercury; Zizania latifolia; Water caltrop; migration; enrichment
10.16218/j.issn.1001- 5051.2017.02.015
2016- 04- 25;
2016- 05- 30
金华市科技局项目资助(KYZKJY12011);浙江省环境污染控制技术研究重点实验室2015年度开放项目资助(2014A002)
王方园(1966-),女,浙江金华人,副教授.研究方向:环境监测与评估;环境污染控制与检测.
X56
A
1001- 5051(2017)02- 0214- 07
