AAPBA@KCC-1的合成及其对血清中唾液酸和神经节苷脂的分析应用
2017-05-11田华君陈巧梅
田华君, 薛 芸, 陈巧梅, 王 彦, 阎 超
(上海交通大学药学院, 上海 200240)
研究论文
AAPBA@KCC-1的合成及其对血清中唾液酸和神经节苷脂的分析应用
田华君, 薛 芸, 陈巧梅, 王 彦*, 阎 超*
(上海交通大学药学院, 上海 200240)
将3-丙烯酰胺基苯硼酸(AAPBA)修饰在介孔二氧化硅KCC-1的表面,合成AAPBA@KCC-1材料,并通过扫描电子显微镜、透射电子显微镜、N2吸附解吸附测试和X射线光电子能谱对其进行表征;将AAPBA@KCC-1材料作为分散固相萃取(dSPE)的吸附剂,对血清样品中的唾液酸和神经节苷脂(GLS)进行提取和富集;采用傅里叶变换离子回旋共振质谱法和超高效液相色谱-离子淌度-四极杆飞行时间质谱法分别对AAPBA@KCC-1材料吸附得到的唾液酸和神经节苷脂进行分析。结果表明,AAPBA@KCC-1材料能够有效吸附唾液酸和神经节苷脂,简化了样品前处理的操作,可以进一步应用于生物样品中唾液酸和神经节苷脂的研究。
分散固相萃取;介孔二氧化硅KCC-1;3-丙烯酰胺基苯硼酸;N-乙酰神经氨酸;唾液酸;神经节苷脂
随着科学技术的发展,越来越多的无机多孔材料得以开发,并因其具有较大的比表面积和特殊的骨架结构,在吸附、催化、传感、光电磁及生物等领域展现出广阔的应用前景[1]。Polshettiwar等[2]在2010年首次提出了一种新型的放射状介孔二氧化硅微球(KCC-1),其具有沿着中心辐射方向排列的二氧化硅纤维或褶皱,构成了放射状孔道,孔道的尺寸也由内向外逐渐增大。这一特殊的形态结构能够防止纳米纤维或褶皱重叠,因此具有比表面积高、孔体积大和内表面可接触的优点。研究者们对放射状介孔二氧化硅的研究逐渐增多,提出了不同的合成方法与合成机理,并将制备的材料应用于催化合成、生物医学、环境等领域[3]。但由于KCC-1材料的本质是二氧化硅微球,无机基质缺乏反应活性中心,应用上受到一定限制,因此需要对材料进行改性。目前,介孔材料的改性方法主要有引入不同类型的有机官能团、固载金属原子(离子)和杂原子取代无机骨架等[4]。其中引入有机官能团是最常用的改性方法,利用材料表面一定数量的硅羟基,通过嫁接法或共缩聚法进行化学改性,接枝有机官能团,拓展材料的应用范围。
唾液酸(sialic acid)是一类含有9个碳原子的酸性氨基糖,具有吡喃糖结构,在高等动物和微生物中已发现近50多种[5]。人体中最常见的唾液酸为5-乙酰氨基-3,5-二脱氧-D-甘油-D-半乳壬酮糖(俗称N-乙酰神经氨酸,Neu5Ac),其含量占唾液酸家族的99%以上,目前研究的唾液酸多指Neu5Ac。研究表明,在肿瘤或细胞恶性转化时,细胞膜合成的唾液酸增多,其脱落或分泌进入血液的量也同时增多,因此血清中唾液酸的变化在一定程度上可反应细胞的恶变、癌症转移及浸润等[6]。另外唾液酸是神经节苷脂(gangliosides, GLS)重要的结构组成部分,而GLS是一类神经鞘糖脂,由亲水的寡糖链(含唾液酸)和亲脂的神经酰胺组成,参与细胞膜组成、大脑神经发育等活动[7]。在肿瘤的形成过程中,肿瘤细胞表面原有GLS的种类和含量均会发生改变,所以血清神经节苷脂也能够作为潜在的疾病标志物在诊断治疗中起到关键作用[8]。杨铭等[9]通过酶联免疫吸附测定法(ELISA)检测正常人和肝癌患者血清中GLS的含量,结果发现,二者血清中GLS的含量存在显著性差异,说明可以用于肝癌诊断的初步筛选。但是血清成分复杂,唾液酸和GLS(尤其是GLS),在血清中的含量极低,对其提取、检测十分困难。因此发展一种高效简单的吸附血清中唾液酸和神经节苷脂的方法十分必要。
硼酸亲和富集法是利用硼酸基团与化合物结构中顺式二羟基间的结合作用进行富集,不会引入其他干扰物质而影响后续研究[10],相较于凝集素亲和、肼化学方法等,具有可操作性强、不破坏糖基结构的优势[11]。刘丽婷等[12]采用硼酸功能化的介孔纳米材料,在非糖肽的干扰下选择性地吸附糖肽,为生物体内的糖肽研究奠定基础。苯硼酸与唾液酸结构中顺式二羟基有特异性亲和作用,具有吸附唾液酸和神经节苷脂的可能性。Zhang等[13]将生物素化的苯硼酸修饰在金纳米粒子表面,使其特异性识别癌细胞表面的唾液酸,用于癌细胞的检测。但目前尚未检索到利用苯硼酸吸附和提取血液中神经节苷脂的研究。
本文将3-丙烯酰胺基苯硼酸(AAPBA)修饰在KCC-1表面,合成具有硼亲和特性的AAPBA@KCC-1材料,并通过扫描电子显微镜(SEM)、透射电子显微镜(TEM)、N2吸附解吸附、X射线光电子能谱(XPS)等测试手段对AAPBA@KCC-1材料的形貌、比表面积、孔径、表面元素等进行考察。将AAPBA@KCC-1材料作为分散固相萃取(dSPE)的吸附剂用于人血清样品的前处理,并采用傅里叶变换离子回旋共振质谱法(FT-MS)检测血清中的Neu5Ac;采用超高效液相色谱-离子淌度-四极杆飞行时间质谱法(UPLC-IMS-QTOF MS)检测血清中的GLS。
1 实验部分
1.1 仪器、试剂与材料
LC-10ADvp高效液相色谱仪(日本岛津公司); 7.0 T SolariX傅里叶变换离子回旋共振质谱仪,配有Bruker Compass DataAnalysis 4.2SR1数据处理系统(德国Bruker Daltonics公司); ACQUITYⅠClass超高效液相色谱-离子淌度-四极杆飞行时间质谱仪(美国Waters公司); S-4800场发射扫描电子显微镜(日本Hitachi公司); JEM-2100F场发射透射电子显微镜(日本电子株式会社); ASAP2020 C+M比表面积孔隙度及化学吸附分析仪(美国麦克仪器公司); AXIS UltraDLD多功能X射线光电能谱仪(日本岛津Kratos公司); DM36-12马弗炉(上海德恭实业有限公司); LSP01-2A单通道注射泵(保定兰格恒流泵有限公司); THZ 82气溶恒温振荡器(上海乔枫实业有限公司); Milli-Q超纯水系统(美国Millipore公司)。
Neu5Ac标准品(纯度98%)、溴代十六烷基吡啶(CPB)购自上海阿拉丁有限公司;无水乙醇、环己烷、尿素、氨水、正硅酸四乙酯(TEOS)、γ-(2,3-环氧丙氧)丙基三甲氧基硅烷(KH-560)、盐酸、甲酸、乙酸、氢氧化钠、丙酮、无水乙醚、甲苯(用前除水)均购自国药集团化学试剂公司;聚乙烯亚胺(PEI600,纯度99%)、丙烯酰氯(纯度96%,含0.02%(质量分数)氢醌甲基醚)购自上海晶纯生化科技股份有限公司;间氨基苯硼酸一水合物购自北京中胜华腾科技有限公司;乙腈、甲醇、异丙醇(质谱纯)购自德国Merck公司;人血清样品(批号H04Q00F, AB型)购自加拿大Gemini公司。
精密称取10 mg Neu5Ac标准品,用少量超纯水溶解,转移至10 mL容量瓶中,用超纯水定容至刻度,配制质量浓度为1 mg/mL的Neu5Ac标准储备液,于4 ℃冰箱中保存,备用。
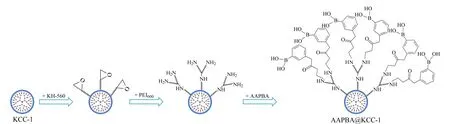
图 1 AAPBA@KCC-1材料的合成示意图Fig. 1 Synthesis schematic of the AAPBA@KCC-1KCC-1: mesoporous silica; KH-560: γ-(2,3-epoxypropoxy)propyltrimethoxysilane; PEI600: polyethyleneimine; AAPBA: 3-acrylamidophenylboronic acid; AAPBA@KCC-1: AAPBA functionalized KCC-1.
1.2 KCC-1微球的制备
根据文献[14]提供的微乳液法合成KCC-1。称取1.1 g CPB、0.6 g尿素,置于250 mL圆底烧瓶中,加入30 mL水,超声5 min后,加入30 mL环己烷、0.94 mL异丙醇,超声混匀。在磁力搅拌的条件下,使用注射泵逐滴滴加3 mL TEOS。将反应混合物于70 ℃磁力搅拌回流20 h。反应结束后,依次用50 mL丙酮、水、无水乙醇以7 000 r/min离心10 min,将得到的微球于60 ℃烘箱中干燥12 h后,于500 ℃马弗炉中煅烧3 h,除去表面活性剂,最终得到KCC-1微球。
称取煅烧好的KCC-1微球1 g,置于250 mL圆底烧瓶中,加入40 mL 1 mol/L盐酸溶液,超声分散2 min,于80 ℃反应24 h。反应结束后,加入大量超纯水抽滤洗涤至中性,最后用无水乙醇抽滤洗涤,所得固体于60 ℃真空干燥12 h,备用。
1.3 AAPBA@KCC-1的制备
第一步:称取1 g干燥后的经盐酸活化的KCC-1微球,置于250 mL圆底烧瓶中,加入40 mL无水甲苯,超声分散2 min后,置于油浴锅中,在磁力搅拌的条件下逐滴加入3 mL KH-560,于115 ℃氮气保护下加热回流24 h,随后冷却至室温,依次用50 mL甲苯、丙酮、无水乙醚抽滤洗涤,得到的固体于60 ℃烘箱中干燥,备用。
第二步:取上述得到的固体1 g置于250 mL圆底烧瓶中,加入40 mL无水乙醇,超声分散2 min;另取0.4 g PEI600置于另一250 mL圆底烧瓶中,加入40 mL超纯水,超声分散2 min。将上述两种溶液混匀后置于油浴锅中,于65 ℃磁力搅拌、氮气保护下反应12 h。反应结束后,依次用50 mL超纯水、无水乙醇、无水乙醚抽滤洗涤,得到的固体于60 ℃烘箱中干燥,备用。
第三步:取上述得到的固体1 g置于250 mL圆底烧瓶中,加入40 mL超纯水,超声分散2 min;另取0.3 g制备好的AAPBA[15],置于另一250 mL圆底烧瓶中,加入40 mL甲醇,超声分散2 min。将上述两种溶液混匀后置于油浴锅中,于65 ℃磁力搅拌、氮气保护下反应12 h。反应结束后,依次用50 mL超纯水、甲醇、无水乙醚抽滤洗涤,得到的固体即为AAPBA@KCC-1(具体合成过程见图1),于60 ℃烘箱中干燥,备用。
1.4 分散固相萃取
称取20 mg AAPBA@KCC-1材料,加入1 mL超纯水,以7 000 r/min离心10 min。取100 μL Neu5Ac标准品或血清样品,用缓冲溶液(pH 7.0)稀释至一定浓度。取1 mL上述溶液加入清洗过的AAPBA@KCC-1材料,涡旋混匀,振荡10 min,以8 000 r/min离心10 min,所得上清液记为上样液(loading solution);用1 mL缓冲溶液(pH 7.0)清洗材料,以8 000 r/min离心10 min,所得上清液记为清洗液(washing solution);取1 mL缓冲溶液(pH 11.0)-乙腈溶液(80∶20, v/v)对AAPBA@KCC-1材料上吸附的物质进行洗脱,振荡混匀10 min,以8 000 r/min离心10 min,所得上清液记为洗脱液(elution)。将得到的3份上清液用N2吹干后,用流动相复溶,并通过0.22 μm滤膜过滤,备用。
本文所用缓冲溶液均由乙酸和氨水配制而成。
1.5 唾液酸和神经节苷脂的提取
唾液酸的提取:取200 μL血清样品,加入200 μL 1 mol/L的盐酸溶液,振荡混匀,于80 ℃烘箱中静置1 h后,加入200 μL甲醇沉淀蛋白质,以12 000 r/min离心15 min,移取上清液,用氮气吹干。用缓冲溶液(pH 7.0)复溶血清样品,按1.4节dSPE条件进行处理,得到洗脱溶液,用氮气吹干,然后用200 μL甲醇复溶,于4 ℃冰箱保存。
神经节苷脂的提取:取500 μL血清,加入1 mL甲醇,振荡混匀,静置30 min后,以12 000 r/min离心15 min,移取上清液,用氮气吹干。用缓冲溶液(pH 7.0,含20%(v/v)甲醇)复溶血清样品,按1.4节dSPE条件进行处理,得到洗脱溶液,用氮气吹干,然后用200 μL甲醇复溶,于4 ℃冰箱保存。
1.6 仪器分析条件
1.6.1 Neu5Ac的分析条件
色谱柱:TSKgel Amide-80亲水色谱柱(150 mm×4.6 mm, 3 μm);流动相:0.05%(v/v)磷酸水溶液-乙腈(30∶70, v/v);等度洗脱;流速:0.5 mL/min;检测波长:195 nm;进样量:10 μL。离子源:电喷雾离子(ESI)源;正离子模式;毛细管喷雾电压:5 500 V;干燥气温度:200 ℃;干燥气流速:4.0 L/min;进样速度:120 μL/min;离子选择模式:吹扫(sweep);扫描范围:m/z150~750。
1.6.2 神经节苷脂的分析条件
色谱柱:ACQUITY UPLC BEH C18色谱柱(100 mm×2.1 mm, 1.7 μm);柱温:55 ℃;进样量:10 μL;流速:0.40 mL/min;流动相A:含10 mmol/L甲酸铵的乙腈-水(40∶60, v/v),流动相B:含10 mmol/L甲酸铵的异丙醇。梯度洗脱程序:0~5.0 min,40%B~43%B;5.0~6.0 min, 43%B~50%B; 6.0~12.0 min, 50%B~54%B; 12.0~12.1 min, 54%B~70%B; 12.1~18.0 min, 70%B~100%B; 18.0~19.1min, 100%B~40%B; 19.1~21.0 min, 40%B。离子源:ESI源;正离子扫描;离子源温度:115 ℃;毛细管电压:2 000 V;锥孔电压:40 V;脱溶剂气体温度:550 ℃;脱溶剂气流量:900 L/h;锥孔气流量:50 L/h;脱溶剂气体、锥形气体:氮气(纯度>99.5%);扫描范围:m/z50~2 000;扫描频率:0.2 s/scan;采用高(30~50 eV)、低(6.0 eV)碰撞能交替切换的MSE模式采集数据。所得数据采用UNIFI软件和Progenesis QI软件进行色谱峰识别和匹配,根据精确相对分子质量,结合人类代谢组数据库(HMDB)进行检索,并对所得离子进行鉴定表征(质量误差小于5×10-6(5 ppm))。
2 结果与讨论
2.1 AAPBA@KCC-1的表征
通过微乳液法[14]合成KCC-1微球,水和环己烷分别作为水相和油相形成微乳液环境,异丙醇作为助溶剂、表面活性剂CPB作为结构导向剂、尿素作为催化剂提供碱性环境、TEOS作为硅源分散在表面活性剂周围发生水解、缩合、聚合反应,最后煅烧除去表面活性剂,即可得到中心径向结构的KCC-1微球,具有放射状孔道分布。
用AAPBA基团修饰KCC-1基质,首先需要用盐酸活化KCC-1基质,盐酸活化可以增加表面羟基密度,更利于后续修饰[16]。然后利用KH-560的水解反应,在KCC-1微球表面修饰环氧丙基;利用环氧丙基与PEI600分子中的氨基发生开环反应,使相对分子质量较高的PEI600分子以共价键修饰到微球表面,以提高其氨基覆盖率,增加反应活性位点。最后通过氨基与α,β-不饱和双键之间的迈克尔(Michael)加成反应,将AAPBA修饰到KCC-1微球上,最终得到AAPBA@KCC-1材料。这一修饰方法机理简单,操作方便。
KCC-1和AAPBA@KCC-1的扫描电镜图和透射电镜图见图2。可以看出,AAPBA@KCC-1与KCC-1的形貌没有明显差异。可能是因为修饰的苯硼酸基团相对分子质量较小,对于KCC-1微球的结构没有显著性影响。实验测得AAPBA@KCC-1微球的粒径约为400 nm。

图 2 KCC-1和AAPBA@KCC-1的扫描电镜图和透射电镜图Fig. 2 Scanning electron microscope (SEM) and transmission electron microscope (TEM) images of the KCC-1 and AAPBA@KCC-1a. SEM image of KCC-1; b. TEM image of KCC-1; c. SEM image of AAPBA@KCC-1; d. TEM image of AAPBA@KCC-1.

图 3 AAPBA@KCC-1的(a)N2吸附解吸附曲线和(b)孔径分布图Fig. 3 (a) N2 adsorption-desorption isotherm plot and (b) pore size distribution curve of the AAPBA@KCC-1
AAPBA@KCC-1的N2吸附解吸附曲线和孔径分布图见图3。可以看出,AAPBA@KCC-1的N2吸附解吸附曲线属于IV型吸附平衡等温线,说明AAPBA@KCC-1仍是介孔材料,且表现为H3型迟滞回线,推测具有狭缝状孔道,孔大小不均匀。由孔径分布图可以看出,AAPBA@KCC-1材料的孔径集中分布在3~4 nm,但在10~20 nm处也有少量分布,这可能是KCC-1材料在合成过程中,放射状纤维或褶皱结构排列不均匀造成的。实验最终测得AAPBA@KCC-1材料的比表面积、孔径和总孔容积分别为453.15 m2/g、3.41 nm和0.81 cm3/g,与KCC-1相比(实验前期测得其比表面积、孔径和总孔容积分别为483.26 m2/g、3.37 nm和0.89 cm3/g)没有显著性差异。说明AAPBA的修饰没有对KCC-1基质的结构造成较大影响。
为进一步表征AAPBA@KCC-1材料表面苯硼酸基团的修饰程度,本文应用X射线光电子能谱测试了KCC-1和AAPBA@KCC-1微球表面各元素含量的变化(见表1)。可以看出,AAPBA@KCC-1材料含有B和N元素,这是由修饰PEI600和AAPBA时引入的,表明AAPBA基团已成功键合在KCC-1基质表面。在合成KCC-1时,使用了CPB表面活性剂,而之后的处理中没有完全去除,造成在KCC-1中检测到C元素的存在。

表 1 XPS测试KCC-1和AAPBA@KCC-1材料表面
2.2 分散固相萃取条件的优化
为考察AAPBA@KCC-1材料对唾液酸的吸附能力,本文采用分散固相萃取的方式对Neu5Ac标准品进行吸附和洗脱,吸附得到的Neu5Ac的含量采用亲水色谱法测定,其色谱图见图4。

图 4 Neu5Ac标准品的亲水色谱图Fig. 4 Hydrophilic chromatogram of the Neu5Ac standard sampleNeu5Ac: N-acetylneuraminic acid.

图 5 不同分散固相萃取条件对Neu5Ac吸附率和回收率的影响(n=3)Fig. 5 Effect of the different dispersive solid phase extraction conditions on the adsorption rates and recoveries of the Neu5Ac (n=3)Buffer: acetic acid-ammonia mixture (pH 11.0); MeOH: methanol; ACN: acetonitrile.
2.2.1 上样条件的优化
本实验通过采用不同pH值(2.5、5.0、7.0、9.0、11.0)的上样缓冲溶液考察AAPBA@KCC-1对Neu5Ac标准品吸附量的影响(见图5a)。可以看出,当上样液的pH值为7.0时,AAPBA@KCC-1材料对Neu5Ac的吸附能力最强。分散固相萃取中,材料与样品溶液需充分接触,本实验采用振荡方式使二者混匀,吸附时间的长短影响材料对Neu5Ac的吸附量。实验结果表明,当吸附时间为10 min时,AAPBA@KCC-1对Neu5Ac标准品的吸附率最高。
2.2.2 洗脱条件的优化
pH条件的改变会影响唾液酸与苯硼酸基团的结合作用,为使结合状态的唾液酸更多地从材料上洗脱下来,洗脱液pH值的选择至关重要。本实验考察了不同pH值(4.0、9.0和11.0)的洗脱液对Neu5Ac回收率的影响(见图5b)。可以看出,当洗脱液的pH值为11.0时,Neu5Ac的回收率最高。
本实验比较了不同洗脱时间(5、10、15、30和60 min)对Neu5Ac回收率的影响(见图5c)。结果表明,洗脱时间过长,Neu5Ac的回收率反而下降,当洗脱时间为10 min时,Neu5Ac的回收率最高。
分散固相萃取的过程类似于色谱分离[17],所以加入适当的有机溶剂可以提高洗脱溶剂的洗脱能力,实验比较了在缓冲溶液(pH 11.0)中加入20%(v/v)甲醇、20%(v/v)乙腈和不加有机溶剂的情况下,Neu5Ac回收率的变化(见图5d)。结果表明,在缓冲溶液(pH 11.0)中加入20%(v/v)乙腈作为洗脱液时,Neu5Ac的回收率最高。
2.2.3 苯硼酸与唾液酸的相互作用
通常来说,苯硼酸基团与顺式二羟基化合物的相互作用随苯硼酸基团pKa(≈8.6)与缓冲溶液pH的大小关系而改变[18]。当pH>pKa时,硼酸基团转变成带负电的四面体结构,能够与顺式二羟基化合物反应形成五元环酯,顺式二羟基化合物结合到苯硼酸材料的表面;当pH 本研究中AAPBA与Neu5Ac的结合在中性(pH 7.0)条件下进行,解离在碱性(pH 11.0)条件下进行。这是因为Neu5Ac结构中具有酰胺基团和较多的羟基基团,使得二者的结合不同于普通的顺式二羟基化合物。Djanashvili等[19]利用多核核磁共振研究苯硼酸与唾液酸的结合作用,发现唾液酸在pH> 8.0时,通过甘油侧链与苯硼酸结合(见图6);在pH为2.0~8.0时,通过羟基羧酸结合苯硼酸,且在pH 7.4时形成的苯硼酸酯稳定常数最高。这与本文中得到的结果一致,中性条件下AAPBA@KCC-1材料的吸附能力最强,吸附率高达96%。 图 6 苯硼酸与Neu5Ac的相互作用示意图Fig. 6 Schematic of the interaction between the phenylboronic acid and Neu5Ac 2.3 血清中唾液酸的分析 在人体中,游离唾液酸的含量较少,多以结合形式出现在糖蛋白、糖肽、糖脂等结构中。因此如果要研究唾液酸,首先要释放唾液酸,最常用的方法为酸水解法[20]。酸水解法是指在加热的条件下,用稀释的酸溶液释放唾液酸,反应时间通常为1~2 h。本文选用1 mol/L盐酸溶液于80 ℃烘箱中静置1 h来水解血清中的唾液酸,然后用甲醇除去血清中的蛋白质等杂质,再用于后续的分散固相萃取。 FT-MS具有分辨力高、准确度高、扫描速度快等优点,能够对化合物进行结构鉴定,十分适合生物样品的分离分析。由于血清中基质较多,本研究中直接采用FT-MS验证AAPBA@KCC-1材料对血清中唾液酸的吸附能力。首先分析Neu5Ac标准品,测得Neu5Ac的准分子离子峰[M+H]+的m/z为310.113 15(理论值为310.113 26),这说明FT-MS分析具有较高的准确性。 血清样品在分散固相萃取处理前后的全扫描质谱图和选择离子提取质谱图见图7。分散固相萃取处理前,有较多m/z为200~500的干扰物质存在(见图7a)。经过选择离子提取,可以明确找到Neu5Ac的存在(见图7b),这表明酸水解法能够从血清中提取唾液酸。经dSPE处理后,血清样品的全扫描质谱图的背景基质干扰较少(见图7c),经选择离子提取后,m/z308.5~312.0范围内的质谱峰减少,Neu5Ac的质谱峰(m/z310.113 09)更加明显(见图7d),说明本实验合成的AAPBA@KCC-1材料对血清中的唾液酸具有较好的选择提取能力。 2.4 血清中神经节苷脂的分析 对于生物组织中神经节苷脂的提取纯化,传统的方法是利用不同比例的氯仿、甲醇、水进行提取[21],但操作步骤繁琐,且氯仿具有一定的毒性和腐蚀性。神经节苷脂的结构较为复杂,由寡糖链(包含唾液酸)和神经酰胺两部分组成。AAPBA@KCC-1材料对唾液酸具有吸附富集能力,而唾液酸又是神经节苷脂结构中的一个重要组成部分,可以尝试将提取和分离唾液酸的方法应用于血清中的神经节苷脂。 血清样品经甲醇去除蛋白质处理后,直接进行分散固相萃取,与传统的提取方法相比,操作更简单。但考虑到血清中神经节苷脂的含量较少[22],本实验选择UPLC-IMS-QTOF MS技术减少检测物的共流出现象,使实验结果更加准确可靠。 图 7 血清样品全扫描和选择离子监测质谱图Fig. 7 Full scan mass spectra and SIM mass spectra of the serum samplesa. full scan mass spectrum of serum without adsorption; b. SIM mass spectrum of serum without adsorption; c. full scan mass spectrum of serum adsorbed by AAPBA@KCC-1; d. SIM mass spectrum of serum adsorbed by AAPBA@KCC-1. 图 8 血清样品中GLS经AAPBA@KCC-1材料(a)吸附前和(b)吸附后的总离子流色谱图Fig. 8 Total ion current chromatograms of ganglioside (GLS) in a serum sample (a) before and (b) after adsorption by the AAPBA@KCC-1 血清样品中神经节苷脂经AAPBA@KCC-1材料吸附前后的总离子流色谱图见图8。可以看出,经AAPBA@KCC-1材料吸附后,血清样品中GLS的色谱峰形更尖锐、对称。 利用数据库对所得物质进行鉴定,在洗脱液中发现了一种单唾液酸二己糖神经节苷脂GM3(NeuAc-α-2-3-Gal-β-1-4-Glc-β-Cer (d 18∶1/16∶0)),[M+H]+为m/z1 153.71 869,质量误差为1.66 ppm(<5 ppm)。GM3的结构式、提取离子色谱图和质谱图见图9。通过数据库检索发现,血清中已确定的GLS仅有3种且含量较低,在洗脱液中能够找到一种神经节苷脂,证明AAPBA@KCC-1材料对其有吸附性能。在接下来的实验中,可将AAPBA@KCC-1材料用于含神经节苷脂丰富的生物组织样品的分离,发挥其吸附提取性能。 图 9 GM3的(a)结构式、(b)提取离子色谱图和(c)一级、(d)二级质谱图Fig. 9 (a) Structure, (b) extracted ion chromatogram (EIC), (c) MS spectrum and (d) MS/MS spectrum of the GM3 本文通过将AAPBA键合在KCC-1表面,成功制备了功能化修饰介孔二氧化硅AAPBA@KCC-1材料,并将AAPBA@KCC-1材料作为分散固相萃取的吸附剂用于血清中唾液酸和神经节苷脂的提取和富集。结果表明,AAPBA@KCC-1材料能够有效吸附血清中的唾液酸和神经节苷脂,从而简化生物样品的前处理步骤,节省处理时间,为生物样品中唾液酸及神经节苷脂的研究提供新方案。 [1] Wang X Y, Ren Z D, Zhu Y C, et al. Modern Chemical Industry, 2012, 32(4): 20 汪晓燕, 任占冬, 朱玉婵, 等. 现代化工, 2012, 32(4): 20 [2] Polshettiwar V, Cha D, Zhang X X, et al. Angew Chem Int Ed, 2010, 49(50): 9652 [3] Du X, Qiao S Z. Small, 2015, 11(4): 392 [4] Guli M N, Yao J X, Li X T, et al. Materials Review, 2013, 27(9): 25 古丽米娜, 姚建曦, 李晓天, 等. 材料导报, 2013, 27(9): 25 [5] Cheng J L, Wang Z, Liu T T, et al. Food Research and Development, 2016, 37(4): 216 程家丽, 王竹, 刘婷婷, 等. 食品研究与开发, 2016, 37(4): 216 [6] Chen X, Varki A. ACS Chem Biol, 2010, 5(2): 163 [7] Lacomba R, Salcedo J, Alegría A, et al. J Pharm Biomed Anal, 2010, 51(2): 346 [8] Hakomori S I, Handa K. Glycoconj J, 2015, 32(1/2): 1 [9] Yang M, Long D. China Journal of Modern Medicine, 2010, 20(9): 1348 杨铭, 龙丹. 中国现代医学杂志, 2010, 20(9): 1348 [10] Zhang Q C, Luo X L, Li G K, et al. Chinese Journal of Chromatography, 2015, 33(9): 904 张仟春, 罗夏琳, 李攻科, 等. 色谱, 2015, 33(9): 904 [11] Bao H M, Xie L Q, Lu H J. Chinese Journal of Chromatography, 2016, 34(12): 1145 包慧敏, 谢力琦, 陆豪杰. 色谱, 2016, 34(12): 1145 [12] Liu L T, Zhang Y, Jiao J, et al. Acta Chimica Sinica, 2013, 71(4): 535 刘丽婷, 张莹, 焦竞, 等. 化学学报, 2013, 71(4): 535 [13] Zhang X, Chen B, He M, et al. Analyst, 2016, 141(4): 1286 [14] Moon D S, Lee J K. Langmuir, 2012, 28(33): 12341 [15] Xue Y, Shi W J, Zhu B J, et al. Talanta, 2015, 140: 1 [16] Li F, Li H Q, Lai X J, et al. Inorganic Chemicals Industry, 2014, 46(4): 33 李峰, 李红强, 赖学军, 等. 无机盐工业, 2014, 46(4): 33 [17] Liu F, Wang Y, Wang Y H, et al. Chinese Journal of Chromatography, 2012, 30(3): 292 刘芳, 王彦, 王玉红, 等. 色谱, 2012, 30(3): 292 [18] Duan Y H, Wei Y M. Chinese Journal of Analytical Chemistry, 2013, 41(3): 406 段语晖, 卫引茂. 分析化学, 2013, 41(3): 406 [19] Djanashvili K, Frullano L, Peters J A. Chem Eur J, 2005, 11(13): 4010[20] Liu Z D, Wang Y Y, Guo B H, et al. Science and Technology of Food Industry, 2010, 31(4): 368 刘志东, 王荫榆, 郭本恒, 等. 食品工业科技, 2010, 31(4): 368 [21] Kolter T. ISRN Biochemistry, 2012, 2012: 506160 [22] Yao K. [MS Dissertation]. Shanghai: Shanghai Jiao Tong University, 2013 姚凯. [硕士学位论文]. 上海: 上海交通大学, 2013 Synthesis of AAPBA@KCC-1 and its application in the analysis of sialic acid and gangliosides in serum TIAN Huajun, XUE Yun, CHEN Qiaomei, WANG Yan*, YAN Chao* (SchoolofPharmacy,ShanghaiJiaoTongUniversity,Shanghai200240,China) A new material AAPBA@KCC-1 was synthesized by using 3-acrylamidophenylboronic acid (AAPBA) modified on mesoporous silica KCC-1. First, AAPBA was modified on the surface of KCC-1 by three-step synthesis method. Then, AAPBA@KCC-1 was characterized by scanning electron microscope (SEM), transmission electron microscope (TEM), N2adsorption-desorption isotherm and X-ray photoelectron spectroscopy (XPS). AAPBA@KCC-1 was used as the dispersive solid-phase extraction (dSPE) adsorbent to extract and enrich sialic acid and ganglioside (GLS) from serum samples. Finally, Fourier transform ion cyclotron resonance mass spectrometry (FT-MS) and ultra performance liquid chromatography-ion mobility spectrometry-quadrupole time of flight mass spectrometry (UPLC-IMS-QTOF MS) were used to evaluated the adsorption ability of AAPBA@KCC-1 to sialic acid and GLS, respectively. The results showed that AAPBA@KCC-1 can effectively adsorb sialic acid and GLS, and can be used for further studies of sialic acid and GLS in biological samples. dispersive solid-phase extraction (dSPE); mesoporous silica KCC-1; 3-acrylamidophenylboronic acid (AAPBA);N-acetylneuraminic acid (Neu5Ac); sialic acid; ganglioside (GLS) 10.3724/SP.J.1123.2017.01025 2017-01-20 上海市科委科研计划项目(15142200200,16142200300);中国博士后科学基金(2015M581628);上海市引进技术的吸收与创新专项(XC-ZXSJ-02-2016-11). Foundation item: Shanghai Science and Technology Commission Scientific Research Project (Nos. 15142200200, 16142200300); China Postdoctoral Science Fund (No. 2015M581628); Special Fund of Shanghai Introduction of Technology Adsorption and Innovation (No. XC-ZXSJ-02-2016-11). O658 A 1000-8713(2017)05-0473-09 * 通讯联系人.E-mail:wangyan11@sjtu.edu.cn(王彦); chaoyan@sjtu.edu.cn(阎超).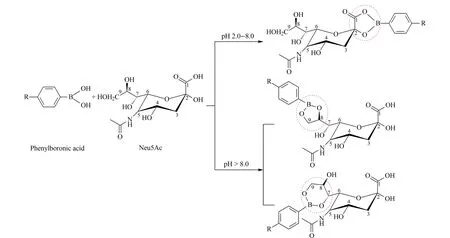



3 结论
