高效液相色谱-串联质谱法测定蜂蜜中20种全氟烷基化合物
2017-05-11金铃和范春林王明林
李 帅, 陈 辉, 金铃和, 彭 涛, 范春林*, 王明林*
(1. 山东农业大学食品科学与工程学院, 山东 泰安 271018; 2. 中国检验检疫科学研究院, 北京 100176)
研究论文
高效液相色谱-串联质谱法测定蜂蜜中20种全氟烷基化合物
李 帅1, 陈 辉2, 金铃和2, 彭 涛2, 范春林2*, 王明林1*
(1. 山东农业大学食品科学与工程学院, 山东 泰安 271018; 2. 中国检验检疫科学研究院, 北京 100176)
建立了高效液相色谱-串联质谱(HPLC-MS/MS)同时测定蜂蜜中20种全氟烷基化合物(PFASs)含量的分析方法。采用改进的QuEChERS方法对样品进行前处理,用含1.5%(v/v)甲酸的乙腈溶液振荡提取,C18和N-丙基乙二胺(PSA)吸附剂净化,Atlantis T3 C18色谱柱(150 mm×2.1 mm, 3 μm)分离,以含5 mmol/L乙酸铵的甲醇溶液和5 mmol/L乙酸铵溶液为流动相进行梯度洗脱。在电喷雾离子(ESI)源负离子模式下以多反应监测(MRM)扫描,采用同位素内标法进行定量分析。结果表明,20种PFASs在16 min内即可完成分离,在0.2~10 μg/L范围内线性关系良好,相关系数(r)均大于0.99;检出限(LOD,S/N=3)和定量限(LOQ,S/N=10)分别为0.04~0.10 μg/kg和0.10~0.20 μg/kg。在0.1、0.5、1.0和2.0 μg/kg加标水平下,20种PFASs的加标回收率为72.6%~113.0%,RSD为0.4%~15.9%(n=6)。该法快速、高效、准确,适用于蜂蜜样品中20种PFASs的同时检测。
高效液相色谱-串联质谱;QuEChERS方法;全氟烷基化合物;蜂蜜
全氟烷基化合物(perfluorinated alkyl substances, PFASs)是一类人工合成的新型持久性有机污染物,由不同长度的疏水烷基碳链和亲水基末端组成,其疏水烷基碳链上的氢原子全部被氟原子(F)替代,形成含有极高化学能的C-F键[1],具有化学惰性、耐热性等优良性能。PFASs被广泛用作表面活性剂、催化剂、润滑剂、杀虫剂以及合成药物、氟橡胶、树脂的中间体[2]。但是PFASs难以新陈代谢、水解、光解和生物降解,在生物体内随着时间的推移不断富集[3]。大量研究表明,全氟辛酸(PFOA)与全氟辛烷磺酸(PFOS)具有神经毒性[4]、肝脏毒性[5]、心血管毒性[6]等生物毒性。目前,国内外学者相继在水产品[7]、动物肝脏[8,9]、鸡蛋[10]、牛奶[11]、母乳[12]及口服液[13]中检测到PFASs,而对于蜂蜜中PFASs的检测却鲜有报道。
蜂蜜是一种附加值较高的营养品,同时又具有一定的药用功效。近年来,国内和国际市场对蜂蜜的需求量不断扩大,对其质量要求也不断提高[14]。从食品安全角度考虑,蜂蜜中不应含有任何化学污染物[15]。因此,对于蜂蜜中PFASs的污染情况进行研究具有重要意义。
目前,国内外对食品中PFASs的前处理方法主要有碱消解法[16]、液液萃取法[17]、固相萃取法[18]等,这些方法步骤繁琐、耗时长、重现性差[19]。而QuEChERS(quick、easy、cheap、effective、rugged、safe)方法快速简便、成本低廉、易于操作,已被广泛应用于化学污染物残留量的检测[20]。因此,本研究建立了改进的QuEChERS结合HPLC-MS/MS同时测定蜂蜜中20种PFASs的分析方法。本方法快速简便、重复性好、准确可靠,可以为我国制定蜂蜜中PFASs相关限量标准提供重要依据。
1 实验部分
1.1 仪器、试剂与材料
Agilent 1290高效液相色谱仪和Agilent 6460三重四极杆质谱仪(美国Agilent公司); Stuart SA8涡旋振荡混匀器(英国Bibby-Stuart公司); SR-2DS水平振荡器(日本TATEC公司); 3-30K高速冷冻离心机(德国Sigma公司); N-EVAP 112氮吹仪(美国Organomation Associates公司); Milli-Q超纯水仪(美国Millipore公司)。
全氟丁酸(PFBA)、全氟戊酸(PFPeA)、全氟丁烷磺酸(PFBS)、全氟己酸(PFHxA)、全氟戊烷磺酸钠(PFPeS)、全氟庚酸(PFHpA)、全氟己烷磺酸(PFHxS)、全氟庚烷磺酸钠(PFHpS)、PFOA、PFOS、全氟壬酸(PFNA)、全氟壬烷磺酸钠(PFNS)、全氟癸酸(PFDA)、全氟癸烷磺酸钠(PFDS)、全氟十一烷酸(PFUdA)、全氟十二烷酸(PFDoA)、全氟十三烷酸(PFTrDA)、全氟十四烷酸(PFTeDA)、全氟十六烷酸(PFHxDA)、全氟十八烷酸(PFODA)标准溶液(50 mg/L)和13C4-全氟丁酸(MPFBA)、13C2-全氟己酸(MPFHxA)、18O2-全氟己烷磺酸钠(MPFHxS)、13C4-全氟辛酸(MPFOA)、13C4-全氟辛烷磺酸钠(MPFOS)、13C5-全氟壬酸(MPFNA)、13C2-全氟癸酸(MPFDA)、13C2-全氟十一烷酸(MPFUdA)、13C2-全氟十二烷酸(MPFDoA)混合内标标准溶液(2 mg/L)均购自加拿大Wellington公司;甲醇、乙腈(HPLC级)购自美国Honeywell公司;C18填料(50 μm)、N-丙基乙二胺(PSA, 40~60 μm)均购自天津博纳艾杰尔公司;无水硫酸镁、氯化钠(分析纯)均购自北京化工厂。实验用水均为由Milli-Q系统提供的电阻率为18.2 MΩ5cm的超纯水,实验过程避免使用聚四氟乙烯材质的器皿和色谱管路。
1.2 标准溶液的配制
准确量取20种PFASs标准溶液(50 mg/L)各200 μL,置于10 mL容量瓶中,用甲醇定容至刻度,配制质量浓度为1 mg/L的混合标准储备液,于-18 ℃冰箱中避光保存。
1.3 样品前处理
称取5.0 g蜂蜜样品于50 mL聚丙烯离心管中,依次加入5 μL 2 mg/L混合内标标准溶液、5 mL水和10 mL含1.5%(v/v)甲酸的乙腈溶液,涡旋1 min后,加入1 g氯化钠和4 g无水硫酸镁,振摇10 min后,以10 000 r/min离心10 min。移取7 mL乙腈层至装有40 mg PSA吸附剂、80 mg C18和900 mg无水硫酸镁的15 mL离心管中,振摇10 min后,以10 000 r/min离心10 min,然后移取4 mL上清液(相当于2.0 g提取液)于玻璃氮吹管中,于40 ℃氮吹至干,用1 mL甲醇定容后,过0.22 μm滤膜,待HPLC-MS/MS分析。
1.4 HPLC-MS/MS条件
色谱柱:Atlantis T3 C18色谱柱(150 mm×2.1 mm, 3 μm);柱温:38 ℃;流速:0.3 mL/min;进样量:10 μL;流动相:A为含5 mmol/L乙酸铵的甲醇溶液,B为5 mmol/L乙酸铵溶液。梯度洗脱程序:0~3 min, 10%A~30%A; 3~13 min, 30%A~100%A; 13~14 min, 100%A~10%A; 14~20 min, 10%A。
离子源:电喷雾离子(ESI)源;负离子模式;离子源温度:325 ℃;扫描模式:多反应监测(MRM)模式;毛细管电压:-4.0 kV;去溶剂气流:10 L/min(氮气);去溶剂温度:250 ℃;锥孔气流:8 L/min(氮气);碰撞气压:0.4 MPa(氮气)。20种PFASs及9种同位素内标的保留时间(tR)、母离子、子离子、碎裂电压和碰撞能量(CE)见表1。
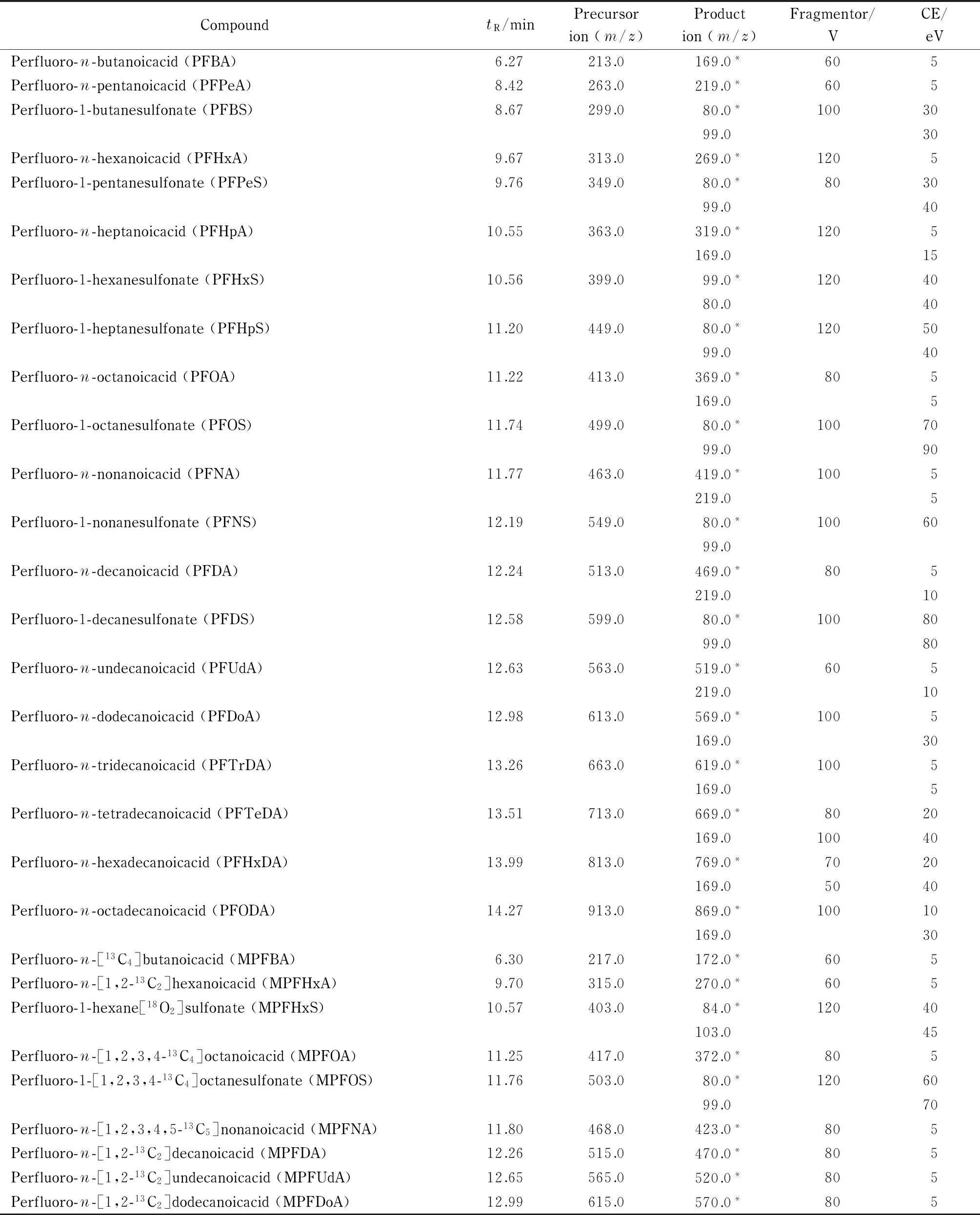
表 1 20种PFASs及9种同位素内标的保留时间、母离子、子离子、碎裂电压和碰撞能量
*Quantitative ion.
2 结果与讨论
2.1 色谱条件的优化
PFASs是一类同时具有疏水和疏油性质的化合物,并具有一定的表面活性和极性,采用较低羟基活性的C18反相柱可以实现这类化合物的分离[21]。PFASs是羧酸或磺酸类物质,在流动相中加入适量的乙酸铵能使流动相保持一定的pH值并提高目标物的离子化效率[19]。研究表明,不同浓度的乙酸铵对PFASs的分离未有明显影响,但是较高浓度的乙酸铵对质谱检测有较强的抑制作用[22]。根据相关文献[8,19],本实验采用Atlantis T3 C18色谱柱,以含5 mmol/L乙酸铵的甲醇溶液-5 mmol/L乙酸铵溶液为流动相,进行梯度洗脱(具体条件见1.4节), 20种PFASs在16 min内即可完成分离(见图1)。由于全氟磺酸类化合物和比其多一个碳链的全氟羧酸类化合物的结构相似,导致其保留时间接近,因此色谱图上只出现14个色谱峰,有6种全氟磺酸类化合物与全氟羧酸类化合物的色谱峰重叠。
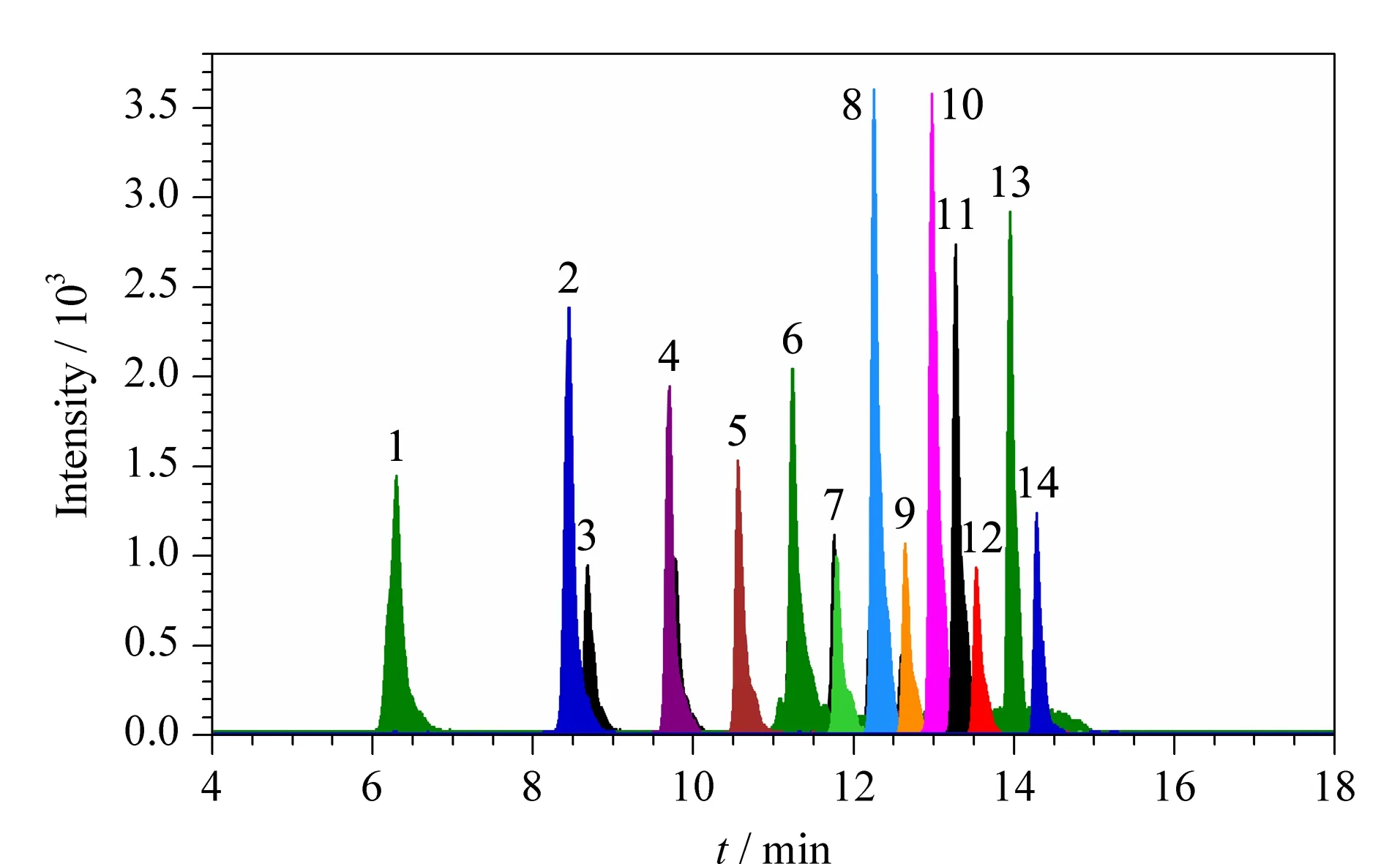
图 1 20种PFASs的选择离子色谱图Fig. 1 Selected ion chromatogram of the 20 PFASs1. PFBA; 2. PFPeA; 3. PFBS; 4. PFHxA and PFPeS; 5. PFHpA and PFHxS; 6. PFHpS and PFOA; 7. PFOS and PFNA; 8. PFNS and PFDA; 9. PFDS and PFUdA; 10. PFDoA; 11. PFTrDA; 12. PFTeDA; 13. PFHxDA; 14. PFODA.
2.2 质谱条件的优化

图 2 PFHxDA标准溶液(10 μg/L)的MRM色谱图Fig. 2 MRM chromatograms of the PFHxDA standard solution (10 μg/L)
2.3 样品前处理条件的优化
2.3.1 提取溶剂的考察
PFASs属于酸性化合物,在酸性环境下呈分子状态,采用酸化有机溶剂有利于目标化合物的提取。研究表明,乙腈的提取效率大于丙酮、甲醇和乙酸乙酯[23],因此本实验考察了含不同体积分数(0.5%、1.5%、2.5%和3.5%)甲酸的乙腈溶液对加标蜂蜜样品(1 μg/kg)中20种PFASs提取效率的影响(见图3)。可以看出,采用含1.5%(v/v)甲酸的乙腈溶液时,整体提取效率较高,目标物的平均回收率为87.7%~110.6%。因此,本实验选择含1.5%(v/v)甲酸的乙腈溶液作为提取溶液。
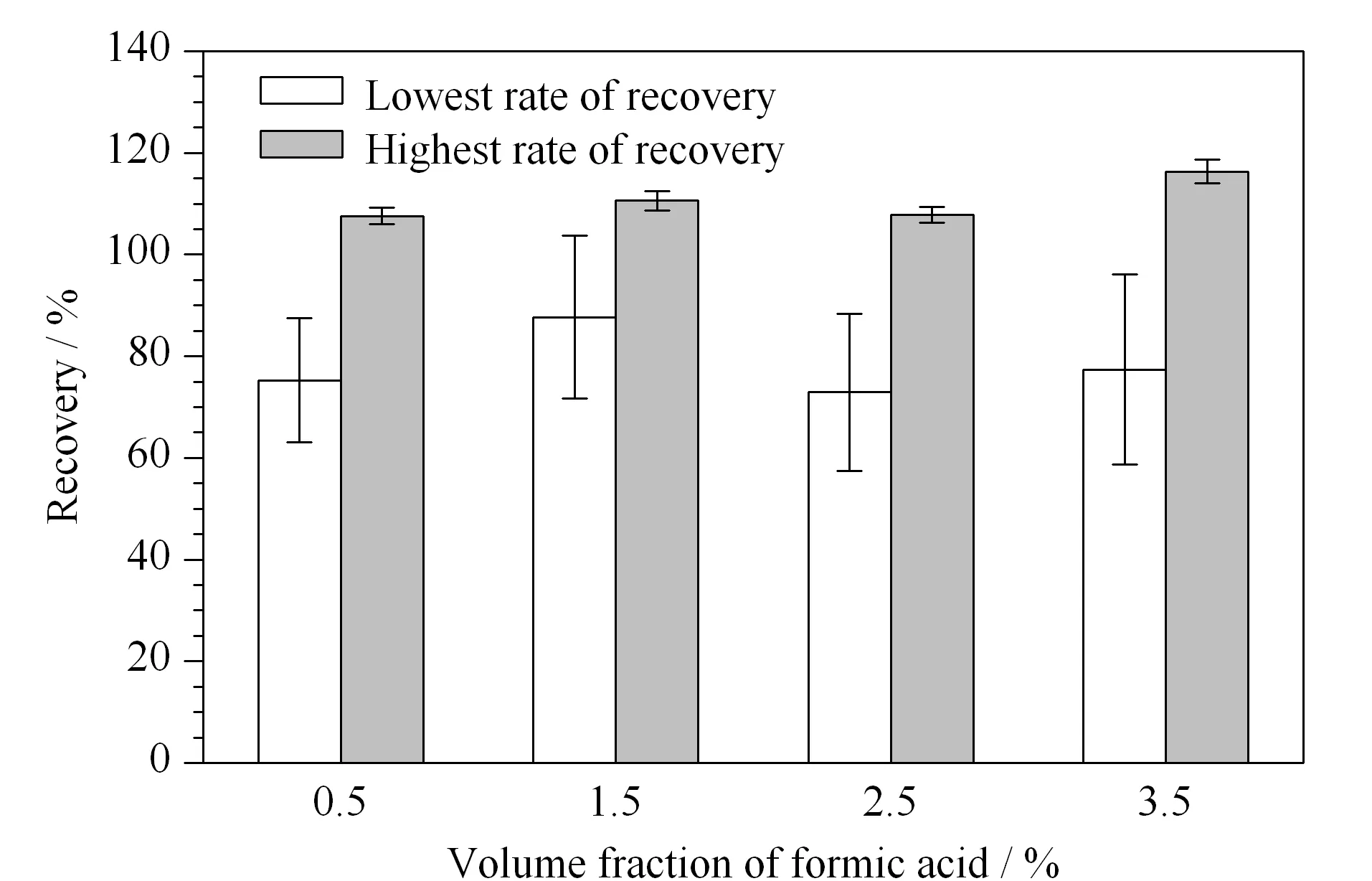
图 3 含不同体积分数甲酸的乙腈溶液对蜂蜜中20种PFASs回收率的影响(n=3)Fig. 3 Effect of the different volume fractions of formic acid in acetonitrile on the recoveries of the 20 PFASs in honey samples (n=3)
2.3.2 净化条件的考察
QuEChERS样品净化方法相比于目前常用的固相萃取法具有快速、操作简便、样品损失量小和回收率高的特点[24]。PSA常用于保留极性有机酸、碳水化合物、脂肪酸等共提物;石墨化炭黑(GCB)可以吸附甾醇和色素;C18用于去除脂类等非极性的干扰物质。因此,根据蜂蜜基质富含碳水化合物、有机酸、色素的特点,选择以上3种吸附剂,并对吸附剂的组合方式和用量进行评价。
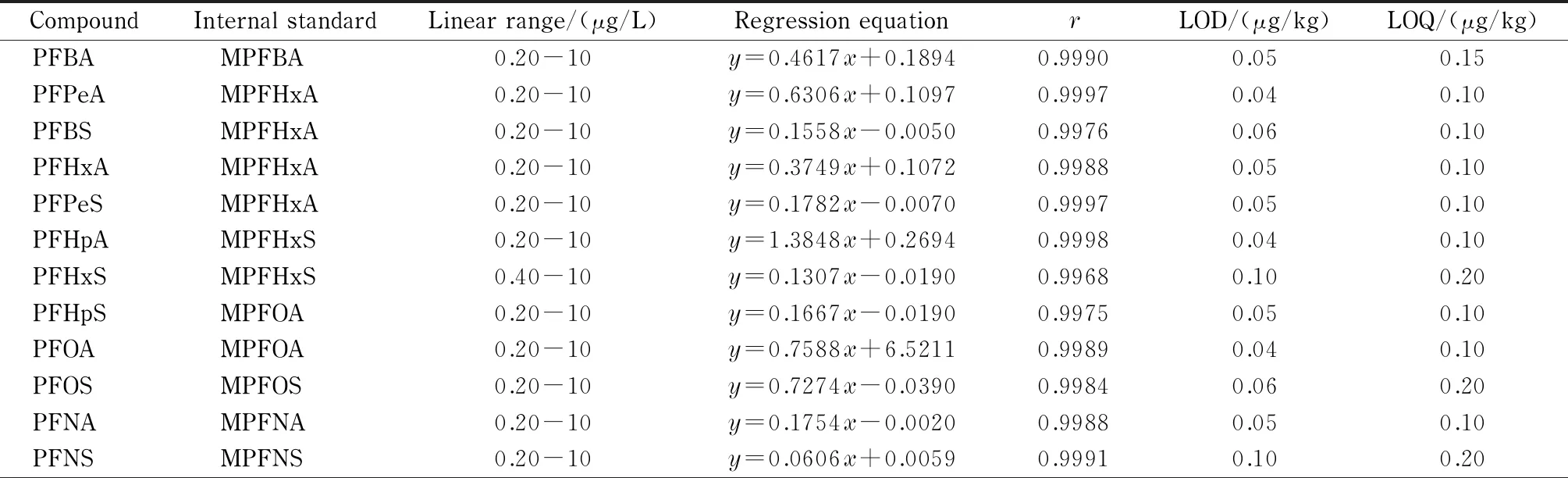
表 2 20种PFASs的线性范围、回归方程、相关系数、检出限和定量限
在1 μg/kg的添加水平下,分别考察不同吸附剂组合方式(PSA、PSA+C18、GCB、GCB+C18、C18)对PFASs回收率的影响(见图4)。结果表明,采用PSA+C18时,20种PFASs的平均回收率为71.1%~112.1%,净化效果优于其他4种情况。而吸附剂的用量直接影响前处理的净化效果和目标物的回收率,因此对PSA+C18的用量进行进一步优化。分别考察不同吸附剂用量(20 mg C18+40 mg PSA、40 mg C18+80 mg PSA、80 mg C18+160 mg PSA、100 mg C18+200 mg PSA)对净化效果的影响(见图5)。可以看出,不同吸附剂用量对蜂蜜中20种PFASs的回收率无明显影响,均大于70%。C18、PSA用量分别为40 mg和80 mg时,有85%的PFASs回收率分布在90%~110%之间,因此确定C18和PSA用量分别为40 mg和80 mg。
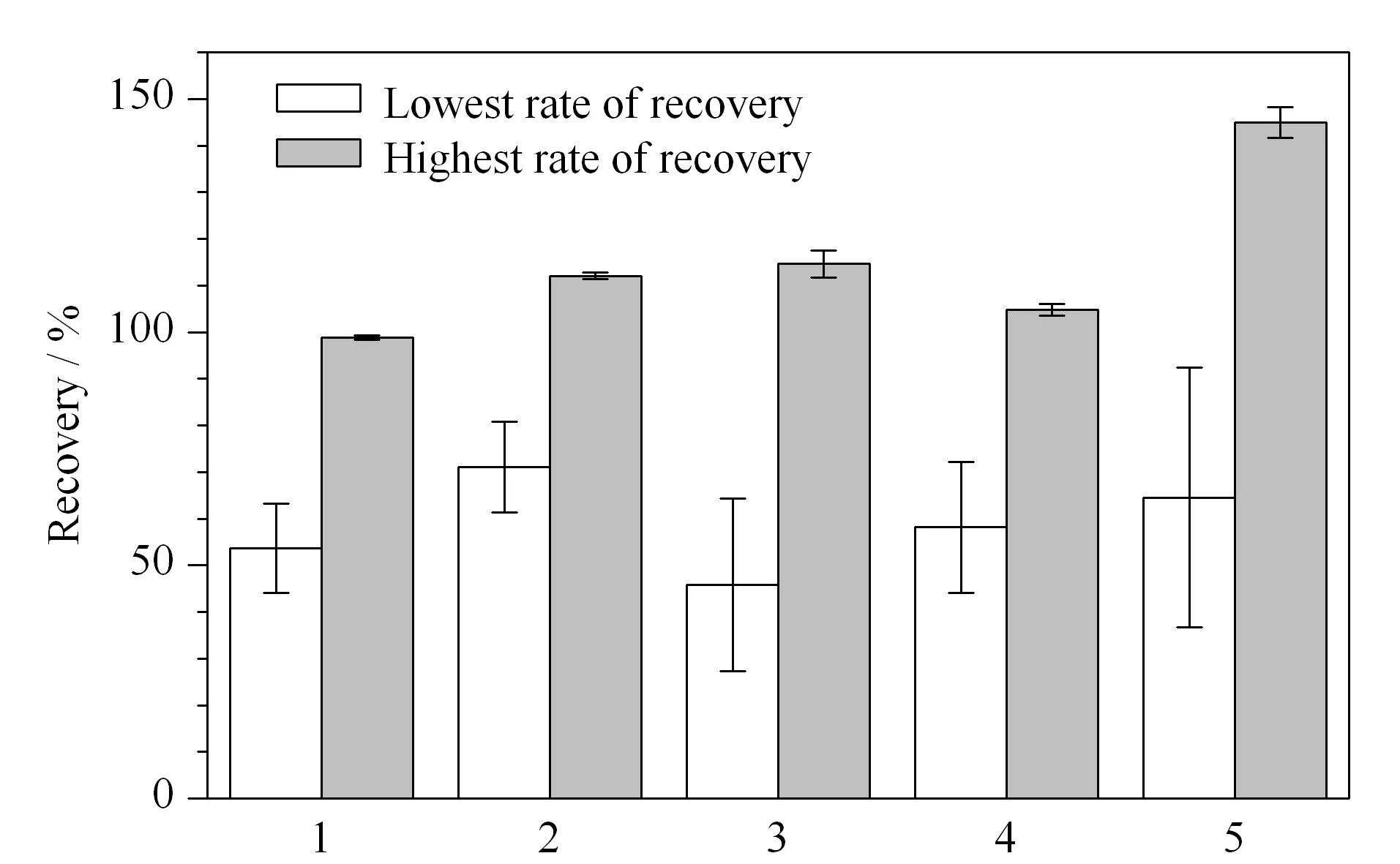
图 4 不同吸附剂组合对蜂蜜样品中20种PFASs回收率的影响(n=3)Fig. 4 Effect of the different combinations of adsorbents on the recoveries of the 20 PFASs in honey samples (n=3) 1. 120 mg N-propylethylenediamine (PSA); 2. 60 mg PSA+60 mg C18; 3. 120 mg graphitized carbon black (GCB); 4. 60 mg GCB+60 mg C18; 5. 120 mg C18.
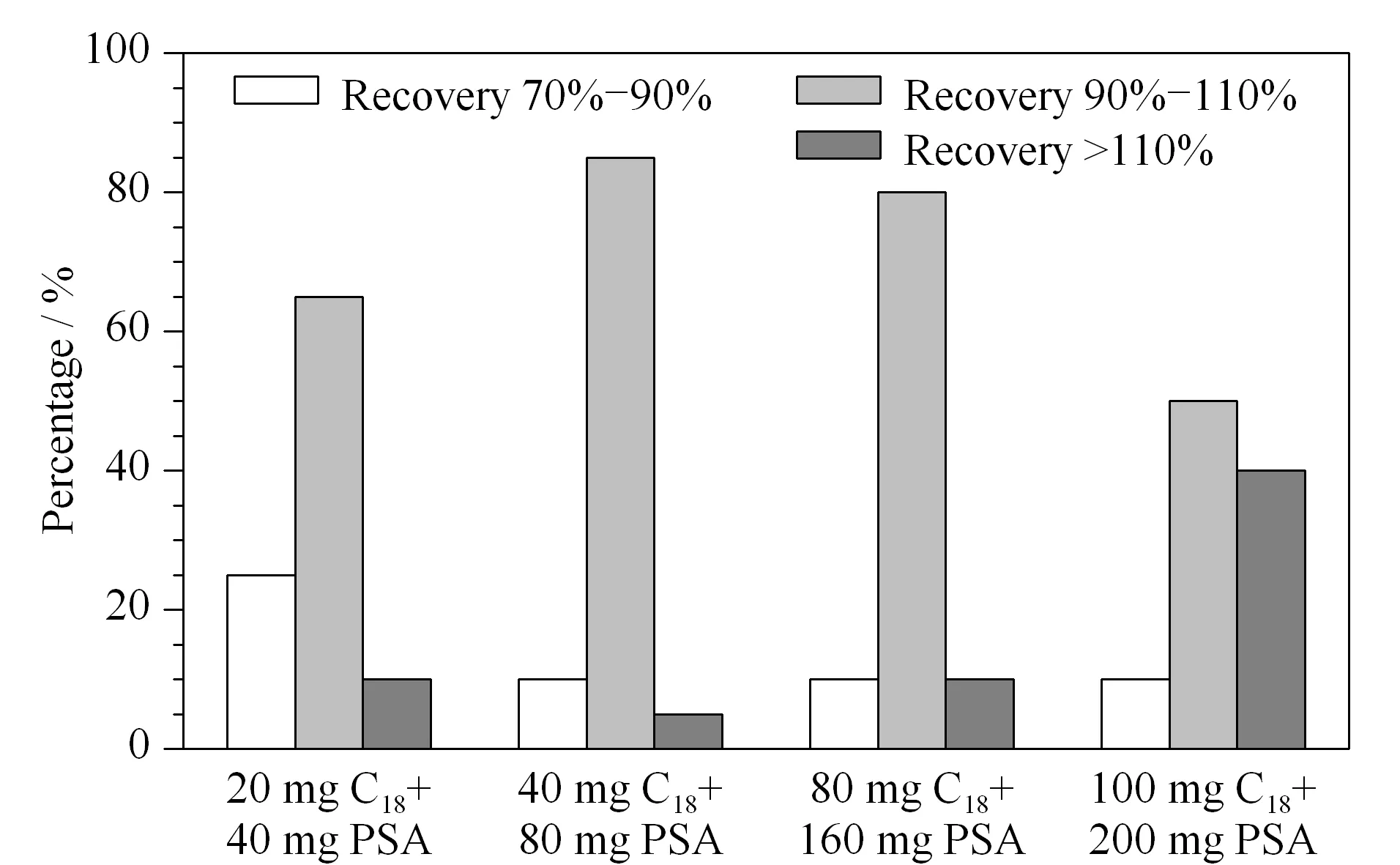
图 5 不同吸附剂用量对蜂蜜样品中20种PFASs回收率的影响Fig. 5 Effect of the different amounts of adsorbent on the recoveries of the 20 PFASs in honey samples
2.4 线性关系和检出限
采用基质曲线-内标法定量,用蜂蜜基质溶液配制质量浓度为0.2、0.4、1.0、2.0、4.0和10.0 μg/L的PFASs基质混合标准溶液,其中内标物的质量浓度均为4 μg/L。以PFASs和对应内标物的定量离子峰面积的比值为纵坐标(y)、各组分的质量浓度(x, μg/L)为横坐标进行线性回归分析。结果表明,20种PFASs在0.2~10 μg/L的范围内线性关系良好,相关系数(r)均大于0.99(见表2)。在空白蜂蜜样品中添加目标化合物,分别以3倍和10倍信噪比(S/N)确定方法的检出限(LOD)和定量限(LOQ),分别为0.04~0.10 μg/kg和0.10~0.20 μg/kg。
2.5 准确度和精密度
对空白蜂蜜样品中分别添加0.1、0.5、1.0和2.0 μg/kg的PFASs混合标准溶液进行测定,同时进行空白样品试验,每个水平做6个平行样品,扣除本底值后计算加标回收率和相对标准偏差(见表3)。结果表明,20种PFASs在蜂蜜样品中的加标回收率为72.6%~113.0%,RSD为0.4%~15.9%(n=6),本方法的准确度和精密度均满足分析要求。

表 2 (续)
y: peak area ratio of the compound to the internal standard;x: mass concentration, μg/L.

表 3 蜂蜜样品中20种PFASs的加标回收率和相对标准偏差(n=6)
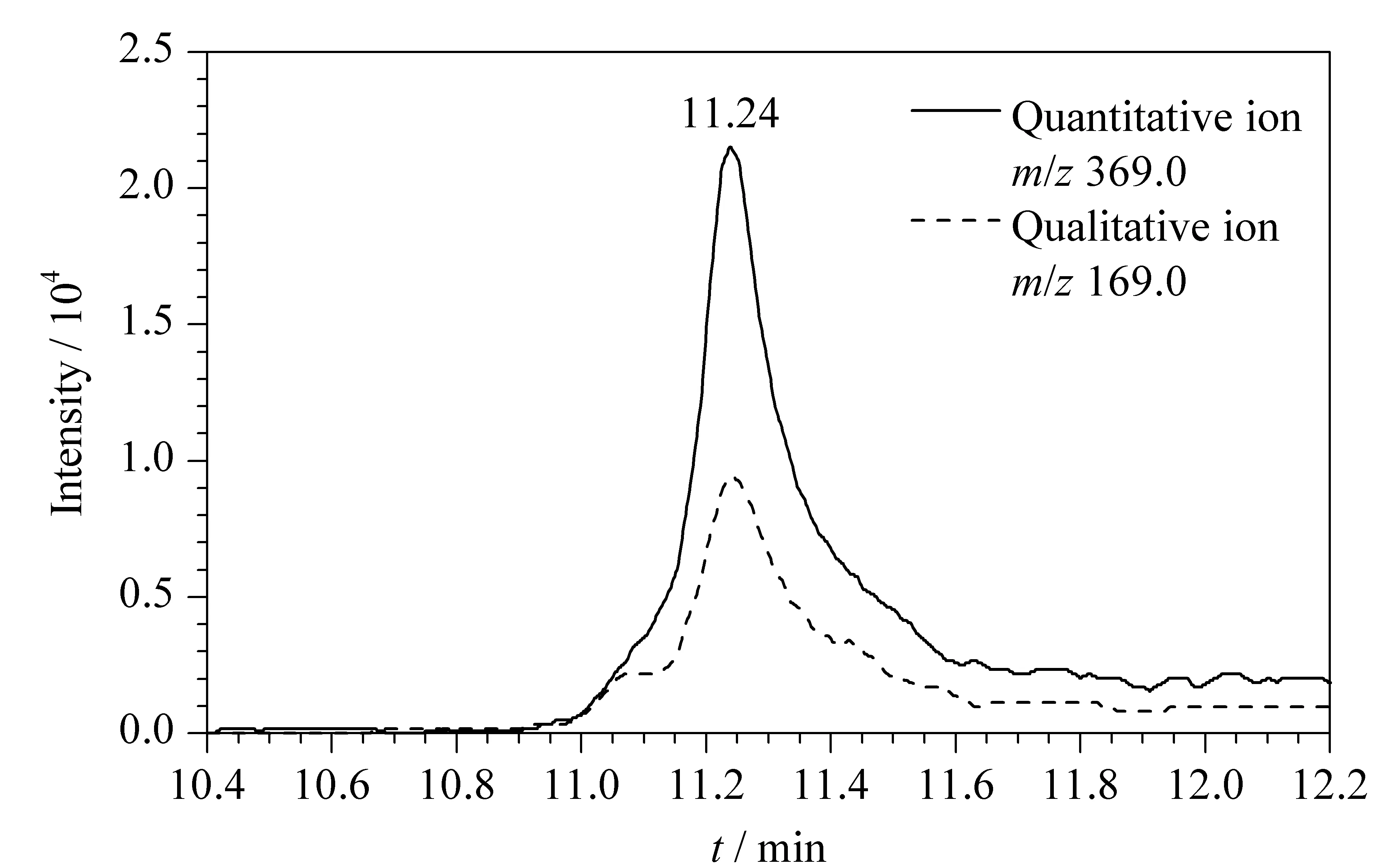
图 6 阳性蜂蜜样品中PFOA的MRM色谱图Fig. 6 MRM chromatograms of the PFOA in a positive honey sample
2.6 实际样品分析
应用所建立的方法对市场上随机采购的10份蜂蜜样品中20种PFASs进行测定。结果发现,其中9份样品中均检出PFOA,其含量为0.04~0.83 μg/kg,其余19种PFASs均未检出。其中某一阳性蜂蜜样品中PFOA的MRM色谱图见图6。
3 结论
本文建立了QuEChERS结合HPLC-MS/MS技术测定蜂蜜中20种PFASs的分析方法。该方法具有前处理成本低、净化效果好、灵敏度高、稳定性好和操作简单的优点,适用于蜂蜜样品中PFASs含量的快速检测。
[1] Surma M, Zieliński H. Pol J Environ Stud, 2015, 24(2): 449
[2] Qu Y, Zhang C J, Li F, et al. Environmental Pollution and Control, 2007, 29(11): 848
曲燕, 张超杰, 李飞, 等. 环境污染与防治, 2007, 29(11): 848
[3] Liu L Z, Guo X D, Fang J, et al. Journal of Instrumental Analysis, 2013, 32(7): 862
刘莉治, 郭新东, 方军, 等. 分析测试学报, 2013, 32(7): 862
[4] Mariussen E. Arch Toxicol, 2012, 86(9): 1349
[5] Song D Y, Lang L, Ji Y B. Proceedings of China Environmental Science Society Academic Conference. Beijing: Beihang University Press, 2009: 1083
宋大禹, 郎朗, 季宇彬. 中国环境科学学会学术年会论文集. 北京: 北京航空航天大学出版社, 2009: 1083
[6] Harada K, Xu F, Ono K, et al. Biochem Bioph Res Co, 2005, 329(2): 487
[7] Guo M M, Wu H Y, Li Z X, et al. Chinese Journal of Analytical Chemistry, 2013, 41(9): 1322
郭萌萌, 吴海燕, 李兆新, 等. 分析化学, 2013, 41(9): 1322
[8] Zhu P P, Yue Z F, Zheng Z K, et al. Chinese Journal of Chromatography, 2015, 33(5): 494
朱萍萍, 岳振峰, 郑宗坤, 等. 色谱, 2015, 33(5): 494
[9] Bai W H, Liu J C, Yan M M, et al. Journal of Food Safety and Quality, 2015, 6(1): 189
白文荟, 刘金钏, 颜朦朦, 等. 食品安全质量检测学报, 2015, 6(1): 189
[10] Li J, Zhang H, Chai Z F, et al. Journal of Instrumental Analysis, 2014, 33(10): 1109
李静, 张鸿, 柴之芳, 等. 分析测试学报, 2014, 33(10): 1109
[11] Lacina O, Hradkova P, Pulkrabova J, et al. J Chromatogr A, 2011, 1218(28): 4312
[12] Guerranti C, Perra G, Corsolini S, et al. Food Chem, 2013, 140(1): 197
[13] Xiao F, Bian X H, Shen J C, et al. Journal of Chinese Mass Spectrometry Society, 2016, 37(6): 562
肖锋, 卞学海, 沈金灿, 等. 质谱学报, 2016, 37(6): 562
[14] Pei G P, Shi B L, Zhao L, et al. Food Science, 2013, 34(15): 329
裴高璞, 史波林, 赵镭, 等. 食品科学, 2013, 34(15): 329
[15] Surma M, Wiczkowski W, Cieslik E, et al. Microchem J, 2015, 121: 150
[16] Wang J M, Wang L, Feng Y J, et al. Food Science, 2010, 31(4): 127
王杰明, 王丽, 冯玉静, 等. 食品科学, 2010, 31(4): 127
[17] Qi Y J, Zhou Z, Shi Y L, et al. Environmental Science, 2013, 34(1): 244
齐彦杰, 周珍, 史亚利, 等. 环境科学, 2013, 34(1): 244
[18] Lin Q, Fu F F, Chen G N, et al. Chinese Journal of Chromatography, 2014, 32(7): 723
林钦, 付凤富, 陈国南, 等. 色谱, 2014, 32(7): 723
[19] He J L, Peng T, Xie J, et al. Chinese Journal of Analytical Chemistry, 2015, 43(1): 40
何建丽, 彭涛, 谢洁, 等. 分析化学, 2015, 43(1): 40
[20] Anastassiades M, Lehotay S J, Stajnbaher D, et al. J AOAC Int, 2003, 86(2): 412
[21] Pan Y Y, Shi Y L, Cai Y Q. Chinese Journal of Analytical Chemistry, 2008, 36(12): 1619
潘媛媛, 史亚利, 蔡亚岐. 分析化学, 2008, 36(12): 1619
[22] Lan F, Feng S, Shen J C, et al. Chinese Journal of Analytical Chemistry, 2013, 41(12): 1893
蓝芳, 冯沙, 沈金灿, 等. 分析化学, 2013, 41(12): 1893
[23] Wang J M, Pan Y Y, Shi Y L, et al. Chinese Journal of Analysis Laboratory, 2009, 28(10): 33
王杰明, 潘媛媛, 史亚利, 等. 分析试验室, 2009, 28(10): 33
[24] Yu Y C. [MS Dissertation]. Xiamen: Jimei University, 2015
余宇成. [硕士学位论文]. 厦门: 集美大学, 2015
Determination of 20 perfluorinated alkyl substances in honey by high performance liquid chromatography-tandem mass spectrometry
LI Shuai1, CHEN Hui2, JIN Linghe2, PENG Tao2, FAN Chunlin2*, WANG Minglin1*
(1.CollegeofFoodScienceandEngineering,ShandongAgriculturalUniversity,Tai’an271018,China;2.ChineseAcademyofInspectionandQuarantine,Beijing100176,China)
A sensitive method for simultaneous determination of 20 perfluorinated alkyl substances (PFASs) in honey was developed by QuEChERS-high performance liquid chromatography-tandem mass spectrometry (HPLC-MS/MS). The samples were extracted by acetonitrile with 1.5% (v/v) formic acid, and purified by C18andN-propylethylenediamine (PSA) adsorbents. The separation of the 20 PFASs was performed on an Atlantis T3 C18column using gradient elution with methanol containing 5 mmol/L ammonium acetate and 5 mmol/L ammonium acetate as mobile phases within 16 min. The PFASs were analyzed under the multiple reaction monitoring (MRM) mode with negative electrospray ionization (ESI-). Under the optimal conditions, the isotope internal standard method was used to quantify the contents of the 20 PFASs. The calibration curves were acquired in the concentration range of 0.2-10 μg/L with correlation coefficients (r) greater than 0.99. The limits of detection (LODs) and limits of quantitation (LOQs) ranged from 0.04 to 0.10 μg/kg and 0.10 to 0.20 μg/kg, respectively. The recoveries of the 20 PFASs spiked in blank honey samples were between 72.6% and 113.0% with relative standard derivations (RSDs) of 0.4%-15.9% (n=6). The developed method is rapid, efficient and accurate, and suitable for the simultaneous analysis of the 20 PFASs in honey samples.
high performance liquid chromatography-tandem mass spectrometry (HPLC-MS/MS); QuEChERS; perfluorinated alkyl substances (PFASs); honey
10.3724/SP.J.1123.2016.12016
2016-12-08
国家科技基础性工作专项(2013FY113100).
Foundation item: National Special Technology Base Work (No. 2013FY113100).
O658
A
1000-8713(2017)05-0495-07
* 通讯联系人.E-mail:caiqfcl@163.com (范春林); mlwang@163.com (王明林).
猜你喜欢
杂志排行
色谱的其它文章
- 分散固相萃取-液相色谱-串联质谱法测定谷物、蔬菜、水果中27种新型杀菌剂
- 气相色谱法测定车用汽油中含氧化合物和苯胺类化合物
- 固相萃取-超高效液相色谱-串联质谱法测定乳粉和果冻中的氯化胆碱
- 在线固相萃取-离子色谱法测定4种芳环磺酸盐中的硫酸根离子
- Enantioseparation of 2-(substituted phenyl)propanoic acids with hydroxypropyl-β-cyclodextrin as a chiral additive:investigation of substituent influence on enantiorecognition
- 超高效液相色谱/静电场轨道阱高分辨质谱法同时测定塑料食品接触材料中光稳定剂和抗氧化剂的特定迁移量
