长效干扰素与普通干扰素治疗HBeAg阳性慢性乙型肝炎患者疗效的meta分析
2017-05-11焦方舟张海月刘菲菲王鲁文龚作炯
焦方舟,张海月,刘菲菲,王鲁文,龚作炯
(武汉大学人民医院感染病科,湖北武汉430060)
·荟萃分析·
长效干扰素与普通干扰素治疗HBeAg阳性慢性乙型肝炎患者疗效的meta分析
焦方舟,张海月,刘菲菲,王鲁文,龚作炯
(武汉大学人民医院感染病科,湖北武汉430060)
目的评价长效干扰素与普通干扰素治疗HBeAg+慢性乙型肝炎患者的疗效。方法检索Medline、Embase、EBSCO、中国生物医学文献数据库(CBM)、中文科技期刊数据库(VIP)、中国期刊全文数据库(CNKI)、万方数字化期刊全文数据库,纳入长效干扰素(PEG-IFN-ɑ-2a或者PEG-IFN-ɑ-2b)与普通干扰素比较治疗HBeAg+慢性乙型肝炎的随机对照研究,并追查了所有纳入文献的参考文献,检索年限均为建库至2016年7月1日。由2位研究者独立进行文献筛选、资料提取及纳入研究的偏倚风险评价后,采用RevMan 5.2软件进行Meta分析。结果最终纳入13项研究1 263例,其中长效干扰素组616例,普通干扰素组647例。Mate分析结果显示,长效干扰素组在治疗HBeAg阳性慢性乙型肝炎24周和48周时观察ALT复常率、HBV-DNA转阴率、HBeAg转阴率三个指标均优于普通干扰素组(P<0.05),在12周时长效干扰素组HBV-DNA转阴率较普通干扰素组高(Z=2.19,P=0.03),而ALT复常率、HBeAg转阴率方面与普通干扰素组比较差异无统计学意义(P>0.05);在治疗12周和24周时,两组所检测的HBsAg阴转率差异无统计学意义(P>0.05),而疗程延长至48周时,长效干扰素组HBsAg阴转率高于普通干扰素组(Z=2.34,P=0.02);在HBeAg血清转换率方面,疗程12周和48周差异均无统计学意义(P<0.05),而在24周时,长效干扰素组优于普通干扰素组(Z=2.90,P=0.004)。结论在治疗24周、48周时,长效干扰素(PEG-IFN-ɑ-2a或者PEG-IFN-ɑ-2b)治疗HBeAg阳性慢性乙型肝炎患者在ALT复常率、HBV-DNA转阴率和HBeAg转阴率三个指标均优于普通干扰素;仅48周疗程时长效干扰素HBsAg阴转率较普通干扰素组高;仅24周疗程时长效干扰素HBeAg血清转换率较高。受纳入研究数量和质量限制,上述结论仍需开展高质量研究加以验证。
聚乙二醇干扰素ɑ-2a/ɑ-2b(PEG-IFN-ɑ-2a/ɑ-2b);e抗原阳性慢性乙型肝炎;普通干扰素;Meta分析
世界卫生组织估计全球约有2.4亿慢性HBV感染者,每年约有65万人死于HBV感染所致的肝功能衰竭、肝硬化和肝细胞癌[1]。HBV慢性感染时,HBV在肝脏组织中不断复制繁殖,最终引起各种肝脏损害。然而随着乙型肝炎病毒疫苗的问世,HBV传播得到了有效的控制。特别是近几十年来干扰素和核苷酸类似物的相继研发,越来越多患者的肝脏损害得到有效控制[2]。干扰素-α是存在人体内的天然信号蛋白,能诱导细胞抗病毒作用。聚乙二醇干扰素(PEG-IFN)是聚乙二醇(PEG)与普通干扰素结合形成的长效干扰素,通过聚乙二醇的修饰,PEG-IFN的半衰期大大延长,能够有效的抑制乙肝病毒的复制达到一个星期,因此PEG-IFN仅需每注射一次,从而使患者能够更方便、更容易地服从治疗安排[3-4]。本研究旨在采用系统评价方法对长效干扰素(PEG-IFN-α-2a或PEG-IFN-α-2b)和普通干扰素治疗HBeAg阳性慢性乙型肝炎的临床疗效进行评价,以期为临床治疗提供决策依据。
1 资料与方法
1.1 文献纳入和排除标准本研究纳入长效干扰素和普通干扰素治疗的随机对照的临床研究。其中研究对象均为HBeAg阳性慢性乙型肝炎,所有病例均满足(2015年版)慢性乙型肝炎防治指南的诊断标准[1]。临床研究处理组的患者均单用PEG-IFN-α-2a或者PEG-IFN-α-2b药物,而对照组的患者给予普通干扰素治疗,治疗结束后,ALT复常率、HBV-DNA转阴率、HBeAg转阴率、HBsAg阴转率、HBeAg血清转换率等五项测量指标被检测。排除标准:①合并其他病毒,包括甲、丙、丁、戊型肝炎病毒或巨细胞病毒、EB病毒、HIV感染;②合并其他引起慢性肝病的疾病,包括酒精性肝炎、药物性肝损伤、自身免疫性肝炎等;③存在样本资料不全、诊断和疗效判定标准不统一等问题;④在分析时无法转化或无法追踪到提供的数据的文献。
1.2 检索策略计算机检索Cochrane Library、Medline、Embase、EBSCO、中国生物医学文献数据库(CBM)、中文科技期刊数据库(VIP)、中国期刊全文数据库(CNKI)、万方数字化期刊全文数据库收录的文献。检索年限为建库至2016年7月1日,以“HBeAg阳性慢性乙型肝炎、普通干扰素、聚乙二醇干扰素α-2a或聚乙二醇干扰素α-2b”为检索词。
1.3 文献筛选、资料提取与纳入研究的偏倚风险评价由两名研究者对纳入研究的文献的数据和资料进行提取,对有分歧的研究通过协商决定是否纳入。提取的内容包括研究的纳入和排除标准、设计方法、疗程和检测指标等。纳入研究的偏倚风险按照根据Cochrane系统评价员手册5.1版偏倚风险评估标准[5]进行评估,所有纳入的研究均按以下方法进行评估:①随机分配的产生方法;②分配方案的隐蔽;③盲法;④结果数据是否完整;⑤择性结局的报道;⑥其他影响结局的偏倚来源;在所有的评估结果中,“Low risk”指低偏倚风险,“High risk”指高偏倚风险,“Unclear risk”指文献提供的偏倚风险相关的信息不足。
1.4 统计分析采用Cochrane协作网提供的RevMan5.2软件进行Meta分析。统计学Ι2检验各研究间的异质性。若异质性小(P≥0.1;Ι2≤50%)使用固定效应模型进行Meta分析,如果研究间异质性较大(P<0.1,Ι2>50%)则根据其异质性可能的来源进行分析,对可能的异质性因素进行相应的亚组分析,并且应用敏感性分析检验结果是否稳定。
2 结果
2.1 纳入研究的一般情况计算机检索数据库共检出相关文献866篇,去除非临床研究和重复文献后纳入345篇,通过查看标题、摘要后剔除不符合研究256篇,然后查找阅读全文和质量评价后筛选得39篇,进一步比较各研究设计方案,排除不符合文献26篇,最终纳入13篇合格文献[6-18]。共1 263例患者(长效干扰素组616例,普通干扰素组647例)被纳入本次研究。具体见表1,文献筛选流程见图1。

图1 文献筛选流程及结果
2.2 纳入研究的偏倚风险评价两名研究员对纳入的13项研究进行偏倚风险评估发现,有7项研究提及“随机”,其中熊茂来[7]的研究指出随机方法是通过随机数字表产生,有3项指出为回顾性研究,其余3项研究未交代是否采用随机分组。所有研究均未描述盲法和分配隐藏方法。研究结果完整性均有报道,且无选择性报道结果。13项研究的偏倚风险结果见图2、图3。
2.3 Meta分析结果
2.3.1 ALT复常率13个研究比较了ALT复常率。通过异质性检验发现,48周疗程时各研究间存在异质性(P=0.08<0.1,I2=44%),给予随机效应模型处理,
而其他疗程时(12和24周)无异质性。Meta分析结果:在治疗12周时,两组之间在ALT复常率方面差异无统计学意义(Z=1.23,P=0.22);在治疗24周和48周时,长效干扰素组HBeAg转阴率高于普通干扰素组,差异具有显著的统计学意义(分别为Z=3.81,P=0.000 1;Z= 3.80,P=0.000 1),敏感性分析发现分别剔除各亚组内研究,合并效应量差异仍具有统计学意义且森林图结果方向均未发生改变,见图4。

表1 纳入研究的基本情况

图2 偏倚风险图:对所有纳入研究产生偏倚风险的项目所占百分比的判断

图3 风险偏倚图:对所有纳入研究中每个偏倚风险项目的判断
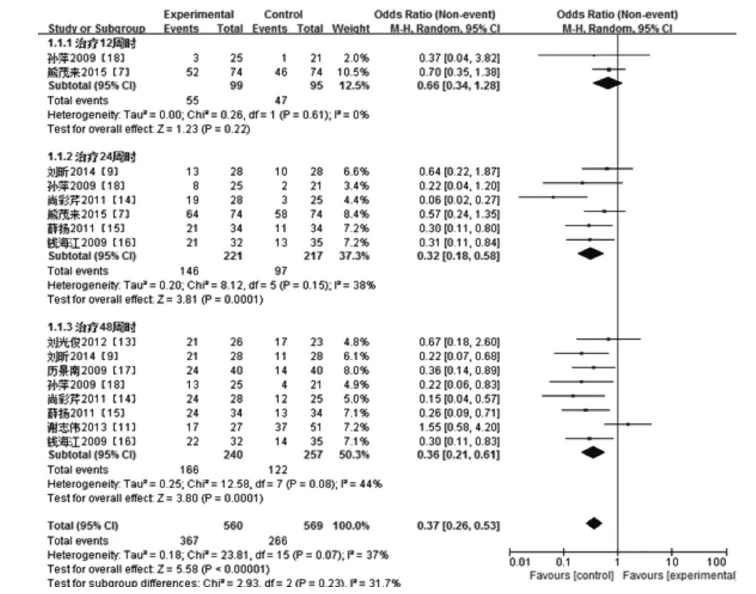
图4 长效干扰素组和普通干扰素组ALT复常率比较的Meta分析
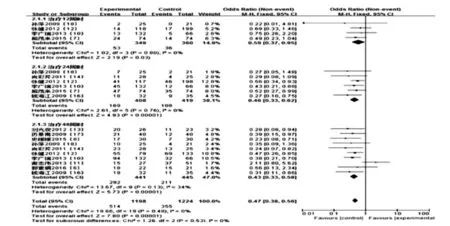
图5 长效干扰素组和普通干扰素组HBV-DNA转阴率比较的Meta分析
2.3.2 HBV-DNA转阴率比较了11个研究间HBV-DNA转阴率。统计学异质性检验发现亚组内研究间同质性好(P=0.48>0.1,I2=0%<50%),故采用固定效应模型。Meta分析结果显示:在治疗12周、24周和48周时,长效干扰素组HBV-DNA转阴率均高于普通干扰素组,两组间的差异具有统计学意义(分别为Z= 2.19,P=0.03;Z=4.93,P<0.000 01;Z=5.73,P<0.000 01),见图5。
2.3.3 HBeAg转阴率11个研究比较了HBeAg转阴率。见图6,各研究间无统计学异质性(P=0.39>0.1,I2=5%<50%),故应用固定效应模型。Meta分析结果显示:在治疗12周时,HBeAg转阴率在长效干扰素组较高,两组之间的差异均无统计学意义(Z=1.35,P= 0.18);在24周和48周时,两组之间的差异均具有显著统计学意义(分别为Z=3.52,P=0.000 4;Z=5.11,P<0.000 01)。
2.3.4 HBsAg阴转率5个研究比较了HBsAg阴转率,研究间同质性好(P=0.98>0.1,I2=0%<50%),采用固定效应模型。Meta分析结果显示:在治疗48周时,长效干扰素组HBsAg阴转率高于普通干扰素组,且两组之间的差异均具有统计学意义(Z=2.34,P= 0.02);在治疗12周和24周时,两组之间的差异均无统计学意义(分别为Z=0.94,P=0.35;Z=1.18,P=0.24),见图7。
2.3.5 HBeAg血清转换率对比了6项研究HBeAg血清转换率,各研究间无统计学异质性(P= 0.44>0.1,I2=1%<50%),应用固定效应模型Meta分析结果显示:在治疗24周时,长效干扰素组HBeAg血清转换率较高,两组之间的差异均具有统计学意义(Z= 2.90,P=0.004);在治疗12周和48周时,长效干扰素组与普通干扰素组差异无统计学意义(分别为Z=0.73,P=0.46;Z=1.59,P=0.11),见图8。
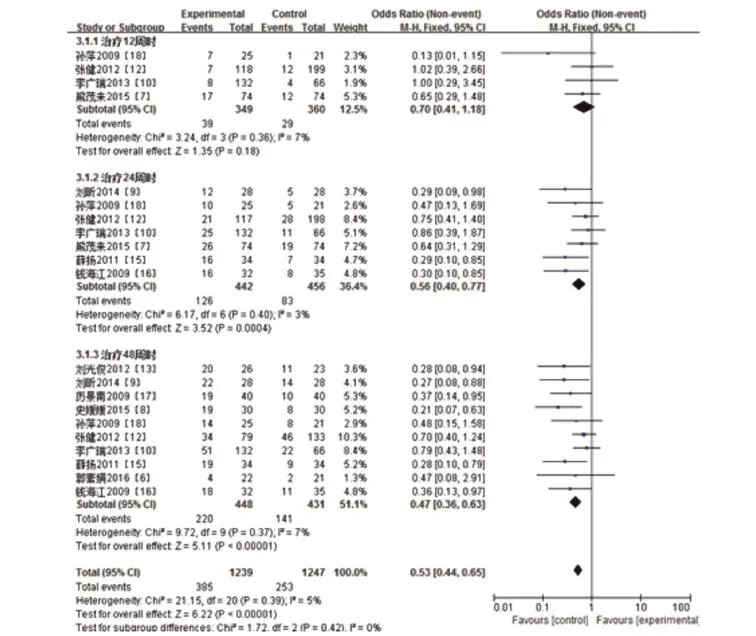
图6 长效干扰素组和普通干扰素组HBeAg转阴率
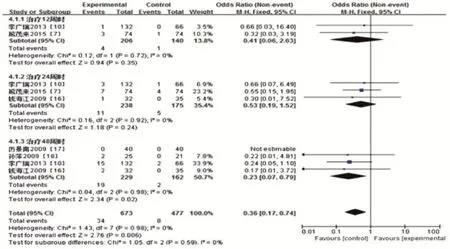
图7 长效干扰素组和普通干扰素组HBsAg转阴率

图8 长效干扰素组和普通干扰素组HBeAg血清转换率比较的Meta分析
3 讨论
本研究收集了2016年7月以前国内外关于PEG-IFN-α-2a或者PEG-IFN-α-2b与普通干扰素相比治疗HBeAg阳性慢性乙型肝炎的疗效研究,针对性观察了两种药物治疗后,ALT复常率、HBV-DNA转阴率、HBeAg转阴率、HBsAg阴转率、HBeAg血清转换率五项指标的差异,通过循证医学方法对比了两种药物在相同剂量和相同疗程时各指标的差异。II期临床试验结果显示,PEG-IFN-α-2a治疗HBeAg阳性慢性乙型肝炎24周时的持续病毒学应答较普通干扰素(IFN-α-2a)治疗高两倍(分别为24%和12%;P=0.036)[19-20],证明PEG-IFN-α-2a治疗HBeAg阳性慢性乙型肝炎优于IFN-α-2a。本研究Meta分析结果显示,在治疗24周、48周时,长效干扰素组(PEG-IFN-α-2a或者PEG-IFN-α-2b)治疗HBeAg阳性慢性乙型肝炎患者ALT复常率、HBV-DNA转阴率和HBeAg转阴率高于普通干扰素组,而且治疗48周时长效干扰素HBsAg阴转率较普通干扰素组高,此外,治疗24周时长效干扰素HBeAg血清转换率较高。本研究因纳入HBsAg阴转率、HBeAg血清转换率相关指标的研究较少,纳入的资料不能充分说明这两个指标上长效干扰素和普通干扰素的疗效差异。类似Meta分析研究发现,48周疗程时在HBeAg阴转率、HBV-DNA阴转率、HBeAg血清转换率和ALT复常率方面,聚二乙醇干扰素效果优于普通干扰素,而仅24周疗程的聚二乙醇干扰素在HBV-DNA阴转率方面优于普通干扰素,其他方面与普通干扰素相当[21]。由此我们可以看出,治疗HBeAg阳性慢性乙型肝炎患者时,聚乙二醇干扰素获得的HBeAg阴转率、HBV-DNA阴转率和ALT复常率相比普通干扰素高,而在HBsAg阴转率、HBeAg血清转换率方面因纳入研究数量与样本量相对来说还不够多、不够大,且质量不高,故不能充分说明聚乙二醇干扰素较普通干扰素优,还需运用需更多高质量、大样本临床试验研究。总之,长效干扰素在给药时间、治疗效果方面均优于普通干扰素,且指南推荐长效干扰素为一线用药,因此临床推荐使用长效干扰素。
本系统评价尚存在以下局限性,有待进一步研究和完善:①国内临床证据等级偏低,且纳入的文献以小样本资料为主,且未纳入英文文献,缺乏高质量的随机对照研究(部分研究为回顾性研究);②各研究的治疗基线水平、普通干扰素(安福隆、凯因益生、运德素)各品牌间的差异也可能造成一定的偏倚;③部分结局指标存在发表偏倚,虽然采用了广泛的检索策略,但仍有会议论文或者灰色文献漏检;④受研究设计的局限和样本量的限制,因此研究结果的可靠性尚需大样本、高质量的研究予以证实。
[1]王贵强,王福生,成军,等.慢性乙型肝炎防治指南(2015年更新版) [S].临床肝胆病杂志,2015,31(12):1941-1960.
[2]Dusheiko G.Treatment of HBeAg positive chronic hepatitis B:interferon or nucleoside analogues[J].Liver Int,2013,33 Suppl 1: 137-150.
[3]Kang L,Pan J,Wu J,et al.Anti-HBV drugs:progress,unmet needs, and new hope[J].Viruses,2015,7(9):4960-4977.
[4]Degasperi E,Viganò M,Aghemo A,et al.Peg-IFN-α2a for the treatment of chronic hepatitis B and C:a 10-year history[J].Expert Rev Anti Infect Ther,2013,11(5):459-474.
[5]Higgins JPT,Green S.Cochrane handbook for systematic reviews of interventions[J].Cochrane Database of Systematic Reviews,2011, 2011(2):S38.
[6]郭素娟,李智伟.聚乙二醇与普通干扰素治疗HBeAg阳性慢性乙型肝炎的疗效[J].肝脏,2016,21(2):119-122.
[7]熊茂来.聚乙二醇干扰素α-2a治疗慢性乙型肝炎74例疗效观察[J].海南医学,2014,25(3):332-334.
[8]史媛媛.长效干扰素与常规干扰素治疗慢性乙肝60例临床对比观察[J].基层医学论坛,2015,19(5):640-642.
[9]刘昕.聚乙二醇干扰素α-2a治疗慢性乙肝疗效观察[J].中国冶金工业医学杂志,2014,31(3):278-280.
[10]李广瑞,邱素民,杨桂艳.聚乙二醇干扰素治疗慢性乙型肝炎的疗效及其对骨髓抑制的影响[J].实用临床医药杂志,2013,17(23): 30-34.
[11]谢志伟.干扰素α和恩替卡韦治疗HBeAg阳性慢性乙型肝炎疗效预测因素的分析[J].南方医科大学,2013,33(6):878-881.
[12]张健,周元平,张艳茹,等.聚乙二醇化干扰素与普通干扰素治疗慢性乙型肝炎的疗效及对骨髓抑制的比较[J].广东医学,2012,33 (13):1924-1927.
[13]刘光俊,潘志敏,王军,等.聚乙二醇干扰素α-2a治疗慢性乙型肝炎效果分析[J].南通大学学报(医学版),2012,32(5):394-396.
[14]尚彩芹.聚乙二醇干扰素α-2a治疗慢性乙型肝炎的疗效分析[J].中国现代医药杂志,2011,13(12):84-85.
[15]薛扬.聚乙二醇干扰素α-2a治疗HBeAg阳性慢性乙型肝炎疗效分析[J].中国实用医药,2011,6(29):134-135.
[16]钱海江.聚乙二醇干扰素与普通干扰素治疗慢性乙型肝炎疗效观察[J].临床医学,2009,29(1):109-110.
[17]厉景南,李朝霞,施云珍,等.聚乙二醇化干扰素α-2a和干扰素α-2a治疗e抗原阳性慢性乙型肝炎[J].中国医刊,2009,44(7):35-36.
[18]孙萍,蒲涛.聚乙二醇干扰素α-2A治疗HBeAg阳性的慢性乙肝的临床研究[J].中国当代医药,2009,16(9):39-40.
[19]Kao JH.HBeAg-positive chronic hepatitis B:why do I treat my patients with pegylated interferon?[J].Liver Int,2014,34 Suppl 1: 112-119.
[20]Craxi A,Cooksley WG.Pegylated interferons for chronic hepatitis B [J].Antiviral Res,2003,60(2):87-89.
[21]王瑶芬,王瑶霞,余琼华.聚乙二醇干扰素α-2a治疗HBeAg阳性慢性乙型肝炎的Meta分析[J].中国循证医学杂志,2009,9(10): 1080-1086.
Meta analysis of efficacy of pegylated interferon versus common interferon in the treatment of HBeAg positive chronic hepatitis B.
JIAO Fang-zhou,ZHANG Hai-yue,LIU Fei-fei,WANG Lv-wen,GONG Zuo-jiong.Department of Infectious Diseases,Renmin Hospital of Wuhan University,Wuhan 430060,Hubei,CHINA
ObjectiveTo evaluate the efficacy of pegylated interferon(PEG-IFN-ɑ-2a or PEG-IFN-ɑ-2b)and common interferon in the treatment of HBeAg positive chronic hepatitis B.MethodsRandomized controlled trials (RCTs)about the efficacy comparison between pegylated interferon(PEG-IFN-ɑ-2a or PEG-IFN-ɑ-2b)and common interferon for the treatment of HBeAg positive chronic hepatitis B before July 1st,2016 were searched from Medline,Embase,EBSCO,Chinese Biomedical Literature Database(CBM),VIP,CNKI and Wanfang database.The references of the obtained literatures were also traced.Mate-analysis was performed by using RevMan 5.2 software after two researchers screened literature independently,extracted data and assessed the risk of bias.ResultsThirteen RCTs(n=1 263)were involved,including 616 cases in Pegylated interferon group and 647 cases in common interferon group.The results of meta-analysis showed that at 24 week and 48 week,the ALT normalization,HBV-DNA negative conversion rate and HBeAg negative conversion rate in Pegylated interferon group were significantly higher than those in common interferon group(P<0.05).At 12 week,HBV-DNA negative conversion rate in Pegylated interferon group was higher than that in common interferon group(Z=2.19,P=0.03),but there were no statistical differences in ALT normalization and HBeAg negative conversion rate between Pegylated interferon group and common interferon group(P>0.05).At 12 week and 24 week,there was no statistical difference in the HBsAg negative conversion rate between the two groups(P>0.05),but at 48 week,HBsAg negative conversion rate in Pegylated interferon group was higher than that in common interferon group(Z=2.34,P=0.02).At 12 week and 48 week,there was no statistical difference in the HBeAg seroconversion rate between Pegylated interferon group and common interferon group(P>0.05),however,that in the Pegylated interferon group was higher than common interferon group at 24 week(Z=2.90,P=0.004).ConclusionAfter the treatment for 24 weeks and 48 weeks,Pegylated interferon(PEG-IFN-ɑ-2a or PEG-IFN-ɑ-2b)was superior to common interferon in ALT normalization,HBV-DNA negative conversion rate,HBeAg negative conversion rate.At 48 week,only HBsAg negative conversion rate in Pegylated interferon group was higher than that in common interferon group,and at 24 week,only HBeAg seroconversion rate in Pegylated interferon group was higher than common interferon.Due to the quantity and quality limitations of included studies,more high quality studies are needed to verify the above conclusions.
PEG-IFN-ɑ-2a/ɑ-2b;HBeAg positive chronic hepatitis;Common interferon;Meta-analysis
10.3969/j.issn.1003-6350.2017.08.055
R512.6+2
A
1003—6350(2017)08—1354—07
2016-11-03)
龚作炯。E-mail:zjgong@163.com
