新辅助化疗对Ⅰ、Ⅱ期宫颈癌患者预后的Meta分析
2017-05-11高丽君成龙刘霄周航
高丽君+成龙+刘霄+周航

[摘要] 目的 探討新辅助化疗联合手术在Ⅰ、Ⅱ期宫颈癌患者治疗中的效果。 方法 计算机检索PubMed、The Cochrane Library、Embase、Web of Science、CNKI、CBM、万方等常用数据库,纳入标准包括发表年限为2000~2016年、FIGO分析为Ⅰ~Ⅱ期。收集符合的文献,评价质量并提取有效数据进行Meta分析,统计学分析采用Review Manager 5.3软件。 结果 共纳入10个RCTs,含1351例患者,Meta分析结果显示:与直接手术组比较,新辅助化疗组可以显著降低淋巴结转移率(OR = 0.49,95%CI:0.38~0.63,P < 0.000 01)、脉管癌栓发生率(OR = 0.41,95%CI:0.17~0.97,P = 0.04)和宫旁阳性率(OR = 0.60,95%CI:0.43~0.84,P = 0.003)。但两组1年生存率(OR = 1.15,95%CI:0.40~3.32,P = 0.79)、3年生存率(OR = 1.05,95%CI:0.73~1.51,P = 0.80)、5年生存率(OR = 1.50,95%CI:0.77~2.92,P = 0.23)比较差异无统计学意义。 结论 新辅助化疗能够减少Ⅰ、Ⅱ期宫颈癌患者术后高危病理因素的发生率,但对生存率无影响。受纳入研究的数量和质量限制,本研究结论尚待多中心、大样本的高质量RCT进行验证。
[关键词] 宫颈癌;新辅助化疗;手术;随机对照实验;Meta分析
[中图分类号] R737.33 [文献标识码] A [文章编号] 1673-7210(2017)03(b)-0102-06
Meta-analysis of neoadjuvant chemotherapy for the prognosis of patients with stage Ⅰ, Ⅱ cervical cancer
GAO Lijun CHENG Long LIU Xiao ZHOU Hang
Department of Abdominal Oncology, Affiliated Hospital of Zunyi Medical University, Guizhou Province, Zunyi 563000, China
[Abstract] Objective To explore the effect of neoadjuvant chemotherapy combined with radical surgery for treating patients with stage Ⅰ, Ⅱ cervical cancer. Methods The data sources for the search included PubMed, The Cochrane Library, Embase, Web of Science, CNKI and Wanfang Data. Inclusion criteria included studies published from 2000 to 2016, and FIGO stages Ⅰ to Ⅱ. All eligible documents were assessed for quality and extracted data was performed by a Meta-analysis. The statistical analysis was performed using Review Manager 5.3 software. Results Data was collected from 1351 patients enrolled in 10 randomized controlled trials. The results of Meta-analysis showed that, compared with the RST alone group, the NACT group was superior in reducing the incidence of lymph node metastasis (OR = 0.37, 95%CI: 0.26-0.53, P < 0.000 01), incidence of lymphovascular space invasion (OR = 0.51, 95%CI: 0.28-0.94, P = 0.03) and the incidence of positive parametrial involvement (OR = 0.60, 95%CI: 0.43-0.84, P = 0.003). However, there were no significant differences between two groups in 1-year survival rate (OR = 1.15, 95%CI: 0.40-3.32, P = 0.79), 3- year survival rate (OR = 1.05, 95%CI: 0.73-1.51, P = 0.80) and 5-year survival rate (OR = 1.50, 95%CI: 0.77-2.92, P = 0.23). Conclusion For stage Ⅰ, Ⅱ cervical cancer patients, neoadjuvant chemotherapy can reduce the incidence of high-risk pathology, but it has no significant effect on the survival of patients. Due to the limitation of quantity and quality of the included studies, more high quality studies are needed to verify the above conclusion.
[Key words] Cervical cancer; Neoadjuvant chemotherapy; Surgery; Randomize controlled trial; Meta-analysis
宫颈癌是影响全世界女性健康的常见恶性肿瘤之一,其发病率及病死率在世界范围内次于乳腺癌、肺癌、结直肠癌,居女性肿瘤第4位。但在发展中国家,宫颈癌是女性第2大常见肿瘤,发病率仅次于乳腺癌[1]。对于Ⅰ、Ⅱ期宫颈癌,手术和放疗是主要的治疗模式,为进一步改善预后,近十年来随着国内外学者的不断探索,以手术、放疗、化疗为主的综合治疗模式得到发展,但最佳的治疗方式尚存在争议[2]。新辅助化疗(neoadjuvant chemotherapy,NACT)作为宫颈癌的辅助治疗方式之一,因其具有可缩小肿瘤体积、杀灭亚临床灶、减少手术难度、降低远处转移等优点进而受到广泛关注[3]。已发表的关于宫颈癌NACT的研究数量众多,但结果存在差异。进一步关注术前NACT与直接手术相关的Meta分析[4-5],结果指出NACT对改善生存率无帮助,但可减少术后病理危险因素。考虑到疾病分期差异对结果产生的影响,故认为有必要针对特定分期的患者进行系统评价。故本文旨在比较Ⅰ、Ⅱ期宫颈癌患者NACT后手术与直接手术的远期疗效、术中情况、术后不良预后因素及术后辅助治疗率的差异,以期为NACT在临床中的应用提供理论依据。
1 资料与方法
1.1 纳入与排除标准
1.1.1 纳入标准 ①随机对照试验(RCTs);②对象为经过病理诊断的宫颈癌[国际妇产科联盟(FIGO)分期为Ⅰ、Ⅱ期]初诊患者,无相关治疗禁忌证;③治疗组为经静脉NACT后手术,对照组直接手术;④除处理因素外的其他因素在两组分布均匀,两组基线一致,具有可比性。
1.1.2 排除标准 ①重复发表、数据资料不完善、随访不严格及失访人数过多的文献;②研究对象为非初诊、复发或Ⅲ~Ⅳ期的宫颈癌;③无对照组或对照组为单纯放疗;④采用动脉NACT的研究。
1.2 检索方法及策略
计算机检索PubMed、The Cochrane Library、Embase、Web of Science、CBM、CNKI、万方等数据库。检索2000~2016年所有关于宫颈癌NACT的文献。检索词:英文“Cervical Cancer,Cervix Neoplasm,neoadjuvant chemotherapy,induction chemotherapy”;中文“宫颈癌,新辅助化疗,诱导化疗”等。采用自由词与主题词相结合的方式,根据数据库实际情况调整。另通过High Wire press、百度学术等搜索引擎查找相关的文献。
1.3 文献筛选与质量评价
1.3.1 文献筛选 将检索结果导入“Endnote”文献管理软件中,由两名研究者独立筛选文献,随后交叉核查,若意见不一致时征求第三方意见。
1.3.2 文献质量评价 由两名研究者采用Cochrane质量评价标准进行质量评价,包括分组、分配隐藏、盲法、不完全结局数据、选择性结局报告和其他偏倚6个方面。
1.4 统计学方法
采用Cochrane协作网提供的Review Manager 5.3软件行Meta分析。对资料进行异质性分析,根据分析结果选择相应的效应模型,如P ≥ 0.10,I2 ≤ 50%,表明各研究间无异质性,选择固定效应模型;若P < 0.10,I2 > 50%,则各研究间存在异质性,分析异质性来源,必要时做敏感性分析,尽量消除异质性,对异质性来源文献仍无法消除的可选用随机效应模型合并。以OR及95%可信区间(CI)表示各效应量的合并结果。以P < 0.05为差异有统计学意义。
2 结果
2.1 文献检索结果
初次检索6769篇文献,导入“Endnote”软件查重后剩4107篇,阅读标题及摘要后初步得到宫颈癌术前NACT与单纯手术比较相关的162篇文献,进一步阅读全文后排除无对照组、会议论文摘要及无法获取全文的文献121篇,对余下的41篇研究仔细阅读全文后排除非随机对照试验27篇,Ⅲ、Ⅳ期及经动脉化疗的研究4篇,最终纳入10篇[6-15]RCTs。
2.2 纳入文献基本情况
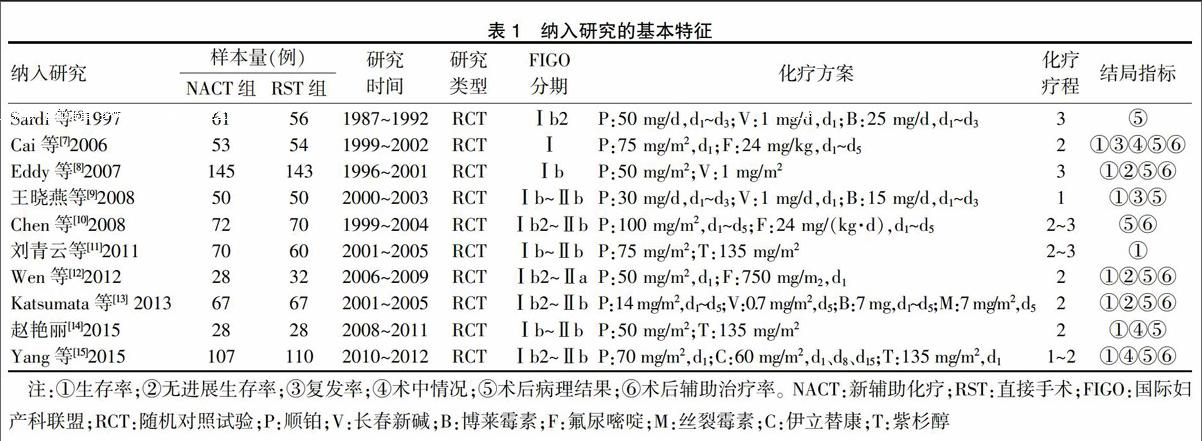
共纳入10项[6-15]研究,其中NACT组681例,直接手术组(RST组)670例,两组基线资料具可比性。纳入研究的基本情况见表1。
2.3 研究质量评价结果
各研究组间一般情况基本匹配,具可比性。纳入的10篇研究均为RCTs,采用Cochrane质量评价标准进行文献质量评价,只有盲法项为高风险,文献经质量评价后质量均较高,予以纳入分析。见图1。
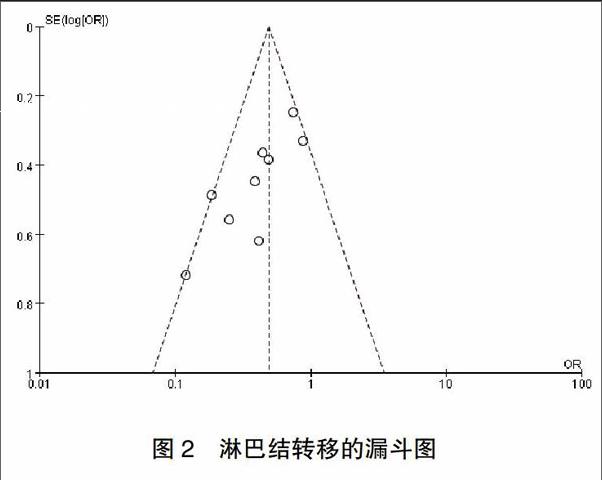
2.4 发表偏倚
对纳入的研究进行漏斗图分析,散点图分布基本对称,存在发表偏倚可能性小。见图2。
2.5 Meta分析结果
2.5.1 总生存率(OS) 3项研究[9,14-15]比较了1年OS,5项研究[8-9,12,14-15]比较了3年OS,4项研究[7-8,11,13]比较了5年OS,根据异质性检验结果,1、3年OS选择固定效应模型,5年OS选择随机效应模型。Meta分析结果:两组1年OS(OR = 1.15,95%CI:0.40~3.32,P = 0.79)、3年OS(OR = 1.05,95%CI:0.73~1.51,P = 0.80)、5年OS(OR = 1.50,95%CI:0.77~2.92,P = 0.23)比较差异无统计学意义,NACT未能提高患者生存率。见图3。
2.5.2 术后病理结果 9项研究[6-10,12-15]比较了術后盆腔淋巴结转移率,5项研究[6-8,12,15]比较了术后脉管癌栓发生率,7项研究[6-10,13,15]比较了术后宫旁阳性率,2项研究[8,12]比较了术后切缘阳性率。根据异质性检验结果,淋巴结转移率、宫旁阳性率、切缘阳性率选择固定效应模型,脉管癌栓发生率选择随机效应模型。Meta分析结果:淋巴结转移率(OR = 0.49,95%CI:0.38~0.63,P < 0.00001),脉管癌栓发生率(OR = 0.41,95%CI:0.17~0.97,P = 0.04),宫旁阳性率(OR = 0.60,95%CI:0.43~0.84,P = 0.003),切缘阳性率(OR = 1.00,95%CI:0.48~2.09,P = 1.00),结果提示:两组盆腔淋巴结转移率、脉管癌栓发生率、宫旁阳性率比较差异有统计学意义,切缘阳性率比较差异无统计学意义。NACT可降低术后盆腔淋巴结转移率、脉管癌栓率及宫旁阳性率,对切缘阳性率无影响。见图4。
2.5.3 无进展生存率(PFS)、术后辅助治疗率及术中情况 两组3年PFS、5年PFS、术后辅助治疗率、平均手术时间及术中出血量比较差异均无统计学意义(P > 0.05)。见表2。
3 讨论
宫颈癌是妇科最常见的恶性肿瘤,严重威胁着女性的身心健康。手术和放疗在宫颈癌治疗中的地位毋庸置疑,但经传统手术或放疗后仍有部分患者未获得长期生存,且近年来随着宫颈癌发病的年轻化,放疗引起的阴道僵硬、缩窄、粘连等并发症对年轻患者生活质量的影响越来越受到关注。NACT因其可以缩小肿瘤体积使原本不能手术的患者获得手术机会而受到广泛关注。临床上期望通过NACT提高患者远期疗效,改善生活质量。但目前关于宫颈癌NACT的研究结果不尽相同,且缺乏高质量大样本的随机对照试验的支持,使得NACT在宫颈癌中的应用存在争议[16-18]。近年来,研究者试图通过Meta分析得出更可信的证据以指导临床治疗决策。苏玉带等[19]、He等[20]的Meta分析指出NACT能降低局部晚期宫颈癌患者术后高危病理结果的发生率,但不影响其长期生存率。目前的Meta分析结果指出NACT不能延长生存期,只对减少预后不良因素有帮助。本次Meta分析共纳入10项RCTs,NACT组681例,RST组670例,Meta分析结果显示:①与RST比较,NACT未能提高患者1、3、5年OS和3、5年PFS。②两组平均手术时间和术中平均出血量比较无差异。③两组患者术后需辅助治疗率相似。④NACT降低了术后盆腔淋巴结转移率、脉管癌栓发生率、宫旁阳性率。总体来说NACT可减少患者术后不良预后因素的发生,但未能提高生存率。
本Meta分析的不足之处:①各研究间的异质性,纳入研究的化疗方案及疗程不同将影响临床效果。②部分研究纳入病例数较少,使该项结局指标可信度降低。③提取数据是发现NACT后反应好的患者远期预后较好,但由于原始研究数据的不完整,未进行亚组分析。④虽然采取了全面广泛的检索策略,但受检索语种限制,仍有部分文献未纳入,可能对结果产生一定影响。
综上所述,本Meta分析基于随机对照试验的结果显示,术前NACT未能提高Ⅰ、Ⅱ期宫颈癌患者的OS和PFS,也未能降低术后辅助治疗率、手术时间和术中出血量,但降低了术后淋巴结阳性率、脉管癌栓发生率等不良预因素的发生。由于本研究存在局限性,故结果仍需多中心、大样本前瞻性随机对照实验证实。
[参考文献]
[1] Ferlay J,Soerjomataram I,Dikshit R,et al. Cancer incidence and mortality worldwide:sources,methods and major patterns in GLOBOCAN 2012 [J]. Int J Cancer,2015, 136(5):E359-E386.
[2] 陳丹丹,阳志军,李力.ⅠB~ⅡB期宫颈癌治疗相关研究进展[J].国际妇产科学杂志,2015,42(1):96-100.
[3] Francesco Plotti MD,Milena Sansone MD,Donato VD,et al. Quality of life and sexual function after type C2/type Ⅲ radical hysterectomy for locally advanced cervical cancer:a prospective study [J]. Journal of Sexual Medicine,2011, 8(3):894-904.
[4] 梁江红,罗蕊丽.新辅助化疗对局部晚期宫颈癌疗效的Meta分析[J].湖北医药学院学报,2016(1):47-51.
[5] 陈艳丽,李力.新辅助化疗加手术治疗局部晚期宫颈癌的Meta分析[J].循证医学,2013,13(4):230-235.
[6] Sardi JE,Giaroli A,Sananes C,et al. Long-term follow-up of the first randomized trial using neoadjuvant chemotherapy in stage Ib squamous carcinoma of the cervix:the final results [J]. Gynecol Oncol,1997,67(1):61-69.
[7] Cai HB,Chen HZ,Yin HH. Randomized study of preoperative chemotherapy versus primary surgery for stage IB cervical cancer [J]. J Obstet Gynaecol Res,2006,32(3):315-323.
[8] Eddy GL,Bundy BN,Creasman WT,et al. Treatment of("bulky")stage IB cervical cancer with or without neoadjuvant vincristine and cisplatin prior to radical hysterectomy and pelvic/para-aortic lymphadenectomy:a phase Ⅲ trial of the gynecologic oncology group [J]. Gynecol Oncol,2007, 106(2):362-369.
[9] 王晓燕,邵淑丽.Ⅰb~Ⅱb期巨块型宫颈鳞癌术前新辅助化疗疗效观察[J].山西医药杂志,2008,37(11):963-964.
[10] Chen H,Liang C,Zhang L,et al. Clinical efficacy of modified preoperative neoadjuvant chemotherapy in the treatment of locally advanced(stage IB2 to IIB)cervical cancer:randomized study [J]. Gynecol Oncol,2008,110(110):308-15.
[11] 刘青云,陈克丽,徐成康.新辅助化疗PTX和DDP对子宫颈癌患者的疗效分析[J].中外妇儿健康:学术版,2011, 19(4):31-32.
[12] Wen H,Wu X,Li Z,et al. A prospective randomized controlled study on multiple neoadjuvant treatments for patients with stage ⅠB2 to ⅡA cervical cancer [J]. Int J Gynecol Cancer,2012,22(2):296-302.
[13] Katsumata N,Yoshikawa H,Kobayashi H,et al. Phase Ⅲ randomised controlled trial of neoadjuvant chemotherapy plus radical surgery vs radical surgery alone for stages ⅠB2,ⅡA2,and ⅡB cervical cancer:a Japan Clinical Oncology Group trial(JCOG 0102)[J]. British J Cancer,2013,109(9):2505-2505.
[14] 赵艳丽.新辅助化疗治疗局部晚期宫颈癌的疗效观察[J].中国肿瘤临床与康复,2015,22(4):459-461.
[15] Yang Z,Chen D,Zhang J,et al. The efficacy and safety of neoadjuvant chemotherapy in the treatment of locally advanced cervical cancer:a randomized multicenter study [J]. Gynecol Oncol,2015,141(2):231-239.
[16] Qin T,Zhen J,Zhou M,et al. Efficacy of neoadjuvant chemotherapy plus radical surgery in patients with bulky stage Ⅱ cervical squamous cell carcinoma:A retrospective cohort study [J]. Int J Surg,2016,30:121-125.
[17] 莊晴晴,王常玉.新辅助化疗与单纯手术在局部晚期宫颈癌患者中的疗效对比分析[J].现代妇产科进展,2016, 25(7):7-10.
[18] Abou-Taleb HA,Koshiyama M,Matsumura N,et al. Clinical efficacy of neoadjuvant chemotherapy with irinotecan(CPT-11)and nedaplatin followed by radical hysterectomy for locally advanced cervical cancer [J]. J Int Med Res,2016,44(2):154-167.
[19] 苏玉带,田凌君,吴素慧,等.新辅助化疗影响宫颈癌预后的Meta分析[J].中国医师杂志,2016,18(3):388-393.
[20] He D,Duan C,Chen J,et al. The safety and efficacy of the preoperative neoadjuvant chemotherapy for patients with cervical cancer:a systematic review and meta analysis [J]. Int J Clin Exp Med,2015,8(9):14693-14700.
