GABAA受体激动剂对AD模型配体门控氯通道的作用
2017-05-10黄玉雕王明华李明哲曹方圆
黄玉雕, 王明华, 段 伟, 李明哲, 曹方圆
GABAA受体激动剂对AD模型配体门控氯通道的作用
黄玉雕1, 王明华1, 段 伟1, 李明哲2, 曹方圆3
目的 观察并分析GABAA受体激动剂蝇蕈醇对GABA激活的配体门控氯通道的作用,为寻找新的抗阿尔茨海默病(AD)药物提供实验依据。方法 Aβ1-42诱导海马神经细胞作为AD细胞模型;通过膜片钳(Patch clamp)技术在大鼠海马神经元上记录配体门控氯通道瞬时外向电流,采用非特异性氯通道阻断剂(NFA)和无GABA的细胞外液确定该电流成份为瞬时外向氯电流;通过膜片钳技术观察GABAA受体激动剂蝇蕈醇对于在大鼠海马神经元上记录瞬时外向电流的作用;向AD细胞模型中加入GABAA受体激动剂,采用MTT观察各组细胞活力。结果 加入GABAA受体激动剂蝇蕈醇后GABA激活氯电流强度增加;加入浓度为1 mmol/L蝇蕈醇的AD模型细胞组存活率为(91.32±3.73)%,略高于未加入蝇蕈醇的模型细胞组,两组对比P>0.05。结论 GABAA受体激动剂蝇蕈醇对于AD细胞模型具有保护作用。
GABAA受体; 阿尔茨海默病; 配体门控氯通道; 膜片钳
临床上对于阿尔茨海默病(AD)的诊断主要是通过尸检后发现胞外β-淀粉样蛋白(Aβ)沉积和细胞内的神经元纤维缠结,另外大脑内起到认知和记忆功能作用的区域如大脑皮质和海马等部分损失了大量的神经元和突触[1]。本实验旨在探索GABAA受体在大鼠AD模型中的电生理机制,通过应用膜片钳技术观察GABA受体门控氯通道在大鼠AD模型中的电流作用及其调节剂的作用。
1 材料与方法
1.1 AD细胞模型制备 健康SD新生24 h内大鼠,体重约5~8 g。取出海马并置于冰浴的PBS液中剥离其周围组织和血管膜;剪成1 mm3的左右组织块[2]。向组织内加入100%DMEM/F12培养液+0.5%胰酶消化液,37 ℃水浴箱内15 min,随后加入含20%特级胎牛血清的培养液终止消化;低温高速离心机1000 r/min离心5 min;重悬计数后以2×106/ml的密度种植于35 mm培养皿内;随后置于37 ℃,95%O2+5%CO2培养箱中培养6 h~8 h;应用98%NEUROBASAL TM AMediu+2%B27的维持培养液维持培养;每36 h~48 h全量换液。加入浓度为20 μmol/L Aβ1-42溶液培养72 h建立新生大鼠AD细胞模型。
1.2 膜片钳记录实验 采用全细胞膜片钳技术。硅酸硼玻璃电极充灌电极内液后尖端电阻为2~3 MΩ。在形成电极细胞膜封接前校正液接电位,破膜后补偿电容和串联电阻。吉欧封接,当封接电阻达到2~8 GΩ,即完成巨欧姆封接,负压破膜稳定后记录通道电流。GABA配体门控氯离子通道刺激程序为钳制电压-60 mV,指令电压-80~+80 mv,电压持续时间800 ms,用跃阶电压的变化方式,跃级电压+20 mv,间隔1 s[3~6]。通过膜片钳技术在大鼠海马神经元上记录配体门控氯通道的瞬时外向电流(transient outward current,Ito),采用非特异性氯通道阻断剂(NFA)和无配体GABA的细胞外液确定该电流成份为瞬时外向氯电流。将AD模型细胞分为添加GABA 50 μmol/L组、GABA100 μmol/L组、GABA 200 μmol/L组和GABA 300 μmol/L组。应用膜片钳技术记录各组GABA配体门控氯通道记录瞬时外向电流,随后向各组以1 mmol/L的浓度添加GABAA受体激动剂蝇蕈醇并记录其GABA配体门控氯通道记录瞬时外向电流的变化,每组3~5个。
1.3 MTT法检测GABAA受体激动剂对于AD细胞模型的作用 原代海马神经细胞培养5 d进行分组。对照组(A组)为正常培养的海马原代细胞;实验1组(B组)为加入浓度为20 μmol/LAβ1-42溶液培养72 h建立新生大鼠AD细胞模型;实验2组(C组)为加入浓度为20 μmol/LAβ1-42溶液+浓度为1 mmol/L的蝇蕈醇溶液。培养72 h后应用MTT法检测细胞存活率。向每孔内加入浓度为5 mg/ml MTT液20 μl,调零孔内只加入维持培养液。继续将其置于95%O2+5%CO2培养箱中培养3~4 h后以扣板法扣除孔内液体,随后向各孔内加入DMSO150 μl,于37 ℃下震荡10~15 min以促进其溶解。待蓝色结晶充分溶解后将96孔板置于酶标仪上,以570 nm的滤过波长测定各孔的光吸收值(OD值)。以细胞存活率(%)=实验组OD值/对照组OD值×100%为公式进行计算。各设置3个平行组,最后取其均值进行统计学分析。
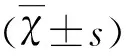
2 结 果
2.1 大鼠海马神经元AD模型细胞配体门控氯通道电流记录
2.1.1 GABA激活的配体门控氯通道电流的鉴定 采用全细胞膜片钳技术,应用实验方法中设计的膜片钳记录方法并在细胞外液中添加200 μmol/LGABA记录到(见图1A)中的电流,而后在细胞外液中加入了1 mmol/L GABAA受体激动剂蝇蕈醇使电流强度增加,记录到了(见图1C)中的电流。记录到的电流是否为GABA激活的氯通道电流呢?随后在细胞外液中去除GABA记录到了(见图1B)中的电流,电流强度明显降低;在另一细胞外液添加200 μmol/LGABA记录到的电流中添加非特异性氯通道阻断剂NFA 5 min后记录到了(见图1D)中的电流,电流强度明显降低。由于NFA为非特异氯通道阻断剂,在添加记录到的电流可能未完全阻断海马神经元上的电流(如钾通道电流、钠通道电流、钙通道电流和钙敏感氯电流等)。由以上结果可推断实验中记录到的电流为GABA激活的氯通道电流。
2.1.2 GABAA受体激动剂对于GABA激活的配体门控氯通道电流的影响 将AD模型细胞分为添加GABA 50 μmol/L组、GABA 100 μmol/L组、GABA 200 μmol/L组和GABA 300 μmol/L组,分别记录各组及以1 mmol/L的浓度添加GABAA受体激动剂蝇蕈醇后的电流,每组记录3~5个细胞。电流变化结果(见表1~表4)。
2.2 GABAA受体激动剂对于AD细胞模型作用的MTT检测结果 经MTT法检测关于GABAA受体激动剂蝇蕈醇对于AD细胞模型影响的结果显示,加入蝇蕈醇浓度为1 mmol/L的实验1组AD模型细胞的存活率为(91.32±3.73)%,与对照组相比P<0.05,具有统计学意义;不加入蝇蕈醇的实验2组模型细胞存活率为(89.37±3.25)%,与对照组相比P<0.05,具有统计学意义;实验1组与实验2组相比P>0.05,无统计学意义(见表5)。
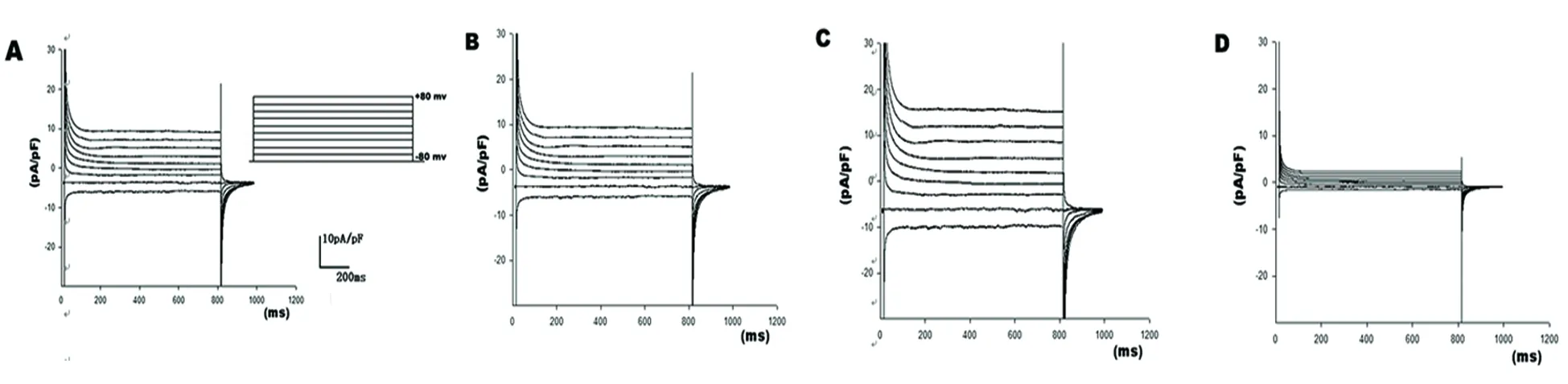
图1 膜片钳实验验证AD模型细胞GABA激活配体门控氯通道电流

电压(mV)对照组(pA/pF)加药组(pA/pF)P值F值t值-80-60-40-20020406080-5.45±1.77-4.10±0.82-2.98±2.31-1.35±2.620.27±1.431.87±0.773.35±0.674.79±0.746.15±1.04-14.53±1.46**-9.86±1.35**-6.02±1.07*-2.56±0.590.84±0.313.96±0.68**6.94±1.23**10.15±2.06**13.21±1.77**<0.001<0.0010.0290.3470.4060.002<0.0010.0010.0018.8528.1586.04915.31544.4910.0520.9776.234.8487.6321.3412.6640.998-0.876-4.567-5.735-5.472-5.328
与对照组相比*P<0.05,具有统计学意义;**P<0.01,具有显著统计学意义

表2 GABA 100 μmol/L组添加GABAA受体激动剂蝇蕈醇前后电流变化结果
与对照组相比*P<0.05,具有统计学意义;**P<0.01,具有显著统计学意义

表3 GABA 200 μmol/L组添加GABAA受体激动剂蝇蕈醇前后电流变化结果
与对照组相比*P<0.05,具有统计学意义;**P<0.01,具有显著统计学意义

表4 GABA 300 μmol/L组添加GABAA受体激动剂蝇蕈醇前后电流变化结果
与对照组相比*P<0.05,具有统计学意义;**P<0.01,具有显著统计学意义

表5 各组阿尔茨海默病模型细胞存活率结果(%)
与对照组相比*P<0.05,具有统计学意义;实验2组与实验1组相比P>0.05,无统计学意义
3 讨 论
AD患者的基底前脑胆碱能神经元、脑干去甲肾上腺素和五羟色胺能神经元及海马谷氨酸能细胞群特别容易受到损伤,而调节这些兴奋性系统的动态平衡主要是通过GABA介导的GABAA受体的抑制作用。AD患者GABAA受体相对较少,其可能的原因是GABAA受体的特殊亚基成分在疾病发展过程中发生改变,大量基础及临床实验证实GABA能神经递质系统参与AD的发生和发展并已确定GABA受体与AD的神经退行性变相关[7~10]。
有学者通过膜片钳技术记录了缺氧后神经元的GABA配体门控氯通道的全细胞电流,认为GABAA受体的功能与L型电压依赖钙通道密切相关,L型电压依赖钙通道被激活后Ca2+内流增加进而引起GABAA受体发挥作用[3]。L型钙通道的阻断剂尼莫地平广泛应用于脑缺血的临床治疗,具有改善脑血管的血液循环和脑保护的作用,但治疗效果不佳;同时在脑缺血治疗中,兴奋性氨基酸受体阻断剂和自由基清除剂等脑保护药物也被广泛应用与临床,但其效果均不理想。而GABA门控氯通道与钙通道这种密切的关系,以及GABA受体激动剂的神经保护作用,使我们推测这将会是一种大有潜力的神经保护机制[11,12]。Zhou等通过对GABA门控氯通道电生理研究肯定了双(7)-他克林治疗AD的有效性,证实了GABAA受体这种配体门控氯通道发挥作用与细胞内外的离子浓度和电流方向密切相关[13]。受以上研究的启发,本实验旨在探索GABAA受体在AD中的电生理机制,为AD的治疗提供新的靶点。
为研究GABAA受体激动剂对于AD细胞模型作用,本实验中采用全细胞膜片钳技术记录GABA激活的氯通道电流,应用NFA和无配体GABA的细胞外液以确定记录到的电流成份为GABA激活的瞬时外向氯电流。由于NFA为非特异氯通道阻断剂,在添加记录到的电流可能未完全阻断海马神经元上其他电流如钾通道电流、钠通道电流、钙通道电流和钙敏感氯电流等,其可能成为影响记录到的GABA激活瞬时外向氯电流真实性的因素之一。确定电流成分后将AD模型细胞以添加GABA浓度的不同将其分成4组,记录各组电流后以1 mmol/L的浓度添加GABAA受体激动剂蝇蕈醇后的电流,每组记录3~5个细胞。通过对结果的分析显示添加GABAA受体激动剂蝇蕈醇后,各组记录的电流显著增加。GABA为抑制性递质,GABAA受体激动剂可以增强GABA与GABAA受体结合,更强的发挥其抑制作用。其抑制作用可能减少AD患者基底前脑胆碱能神经元、脑干去甲肾上腺素神经元和五羟色胺能神经元及海马谷氨酸能细胞群受到损伤,从而发挥其保护作用。
另外本实验中应用GABAA受体激动剂蝇蕈醇体外添加后继续培养的方式探讨GABAA受体激动剂对于AD细胞模型作用,经MTT法检测实验各组细胞存活率。统计结果显示加入蝇蕈醇浓度为1 mmol/L的实验1组和不加蝇蕈醇的实验2组的AD模型细胞的存活率分别为(91.32±3.73)%和(89.37±3.25)%,经统计学分析发现实验1组与实验2组相比P>0.05,无统计学意义,但实验1组细胞存活率高于实验2组。如上所述原代海马神经元体外培养细胞减少的主要方式包括主动性凋亡和继发性坏死两种,在对照组与实验组培养环境、条件和方法相同情况下可相对排除主动性凋亡因素。结合上述膜片钳的研究结果考虑GABAA受体激动剂对于AD细胞模型具有保护作用,可设想GABAA受体激动剂可参与AD的发病机制,对于阿尔茨海默病具有保护作用。
综上所述,GABAA受体激动剂蝇蕈醇对于SD大鼠AD细胞模型具有保护作用,同时对于AD进程的抑制性作用。由以上结果可推断GABAA受体对于改善及治疗AD的认知功能障碍有潜在的治疗作用,从而改善AD患者治疗效果不佳的窘境。
[1]王亚男,余 意,冯成强.tau蛋白与阿尔茨海默病[J].中国老年学杂志,2016,36(3):740-741.
[2]张云鹤,张一娜,刘 歆,等.Aβ1-42诱导原代海马神经细胞建立阿尔茨海默病细胞模型[J].中国老年学杂志,2011,31(6):2027-2029.
[3]Liping Wang,John Greenfield.Post-hypoxic changes in rat cortical neuron GABAAreceptor function require L-type voltage-gated calcium channel activation[J].Neuropharmacology,2009,56(1):198-207.
[4] 李建国,李晓明,胡 平,等.成年大鼠海马CA1区锥体神经元外向整流氯离子单通道特性[J].生物化学与生物物理进展,2003,30(6):874-877.
[5] 钟志超,范洪领,尹金宝,等.氯通道电流在离体大鼠海马缺血缺氧性神经元凋亡中的变化及SITS的拮抗作用[J].郑州大学学报(医学版),2011,46(3):367-369.
[6] 崔文玉,张颖丽,殷晓峰,等.培养的大脑皮质、海马及交感神经细胞钠、钾和钙离子通道的全细胞记录技术[J].中国应用生理学杂志,2005,21(1):105-109.
[7] 包新民,舒斯云,王 虹.γ-氨基丁酸及其受体在大鼠纹状体边缘区的表达[J].第一军医大学学报,2002,22(11):961-965.
[8]Rissman RA,De Blas AL,Armstrong DM.GABA(A) receptors in aging and Alzheimer’s disease[J].J Neurochem.2007,103(4):1285-1292.
[9]Garcia-Alloza M,Tsang SW,Gil-Bea FJ,et al.Involvement of the GABA ergic system in depressive symptoms of Alzheimer’s disease[J].Neurobiol Aging,2006,27(8):1110-1117.
[10]王擒云,戴体俊,曾因明.GABAA受体对内源性痛觉下行抑制系统的调控作用[J].国外医学麻醉学与复苏分册,2004,25(4):209-212.
[11]Jing Xu,Chong Li,Xiao-Hui Yin,et al.Additive neuroprotection of GABAAand GABABreceptor agonists in cerebral ischemic injury via PI-3K/Akt pathway inhibiting the ASK1-JNK cascade[J].Neuropharmacology,2008,54(7):1029-1040.
[12]Farr SA,Uezu K,Creonte TA,et al.Modulation of memory processing in the cingulate cortex of mice[J].Pharmacol Biochem Behav,2000,65(3):363-368.
[13]Li Zhou,Yu-Wei Liu,Robert W,et al.Mechanism of bis(7)-tacrine inhibition of GABA-activated current in cultured rat hippocampal neurons[J].Neuropharmacology,2009,57:33-44.
The role of GABAA receptor agonist for the ligand-gated chloride channels in the model of Alzheimer’s disease
HUANGYudiao,WANGMinghua,DUANWei,etal.
(DepartmentofNeurology,the5ndAffiliatedHospitalofHarbinMedicalUniversity,Daqing163319,China)
Objective To observe and analyze the role of the GABAAreceptor agonist muscimol on the GABA-activated ligand gated chloride channel,in order to provide experimental basis for finding new anti-Alzheimer’s disease drugs.Methods Add Aβ1-42to induce the hippocampal neurons as Alzheimer’s disease cell model.Record the transient outward current of ligand-gated chloride channel in rat hippocampal neurons by the technique of patch clamp.Then use non-specific chloride channel blockers (NFA) and non-GABA extracellular fluid to determine the currents recorded in was the transient outward chloride current.Through patch-clamp technique to observe the role of the GABAAreceptor agonist muscimol for the transient outward currents in the cell model of Alzheimer’s disease.Add GABAAreceptor agonist to the cell model of Alzheimer’s disease and observe the cell viability of each group by the method of MTT.Results The GABA-activated chloride current intensity was increased by adding the GABAAreceptor agonist of muscimol.The survival rate of the rats cell in model of Alzheimer’s disease was (91.32±3.73)% by adding a concentration of 1mmol/L muscimol,it was slightly higher than the model cell group without muscimol,the compared result of two groups wasP>0.05.Conclusions The GABAA receptor agonist of muscimol has protective effect for the rats cell model of Alzheimer’s disease.
GABAAreceptor; Alzheimer’s disease; Ligand-gated chloride channels; Patch clamp
1003-2754(2017)04-0308-04
2016-12-07;
2017-03-30
(1.哈尔滨医科大学附属第五医院神经内科,黑龙江 大庆 163319;2.哈尔滨医科大学附属第五医院,黑龙江 大庆 163319;3.哈尔滨医科大学(大庆)基础医学院形态实验中心,黑龙江 大庆 163319)
曹方圆,E-mail:1554293985@qq.com
R749.1
A
