P2X7受体与年龄相关性黄斑变性
2017-05-09戴乐舒王诗惠宋剑涛
戴乐舒,王诗惠,宋剑涛
年龄相关性黄斑变性 (age-related macular degeneration,AMD)是一种以中心视力损害为表现并可导致不可逆性视力严重下降的眼病。据统计全世界有3000万~5000万AMD患者[1]。在发达国家AMD患病率在9.1%~20.9%之间,发展中国家是3.1%~10.6%[2]。有资料表明在1990年~2010年,AMD是全球第三位致盲原因[3],预计到2020年将有1.96亿人受到AMD的影响,到2040年数值将增加到2.88亿[4]。AMD的危险因素包括吸烟、饮酒、高血压、肥胖等[5],AMD的发生与多种因素有关,其形成机制可能与视网膜色素上皮 (retinal pigment epithelium,RPE)的衰老、代谢、光损伤、氧化损伤、免疫炎症因素、遗传及基因突变[6-8]等有关,但仍未完全明了。目前的治疗方法有光动力学疗法和抗血管内皮生长因子(vascular endothelial growth factor,VEGF)药物等[9],但这主要针对湿性AMD,且需要重复治疗,治疗后脉络膜新生血管(choroidal neovascularization,CNV)可能复发,不能从根本上解决问题,因而深入研究AMD有重要意义。我们曾经综述P2X4受体在视网膜小胶质细胞及光损伤作用[10],P2X7受体与 P2X4受体为P2X同一亚型,视网膜神经感觉层及RPE层中均有表达,P2X7受体作为一种非选择性的阳离子通道受体,涉及氧化应激、细胞凋亡、炎症过程[6],而这些过程与AMD的形成密切相关,现将有关内容综述如下。
1 P2X7受体
P2X7受体(P2X7R)是嘌呤受体的一个亚型,嘌呤受体是以嘌呤和嘧啶为配体的膜分子。依据配体的差异,嘌呤受体分为P1和P2两大类,依据分子结构和信号传导方式的差异,P2型受体又分为P2X和P2Y两类受体,P2X型受体共发现有7型,即P2X1~P2X7[11]。P2X受体是响应于细胞外腺苷三磷酸(adenosine triphosphate,ATP)的结合而打开的膜离子通道,脊椎动物中的7个基因编码P2X受体亚基,其氨基酸序列中40%~50%相同,每个亚基具有两个跨膜结构域,被细胞外结构域(大约280个氨基酸)隔开。P2X受体具有与其他离子通道蛋白家族不同的分子结构,具有多种独特的功能特性[12],所有的P2X受体对小的单价阳离子均是可渗透的,一些P2X受体具有显著的钙离子或阴离子的渗透性。激活P2X7受体会使渗透性增加,可渗透较大的有机阳离子,包括一些荧光染料。P2X7受体在多种类型细胞表达,包括上皮细胞、神经元细胞、骨细胞、造血组织等,在这些组织中可见其功能性反应[13]。
P2X7受体首先在免疫细胞中被发现,之后从大鼠大脑中克隆出来,现在已被证实广泛表达于上皮细胞,包括眼部的上皮细胞及RPE[14]。人、猴及啮齿类动物的视网膜中均发现有P2X7受体存在,但分布情况并不相同。人P2X7受体蛋白存在于内丛状层、外丛状层、Müller细胞、RPE细胞,P2X7受体mRNA表达在内层视网膜和节细胞,而猴视网膜Müller细胞、RPE细胞未发现有P2X7受体[15-18]。在啮齿动物中,P2X7受体广泛表达在内层视网膜及外层视网膜,节细胞、无长突细胞、水平细胞、小胶质细胞、光感受器细胞都表达有P2X7受体或功能性P2X7受体[19-20]。P2X7受体是由595个氨基酸残基组成,包含氨基端(N端)和羧基端(C端),它是一种两次跨膜的蛋白,其N端和C端均在细胞内,在细胞膜上形成三个或更多个同源亚基组成的多聚体[21](分子结构见图1)。
P2X7受体与其他P2X受体的不同在于P2X7受体位于胞内的氨基酸有239个,显著多于其他已知ATP受体亚型羧基端氨基酸的数量(27~129个),此结构基础决定了P2X7功能的特异性[22]。P2X7受体遇到低剂量ATP刺激,膜通道可逆性打开,可使小的阳离子渗透(如Na+,Ca2+),如果长时间暴露在高剂量ATP下,会导致非选择性渗透大分子(900 Da),这会引起细胞凋亡或坏死[23-24]。老化与促炎细胞因子和趋化因子相关[25-26],氧化应激是衰老标志,氧化应激与各种年龄相关疾病有联系,如老年痴呆、年龄相关性黄斑病变等,大量研究显示,P2X7受体参与了AMD氧化应激、炎症反应等老化过程[15,27]。
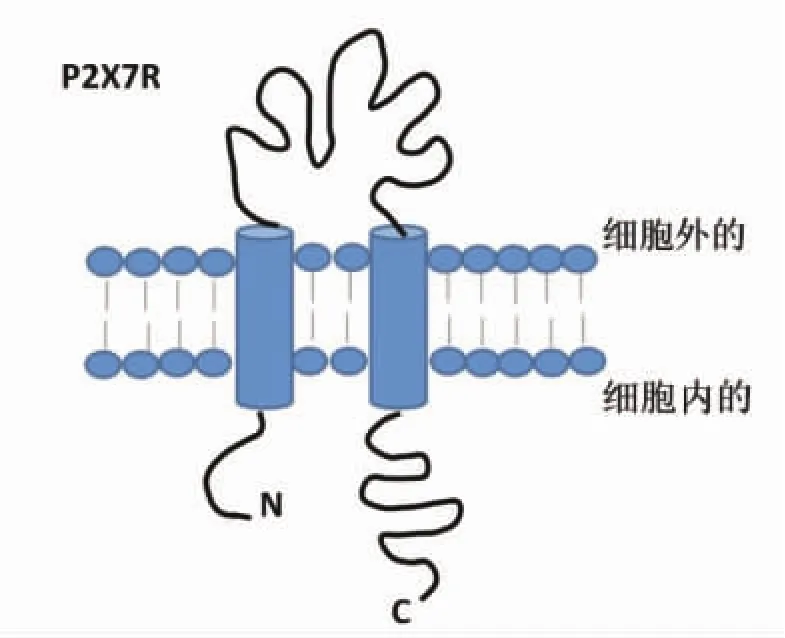
图1 P2X7受体(P2X7R)分子结构
2 RPE中的P2X7受体
P2X7受体表达于RPE中,并随年龄增长上调[28]。在正常的生理条件下,P2X7受体活性维持在低水平,由细胞外二价阳离子浓度和细胞外低浓度量ATP维持[29-30]。细胞外二价阳离子似乎改变了ATP结合的亲和力[31],低浓度ATP不激活P2X7受体,但是在应激状态下,RPE细胞和神经视网膜都能释放ATP,ATP作用在RPE细胞及光感受器中P2X受体[32-33]。ATP是一种内源性P2X7受体激动剂,而苯甲酰苯甲酸ATP[2’,3’-O-(4-benzoyl)benzoyl-ATP,BzATP]是一种合成的、选择性的 P2X7受体激动剂[12],当刺激 6 h或 24 h后,ATP和BzATP均可诱导RPE凋亡。P2X7受体经ATP或BzATP的活化,打开了Ca2+膜通道,可促使RPE细胞死亡。氧化ATP能明显地抑制ATP或BzATP诱导Ca2+的流入和RPE的凋亡。BzATP诱导的RPE凋亡可以被P2X7受体的拮抗剂亮蓝G(brilliant blue G,BBG)、1-[N,O-二(5-异喹啉磺酰基)-N-甲基-L-型酪氨酸]-4-苯基哌嗪(KN-62)和氧化型ATP(oxidized ATP,oATP)抑制,细胞外或细胞内Ca2+减少,能明显抑制或阻断ATP诱导的细胞凋亡[32]。已有的研究结果[31-33]提示:P2X7受体和ATP或BzATP诱导的RPE钙信号和凋亡有关;因此,钙稳态失常和激活P2X7受体膜孔形成,是AMD中RPE凋亡的可能原因。
3 P2X7受体在AMD病理过程中的作用
RPE是维持视网膜光感受器细胞健康的内环境,组织受到炎症、损伤、感染等刺激,会引起细胞外的ATP释放增加,P2X7受体激活膜孔形成,钙离子内流,RPE细胞凋亡,干性AMD发生;同时激活P2X7受体,释放活性氧,刺激慢性氧化应激发生,使RPE细胞老化,导致AMD发生[34-35]。另一方面,P2X7受体激活后,也激活p38,p38调节白细胞介素-8(interleukin-1,IL-8)和VEGF,激发血管生长形成湿性AMD。氧化应激,炎症反应和细胞死亡都与AMD形成相关,这已被广泛认识,P2X7受体参与了AMD氧化应激、炎症反应等过程,P2X7受体激活引起钙稳态失常也是AMD形成的可能原因[36]。
在干性AMD中,RPE首先损伤,进一步引起光感受器细胞、脉络膜血管功能损伤。在湿性AMD中,光感受器细胞损伤,脉络膜新生血管形成,伴发视网膜下出血。Notomi S等[37]从湿性AMD(伴有视网膜下出血)患者中提取玻璃体,检测ATP含量,发现ATP含量明显增加;在一项体外研究中,Notomi S等用鼠视网膜细胞培养实验,发现ATP大量释放,光感受器细胞凋亡,半胱氨酸天冬氨酸蛋白酶9(caspases-9)激活,凋亡诱导因子从线粒体移位到细胞核,表明线粒体细胞凋亡途径参与ATP诱导的光感受器细胞损伤。BBG(brilliant blue G)是一个选择性P2X7受体拮抗剂,可以抑制视网膜下出血小鼠模型光感受器细胞的凋亡。在干性AMD的发展中,P2X7受体也起了重要作用,在一项体外研究,使用人类RPE细胞培养模型,发现P2X7受体表达在人类RPE细胞,P2X7受体激活可诱导RPE细胞凋亡[32]。
4 总结与展望
综上所述,表达于人视网膜神经感觉层及RPE层中的P2X7受体参与了AMD的病理过程,P2X7受体被激活导致钙稳态失常、RPE损伤细胞凋亡等氧化应激反应。在过去的十几年里,人们对P2X7受体的研究已经取得了较大进展,但是要阐明P2X7受体在AMD中的病理生理作用及其对AMD进程的调节过程,仍需要进一步深入研究,这对于探索新的治疗AMD的方法可能起到重要的指导作用。
[1] Ambati J.Age-Related Macular Degeneration and the Other Double Helix The Cogan Lecture[J].Investigative Ophthalmology&Visual Science,2011,52(5):2165.
[2] Thapa R,Bajimaya S,Paudyal G,et al.Prevalence of and risk factors for age-related macular degeneration in Nepal:the Bhaktapur Retina Study[J].Clin Ophthalmol,2017,11:963.
[3] Bourne R R A,Stevens G A,White R A,et al.Causes of vision loss worldwide,1990–2010:a systematic analysis[J].Lancet Global Health,2013,1(6):e339-e349.
[4] Wong W L,Su X,Li X,et al.Global prevalence of age-related macular degeneration and disease burden projection for 2020 and 2040:a systematic review and meta-analysis[J].Lancet Global Health,2014,2(2):e106.
[5] García-Layana A,Cabrera-López F,García-Arumí J,et al.Early and intermediate age-related macular degeneration:update and clinical review[J].Clinical Interventions in Aging,2017,12:1579.
[6] Ciulla TA.Evolving pathophysiological paradigms for age related macular degeneration[J].Br J Ophthalmol,2001,85(5):510-512.
[7] Bindewald A,Schmitz-Valckenberg S,Jorzik JJ,et al.Classification of abnormal fundus autofluorescence patterns in the junctional zone of geographic atrophy in patients with age related macular degeneration[J].Br J Ophthalmol,2005,89(7):874-878.
[8] Nussenblatt R B,Frederick Ferris I.Perspectives:Age Related Macular Degeneration and the Immune Response-Implications for Therapy[J].AmericanJournalofOphthalmology,2007,144(4):618-626.
[9] 张歆,任百超.年龄相关性黄斑变性的治疗研究新进展 [J].国际眼科杂志,2007(06):1674-1676.
[10]赵亚飞,唐勇,王诗惠,等.小胶质细胞P2X4受体:探索视网膜光损伤的新靶点[J].中国中医眼科杂志,2017,27(1):56-58.
[11]秦姗姗,樊波,徐昌水.P2X7受体在炎症和疼痛中的潜在作用及治疗应用[J].中国药理学通报,2014,30(07):908-911.
[12]North R A.Molecular physiology of P2X receptors[J].Physiological Reviews,2002,82(4):1013.
[13]Khakh B S,North R A.P2X receptors as cell-surface ATP sensors in health and disease[J].Nature,2006,442(7102):527-532.
[14]Yang D.Targeting the P2X7 Receptor in Age-Related Macular Degeneration[J].Vision,2017,1(2):1-10.
[15]Gu BJ,Baird PN,Vessey KA,et al.A rare functional haplotype of the P2RX4 and P2RX7 genes leads to loss of innate phagocytosis and confers increased risk of age-related macular degeneration[J].FASEB J,2013,27(4):1479-1487.
[16]shii K,Kaneda M,Li H,et al.Neuron‐specific distribution of P2X7 purinergic receptors in the monkey retina[J].Journal of Comparative Neurology,2003,459(3):267.
[17]Niyadurupola N,Sidaway P,Ma N,et al.P2X7 receptor activation mediates retinal ganglion cell death in a human retina model of ischemic neurodegeneration[J].Invest Ophthalmol Vis Sci,2013,54(3):2163-2170.
[18]Wurm A,Pannicke T,Iandiev I,et al.Purinergic signaling involved in Muller cell function in the mammalian retina[J].Progress in Retinal&Eye Research,2011,30(5):324.
[19]Chavda S,Luthert P J,Salt T E.P2X7R modulation of visually evoked synaptic responses in the retina[J].Purinergic Signalling,2016,12(4):611-625.
[20]Corso L,Cavallero A,Baroni D,et al.Saffron reduces ATP-induced retinal cytotoxicity by targeting P2X7 receptors.[J].Purinergic Signalling,2016,12(1):1-14.
[21]徐宏,梁尚栋.P2X7受体在炎症性疾病中的作用及其机制[J].生理学报,2013,65(02):244-252.
[22]曹淑花,袁绍鹏,侯琦.P2X7与呼吸系统炎症性疾病的研究进展[J].药学学报,2013,48(08):1183-1188.
[23]Sluyter R,Shemon AN,Wiley JS.Glu496 to Ala polymorphism in the P2X7 receptor impairs ATP-induced IL-1 beta release from human monocytes[J].J Immunol,2004,172(6):3399-3405.
[24]Surprenant A,Rassendren F,Kawashima E,et al.The cytolytic P2Z receptor for extracellular ATP identified as a P2X receptor(P2X7)[J].Science.1996,272(5262):735-738.
[25]Lin T,Walker GB,Kurji K,et al.Prasad SS.Parainflammation associated with advanced glycation endproduct stimulation of RPE in vitro:implications for age-related degenerative diseases of the eye[J].Cytokine,2013 62(3):369-381.
[26]Chen J,Mo R,Lescure PA,et al.Aging is associated with increased T-cell chemokine expression in C57BL/6 mice[J].J Gerontol A Biol Sci Med Sci,2003,58(11):975-983.
[27]Takenouchi T,Sekiyama K,Sekigawa A,et al.P2X7 receptor signaling pathway as a therapeutic target for neurodegenerative diseases[J].Arch Immunol Ther Exp(Warsz),2010,58(2):91-96.
[28]Yang D,Cui B,Elner SG,et al.Upregulation of P2X7 receptor expression by aging,lipopolysaccharide and interferon-γ in the retinal pigment epithelium[J].Invest Ophthalmol Vis Sci,2013,54(15):1170.
[29]Gudipaty L,Humphreys B D,Buell G,et al.Regulation of P2X(7)nucleotide receptor function in human monocytes by extracellular ions and receptor density[J].Am J Physiol Cell Physiol,2001,280(4):C943.
[30]Jiang L H.Inhibition of P2X(7)receptors by divalent cations:old action and new insight[J].European Biophysics Journal,2009,38(3):339-346.
[31]Stojilkovic S S,Leivasalcedo E,Rokic M B,et al.Regulation of ATP-gated P2X channels:from redox signaling to interactions with other proteins[J].Antioxidants&Redox Signaling,2013,21(6):953-970.
[32]Dongli Y,Elner S G,Clark A J,et al.Activation of P2X receptors induces apoptosis in human retinal pigment epithelium[J].Investigative Ophthalmology&Visual Science,2011,52(3):1522.
[33]Notomi S,Hisatomi T,Murakami Y,et al.Dynamic Increase in Extracellular ATP Accelerates Photoreceptor Cell Apoptosis via Ligation of P2RX7 in Subretinal Hemorrhage[J].Plos One,2013,8(1):e53338.
[34]Hirata Y,Takahashi M,Kudoh Y,et al.Trans-fatty acids promote proinflammatory signaling and cell death by stimulating the apoptosis signal-regulating kinase 1 (ASK1)-p38 pathway[J].Journal of Biological Chemistry,2017,292(20):8174.
[35]Moore S F,Mackenzie A B.NADPH oxidase NOX2 mediates rapid cellular oxidation following ATP stimulation of endotoxin-primed macrophages[J].Journal of Immunology,2009,183(5):3302.
[36]Noguchi T,Ishii K,Fukutomi H,et al.Requirement of reactive oxygen species-dependent activation of ASK1-p38 MAPK pathway for extracellular ATP-induced apoptosis in macrophage[J].The Journal of biological chemistry,2008,283(12):7657.
[37]Notomi S,Hisatomi T,Murakami Y,et al.Dynamic Increase in Extracellular ATP Accelerates Photoreceptor Cell Apoptosis via Ligation of P2RX7 in Subretinal Hemorrhage[J].Plos One,2013,8(1):e53338.
