1,2,4-噁二唑类含能化合物研究进展
2017-05-07黄晓川王子俊秦明娜邱少君
黄晓川, 王子俊, 郭 涛, 秦明娜, 刘 敏, 邱少君
(西安近代化学研究所, 陕西 西安 710065)
1 引 言
随着时代的发展以及战争形势的快速变化,现代战争特别对炸药的安全性、耐用性和环境友好性等方面提出了越来越高的要求,而传统含能材料无论是其性能还是生产过程都已很难满足以上要求[1-2]。因此各国科研工作者为获得高性能含能材料,在含能化合物设计、合成以及新型绿色合成工艺等领域作出了许多艰辛探索,并获得了一定成就[3-6]。在目前所探索的诸多类型的新型含能材料中,噁二唑类含能化合物以其高密度、高氮含量、高氧平衡和高热稳定性等特点得到了广泛关注[7-10]。
高生成焓以及化学键断裂所释放出的键能是噁二唑类含能化合物的主要能量来源[11]。四种噁二唑异构体中1,2,5-噁二唑(俗称呋咱)的生成焓值最高(216.3 kJ·mol-1),且结构中的N—N和N—O的数量最多,因而在之前很长一段时间内深受科研工作者的青睐,并合成得到一系列基于1,2,5-噁二唑结构单元的高能化合物[12-15]。然而进一步研究表明1,2,5-噁二唑类含能化合物虽然在密度、爆速和爆压等方面有着突出的优势,但较高的感度阻碍了该类化合物在实际中的应用[16]。考虑到高能和低感始终是一对相互矛盾的因素,而在保证密度不降低的前提下适当降低主体结构的生成焓可能是一种使爆轰性能和感度达到理想平衡的方法。因而在最近一段时间,国内外一些研究机构已逐渐将关注目光转移至另一种噁二唑异构体——1,2,4-噁二唑[17-19]。
最新研究发现,1,2,4-噁二唑类化合物的总体能量水平略低于1,2,5-噁二唑类化合物,但在感度性能方面则要相对低感,可在侧链上引入高能化学基团(如呋咱基、偶氮基、硝基、硝胺基及硝仿基等)[20-21]可进一步提高1,2,4-噁二唑类化合物的能量密度,因此1,2,4-噁二唑类化合物的性能还有较大的提升空间。本文综述了国内外关于单-1,2,4-噁二唑类、偶氮基-1,2,4-噁二唑类以及联-1,2,4-噁二唑类等三十余种含能化合物的最新研究成果,并对部分化合物的性能进行了阐述。通过与传统硝胺类含能材料黑索今(RDX)和奥克托今(HMX)的综合性能对比,发现1,2,4-噁二唑类含能化合物具有高氧平衡、高能及不敏感特性。针对1,2,4-噁二唑环的结构特点,指出下一步的工作重点为基于1,2,4-噁二唑环开展新型无卤氧化剂的合成研究,此外设计得到两种新型1,2,4-噁二唑类无卤氧化剂,并采用量子化学方法对其性能进行预估,为进一步研究工作提供参考。
2 单-1,2,4-噁二唑类含能化合物的合成及性能
单-1,2,4-噁二唑结构一般可通过酰基、氰基等基团与氨基肟结构单元发生环加成反应合成得到[22],而如何在合成1,2,4-噁二唑环的同时尽可能多地引入高反应活性或高能基团(如氨基、乙酸乙酯基、呋咱基、硝基、硝胺基等)是1,2,4-噁二唑类化合物合成的难点。Huttunen等[23]以二氰基胺钠为原料,在二甲基氨的催化作用下与盐酸羟胺发生反应得到1。同时,他们认为该反应机理为二氰基胺钠与二甲基氨发生作用得到过渡态2,2与盐酸羟胺发生加成反应得到过渡态3,最后3脱去一分子二甲基氨,并发生合环反应得到1(Scheme 1)。
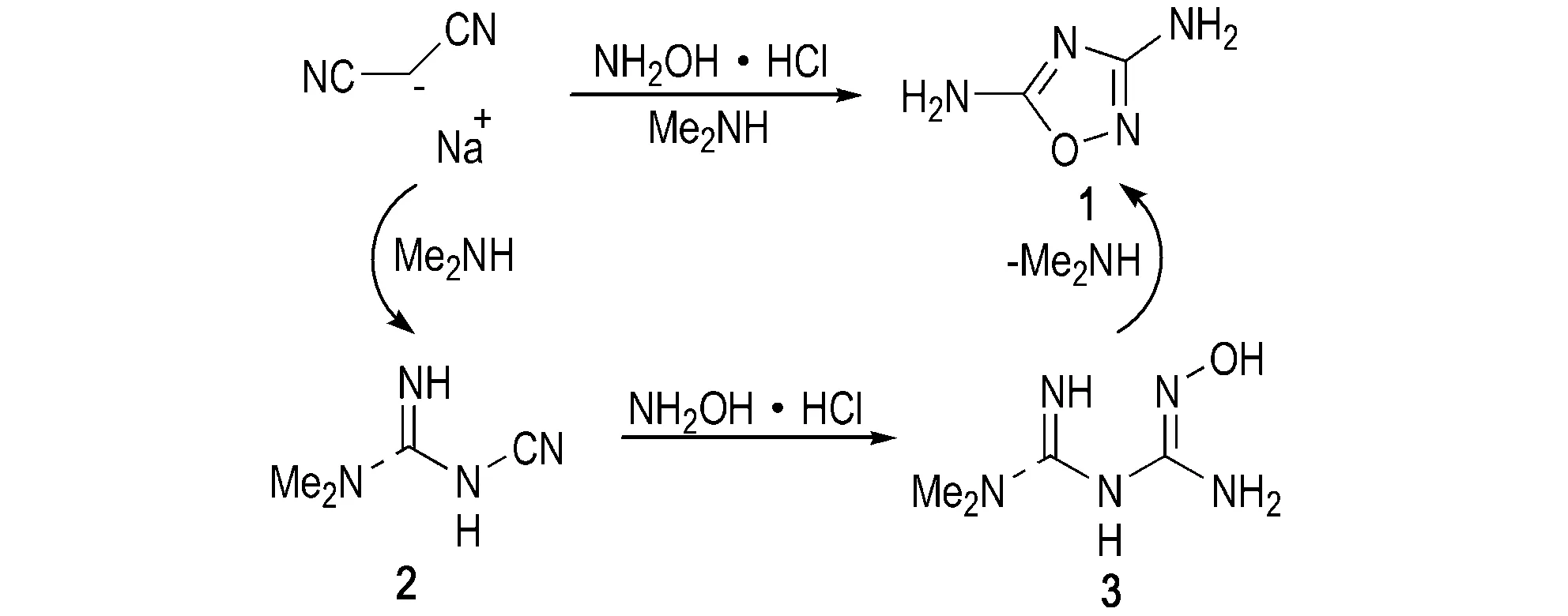
Scheme 1[23]
利用1在3、5位上的高活性氨基,可以进行硝化、成盐等衍生反应得到含能化合物。Tang等[24]以氯甲酸乙酯为亲电试剂,使其在回流的二氧六环体系中与1发生亲电取代反应得到4,4经硝酸/醋酐硝化得到5(由于分子结构重排,5存在伯胺和仲胺两种分子构型),5在水合肼的作用下脱去一分子甲酸乙酯,并与肼结合得到含能离子盐6a,6a可经盐酸酸化得到酸性母体6。利用6自身较强的酸性,可以直接与氨水或羟氨反应得到两种含能离子盐6b和6c(Scheme 2)。6及其三种含能离子盐的爆速均达到8000 m·s-1,撞击感度不低于16 J,摩擦感度不低于240 N,是一类性能优异钝感含能材料(详细性能参数见表1)。
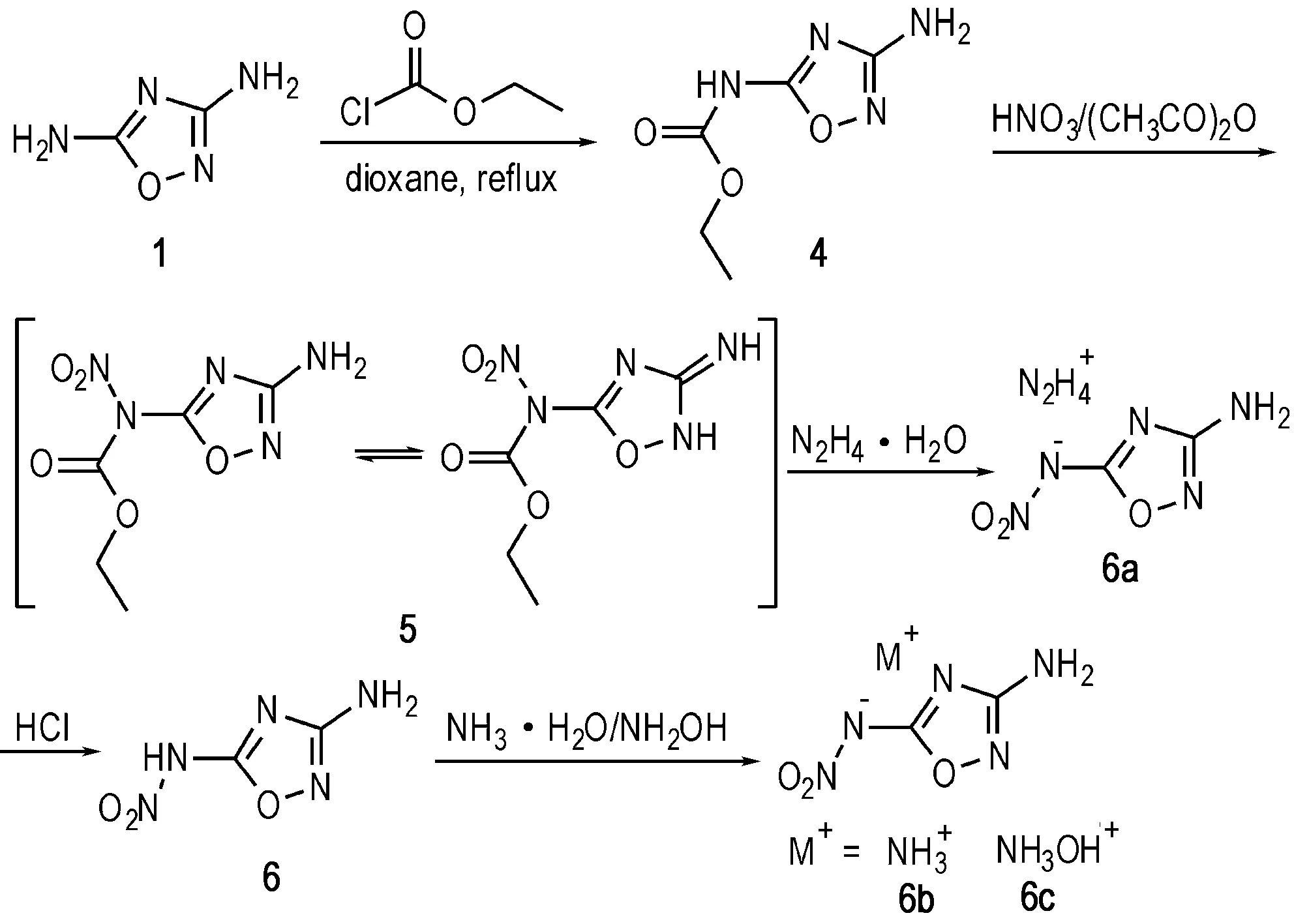
Scheme 2[24]
呋咱环具有高能量密度的特点,因此若在1,2,4-噁二唑类化合物中引入呋咱基,是得到高性能含能化合物的有效方法。Shaposhnikov等[25]以3-氨基-4-偕氨肟基呋咱为原料,与溴化氰经发生重排合环反应得到呋咱基-1,2,4-噁二唑化合物7。Wei[26]等以7为原料,对侧链上的两个活性氨基进行硝化、阴离子化及成盐等多步反应得到7种含能离子盐8a~8f(Scheme 3)。其中8c的密度为1.85 g·cm-3,理论爆速达到9046 m·s-1,理论爆压为37.4 GPa,而且其撞击感度为16 J,摩擦感度为160 N,综合性能优于RDX,是一种具有潜在应价值的高能不敏感含能离子盐(详细性能参数见表1)。
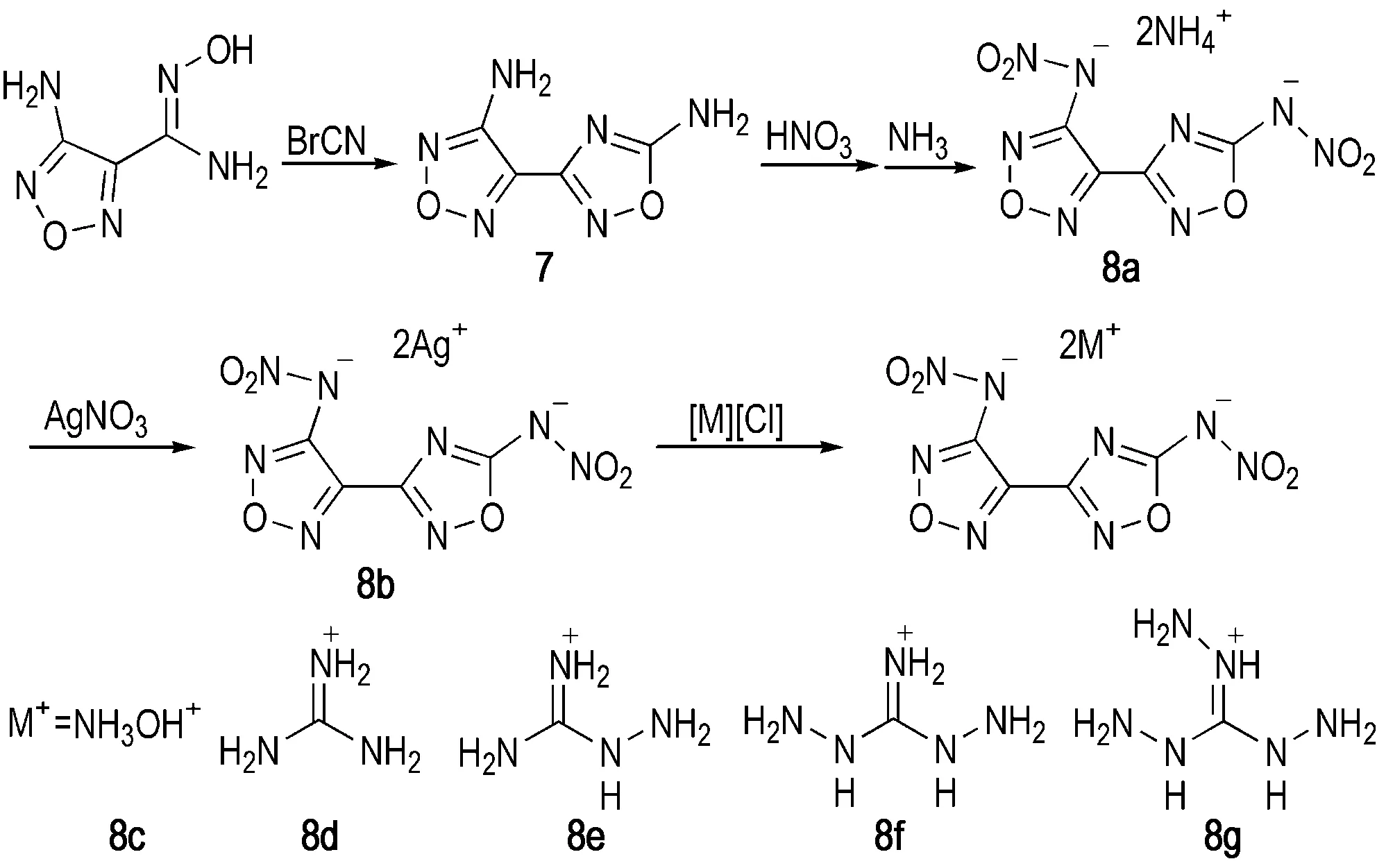
Scheme 3[26]
Wei等[26]还以氯化锌作为路易斯酸催化剂,在对甲苯磺酸/二甲基甲酰胺的酸性体系中催化3-氨基-4-偕氨肟基呋咱与3-氨基-4-氰基呋咱进行合环反应,得到双呋咱基1,2,4-噁二唑化合物9,并继而进行硝化、成盐等反应得到10及其两种含能离子盐10a~10b(Scheme 4)。由于1,2,4-噁二唑结构与两个呋咱基均形成共平面结构,这可有效降低分子的偶极距,提高分子空间排布的紧密程度,因此10、10a及10b与其他单环1,2,4-噁二唑含能化合物相比,其能量密度不仅有一定提高,而且机械感度维持在较低的水平(详细性能参数见表1)。

Scheme 4[26]
表1部分单-1,2,4噁二唑类化合物性质与RDX和HMX的对比
Table1Properties of selected 1,2,4-oxadiazoles in comparison to RDX and HMX
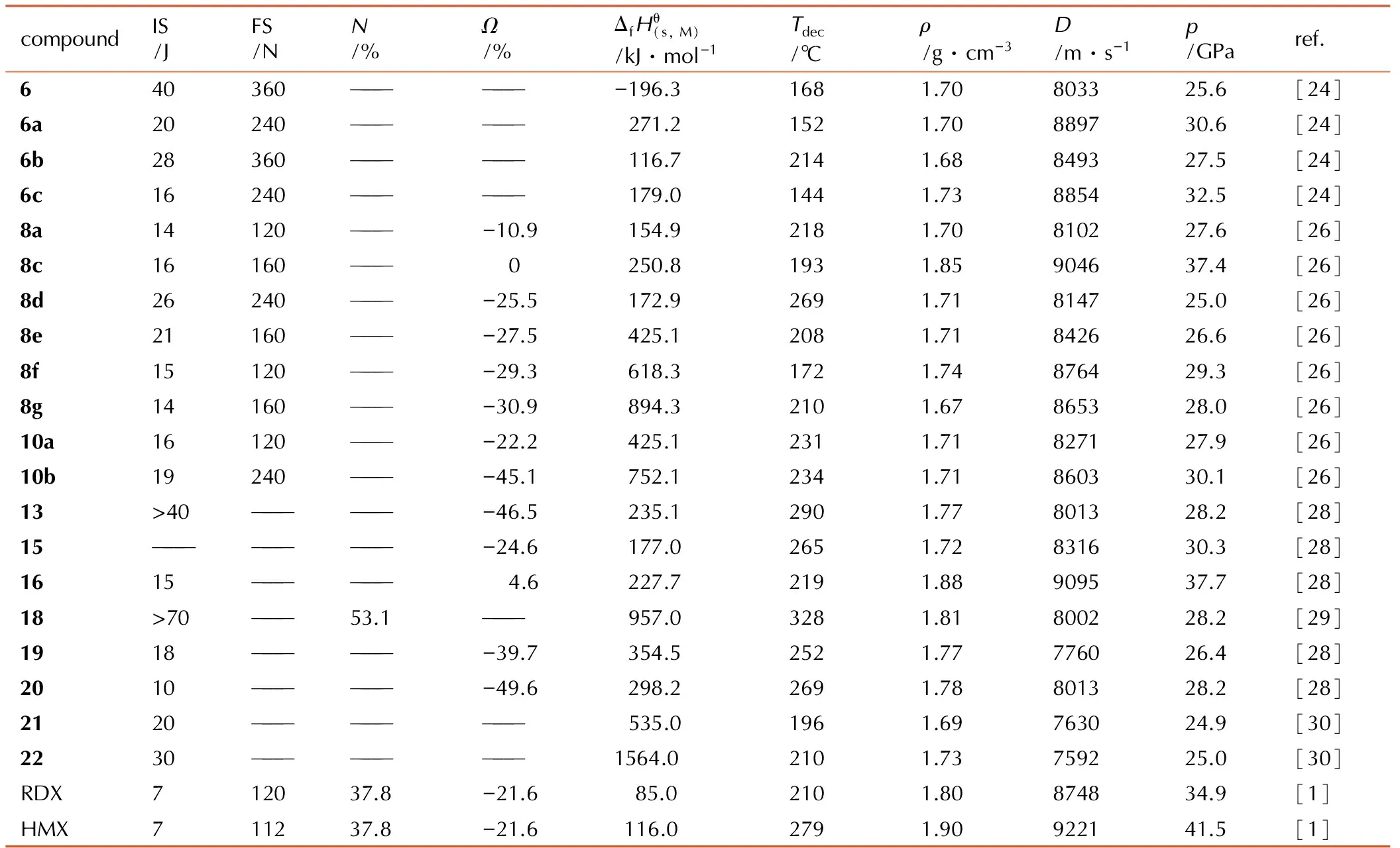
compoundIS/JFS/NN/%Ω/%ΔfHθ(s,M)/kJ·mol-1Tdec/℃ρ/g·cm-3D/m·s-1p/GParef.640360——————-196.31681.70803325.6[24]6a20240——————271.21521.70889730.6[24]6b28360——————116.72141.68849327.5[24]6c16240——————179.01441.73885432.5[24]8a14120———-10.9154.92181.70810227.6[26]8c16160——— 0250.81931.85904637.4[26]8d26240———-25.5172.92691.71814725.0[26]8e21160———-27.5425.12081.71842626.6[26]8f15120———-29.3618.31721.74876429.3[26]8g14160———-30.9894.32101.67865328.0[26]10a16120———-22.2425.12311.71827127.9[26]10b19240———-45.1752.12341.71860330.1[26]13>40——————-46.5235.12901.77801328.2[28]15—————————-24.6177.02651.72831630.3[28]1615—————— 4.6227.72191.88909537.7[28]18>70———53.1———957.03281.81800228.2[29]1918——————-39.7354.52521.77776026.4[28]2010——————-49.6298.22691.78801328.2[28]2120—————————535.01961.69763024.9[30]2230—————————1564.02101.73759225.0[30]RDX712037.8-21.685.02101.80874834.9[1]HMX711237.8-21.6116.02791.90922141.5[1]
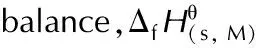
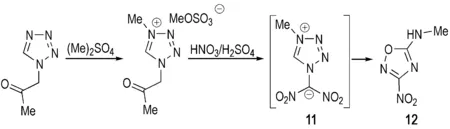
除了以上通过环加成得到单环1,2,4-噁二唑类结构的反应之外,近年来科研工作者还发现了多个通过其他氮杂环结构进行重排反应合成单环1,2,4-噁二唑结构的实例[2, 19]。Katritzky等[27]以1-乙酰基四唑为原料,先后在硫酸二甲酯和硝硫混酸介质中反应,重排得到一种硝基-1,2,4-噁二唑化合物12(Scheme 5)。Katritzky认为该反应的机理[27]为: 首先1-乙酰基四唑与硫酸二甲酯发生甲基化反应,再在硝硫混酸体系中进行硝化得到过渡态11,最后脱除一分子二氧化氮重排得到一种硝基-1,2,4-噁二唑化合物12。12的晶体密度为1.694 g·cm-3,熔点为125~126 ℃,其他性能尚未见报道。
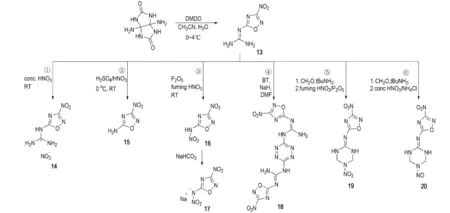
陈甫雪等[28-29]以葫芦脲为原料,在乙腈水溶液体系中经二甲基二氧杂环丙烷(DMDO)氧化重排得到1,2,4-噁二唑化合物13,并利用13侧链上的高活性胍基,分别进行衍生反应如Scheme 6所示。化合物13~20这一系列化合物基本都表现出了高能高密度(1.72~1.88 g·cm-3)的特点,并且还具有较高热稳定性(分解温度均高于220 ℃)和较低感度(撞击感度均大于10 J),是理想的高能不敏感含能化合物(详细性能参数见表1)。
Scheme 5[27]
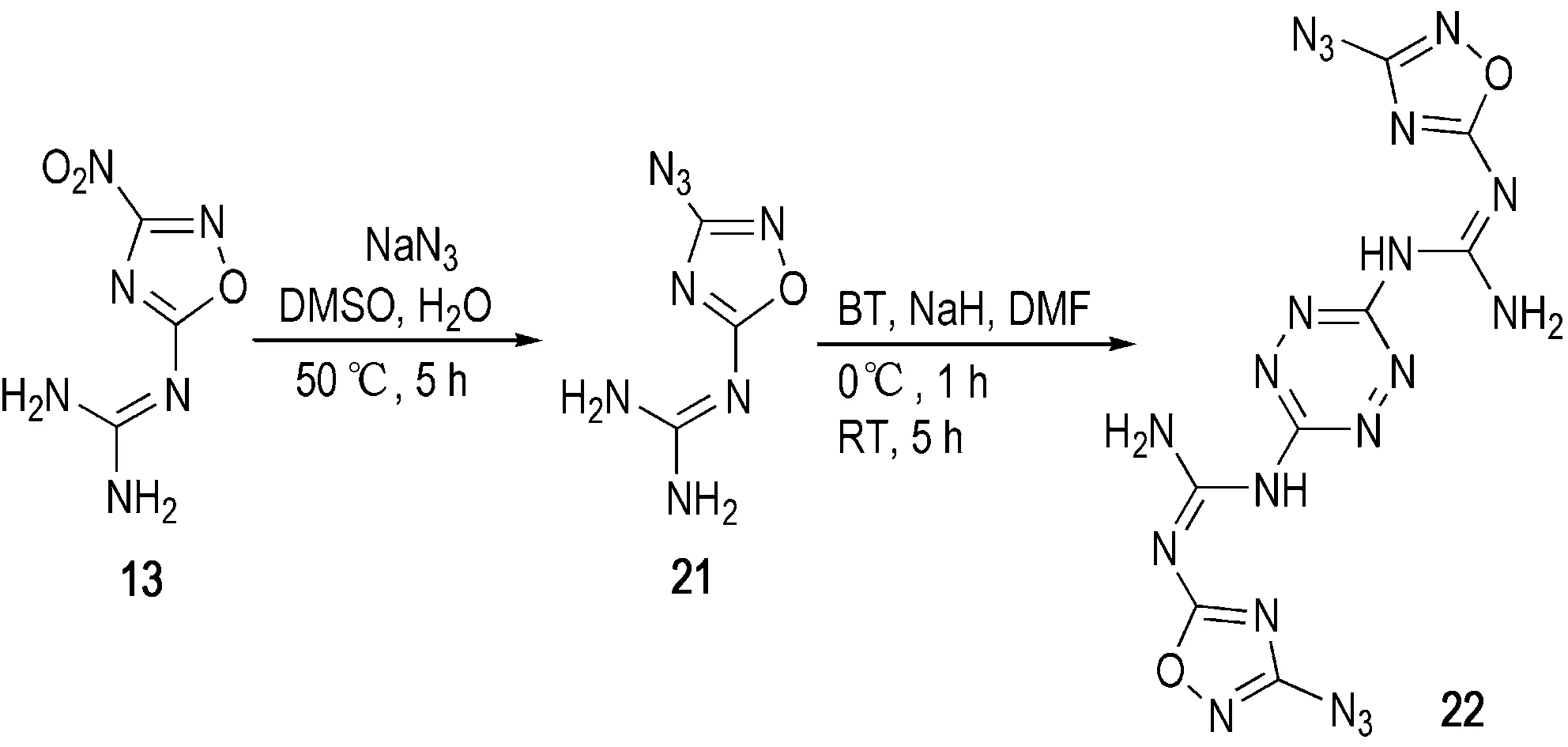
在后续研究中,陈甫雪等[30]还针对13的衍生反应作了进一步的研究,如Scheme 7所示)。21与22的密度分别为1.69 g·cm-3和1.73 g·cm-3,爆速分别为7630 m·s-1和7592 m·s-1,撞击感度分别为20 J和30 J,具有一定的钝感高能特性(详细性能参数见表1)。
Scheme 6[28-29]
Scheme 7[30]
3 偶氮基-1,2,4-噁二唑类含能化合物
偶氮键是一种常规含能基团,在含能化合物分子结构中引入偶氮键,不仅可以有效提高氮含量和生成焓,而且对的分子偶极距的减小也有一定的促进作用[31]。Thottempudi等[32]以1为原料,通过高锰酸钾/盐酸体系的氧化反应,得到引入偶氮基的1,2,4-噁二唑化合物23,再在硝酸/醋酐体系中反应得到偶氮噁二唑酮化合物24,进而利用噁二唑酮环上的活泼N—H键直接成盐得到24a~24c(Scheme 8)。以上五种化合物的密度为1.67~1.73 g·cm-3,爆速均高于7000 m·s-1,撞击感度均大于40 J。其中化合物23的的分解点高于350 ℃,是一种性能良好的高热稳定钝感含能化合物(详细性能参数见表2)。
Tang等[20]采用纯硝酸在室温条件下对23进行硝化,结果得到引入二硝胺基的偶氮噁二唑化合物25,并进一步通过成盐反应得到25a~25h等8种含能离子盐(Scheme 9)。25的密度达到1.90 g·cm-3,爆速为9180 m·s-1,撞击感度和摩擦感度分别为2 J和10 N,可见其能量密度与传统二代含能单质材料HMX相当,但感度较高; 其含能离子与之相比,感度不仅得到大幅降低,而且依然保持较高的能量密度,其中25a的密度为1.86 g·cm-3,爆速为9234 m·s-1,撞击感度和摩擦感度分别为10 J和160 N,是一种综合性能优于RDX的含能单质材料(详细性能参数见表2)。

Scheme 8[32]
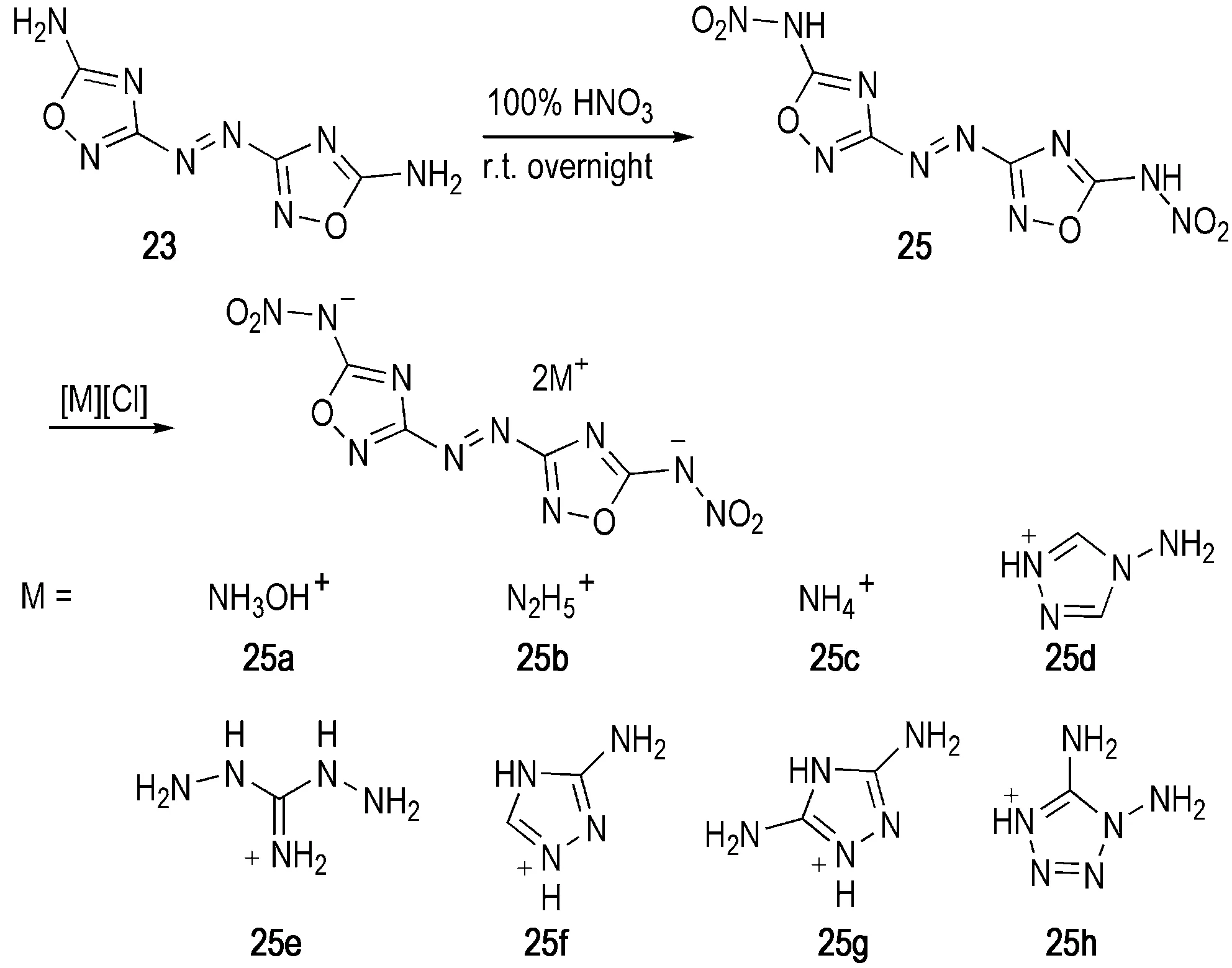
Scheme 9[20]
表2部分单-1,2,4噁二唑类化合物性质与RDX和HMX的对比
Table2Properties of selected 1,2,4-oxadiazoles in comparison to RDX and HMX
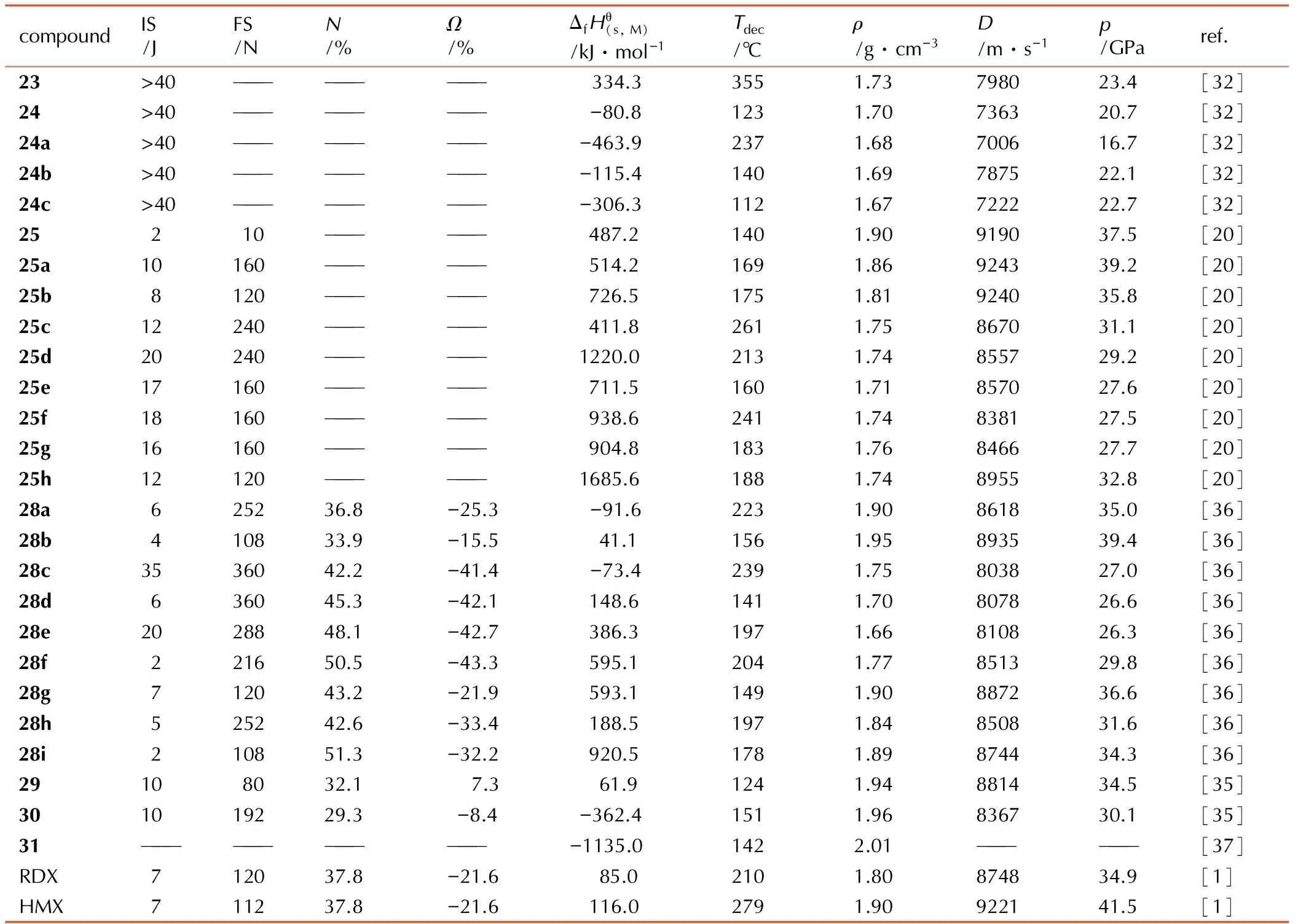
compoundIS/JFS/NN/%Ω/%ΔfHθ(s,M)/kJ·mol-1Tdec/℃ρ/g·cm-3D/m·s-1p/GParef.23>40————————— 334.33551.73798023.4[32]24>40————————— -80.81231.70736320.7[32]24a>40—————————-463.92371.68700616.7[32]24b>40—————————-115.41401.69787522.1[32]24c>40—————————-306.31121.67722222.7[32]25210—————— 487.21401.90919037.5[20]25a10160—————— 514.21691.86924339.2[20]25b8120—————— 726.51751.81924035.8[20]25c12240—————— 411.82611.75867031.1[20]25d20240——————1220.02131.74855729.2[20]25e17160—————— 711.51601.71857027.6[20]25f18160—————— 938.62411.74838127.5[20]25g16160—————— 904.81831.76846627.7[20]25h12120——————1685.61881.74895532.8[20]28a625236.8-25.3 -91.62231.90861835.0[36]28b410833.9-15.5 41.11561.95893539.4[36]28c3536042.2-41.4 -73.42391.75803827.0[36]28d636045.3-42.1 148.61411.70807826.6[36]28e2028848.1-42.7 386.31971.66810826.3[36]28f221650.5-43.3 595.12041.77851329.8[36]28g712043.2-21.9 593.11491.90887236.6[36]28h525242.6-33.4 188.51971.84850831.6[36]28i210851.3-32.2 920.51781.89874434.3[36]29108032.17.3 61.91241.94881434.5[35]301019229.3-8.4-362.41511.96836730.1[35]31————————————-1135.01422.01——————[37]RDX712037.8-21.6 85.02101.80874834.9[1]HMX711237.8-21.6 116.02791.90922141.5[1]
4 联-1,2,4-噁二唑类含能化合物
联-1,2,4-噁二唑结构由两个1,2,4-噁二唑通过碳碳键相连构成,是一种共平面的方向结构,对提高化合物的能量密度及稳定性有着促进作用。联-1,2,4-噁二唑结构一般可通过底物——二氨基乙二肟与丙二酸二乙酯、原甲酸三乙酯等合环反应得到[33]。其中二氨基乙二肟与丙二酸二乙酯反应得到的化合物26具有高反应活性的乙酸乙酯基,可进一步进行硝化、氟化等衍生反应得到多种具有优良性能的含能化合物。Kiseleva等[34]以二氨基乙二肟和丙二酸二乙酯为原料,经两步高温加热反应得到联-1,2,4-噁二唑结构化合物26。Klapötke等人[17-18, 35-36]在化合物26的基础上,进行了衍生反应,如Scheme 10所示。28b的密度为1.95 g·cm-3,爆速为8955 m·s-1,而撞击感度和摩擦感度分别为4 J和108 N,其综合性能与HMX相当;29的密度为1.94 g·cm-3,爆速为8814 m·s-1,撞击感度和摩擦感度分别为10 J和80 N,氧平衡水平(ΩCO2)为7.3%,是一种综合性能优良的氧化剂;30的密度为1.96 g·cm-3,爆速为8367 m·s-1,撞击感度和摩擦感度分别为10 J和192 N,是一种潜在的不敏感含能单质材料(详细性能参数见表2)。
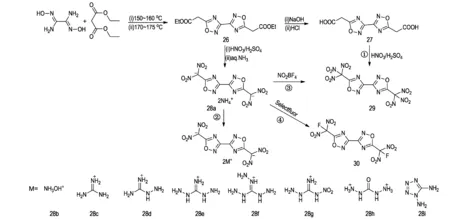
Scheme 10[17-18,35-36]
Kettner等[37]通过二氨基乙二肟与三氟醋酐的成环反应得到含有双三氟甲基的联-1,2,4-噁二唑化合物31(Scheme 11),该反应过程与二氨基乙二肟和丙二酸二乙酯的合环反应类似,只是所需反应温度较低,仅为35 ℃。由于引入了三氟甲基,31的密度具有较高的密度,为2.01 g·cm-3,熔点为98 ℃,分解温度为142 ℃,是一种潜在的熔铸型含能材料(详细性能参数见表2)。
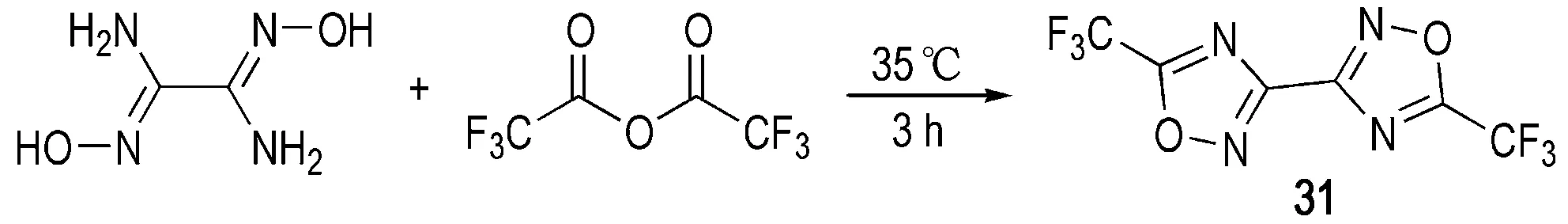
Scheme 11[37]
呋咱的开环重排反应也是一种合成得到联-1,2,4-噁二唑结构化合物的方法。李战雄等人[38]通过二氨基呋咱与氯乙酰氯的偶联合环反应得到32,再与叠氮化钠反应得到含有双叠氮甲基联联-1,2,4-噁二唑化合物33。李战雄等人[38]认为该反应过程是: 首先二氨基呋咱与氯乙酰氯通过偶联反应得到32a,32a的羰基氧原子亲和进攻呋咱环上的氮原子,并诱导呋咱环开环形成过渡态32b,最后发生重排反应得到33(Scheme 12)。
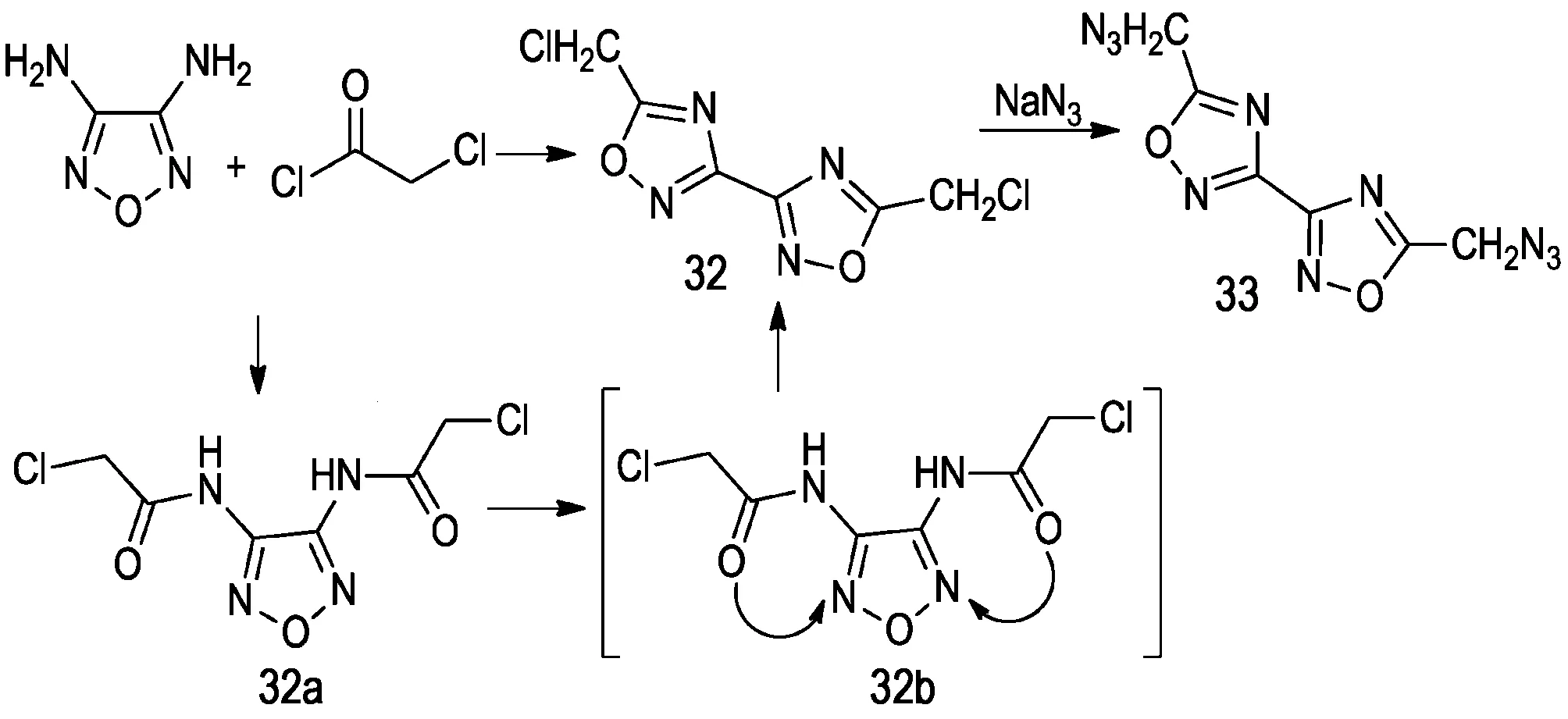
Scheme 12[38]
5 两种新型1,2,4-噁二唑含能化合物的设计及性能
由于1,2,4-噁二唑类含能化合物的研究历程较短,在许多方面的研究不够深入,对该类材料潜在用途的定位也尚不明了。纵观上述1,2,4-噁二唑类含能化合物的研究进展,其最大优势在于1,2,4-噁二唑环为离域平面结构以及具有较高的氧平衡水平。因此基于1,2,4-噁二唑环结构,进一步引入硝仿基、氟偕二硝基等高能高氧基团,得到新型高能无卤氧化剂,是较具潜力的发展方向之一,例如文中所介绍的化合物29,不仅具有较高的能量密度和较低的感度,而且氧平衡水平高达7.3%,是潜在的高能无卤氧化剂。
以下为基于1,2,4-噁二唑环结构自主设计得到的两种新型无卤氧化剂34和35的结构式(Scheme 13)。基于密度泛函理论(DFT)在B3LYP/6-31G**基组水平[39-40]上对化合物34和35的结构优化,采用Monte-Carlo方法[41]、CBS-4M方法[42]以及Kamlet-Jacobs公式[43]对其理论性能进行预估(理论性能与ADN和HNF的对比详见表3)。34和35的理论密度分别为2.05 g·cm-3和2.08 g·cm-3,均远高于ADN和HNF; 理论爆速分别为8788 m·s-1和8706 m·s-1;
氧平衡水平分别为21.7%和5.1%,接近ADN和HNF水平。以上结果表明34和35具有优异的理论性能,可作为下一步的重点研究对象。
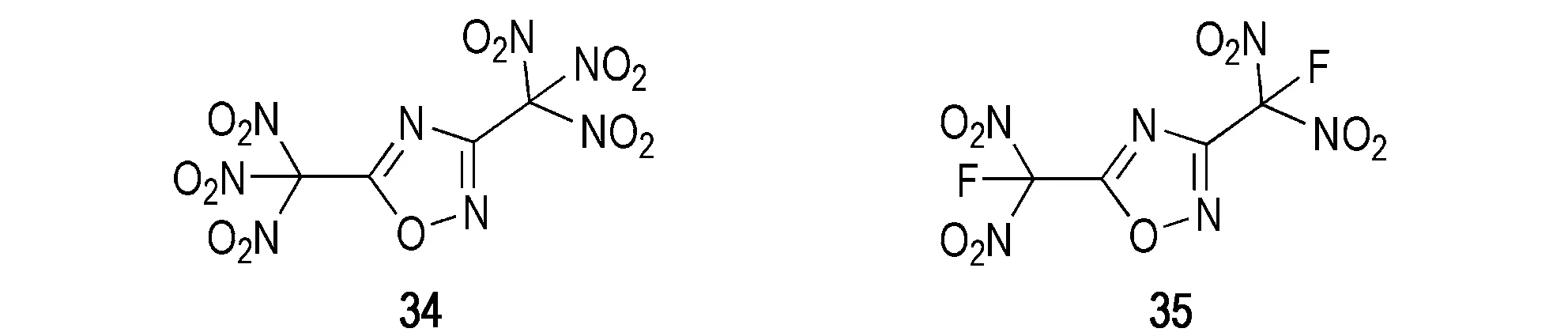
Scheme 13
表3化合物34和35理论性能与ADN和HNF的对比
Table3Theoretical properties of34and35in comparison to ADN and HNF

compoundN/%Ω/%ΔfHθ(s,M)/kJ·mol-1ρ/g·cm-3D/m·s-1p/GParef.3430.421.7145.18642.05878837.59———3526.85.1-325.7092.08870637.20———ADN52.026.0———1.81——————[44]HNF38.013.0———1.86——————[45]
6 结论与展望
研究人员通过偶联合环或其他杂环结构的重排反应构建1,2,4-噁二唑环结构,并结合硝化、氧化、偶氮化、氟化及成盐等各类衍生反应,获得了一系列结构各异的1,2,4-噁二唑含能化合物。通过与传统含能材料的综合性能对比,1,2,4-噁二唑类含能化合物具有以下特点:
(1) 1,2,4-噁二唑环为平面结构,有利于分子的空间紧密排布,因此1,2,4-噁二唑类含能化合物具有较高的密度;
(2) 1,2,4-噁二唑环具有芳香性,可有效降低分子的偶极距,例如即使在支链上引入硝仿、偕二硝基及氟偕二硝基等高极性基团,也能保持较低感度;
(3) 在构建1,2,4-噁二唑环的过程中,容易引入具有多反应位点的支链,便于进行各种含能衍生反应,合成出性能变化范围较广的含能化合物。文中所介绍的化合物中,8c、16、28a、28b、29以及30不仅能量密度与HMX相当,而且部分感度参数要优于HMX,具有一定的潜在应用价值。
此外,本课题组基于1,2,4-噁二唑环结构,自主设计得到的两种新型无卤氧化剂34和35,其理论密度分别为2.05 g·cm-3和2.08 g·cm-3,理论爆速分别为8788 m·s-1和8706 m·s-1,氧平衡水平分别为21.7%和5.1%,综合性能优于ADN和HNF,可为下一步合成研究工作提供参考。
参考文献:
[1] Meyer R, Homburg A. Explosives[M]. 5th. US: Wiley, 2007: 236-237.
[2] 付占达, 王阳, 李金山, 等. 新型含能材料NONHT和NONsHT的合成与热分解[J]. 兵工学报, 2013, 34(2): 235-239.
FU Zhan-da, WANG Yang, LI Jin-shan, et al.Synthesis and thermal decomposition of new energetic materials NONHT and NONsHT[J].ActaArmamentarii, 2013, 34(2): 235-239.
[3] Karaghiosoff K, Klapötke T M, Michailovski A, et al. 1,4-Diformyl-2,3,5,6-tetranitratopiperazine: a new primary explosive based on glyoxal [J].Propellants,Explosives,Pyrotechnics, 2003, 28(1): 1-6.
[4] Klapötke T M, Krumm B, Scherr M, et al. Experimental and theoretical studies on some energetic functionalized trimethylamine derivatives[J].Chemistry-AEuropeanJournal, 2009, 15(42): 11341-11345.
[6] 何志勇, 罗军, 吕春绪, 等. N2O5硝解DPT制备HMX[J], 火炸药学报, 2010, 33(2): 1-4.
HE Zhi-yong, LUO Jun, LV Chun-xu, et al. Synthesis of HMX from DPT by reennitrolysis with dinitrogen pentoxide[J].ChineseJournalofExplosives&Propellants, 2010, 33(2): 1-4.
[7] Dippold A A, Klapötke T M. Nitrogen-Rich Bis-1,2,4-triazoles-A Comparative Study of Structural and Energetic Properties[J].Chemistry-AEuropeanJournal, 2012, 18(52): 16742-16753.
[8] Wang Y, Xu K, Zhao F, et al. Synthesis, Crystal structure, and thermal behaviors of 3-nitro-1,5-bis(4,4′-dimethylazide)-1,2,3-triazolyl-3-azapentane (NDTAP)[J].Propellants,Explosives,Pyrotechnics, 2013, 38(5): 644-650.
[9] Fischer N, Fischer D, Klapötke T M, et al. Pushing the limits of energetic materials-the synthesis and characterization of dihydroxylammonium 5,5′-bistetrazole-1,1′-diolate[J].JournalofMaterialsChemistry, 2012, 22(38): 20418-20422.
[10] Fischer D, Klapötke T M, Reymann M, et al. Dense energetic nitraminofurazanes[J].Chemistry-AEuropeanJournal, 2014, 20(21): 6401-6411.
[11] Zhang Q, Zhang J, Qi X, et al. Molecular design and property prediction of high density polynitro [3.3.3]-propellane-derivatized frameworks as potential High Explosives[J].TheJournalofChemicalPhysics, 2014, 118(45): 10857-10865.
[12] 何金选, 卢艳华, 雷晴,等. 3,3′-二硝基-4,4′-偶氮氧化呋咱的合成及性能[J]. 火炸药学报 ,2011, 34(5): 9-12.
HE Jin-xuan, LU Yan-hua, LEI Qing, et al. Synthesis and properties of high energetic compound 3,3-dinitro-4,4-azofuroxan[J].ChineseJournalofExplosives&Propellants., 2011, 34(5): 9-12.
[13] Makakhova N N, Ovchinnikov I V, Kulikov A S, et al. Monocyclic and cascade rearrangements of furoxans[J].PureandAppliedChemistry, 2004, 76(9): 1691-1703.
[14] 林智辉, 高莉, 李敏霞, 等. 几种呋咱类含能化合物的合成,热行为及理论爆轰性能预估[J]. 火炸药学报, 2014, 37(3): 6-10.
LIN Zhi-hui, GAO Li, LI Min-xia, et al. Synthesis, thermal behavior and prediction of theoretical detonation performance for some energetic compounds derived from furazan[J].ChineseJournalofExplosives&Propellants, 2014, 37(3): 6-10.
[15] Zhang J, Shreeve J. 3,3′-dinitroamino-4,4′-azoxyfurazan and its derivatives: an assembly of diverse NO building blocks for high-performance energetic materials[J].JournaloftheAmericanChemicalSociety, 2014, 136(11): 4437-4445.
[16] 王浩, 王亲会, 黄文斌, 等. DNAN降低DNTF冲击波感度研究[J]. 含能材料, 2010, 18(4): 435-438.
WANG Hao, WANG Qin-hui, HUANG Wen-bin, et al. Shock sensitivity of DNTF reduced by using DNAN[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2010, 18(4): 435-438.
[17] Kettner M, Klapötke T. 5,5′-Bis-(trinitromethyl)-3,3′-bi-(1,2,4-oxadiazole): a stable ternary CNO-compound with high density[J].ChemicalCommunications, 2014, 50(18): 2268-2270.
[18] Axthammer Q, Kettner M, Klapötke T, et al. Progress in the development of high energy dense oxidizers based on CHNO(F) materials[C]∥New Trends in Research of Energetic Materials, Czech Republic: University of Pardubice, 2013, 29-39.
[19] 付占达, 王阳, 陈甫雪. 新型异呋咱类含能材料 NOG 的热行为[J]. 含能材料, 2012, 20(5): 583-586.
FU Zhan-da, WANG Yang, CHEN Fu-xue. Thermal behavior of 3-nitro-5-guanidino-1,2,4-oxadiazole[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2012, 20(5): 583-586.
[20] TANG Y, GAO H, Mitchell L A, et al. Syntheses and promising properties of dense energetic 5,5′-dinitramino-3,3′-azo-1,2,4-oxadiazole and its salts[J].AngewandteChemie, 2016, 128(9): 3252-3255.
[21] TANG Y, GAO H, Parrish D A, et al. 1,2,4-Triazole links and N-azo bridges yield energetic compounds[J].Chemistry-AEuropeanJournal, 2015, 21(32): 11401-11407.
[22] Goldberg K, Clarke D S, Scott J S. A facile synthesis of 3-trifluoromethyl-1,2,4-oxadiazoles from cyanamides[J].TetrahedronLetters, 2014, 55(32): 4433-4436.
[23] Huttunen K M, Leppänen J, Kemppainen E, et al. Towards metformin prodrugs[J].Synthesis, 2008, 40(22): 3619-3624.
[24] Tang Y, Gao H, Mitchell L A, et al. Enhancing energetic properties and sensitivity by incorporating amino and nitramino groups into a 1,2,4-oxadiazole building block[J].AngewandteChemieInternationalEdition, 2015, 54(3): 1-5.
[25] Shaposhnikov S, Korobov N, Sergievskii A, et al. New heterocycles with a 3-aminofurazanyl substituent[J].RussianJournalofOrganicChemistry, 2002, 38(9): 1351-1355.
[26] Wei H, He C, Zhang J, et al. Combination of 1,2,4-oxadiazole and 1,2,5-oxadiazole moieties for the generation of high-performance energetic materials[J].AngewandteChemie, 2015, 127(32): 9499-9503.
[27] Katritzky A, Sommen G, Gromova A, et al. Synthetic routes towards tetrazolium and triazolium dinitromethylides[J].ChemistryofHeterocyclicCompounds, 2005, 41(1): 111-118.
[28] Fu Z, Su R, Wang Y, et al. Synthesis and characterization of energetic 3-nitro-1,2,4-oxadiazoles[J].Chemistry-AEuropeanJournal, 2012, 18(7): 1886-1889.
[29] Fu Z, He C, Chen F-X. Synthesis and characteristics of a novel, high-nitrogen, heat-resistant, insensitive material (NOG2Tz)[J].JournalofMaterialsChemistry, 2012, 22(1): 60-63.
[30] Fu Z, Wang Y, Yang L, et al. Synthesis and characteristics of novel, high-nitrogen 1,2,4-oxadiazoles[J].RSCAdvances, 2014, 4(23): 11859-11861.
[31] Sheremetev A B, Lyalin B V, Kozeev A M, et al. A practical anodic oxidation of aminofurazans to azofurazans: an environmentally friendly route[J].RSCAdvances, 2015, 5(47): 37617-37625.
[32] Thottempudi V, Zhang J, He C, et al. Azo substituted 1,2,4-oxadiazoles as insensitive energetic materials[J].RSCAdvances, 2014, 4(92): 50361-50364.
[33] Richardson C, Steel P J. The first metal complexes of 3,3′-bi-1,2,4-oxadiazole: A curiously ignored ligand[J].InorganicChemistryCommunications, 2007, 10(8): 884-887.
[34] Kieseleva V, Gakh A, Fainzil'berg A. Synthesis of C-azolylacetic acid esters based on carbethoxyethylacetimidate[J].Russianchemicalbulletin, 1990, 39(9): 1888-1895.
[35] Ketener M, Karaghiosoff K, Klapötke T M, et al. 3,3′-Bi (1,2,4-oxadiazoles) featuring the fluorodinitromethyl and trinitromethyl groups[J].Chemistry-AEuropeanJournal, 2014, 20(1): 1-11.
[36] Klapötke T M, Mayr N, Stierstorfer J, et al. Maximum compaction of ionic organic explosives: bis (hydroxylammonium) 5,5′-Dinitromethyl-3,3′-bis (1,2,4-oxadiazolate) and its derivatives[J].Chemistry-AEuropeanJournal, 2014, 20(5): 1410-1417.
[37] Ketener M, Klapötke T M, Witkowski T G, et al. Synthesis, characterisation and crystal Structures of two bi-oxadiazole derivatives featuring the trifluoromethyl group[J].Chemistry-AEuropeanJournal, 2015, 21(11): 4238-4241.
[38] 李战雄, 唐松青, 刘金涛. 3,4-二氨基呋咱的乙酰化反应[J]. 有机化学, 2002, 22(11): 902-904.
LI Zhan-xiong, TANG Song-qing, LIU Jin-tao. Acetylation of 3,4-diaminofurazine[J].ChineseJournalofOrganicChemistry, 2002, 22(11): 902-904.
[39] Del Bene J E, Person W B, Szczepaniak K. Properties of hydrogen-bonded complexes obtained from the B3LYP functional with 6-31G(d,p) and 6-31+G(d,p) basis sets: comparison with MP2/6-31+G(d,p) results and experimental data[J].TheJournalofphysicalchemistry, 1995, 99(27): 10705-10707.
[40] Slanina Z, Uhlík F, Zhao X, et al. Enthalpy-entropy interplay for C36 cages: B3LYP/6-31G*calculations[J].TheJournalofChemicalPhysics, 2000, 113(12): 4933-4937.
[41] Pastore S, Wiringa R, Schiavilla R, et al. Quantum Monte Carlo calculations of electromagnetic transitions in8Be with meson-exchange currents derived from chiral effective field theory[J].PhysicalReviewC, 2014, 90(2): 59-65.
[42] Wu Q, Zhu W, Xiao H. Theoretical design of energetic nitrogen-rich derivatives of 1,7-diamino-1,7-dinitrimino-2,4,6-trinitro-2,4,6-triazaheptane[J].JournalofMolecularModeling, 2013, 19(8): 2945-2954.
[43] Zhang Y, Wang J, Dong F, et al. A DFT study of cage compounds: 3,5,8,10,11,12-hexanitro-3,5,8,10,11,12-hexaazatetracyclo [5.5.1.12,6.04,9] dodecane and its derivatives as high energetic materials[J].StructuralChemistry, 2013, 24(4): 1339-1346.
[44] Nagamachi M, Oliveira J, Kawamoto A, et al. ADN-The new oxidizer around the corner for an environmentally friendly smokeless propellant[J].JournalofAerospaceTechnologyandManagement, 2011, 1(2): 153-160.
[45] Joo Y, Min B. Denitration of hydrazinium nitroformate to form hydrazinium dinitromethanide[J].NewJournalofChemistry, 2014, 38(1): 50-54.
