3-氟偕二硝甲基-1,2,4-三唑的合成及性能
2017-05-07李亚南舒远杰张生勇王伯周翟连杰
李亚南, 舒远杰, 张生勇, 王伯周, 翟连杰, 霍 欢
(西安近代化学研究所 氟氮化工资源高效开发与利用国家重点实验室, 陕西 西安 710065)
1 引 言
近年来,氮杂芳环化合物(如吡唑、咪唑、三唑、四唑、三嗪、四嗪、呋咱等)因具有高氮含量、高生成焓、产气量大、爆轰产物清洁等优点,成为各国含能材料研究者普遍关注的热点之一[1-5]。由于此类高氮化合物分子中所含氮、氧原子的电负性较高、大多具有未使用的孤电子对,从而使整个杂环体系容易形成类似苯环的大л键共轭结构。因此,具有热稳定性好、对摩擦、撞击刺激钝感等特点,国内外研究者已经设计并合成出多种富氮杂环含能化合物,大多具有较好的爆轰性能[6-10]。氟偕二硝甲基基团作为一种非常重要的新型高能量密度含能官能团,已应用于多种含能化合物的分子结构设计与合成中,含有该官能团的化合物大多具有较好的热稳定性和较低的感度,和传统含偕二硝甲基官能团的含能化合物相比,含氟偕二硝甲基基团的化合物大多具有较高的密度、适宜的感度、较高的氧平衡和良好的爆轰性能[11-12]。因此,将富氮的三唑环引入分子结构中,可以增加化合物的氮含量; 而将氟偕二硝甲基基团引入分子结构中,可以有效改善化合物的密度和氧平衡,提升含能化合物的爆轰性能。
基于此,本研究以3-氰基-1,2,4-三唑为原料,设计并合成了未见文献报道的新型含能化合物——3-氟偕二硝甲基-1,2,4-三唑(FDNMT),优化并确定了肟化反应的适宜条件; 采用Gaussian 09程序[13]中的CBS-4M方法和Kamlet-Jacobs爆轰方程[14]预估了目标化合物的爆轰性能,为进一步开展此类化合物的设计、合成提供借鉴。
2 实验部分
2.1 试剂与仪器
五氧化二氮,自制; 3-氰基-1,2,4-三唑,化学纯,济南伟都化工试剂有限公司; 盐酸羟胺、氢氧化钠、亚硝酸钠、碘化钾、二氯甲烷、三氯甲烷、甲醇、乙腈,分析纯,成都市科龙化工试剂厂; 浓盐酸(36%~38%),工业级,西安福晨化学试剂有限公司。
ZF-Ⅱ型三用紫外仪,上海市安亭电子仪器厂; NEXUS 870型傅里叶变换红外光谱仪,美国热电尼高力公司; AV500型(500MHz)超导核磁共振仪,瑞士BRUKER公司; GCMS-QP2010型质谱仪,日本岛津公司; VARIO-EL-3型元素分析仪,德国EXEMENTAR公司; LC-2010A型高效液相色谱仪(归一化法),日本岛津公司; SMART APEX Ⅱ CCD X-射线单晶衍射仪,德国Bruker公司。
2.2 合成路线
以3-氰基-1,2,4-三唑和盐酸羟胺为原料,经肟化、重氮化-氯化、硝解、还原、氟化等反应合成了3-氟偕二硝甲基-1,2,4-三唑,合成路线如Scheme 1所示。
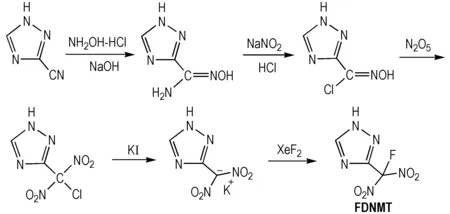
Scheme1Synthetic route of FDNMT
2.3 实验过程
2.3.1 3-偕氨基羟亚氨基甲基-1,2,4-三唑的合成
搅拌下,将10.0 g(0.106 mol) 3-氰基-1,2,4-三唑加入100.0 mL去离子水中,分批加入9.6 g(0.138 mol)盐酸羟胺,用30%(质量分数)的氢氧化钠水溶液将反应液的pH值调节至8,在70~75 ℃反应2.5 h,冷却、过滤反应液、水洗滤饼至中性,干燥滤饼得白色固体3-偕氨基羟亚氨基甲基-1,2,4-三唑6.6 g,收率为48.8%,纯度为99.1%(HPLC)。
1H NMR(DMSO-d6, 500 MHz)δ: 5.831(s, 2H, NH2), 8.323(s, 1H, CH), 9.956(s, 1H, NH), 14.281(s, 1H, OH);13C NMR(DMSO-d6, 125 MHz)δ: 143.79(s), 147.76(s), 151.84 (s); IR(KBr,ν/cm-1): 3472, 3453, 3360, 3336, 3143, 1655, 1472, 1390, 1292, 1151, 932; Anal.calcd for C3H5N5O(%): C 28.35, H 3.96, N 55.10; found C 28.37, H 4.01, N 55.29; MS(EI)m/z: 127[M+]。
2.3.2 3-偕氯羟亚氨基甲基-1,2,4-三唑的合成
搅拌下,将4.0 g(0.031 mol)3-偕胺肟基-1,2,4-三氮唑加入9.5 mL浓盐酸和30 mL蒸馏水的混合溶液中,缓慢加热使其完全溶解,然后将反应液冷却到5 ℃以下析出白色粉晶,滴加2.1 g(0.031 mol)亚硝酸钠水溶液,过程中加入0.5 mL CH2Cl2消泡,然后在5 ℃以下保持反应3.0 h,升温到30 ℃反应1.5 h,冷却、过滤、水洗至中性,干燥得白色固体3-偕氯羟亚氨基甲基-1,2,4-三唑3.6 g,收率为78.1%,纯度98.9%(HPLC)。
1H NMR(DMSO-d6, 500 MHz)δ: 8.604(s, 1H, CH), 12.605(s, 1H, NH), 14.408(s, 1H, OH);13C NMR(DMSO-d6, 125 MHz)δ: 128.36, 145.95, 154.79; IR(KBr,ν/cm-1): 3237, 1619, 1477, 1370, 1279, 1040, 937, 748; Anal.calcd for C3H3N4OCl(%): C 24.59, H 2.064, N 38.23; found C 24.79, H 2.050, N 37.70; MS(ESI-)m/z:145, 147[M-H]-。
2.3.3 3-氯偕二硝甲基-1,2,4-三唑的合成
搅拌下,依次将1.5 g(0.01 mol) 3-偕氯肟基-1,2,4-三唑、75.0 mL三氯甲烷加入到烧瓶中,分批加入1.5 g(0.053 mol)五氧化二氮,加完后升温至45 ℃反应45 min,减压蒸除三氯甲烷,干燥得3-氯偕二硝甲基-1,2,4-三唑1.95 g,收率为91.9%,纯度为98.6%(HPLC)。
1H NMR(DMSO-d6, 500 MHz)δ: 8.988(s, 1H, CH), 9.114(s, 1H, NH);13C NMR(DMSO-d6, 125 MHz)δ: 144.49, 147.49, 153.09; IR(KBr,ν/cm-1): 3152, 3103, 3025, 1537, 1476, 1385, 1348, 1326, 1279, 1052; Anal.calcd for C3H2N5O4Cl(%): C 17.36, H 0.97, N 33.75; found C 17.33, H 0.92, N 33.80; MS(ESI-)m/z: 206, 208[M-H]-。
2.3.4 3-偕二硝甲基-1,2,4-三唑钾盐的合成
搅拌下,依次将0.5 g(2.4 mmol) 3-氯偕二硝甲基-1,2,4-三唑、10.0 mL甲醇加入到烧瓶中,滴加10.0 mL含1.0 g(6.0 mmol)碘化钾的甲醇溶液,加完后在25 ℃反应1 h,过滤、甲醇洗、干燥得3-偕二硝甲基-1,2,4-三唑钾盐0.31 g,收率为61.0%,纯度为98.8%(HPLC)。
1H NMR(D2O-d2, 500 MHz)δ: 8.503(s, 1H, CH);13C NMR(D2O-d2, 125 MHz)δ: 126.90, 146.17, 150.91; IR(KBr,ν/cm-1): 3150, 3097, 2879, 1538, 1520, 1463, 1377, 1359, 1323, 1243, 1099; Anal.calcd for C3H2N5O4K(%): C 17.06, H 0.95, N 33.16; found C 17.13, H 0.91, N 33.22; MS(ESI-)m/z: 172[M-K]-。
2.3.5 3-氟偕二硝甲基-1,2,4-三唑(FDNMT)的合成
搅拌下,依次将0.15 g(0.71 mmol)3-偕二硝甲基-1,2,4-三唑钾盐、8.0 mL乙腈加入到烧瓶中,然后分批向体系中加入0.25 g(1.49 mmol)二氟化氙,加完后在25 ℃保持反应48 h,过滤,滤液蒸干溶剂、干燥得3-氟偕二硝甲基-1,2,4-三唑0.077 g,收率为56.6%,纯度为98.0%(HPLC)。
1H NMR(DMSO-d6, 500 MHz)δ: 8.961(s, 1H, CH), 9.061(s, 1H, NH);13C NMR(DMSO-d6, 125 MHz)δ: 124.68, 147.18, 153.09;19F NMR(DMSO-d6, 470.5MHz)δ: -95.25; IR(KBr,ν/cm-1): 3142, 2908, 1520, 1463, 1348, 1314, 1267, 1052; Anal.calcd for C3H2N5O4F(%): C 18.86, H 1.06, N 36.65; found C 18.83, H 1.11, N 36.72; MS(ESI-)m/z: 190[M-H]-。
2.4 FDNMT的单晶培养
称取0.1 g纯度大于98.0%的3-氟偕二硝甲基-1,2,4-三唑样品,将其分散于适量的无水乙腈中,加热至40℃使其完全溶解,得到无色澄清溶液,冷却至室温,过滤出不溶物,滤液置于干净的烧杯中,室温(20~25 ℃)下缓慢挥发7天,得到无色晶体,挑选合适尺寸的单晶颗粒进行晶体结构测试。
2.5 FDNMT晶体结构测定
选取尺寸为0.33 mm×0.26 mm×0.14 mm的单晶,在 Smart APEXⅡCCD衍射仪上,用Mo Kα射线(λ=0.71073 nm)、石墨单色器。在296(2) K温度下,以ω扫描方式扫描,扫描范围: 1.05°≤θ≤25.10°,-8≤h≤8,-11≤k≤11,-46≤l≤41,共收集衍射点12967个,其中独立衍射点2522个,选取I>2σ(I)的2522个点用于结构的测定和修正,全部数据均经Lp因子和半经验吸收校正,所有计算均用SHELXTL—97程序包[15]完成。
3 结果与讨论
3.1 合成条件优化
在碱性条件下,3-氰基-1,2,4-三唑与盐酸羟胺反应生成3-偕胺肟基-1,2,4-三唑,实验中分别考察了3-氰基-1,2,4-三唑与盐酸羟胺摩尔比(n1∶n2)、反应温度、pH值和反应时间对合成3-偕胺肟基-1,2,4-三唑反应收率的影响。结果见表1,由表1确定该反应的较佳合成条件为: 3-氰基-1,2,4-三唑/盐酸羟胺的料比为1∶1.15,反应温度为60 ℃,pH值为8,反应时间为2 h,收率为49.0%。
表1合成条件对收率的影响
Table1Influence of synthetic conditions on yield
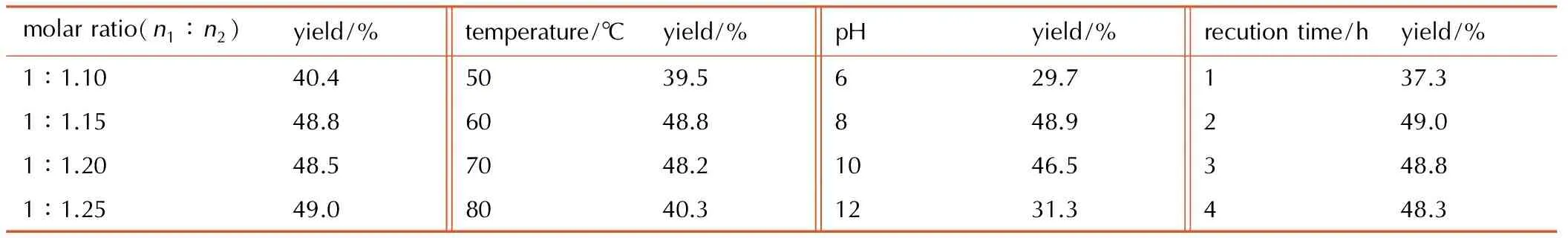
molarratio(n1∶n2)yield/%temperature/℃yield/%pHyield/%recutiontime/hyield/%1∶1.1040.45039.5629.7137.31∶1.1548.86048.8848.9249.01∶1.2048.57048.21046.5348.81∶1.2549.08040.31231.3448.3
3.2 FDNMT晶体结构解析
FDNMT晶体的分子结构和分子在晶胞中的堆积分别如图1、图2所示。测试结果表明,该晶体为正交晶系,空间群为Pbcn。晶体学参数为:a=7.4821(11) Å,b=9.8106(15) Å,c=38.683(6) Å,α=β=γ=90°,V=2839.5(7) Å3,Z=16,μ=0.178 mm-1,F(000)=1536,CCDC号: 1434789。该晶体结构由Patterrson直接法解出,原子位置均由差值Fourier合成法得到。分子结构用235个参数,由块矩阵最小二乘法进行优化(对于氢原子采用各向同性热参数,对于非氢原子采用各向异性热参数)。对于I>2σ(I)数据的最终偏差因子R1=0.0796,wR2=0.2402; 对所有数据的偏差因子R1=0.0823,wR2=0.2437,最佳拟合度s=1.000,最终差值电子云密度的最高峰为539 e·nm-3,最低峰为-675 e·nm-3。
由图1和图2可知,在一个FDNMT晶体单胞中包含两个FDNMT分子,其中F(1)—C(1)—C(2)—N(3)、F(1)—C(1)—C(2)—N(4)、F(2)—C(4)—C(5)—N(8)和F(2)—C(4)—C(5)—N(9)的二面角分别为-178.8(4)°、0.4(5)°、-2.1(5)°和-179.0(3)°,表明氟-碳键和三唑环上的所有原子几乎处在同一平面; 分子中两个硝基基团与该平面的分别呈一定的夹角,且两个硝基基团以该平面近似呈镜面对称分布,如N(1)—C(1)—C(2)—N(3)、N(2)—C(1)—C(2)—N(3)、N(6)—C(4)—C(5)—N(9)和N(7)—C(4)—C(5)—N(9)的二面角分别为-58.7(5)°、58.6(5)°、59.2(5)°和-59.2(5)°; N(1)—C(1)、N(2)—C(1)、N(6)—C(4)和N(7)—C(4)键的键长分别为1.553(5)Å、1.541(5)Å、1.548(5)Å和1.547(5)Å,大于正常N—N单键(1.460 Å)的键长,这可能是由于碳原子上硝基的强吸电子效应导致的结果; 在三唑环单元中,所有的碳氮键和氮氮键的键长都处于N—N单键(1.460 Å)和NN双键(1.250 Å)、C—N 单键(1.470 Å)和CN双键(1.220 Å)之间,三唑环本身形成一个独立的共轭体系。
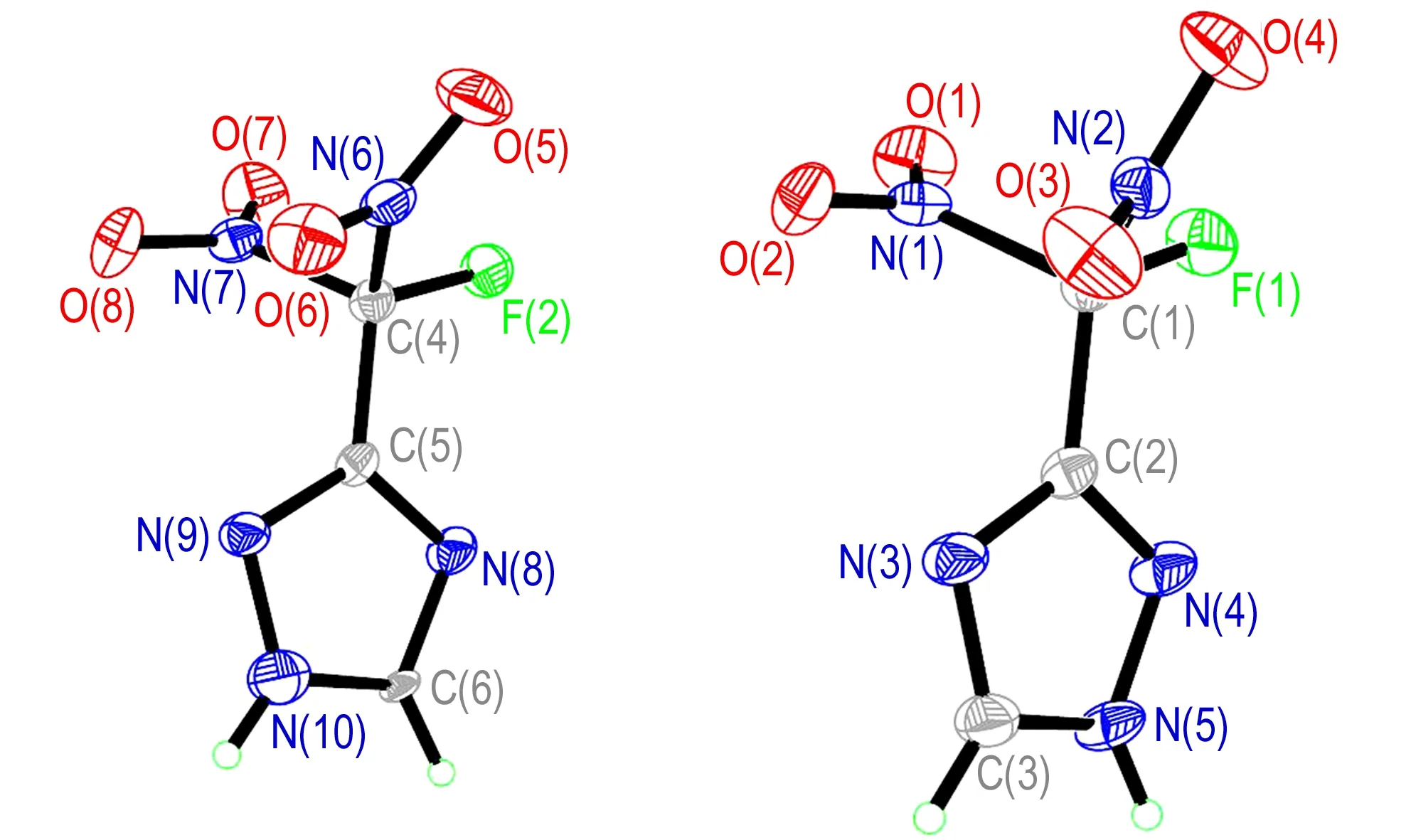
图1FDNMT的单晶结构
Fig.1Single crystal structure of FDNMT
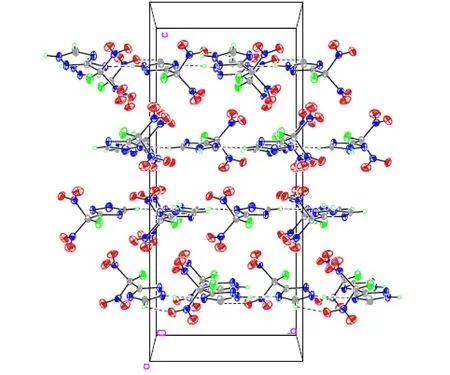
图2FDNMT的晶胞堆积图
Fig.2Packing program of FDNMT
3.3 FDNMT的性能预估
3-氟偕二硝甲基-1,2,4-三唑是一种白色粉状晶体,可溶于二甲基亚砜、N,N-二甲基甲酰胺、甲醇、乙醇等; 微溶于二氯甲烷、水、乙醚、石油醚、环己烷等。采用Gaussian 09程序[13]中的CBS-4M方法计算了该化合物的生成热,基于晶体密度和计算生成热,利用Kamlet-Jacobs爆轰方程[14]预估该化合物的爆轰性能; 采用ZBL-B撞击感度仪测试了FDNMT的感度,并与TNT、RDX的性能对比,结果见表2。
从表2可以看出,FDNMT的爆轰性能明显优于TNT,爆速和爆压等性能参数略低于RDX,而爆热明显高于TNT和RDX,撞击感度测试结果表明,FDNMT是一种较RDX更为钝感的新型含能材料。
表2FDNMT、TNT和RDX的性能比较
Table2Performance of FDNMT、TNT and RDX

compoundsρ/g·cm-3ΔHθf/kJ·mol-1D/m·s-1p/GPaQ/kJ·kg-1impactsensitivity/JFDNMT1.81-8.7836531.1561416.0TNT[16]1.65-74.0688119.0422215.0RDX[17]1.8092.6871233.753557.0

4 结 论
(1) 以3-氰基-1,2,4-三唑为原料,经肟化、重氮化-氯化、硝化、还原、氟化等反应合成了新型含能化合物——3-氟偕二硝甲基-1,2,4-三唑(FDNMT), 表征了化合物结构,培养了单晶并进行了晶体结构解析。
(2) 考察了肟化反应的影响因素,获得了最适宜的合成条件: 3-氰基-1,2,4-三唑和盐酸羟胺摩尔比为1∶1.15,pH值为8,反应时间为2 h,反应温度为60 ℃,收率为49.0%。
(3) 采用Gaussian 09程序中的CBS-4M方法和Kamlet-Jacobs爆轰方程,预估该化合物的爆轰性能,其密度1.81 g·cm-3,爆速8365.0 m·s-1,爆压31.1 GPa,生成热-8.7 kJ·mol-1,爆热为5614.4 kJ·kg-1。
参考文献:
[1] 阳世清, 徐松林, 雷永鹏. 氮杂环含能化合物的研究进展[J]. 含能材料, 2006, 14(6): 475-480.
YANG Shi-qing, XU Song-lin, LEI Yong-peng. Development on nitrogen heterocyclic energetic compounds[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2006, 14(6): 475-480.
[2] WANG Bo-zhou, ZHANG Guo-fang, HUO Huan, et al. Synthesis, characterization and thermal properties of energetic compounds derived from 3-amino-4-(tetrazol-5-yl)furazan[J].ChinJChem, 2011, 29: 2421-2427.
[3] 李玉川, 李生华, 祁才, 等. 新型多氮化合物1,1′-偶氮-1,2,3-三唑的合成与性能研究[J]. 化学学报, 2011, 69(18): 21595-2165.
LI Yu-chuan, LI Sheng-hua, QI Cai, et al. Synthesis and performance of a novel poly-nitrogen compound 1,1′-azobis-1,2,3-trizaole[J].ActaChimicaSinica, 2011, 69(18): 21595-2165.
[4] Venugopal T, Shreeve J M. Synthesis and promising properties of a new family of high-density energetic salts of 5-nitro-3-trinitrometyl-1H-1,2,4-trizole and 5,5′-bis(trinitrometyl)-3,3′-zao-1H-1,2,4-triazole[J].JAmChemSoc, 2011, 133: 19982-19992.
[5] 李亚南, 张志忠, 周彦水, 等. 3,4-双取代氧化呋咱衍生物的合成、结构表征及热性能研究[J]. 化学学报, 2011, 69(6): 701-708.
LI Ya-nan, ZHANG Zhi-zhong, ZHOU Yan-shui, et al. Study on the synthesis, structure characterization and thermal performance of 3,4-disubstituted furoxano derivatives[J].ActaChimicaSinica, 2011, 69(6): 701-708.
[6] Gao H, Shreeve J M. Azole-based energetic salts[J].ChemRev, 2011, 111: 7377-7436.
[7] Liu L, Zhang Y, Zhang S,Fei T. Heterocyclic energetic salts of 4,4′,5,5′-tetranitro-2,2′-biimidazole[J].JEnergMater, 2015, 33: 202-214.
[8] Yongxing Tang, Chunlin He, Haixiang Gao, et al. Energized nitro-substituted azoles through ether bridges[J].JMaterChemA, 2015, 3: 15576-15582.
[9] Joo Y H, Shreeve J M. Nitroimino-tetrazolates and oxy-nitroimino-tetrazolates[J].JAmChemSoc, 2010, 132: 15081-15090.
[10] Xin Yin, Jin-Ting Wu, Xin Jin, et al. Nitrogen-rich salts of 1-aminotetrazol-5-one: oxygen-containing insensitive energetic materials with high thermal stability[J].RSCAdv, 2015, 5: 60005-60014.
[11] Lianjie Zhai, Xuezhong Fan, Bozhou Wang, et al. A green high-initiation-power primary explosive: synthesis, 3D structure and energetic properties of dipotassium 3,4-bis(3-dinitromethylfurazan-4-oxy)furazan[J].RSCAdv, 2015, 5: 57833-57841.
[12] Chunlin He, Shreeve J M. Potassium 4,5-bis(dinitromethyl)furoxanate: a green primary explosive with a positive oxygen balance[J].AngewChemIntEd, 2016, 55: 772-775.
[13] Frisch M J, Trucks G W, Schlegel H B, et al. Gaussian 09[CP], Gaussian, Inc., Wallingford CT, 2009.
[14] Hariharan P C, Pople J A. Influence of polarization functions on molecular-orbital hydrogenation energies[J].TheorChimActa, 1973, 28: 213-222.
[15] Sheldrick G M. SHELXTS-97, Program for crystal structure solution[CP], University of Göttingen, Germany, 1997.
[16] Zhang Y Q,Guo Y, Joo Y H, et al. 3,4,5-Trinitropyrazole-based energetic salts[J].ChemEurJ, 2010, 16: 10778-10784.
[17] Mayer R,Köhler J, Homburg A. Explosive. 6th ed[CP]. Weinheim, Germany, Wiley-VCH, 2007.
