4,4′-二(氯偕二硝基甲基)-3,3′-偶氮呋咱的晶体结构和热稳定性
2017-05-07杨红伟程广斌范桂娟
顾 昊, 马 卿, 杨红伟, 程广斌, 范桂娟
(1. 南京理工大学化工学院, 江苏 南京 210094; 2. 中国工程物理研究院化工材料研究所, 四川 绵阳 621999)
1 引 言
随着国防、科技及工业发展的需要,各国对高能低感含能材料的研究日益增多[1-3]。在新型高能低感含能材料的开发与设计中,高氮化合物拥有高氮低碳氢含量的特性,既能提高材料密度,又易实现氧平衡[4],成为含能材料研究者关注的焦点。其中,呋咱五元氮氧杂环对设计含C、H、O、N的高能低感化合物是一个非常有效的结构单元。以呋咱环为母体的化合物往往有较高的生成热[5],且氮杂芳环体系能形成类苯结构的大π键,具有环共面性,增加结构稳定性和堆积密度[6]。以呋咱结构单元为基础的含能材料衍生设计与构筑合成,已成为新型高能低感含能材料发展的重要方向。
目前国内外对多硝基致爆修饰偶氮呋咱的关注多存在于偕二硝基钾盐类、硝仿类、氟偕二硝基类呋咱化合物。而作为至关重要的中间体——氯偕二硝基取代偶氮呋咱,却很少有对其结构与性能的关注。其原因是大多数氯偕二硝基化合物难以培养单晶获得单晶结构,缺少性能预测的关键参数。作为重要的中间体,有必要对其结构与性能进行分析研究,以便为进一步的研究工作提供参考。
本研究以4,4′-二氰基-3,3′-偶氮呋咱为原料制得4,4′-二(氯偕二硝基甲基)-3,3′-偶氮呋咱(BCNAF),经过多次尝试,以甲醇作为溶剂成功培养出了该化合物的单晶。并利用X-射线单晶衍射仪对其单晶进行了分析,采用差示扫描量热分析研究对其热性能进行了测试。将结果与类似结构化合物经行比较,说明氯偕二硝基取代杂环化合物的具有进一步研究和应用的前景。
2 实验部分
2.1 仪器与试剂
试剂: 50%羟胺水溶液、亚硝酸钠、三氟乙酸酐为分析纯,购自阿拉丁试剂; 浓盐酸购自成都科龙试剂有限公司; 100%纯硝酸为自制,4,4′-二氰基-3,3′-偶氮呋咱为自制(纯度>99%)。
仪器: 瑞士Mettler Toledo公司差示扫描量热-热重联用仪(TGA/DSC1); XRD单晶衍射采用Bruker SMART APEX II CCD面探X射线单晶衍射仪。
2.2 BCNAF单晶培养
以4,4′-二氰基-3,3′-偶氮呋咱为原料,根据文献[13]制备得到BCNAF。合成路线如Scheme 1所示。
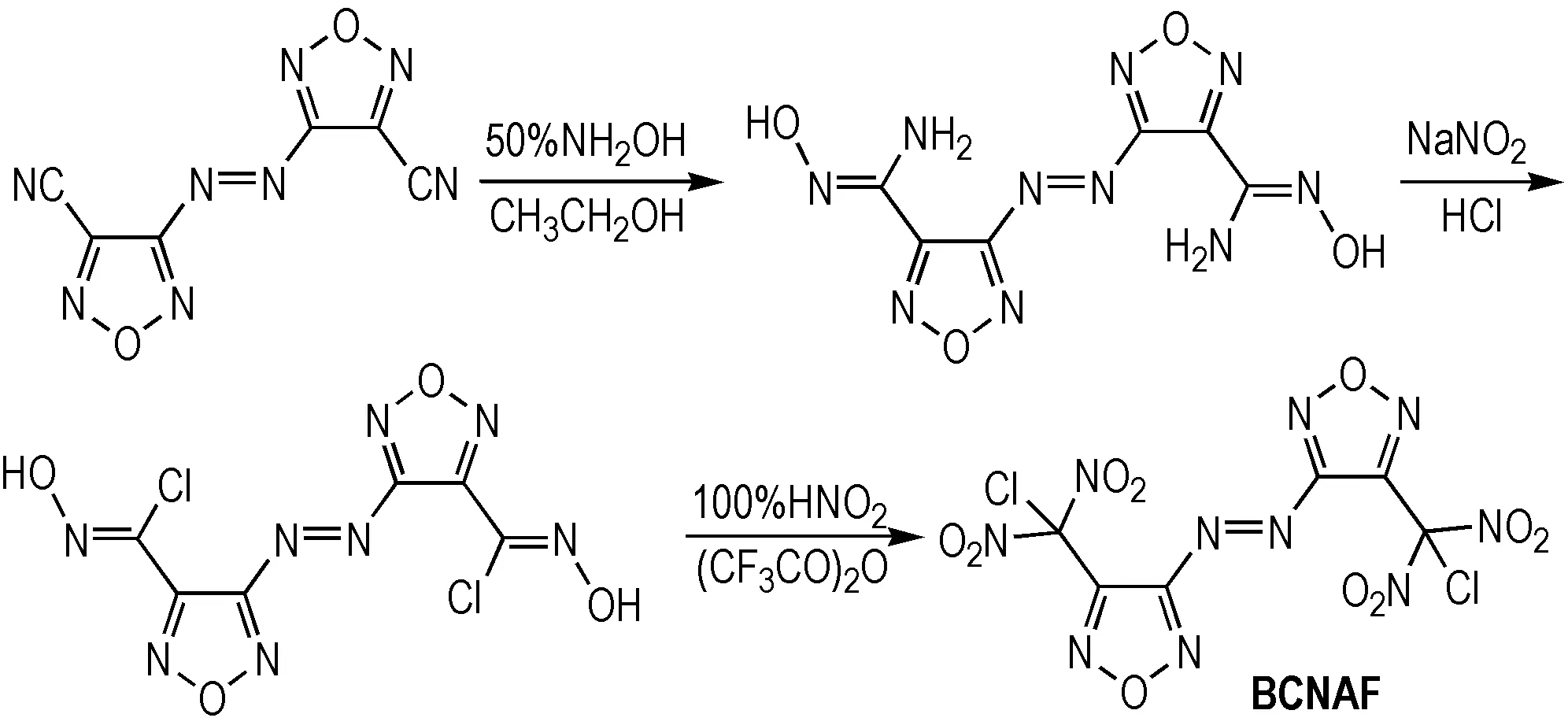
Scheme1Synthesis route of compound BCNAF[13]
取适量BCNAF,先后分别以氯仿、无水乙醇、丙酮、乙腈、无水甲醇为溶剂,进行单晶培养。采用溶剂挥发法,适当降低挥发速度,室温下自然挥发三天。最后在无水甲醇中获得不含溶剂的黄色块状单晶。
3 结果与讨论
3.1 BCNAF的单晶结构表征与分析
选取尺寸为0.180 mm×0.140 mm×0.100 mm的单晶,采用X射线单晶衍射仪进行解析。收集数据如表1所示。该单晶数据被英国剑桥晶体学数据库收录(CCDC号: 1526856)。
表1BCNAF的晶体学数据
Table1Crystallography data and refinement parameters of BCNAF

empiricalformulaC6C12N10O10formulamass443.06temperature/K293(2)wavelength/Å0.71073crystalsystemMonoclinicspacegroupP21/na/Å7.5846(14)b/Å8.4227(15)c/Å12.324(2)α/(°)90β/(°)90.880(4)γ/(°)90V/Å3787.2(2)Z2Dc/g·cm-31.869F(000)440indexranges-8≤h≤9,-8≤k≤10,-9≤l≤14reflectionscollected4334data/restraints/parameters1457/0/127goodness⁃of⁃fitonF21.072finalRindices[I>2δ(I)]R1=0.0558,wR2=0.1356Rindices(alldata)R1=0.0697,wR2=0.1458largestdiff.peakandhole0.449and-0.301e.Å-3
结晶后的BCNAF为黄色的块状晶体。其分子结构如图1所示,晶胞堆积如图2所示。部分键长、键角、扭转角数据列于表2至表4中。
表2中,氯偕二硝基的基团中的Cl(1)—C(3)键、N(4)—C(3)键和N(5)—C(3)键键长分别为1.716(3)Å,1.563(4)Å,1.533(4)Å。其中,C—Cl的键长最长。另外,4,4′-二(氟偕二硝基甲基)-3,3′-偶氮呋咱中的C—F键长1.383Å[14],比BCNAF中的C—Cl的键长要短。这说明,氯偕二硝基中的C—Cl易于断裂离去,这有利于偕二硝基化合物进行成盐、取代等一系列反应,进一步修饰含能分子,从而获得其他新型多硝基致爆含能材料。同时,由晶胞堆积图可知(见图2),分子间存在卤键作用,主要是Cl…N键(3.223 Å)与Cl…O键(3.108 Å)的作用。卤键的存在可以提高化合物的稳定性,在一定程度上可以缓解偕二硝基的引入对于化合物整体感度的影响[19-20]。
从表3可以看出,BCNAF中的呋咱环的键长都在1.32 Å左右,这说明键长趋于平均化,这与呋咱的芳香性一致; 由表4的键角数据可以看出,N(3A)—N(3)—C(1)—N(1)与N(3A)—N(3)—C(1)—C(2)的扭转角分别174.1(3)°和-8.0(5)°,这说明偶氮键和呋咱环近似处于一个平面。再结合O(1)—N(2)—C(2)—C(3)的扭转角-176.6(3)°可知偕二硝基的C也与呋咱环和偶氮键近似共平面。由图1可以看出,化合物BCNAF的分子结构高度对称,两个具有芳香性的呋咱母体环和偶氮键构成的平面结构,有利于分子的紧密堆积。图2中BCNAF的晶胞堆积图可以看出分子间的呋咱环相互有序堆积,结合分子排布的有序性可知,BCNAF分子的母体环之间存在π-π堆积作用,同时与呋咱环直接相连的偕二硝基能够降低呋咱环的电子云密度,有利于保持这种堆积的稳定性。
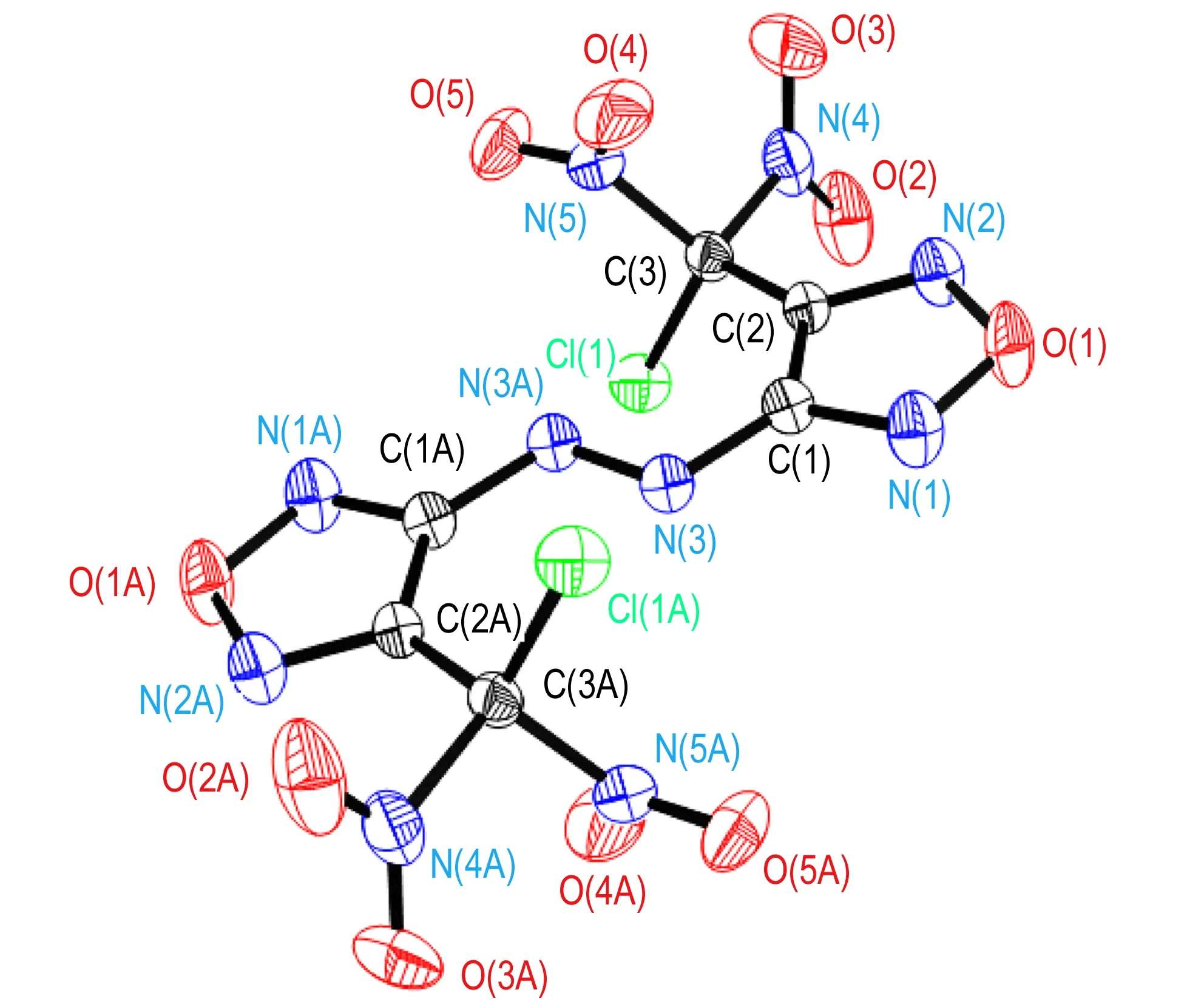
图1BCNAF的晶体结构图
Fig.1Crystal structure of BCNAF
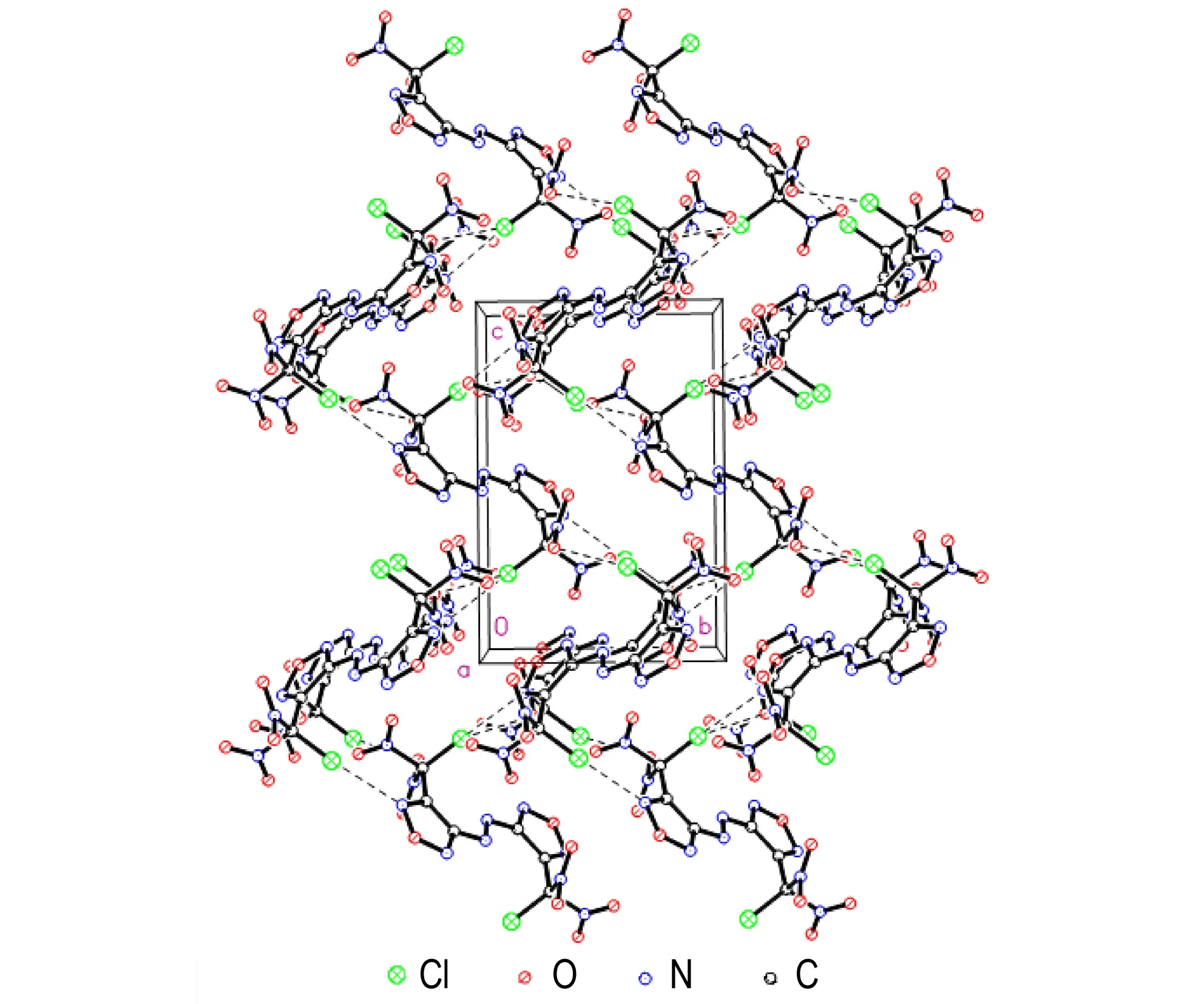
图2BCNAF的晶胞堆积图(虚线表示分子间卤键作用)
Fig.2Crystal packing map of BCNAF (Dashed line indicates the intermolecular halogen-bonding interaction)
表2BCNAF的部分键长
Table2Select bond length of BCNAF

bondlength/ÅCl(1)—C(3)1.716(3)N(1)—C(1)1.291(4)N(1)—O(1)1.357(4)N(2)—C(2)1.291(4)N(2)—O(1)1.377(4)N(3)—N(3A)a1.246(5)N(3)—C(1)1.401(4)N(4)—O(3)1.171(5)N(4)—O(2)1.210(5)N(4)—C(3)1.563(4)N(5)—O(4)1.190(4)N(5)—O(5)1.200(4)N(5)—C(3)1.533(4)C(1)—C(2)1.429(4)C(2)—C(3)1.486(4)
Note: a: -x+2, -y+1, -z+2.
表3BCNAF的部分键角
Table3Select bond angle of BCNAF
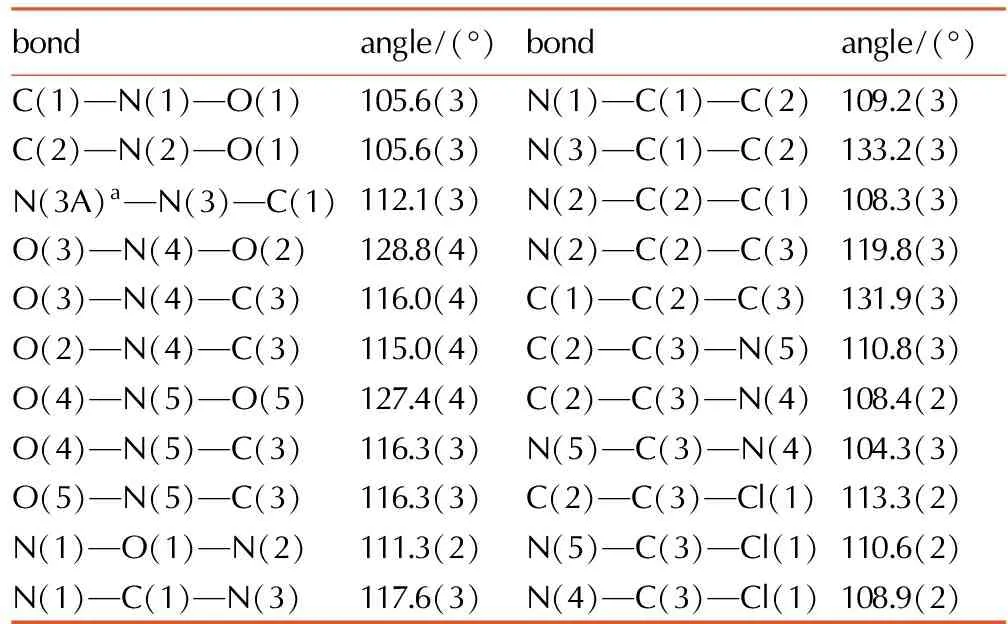
bondangle/(°)bondangle/(°)C(1)—N(1)—O(1)105.6(3)N(1)—C(1)—C(2)109.2(3)C(2)—N(2)—O(1)105.6(3)N(3)—C(1)—C(2)133.2(3)N(3A)a—N(3)—C(1)112.1(3)N(2)—C(2)—C(1)108.3(3)O(3)—N(4)—O(2)128.8(4)N(2)—C(2)—C(3)119.8(3)O(3)—N(4)—C(3)116.0(4)C(1)—C(2)—C(3)131.9(3)O(2)—N(4)—C(3)115.0(4)C(2)—C(3)—N(5)110.8(3)O(4)—N(5)—O(5)127.4(4)C(2)—C(3)—N(4)108.4(2)O(4)—N(5)—C(3)116.3(3)N(5)—C(3)—N(4)104.3(3)O(5)—N(5)—C(3)116.3(3)C(2)—C(3)—Cl(1)113.3(2)N(1)—O(1)—N(2)111.3(2)N(5)—C(3)—Cl(1)110.6(2)N(1)—C(1)—N(3)117.6(3)N(4)—C(3)—Cl(1)108.9(2)
Note: a: -x+2, -y+1, -z+2.
表4BCNAF的扭转角
Table1Torsion angles of BCNAF
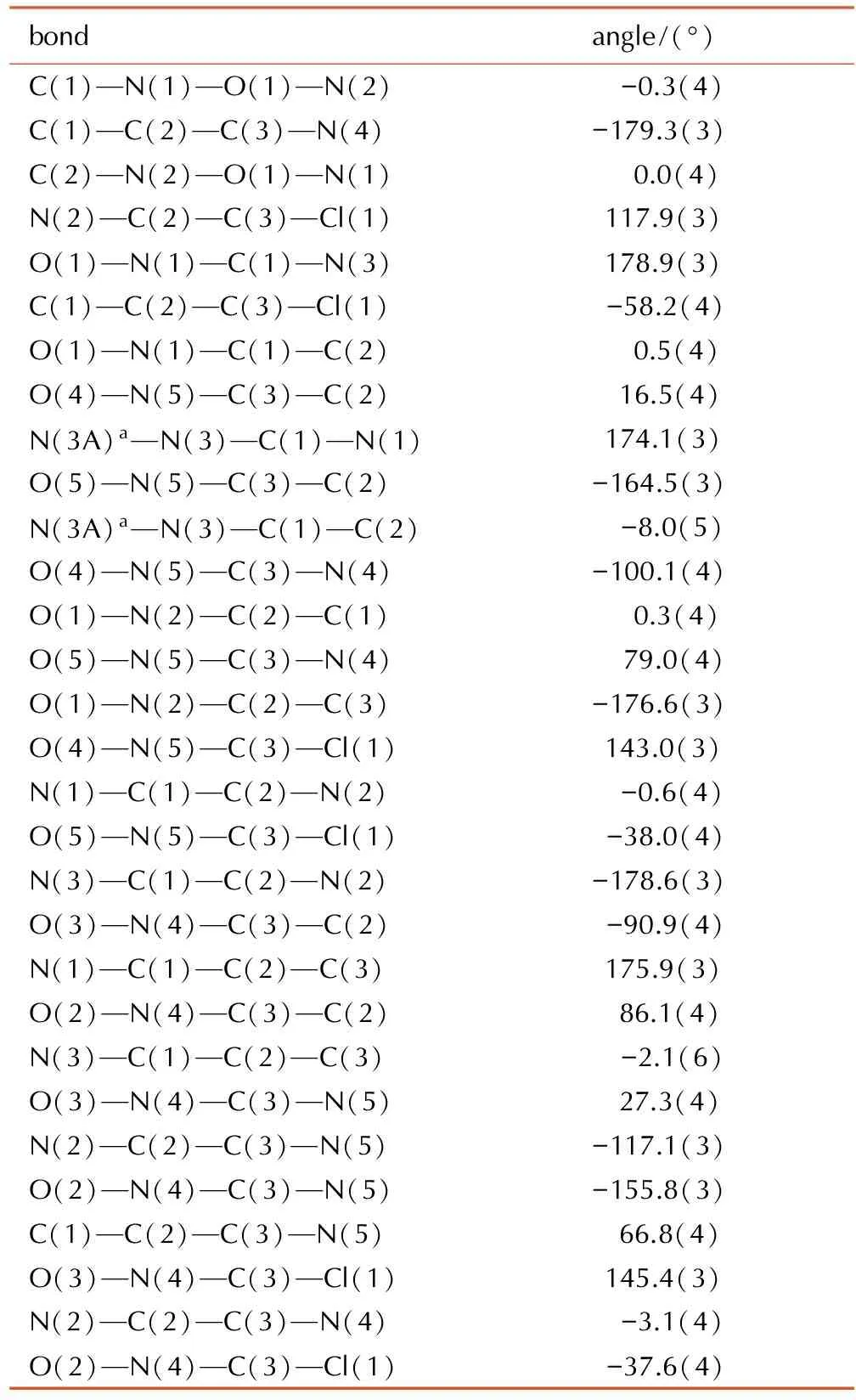
bondangle/(°)C(1)—N(1)—O(1)—N(2)-0.3(4)C(1)—C(2)—C(3)—N(4)-179.3(3)C(2)—N(2)—O(1)—N(1)0.0(4)N(2)—C(2)—C(3)—Cl(1)117.9(3)O(1)—N(1)—C(1)—N(3)178.9(3)C(1)—C(2)—C(3)—Cl(1)-58.2(4)O(1)—N(1)—C(1)—C(2)0.5(4)O(4)—N(5)—C(3)—C(2)16.5(4)N(3A)a—N(3)—C(1)—N(1)174.1(3)O(5)—N(5)—C(3)—C(2)-164.5(3)N(3A)a—N(3)—C(1)—C(2)-8.0(5)O(4)—N(5)—C(3)—N(4)-100.1(4)O(1)—N(2)—C(2)—C(1)0.3(4)O(5)—N(5)—C(3)—N(4)79.0(4)O(1)—N(2)—C(2)—C(3)-176.6(3)O(4)—N(5)—C(3)—Cl(1)143.0(3)N(1)—C(1)—C(2)—N(2)-0.6(4)O(5)—N(5)—C(3)—Cl(1)-38.0(4)N(3)—C(1)—C(2)—N(2)-178.6(3)O(3)—N(4)—C(3)—C(2)-90.9(4)N(1)—C(1)—C(2)—C(3)175.9(3)O(2)—N(4)—C(3)—C(2)86.1(4)N(3)—C(1)—C(2)—C(3)-2.1(6)O(3)—N(4)—C(3)—N(5)27.3(4)N(2)—C(2)—C(3)—N(5)-117.1(3)O(2)—N(4)—C(3)—N(5)-155.8(3)C(1)—C(2)—C(3)—N(5)66.8(4)O(3)—N(4)—C(3)—Cl(1)145.4(3)N(2)—C(2)—C(3)—N(4)-3.1(4)O(2)—N(4)—C(3)—Cl(1)-37.6(4)
Note: a: -x+2, -y+1, -z+2.
3.2 BCNAF的热稳定性
4,4′-二(氯偕二硝基甲基)-3,3′-偶氮呋咱(BCNAF) DSC曲线及TG-DTG曲线如图3、图4所示。由图3可知,在5 ℃·min-1的升温条件下,在142 ℃时有一个明显的放热峰,且峰型窄而尖,表明该化合物在142 ℃下发生了剧烈的放热分解反应。由图4 的TG曲线可知,BCNAF经历了两个失重阶段。第一阶段为100~150 ℃,样品失重63%。该阶段TG曲线较为陡峭,DTG曲线变化明显,对应图3 DSC曲线中142 ℃尖而窄的放热峰,说明化合物在这一阶段经历了剧烈的放热分解反应。第二阶段为150~450 ℃,DSC曲线在190 ℃附近出现了一个小的放热峰,样品失重22%,说明化合物分解残留物发生了进一步分解。

图3BCNAF的DSC曲线
Fig.3DSC curve of BCNAF
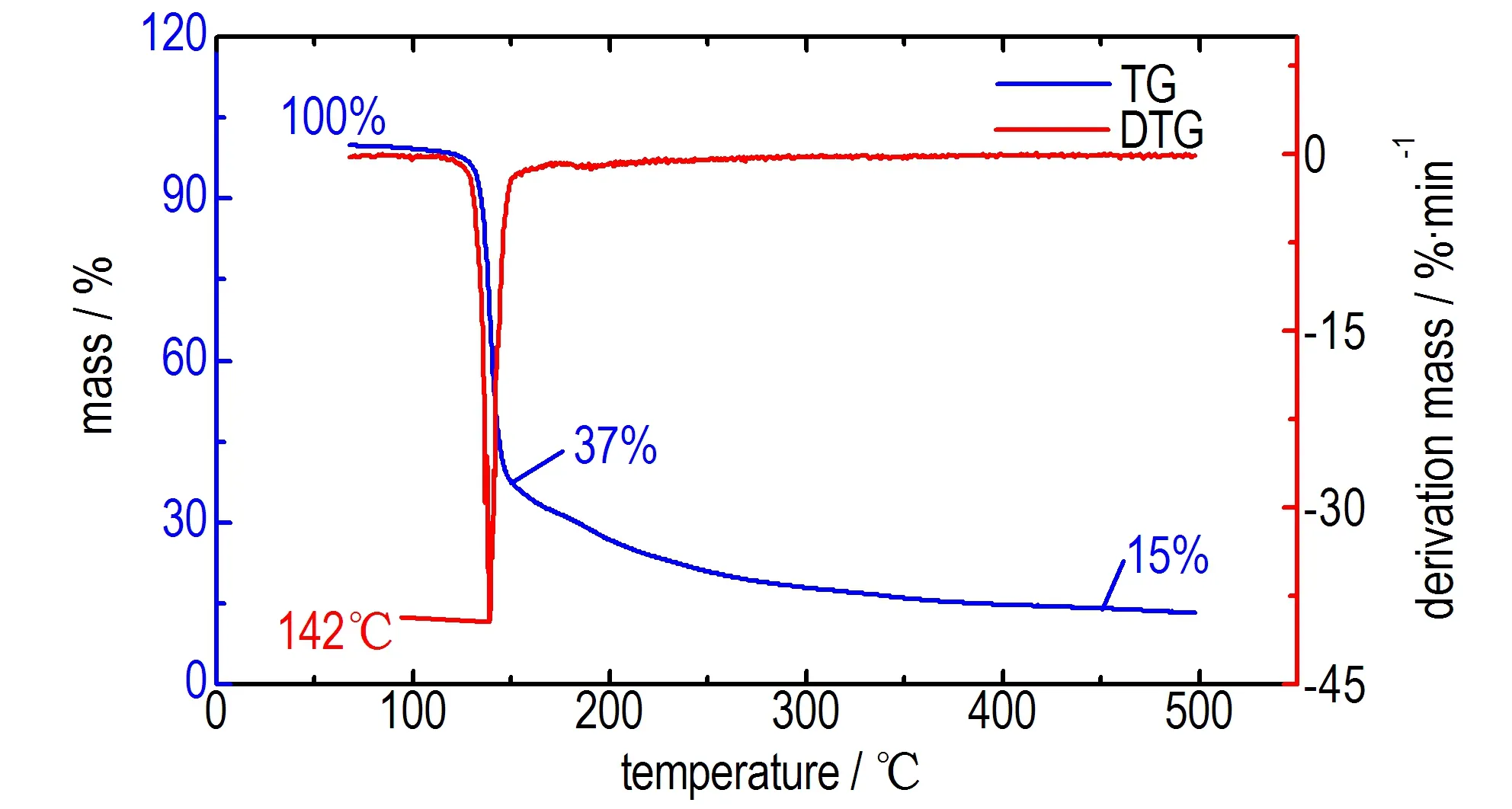
图4BCNAF的TG-DTG曲线
Fig.4TG-DTG curve of BCNAF
3.3 BCNAF的能量性质
为了研究BCNAF的爆轰性能,基于等键反应(图5)采用Gaussian 09程序[21]在B3LYP/6-31+G**//MP2/6-311++G**水平下对其标准摩尔生成热进行了计算,进一步采用EXPLO5程序[22]对其爆轰性能进行了预测,结果见表5所示。由表5可见,BCNAF的标准摩尔生成热高于RDX和4,4′-二(氟偕二硝基甲基)-3,3′-偶氮呋咱(BFNAF); BCNAF的理论爆速和理论爆压与RDX、BFNAF相当[14,23]。

Scheme2Isodesmic reaction of BCNAF
表5BCNAF和其它炸药的能量特性
Table5Energetic properties of BCNAF and other explosives

compd.ρ/g·cm-3ΔHf,solid/kJ·mol-1D/m·s-1p/GPaBCNAF1.869816.5840030.8BFNAF[14]1.865175.8849230.5RDX[23]1.8270864033.8
4 结 论
(1)以无水甲醇为溶剂,培养出BCNAF不含溶剂分子的黄色块状单晶。用X射线衍射仪检测分析其单晶结构可知,293(2) K下晶体密度为1.869 g·cm-3,单晶结构为单斜晶系,空间群为P21/n。分子结构对称,母体结构接近共平面,分子间存在卤键作用和π-π堆积作用,有利于分子稳定性和晶体密度的提高。同时,氯偕二硝基基团中较长的C—Cl键中的Cl更容易离去,为BCNAF提供进一步修饰的位点。
(2)BCNAF热分解温度为142℃。共经历了两段分解过程,在第一段100~150℃的分解过程中失重63%,第二段150~450 ℃失重22%,共失重85%。
(3)BCNAF标准摩尔生成热为816.5 kJ·mol-1,高于BFNAF,理论爆速为8400 m·s-1,理论爆压30.8 GPa,与RDX相当。
参考文献:
[1] 阳世清, 徐松林, 黄亨健, 等. 高氮化合物及其含能材料[J]. 化学进展, 2008, 20(4): 526-537.
YANG Shi-qing, XU Song-lin, HUANG Heng-jian, et al. High nitrogen compound and their energetic materials[J].ProgressinChemistry, 2008, 20(4): 526-537.
[2] Yin P, Zhang Q, Shreeve J M. Dancing with energetic nitrogen atoms: VersatileN-functionalization strategies forN-heterocyclic frameworks in high energy density materials[J].AccountsofChemicalResearch, 2016, 49(1): 4-16.
[3] 欧育湘, 刘进全. 高能量密度化合物[M]. 北京: 国防工业出版社, 2005: 5-16.
OU Yu-xiang, LIU Jin-quan. High energy density compound[M]. Beijing: National Defense Industry Press, 2005: 5-16.
[4] Chavez D E, Hiskey M A, Gilardi R D. 3,3′ -Azobis(6-amino-1,2,4,5-tetrazine): A novel high-nitrogen energetic material[J].AngewandteChemieInternationalEdition, 2000, 39(10): 1791-1793.
[5] 欧育湘. 炸药学[M]. 北京: 北京理工大学出版社, 2014: 329-330.
OU Yu-xiang. Explosive methodology[M]. Beijing: Beijing University of Technology Press, 2014: 329-330.
[6] 高莉. 呋咱类含能化合物的合成研究[D]. 南京: 南京理工大学, 2013.
GAO Li. Study on the synthesis of furazan compounds[D]. Nanjing: Nanjing University of Science and Technology, 2013.
[7] 张德雄, 张衍, 王琦, 等. 呋咱系列高能量密度材料的发展[J]. 固体火箭技术, 2004, 27(1): 32-36.
ZHANG De-xiong, ZHANG Yan, WANG Qi. Advances in high energy density matter of furazan series[J].JournalofSolidRocketTechnology, 2004, 27(1): 32-36.
[8] 范艳洁, 王伯周, 周彦水, 等. 3-3′-二氰基-4-4′-偶氮呋咱(DCAF)合成及晶体结构[J]. 含能材料, 2009,17(4): 385-388.
FAN Yan-jie,WANG Bo-zhou, ZHOU Yan-shui, et al. Synthesis and crystal structure of 3,3′-dicyano-4,4′-azofurazan[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2009, 17(4): 385-388.
[9] Hiskey M A, Chavez D E, Bishop R L, et al. Use of 3-3′-diamino-4,4′-azoxyfurazan and 3,3′-diamino-4,4′-azofurazan as insensitive high explosive materials: US134476 A1 [P], 2002.
[10] Zhang J, Shreeve J M. 3,3′-Dinitroamino-4,4′-azoxyfurazan and Its derivatives: An assembly of diverse N—O building blocks for high-performance energetic materials[J].JournaloftheAmericanChemicalSociety, 2014, 136(11): 4437-4445.
[11] Zhang J, Shreeve J M. Nitroaminofurazans with azo and azoxy linkages: A comparative study of structural, electronic, physicochemical, and energetic properties[J].JournalofPhysicalChemistryC, 2015, 119(23): 12887-12895.
[12] Yu Q, Wang Z, Yang H, et al.N-trinitroethyl-substituted azoxyfurazan: High detonation performance energetic materials[J].RSCAdvances, 2015, 5(35): 27305-27312.
[13] Tang Y, He C, Shreeve J M, et al. Potassium 4,4′-bis(dinitromethyl)-3,3′-azofurazanate: A highly energetic 3D metal-organic framework as a promising primary explosive[J].AngewandteChemieInternationalEdition, 2016, 55(18): 5565-5567.
[14] Tang Y, Gao H, Shreeve J M, et al. Energetic dinitromethyl group functionalized azofurazan and its azofurazanates[J].RSCAdvances, 2016, 6(94): 91477-91482.
[15] Shastin A V, Korsunskii B L, Godovikova T I, et al. Synthesis of 5-dinitromethyltetrazole[J].RussianJournalofAppliedChemistry, 2009, 82(10): 1802-1804.
[16] Zhang J, Dharavath S, Shreeve J M, et al. Energetic salts based on 3,5-bis(dinitromethyl)-1,2,4-triazole monoanion and dianion: Controllable preparation, characterization and high performance[J].JournaloftheAmericanChemicalSociety, 2016, 138(24): 7500-7503.
[17] Kettner M A, Karaghiosoff K, Klapötke T M, et al. 3,3′-Bi(1,2,4-oxadiazoles) Featuring the fluorodinitromethyl and trinitromethyl groups[J].ChemistryAEuropeanJournal, 2014, 20(25): 7622-7631.
[18] Li H, Gao H X, Zhao F Q, et al. Three energetic salts based on oxy-bridged bis(gem-dinitro) furazan: Syntheses, structures and thermal behaviors[J].InorganicaChimicaActa, 2014, 423(Part_A): 256-262.
[19] Landenberger K B, Bolton O, Matzger A J. Energetic-energetic cocrystals of diacetone diperoxide (DADP): Dramatic and divergent sensitivity modifications via cocrystallization[J].JournaloftheAmericanChemicalSociety, 2015, 137(15): 5074-5079.
[20] Goud N R, Matzger A J. Impact of hydrogen and halogen bonding interactions on the packing and ionicity of charge-transfer cocrystals[J].CrystalGrowth&Design, 2017, 17(1): 328-336.
[21] Frisch M J, Trucks G W, Schlegel H B, et al. Gaussian 09, Revision D.01, Gaussian[CP/DK]. Gaussian Inc., Wallingford CT, Connecticut , 2009.
[23] 欧育湘. 炸药学[M]. 北京: 北京理工大学出版社, 2014: 226-227.
OU Yu-xiang. Explosive methodology[M]. Beijing: Beijing University of Technology Press, 2014: 226-227.
