CXCL12/CXCR7生物学轴在肠型与弥漫型胃癌组织中的表达差异及意义
2017-05-03辛琪张勤张娜刘贵秋温立坤张传山战忠利
辛琪,张勤,张娜,刘贵秋,温立坤,张传山,战忠利
(1天津市第三中心医院,天津300170;2天津市滨海新区大港医院;3天津市肿瘤医院)
CXCL12/CXCR7生物学轴在肠型与弥漫型胃癌组织中的表达差异及意义
辛琪1,张勤1,张娜2,刘贵秋1,温立坤1,张传山1,战忠利3
(1天津市第三中心医院,天津300170;2天津市滨海新区大港医院;3天津市肿瘤医院)
目的 观察CXCL12/CXCR7生物学轴在肠型与弥漫性胃癌组织中的表达差异,并探讨其临床意义。方法 收集肠型胃癌组织60例、弥漫型胃癌组织55例,采用免疫组化法检测组织中的CXCL12、CXCR7,分析其与两型胃癌患者临床病理特征的关系。结果 肠型胃癌组织中CXCL12、CXCR7表达均高于弥漫型胃癌(P均﹤0.05)。在肠型胃癌中,CXCL12、CXCR7表达与肿瘤大小、浸润深度、临床分期及淋巴结、肝脏转移有关(P均﹤0.05);但在弥漫型胃癌中,仅CXCL12与浸润深度及淋巴结、卵巢转移有关(P均﹤0.05),CXCR7仅与肿瘤浸润深度有关(P﹤0.01)。结论 肠型胃癌组织中CXCL12、CXCR7表达高于弥漫性胃癌,且与淋巴结、肝脏转移有关;CXCL12/CXCR7生物学轴在肠型胃癌侵袭转移中起重要作用,可作为阻止侵袭转移的治疗靶点。
肠型胃癌;弥漫型胃癌;CXCL12蛋白;CXCR7蛋白;生物学轴
胃癌是一种高病死率的恶性肿瘤,浸润和转移是影响其预后最重要的原因。趋化因子CXCL12在胃癌的生长、侵袭和转移中起重要作用[1,2],可能是影响胃癌预后的一个独立影响因子[3]。CXCR7是近年来发现的CXCL12的一个新受体,在各种肿瘤中均有表达,并且与肿瘤的发生发展密切相关[4,5]。CXCR7通过与CXCL12结合形成生物学轴,可以调节细胞的增殖、黏附。我们之前的研究证实,CXCR7在胃癌组织中高表达,并能促进其生长、侵袭[6,7]。本研究运用免疫组化法检测CXCL12/CXCR7生物学轴在肠型、弥漫型胃癌组织的表达,并分析其与患者临床病理特征及远处转移的关系,进一步探讨CXCL12/CXCR7生物学轴作为治疗靶点的价值。
1 资料与方法
1.1 临床资料 选取2010年~2012年在天津市肿瘤医院行胃癌根治手术患者的石蜡标本115例,均经HE切片复读确认,术前未经任何针对肿瘤的治疗。按照Lauren′s分型法肠型胃癌60例,弥漫型胃癌55例(均为印戒细胞癌)。肠型胃癌中,男33例、女27例,年龄﹤56岁34例、≥56岁26例,肿瘤直径﹤5 cm 26例、≥5 cm 34例,浸润深度T1~T226例、T3~T434例,临床分期Ⅰ~Ⅱ期29例、Ⅲ~Ⅳ期31例,发生淋巴结转移31例、肝转移20例;肠型胃癌中男21例、女34例,年龄﹤56岁33例、≥56岁22例,肿瘤直径﹤5 cm 23例、≥5 cm 32例,浸润深度T1~T224例、T3~T431例,临床分期Ⅰ~Ⅱ期30例、Ⅲ~Ⅳ期25例,发生淋巴结转移25例、卵巢转移20例。同时,留取两种胃癌的转移淋巴结及肝、卵巢组织。
1.2 CXCL12、CXCR7检测方法 所有标本均经4%甲醛固定,常规石蜡包膜,4 μm连续切片。采用免疫组化SP法检测肠型胃癌、弥漫型胃癌组织及淋巴结、肝脏、卵巢组织中的CXCL12、CXCR7,CXCL12、CXCR7多克隆抗体购自美国Dako公司,快捷型酶标羊抗鼠/兔IgG聚合物及二氨基联苯胺(DAB)酶底物显色试剂盒等均购自北京中杉金桥生物技术有限公司,按试剂盒说明书操作。细胞膜或细胞质内出现淡黄至棕黄色染色为CXCR7、CXCL12阳性细胞,随机选取5个高倍镜视野(×400)进行判断。阳性细胞百分比:﹤1%计0分,1%~﹤30%计1 分, 30%~﹤60%计2 分,≥ 60%计3分;染色强度:无染色计0 分,淡黄色计1 分,棕黄色计2 分,深棕黄色计3 分。两项得分相乘< 2为阴性表达,≥2为阳性表达。
1.3 统计学方法 采用SPSS16.0统计软件。计数资料比较用χ2检验,相关性分析用Spearman等级相关。P<0.05为差异有统计学意义。
2 结果
2.1 肠型与弥漫型胃癌组织中CXCL12、CXCR7的表达比较 肠型胃癌组织中CXCL12、CXCR7阳性表达分别为38、42例,均高于弥漫型胃癌组织中的24、25例(χ2=4.418,P<0.05;χ2=7.109,P<0.01)。
2.2 CXCL12、CXCR7表达与肠型、弥漫型胃癌临床病理特征的关系 CXCR7与CXCL12的表达均与肠型胃癌肿瘤直径、浸润深度、临床分期、淋巴结转移、肝转移有关(P均﹤0.05),但与年龄、性别无关(P均>0.05)。见表1。
在弥漫型胃癌中,CXCR7表达仅与肿瘤浸润深度有关(P<0.01),而与年龄、性别、肿瘤大小、临床分期、淋巴结转移无关(P均>0.05);CXCL12表达与淋巴结转移和浸润深度有关(P均<0.05)。见表2。

表1 CXCL12、CXCR7表达与肠型胃癌临床病理特征的关系(例)
3 讨论
影响晚期胃癌预后最重要的因素就是发生转移,不同类型胃癌有不一样的分子学机制,根据各自的分子学机制来研究其靶向治疗和个性化治疗是减少胃癌病死率最有效的方法。研究发现,胃癌转移受趋化因子及其受体的调节。趋化因子是具有趋化作用的小细胞因子家族中的一类,它通过与受体结合在胚胎发育及许多恶性肿瘤的发生过程中都起关键性作用。CXCL12就是趋化因子中的一种,它在许多恶性肿瘤中表达,并能通过与其受体结合促进恶性肿瘤细胞的侵袭和转移。一直以来,CXCR4被认为是CXCL12的惟一受体;但近年研究表明,CXCR7是CXCL12的另外一个受体,并且与CXCL12的亲和性还明显高于CXCR4。同CXCL12/CXCR4生物学轴一样,CXCL12/CXCR7生物学轴在肿瘤的形成及发展和转移过程中起重要作用。
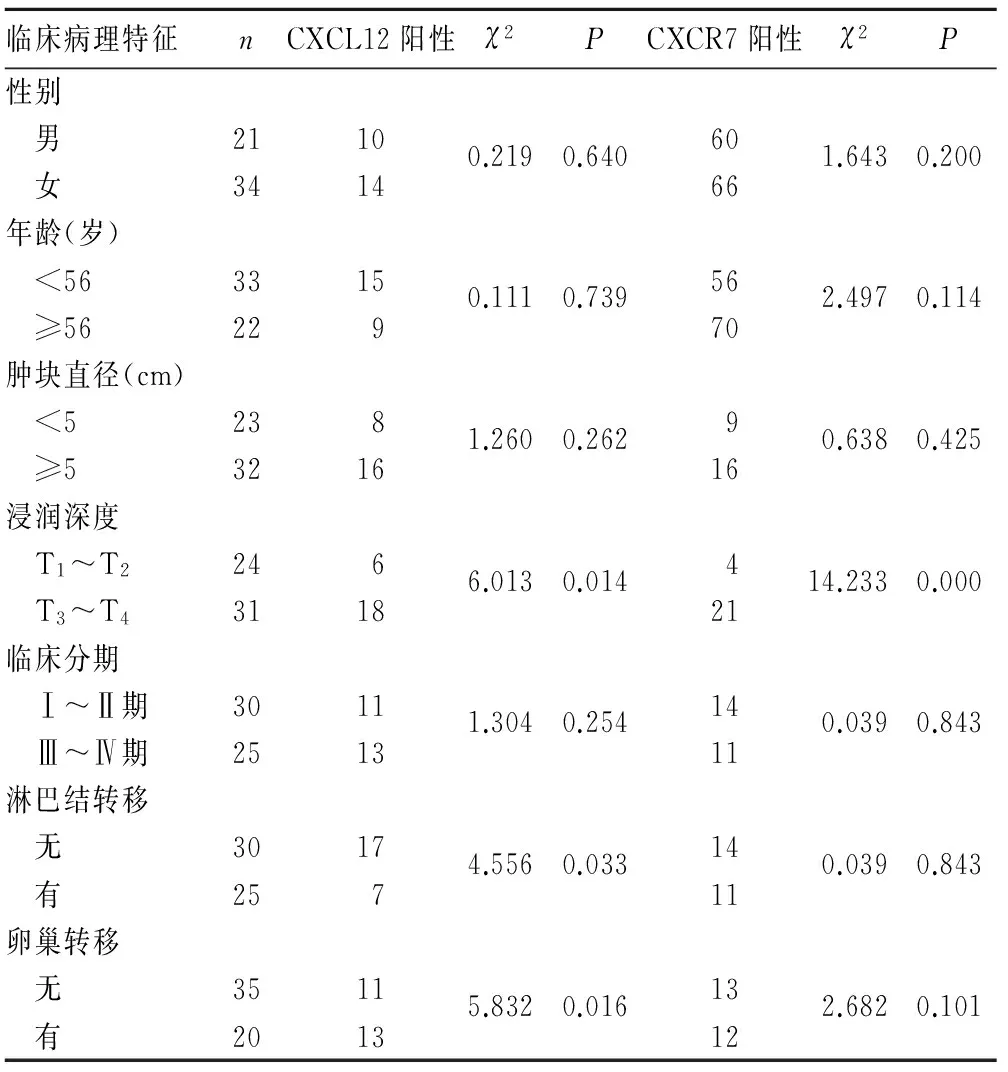
表2 CXCL12、CXCR7表达与弥漫型胃癌临床病理特征的关系(例)
CXCR7在多种不同的癌细胞表面表达,能促进肿瘤的生长,并能调节免疫、血管发生和器官特异性的转移[8,9]。我们发现,在不同分型的胃癌组织中CXCL12/CXCR7表达水平不同,肠型胃腺癌组织中CXCL12/CXCR7表达明显高于弥漫型胃癌。我们分析CXCL12/CXCR7和肠型胃癌的生物学行为发现,肠型胃癌中CXCL12/CXCR7的表达与肿瘤直径、浸润深度、临床分期有关,肿瘤直径越大、浸润深度越深、临床分期越高,CXCL12/CXCR7表达越高,提示CXCL12/CXCR7表达能够促进肠型胃癌的侵袭。但是,在弥漫型胃癌中CXCL12/CXCR7表达仅与浸润深度有关,而与其他病理特征无关。有学者[10,11]发现,皮肤鳞状细胞癌组织中CXCR7表达仅与浸润深度有关,但是在宫颈鳞状细胞癌组织中CXCL12/CXCR7表达与分化程度及淋巴结转移有关。这一现象与不同的癌组织具有不同的分子学机制有关。同时,体外研究[12]发现沉默CXCR7能抑制人肝癌细胞生长和侵袭能力。但是,目前关于CXCR7对肿瘤侵袭能力的调节机制尚有很大的争议。有研究认为,CXCR7促进肿瘤细胞侵袭并非通过增强肿瘤细胞运动能力,而是通过促进基质金属蛋白酶的分泌降解胞外基质,从而有利于肿瘤细胞的侵袭[13]。
在向远处转移的过程中,表达趋化因子受体的实体肿瘤在其配体趋化因子的引导下,向特定的靶器官转移,表现为归巢现象。其中CXCL12就是引导其归巢迁移的一个重要的趋化因子。Zhao等[14]发现,CXCL12在胃癌组织中阳性表达且与淋巴结转移有关。Iwasa等[15]也发现,在发生转移的肿瘤患者血清CXCL12水平比未发生转移者高,且与远处转移呈正相关。因此,我们推测表达CXCR7的胃癌细胞可以沿着CXCL12浓度梯度移动到相应的靶器官。淋巴结和肝脏是胃癌最常见的转移器官,本研究发现肠型胃癌CXCL12/CXCR7表达与淋巴结和肝转移都有关,提示我们在肠型胃癌中CXCL12/CXCR7生物学轴参与淋巴结、肝脏转移这一过程。 因此在肠型胃癌中CXCL12/CXCR7的表达与侵袭及远处转移有关,能够作为胃癌治疗的新靶点。其他研究显示,CXCL12的另一受体CXCR4在肠型胃癌中也能够促进淋巴结和肝脏转移[15]。但是与肠型胃癌不同,弥漫型胃癌组织中CXCL12表达与淋巴结及卵巢转移有关,但CXCR7表达仅与肿瘤浸润深度有关,并不能促进癌细胞的侵袭转移,这可能与肠型胃癌与弥漫型胃癌具有不同的分子学机制有关。在弥漫型胃癌中,CXCL12可能与另外一个受体CXCR4相互作用趋化促进淋巴结或卵巢转移。因此,在肠型胃癌中CXCL12/CXCR7生物学轴发挥了重要作用,能够促进其侵袭和远处转移,能够预测肠型胃癌的预后,靶向抑制CXCL12/CXCR7可能阻断肠型胃癌的淋巴结和肝脏转移,提示CXCL12/CXCR7生物学轴可能成为肠型胃癌治疗的新靶点。
[1] Satomura H, Sasaki K, Nakajima M, et al. Can expression of CXCL12 and CXCR4 be used to predict survival of gastric cancer patients[J]. Anticancer Res, 2014,34(8):4051-4057.
[2] Liarmako Poulos E, Theodoropoulos G, Vaiopoulou A, et al. Effects of stromal cell-derived factor-1 and survivin gene polymorphisms on gastric cancer risk[J]. Mol Med Rep, 2013,7(3):887-892.
[3] Ishigami S, Natsugoe S, Okumura H, et al. Clinical implication of CXCL12 expression in gastric cancer[J].Ann Surg Oncol, 2007,14(11):3154-3158.
[4] Xue TC, Jia QA, Bu Y, et al. CXCR7 correlates with the differentiation of hepatocellular carcinoma and suppresses HNF4α expression through the ERK pathway[J]. Oncol Rep, 2014,32(6):2387-2396.
[5] Liu Z, Teng XY, Meng XP, et al. Expression of stromal cell- derived factor 1 and CXCR7 ligand receptor system in pancreatic adenocarcinoma[J]. World J Surg Oncol, 2014,12(1):348-354.
[6] 辛琪,张娜,张传山,等.胃癌组织中趋化因子受体CXCR7的表达变化及意义[J].山东医药,2014,54(40):68-70.
[7] 张娜,辛琪,杨艳,等.CXCR7对胃癌生长、黏附及侵袭的影响[J].天津医药,2014,42(9):870-873.
[8] Kollmar O, Rupertus K, Scheuer C, et al.CXCR4 and CXCR7 regulate angiogenesis and CT26.WT tumor growth independent from SDF-1[J]. Int J Cancer, 2010,126(6):1302-1315.
[9] Luker KE, Lewin SA, Mihalko LA, et al. Scavenging of CXCL12 by CXCR7 promotes tumor growth and metastasis of CXCR4-positive breast cancer cells[J]. Oncogene, 2012,31(45):4750-4758.
[10] Hu SC,Yu HS,Yen FL, et al. CXCR7 expression correlates with tumor depth in cutaneous squamous cell carcinoma skin lesions and Promotes tumor cell survival through ERK activation[J]. Exp Dermatol, 2014,23(12):902-908.
[11] Kurban S, Tursun M, Kurban G, et al. Role of CXCR7 and effects on CXCL12 in SiHa cells and upregulation in cervical squamous cell carcinomas in uighur women[J]. Asian Pac J Cancer Prev, 2014,15(21):9211-9217.
[12] Dai X, Xiong X,Wang L, et al. Effects of CXCR7-shRNA lentiviral vector on the growth and invasiveness of human hepatoma carcinoma cells in vitro[J]. Nan Fang Yi Ke Da Xue Xue Bao, 2013,33(7):994-998.
[13] Zabel BA, Miao Z, Lai NL, et al. CXCR7 protein expression correlates with elevated mmp-3 secretion in breast cancer cells[J].Oncol Lett, 2010,1(5):845-847.
[14] Zhao BC, Wang ZJ, Mao WZ, et al. CXCR4/SDF-1 axis is involved in lymPh node metastasis of gastric carcinoma[J]. World J Gastroenterol, 2011,17(19):2389-2396.
[15] Iwasa S, Yanagawa T, Fan J, et al. Expression of CXCR4 and its ligand SDF-1 in intestinal-type gastric cancer is associated with lymph node and liver metastasis[J]. Anticancer Res, 2009,29(11):4751-4758.
天津市滨海新区卫生局医药卫生科技项目(2011BHKY021);天津市滨海新区大港区域社会发展科技项目(20120211);天津市滨海新区科技发展战略研究计划项目(2012DK15W007)。
张娜(E-mail: zhangna169@163.com )
10.3969/j.issn.1002-266X.2017.10.017
R735.2
B
1002-266X(2017)10-0052-03
2016-07-19)
