分散固相萃取结合液相色谱-串联质谱法测定饲料中8种脂溶性着色剂
2017-04-27吴银良
付 岩,朱 勇,吴银良
(宁波市农业科学研究院,浙江 宁波 315040)
分散固相萃取结合液相色谱-串联质谱法测定饲料中8种脂溶性着色剂
付 岩,朱 勇,吴银良*
(宁波市农业科学研究院,浙江 宁波 315040)
建立了饲料中8种脂溶性着色剂(对位红、苏丹红Ⅰ、苏丹红Ⅱ、苏丹红Ⅲ、苏丹红Ⅳ、苏丹红7B、苏丹红G、苏丹黄)含量的液相色谱-串联质谱测定方法。饲料样品中脂溶性着色剂经乙腈提取,离心后上清液采用分散固相萃取净化,净化液稀释后进行LC-MS/MS分析。样品测定时采用Acquity BEH C18色谱柱进行色谱分离,以0.2%甲酸溶液-乙腈作为流动相进行梯度洗脱,电喷雾正离子(ESI+)模式电离,多反应监测(MRM)模式检测,同位素稀释内标法定量。8种脂溶性着色剂在1.0~200 μg/L范围内线性关系良好,相关系数(r2)均大于0.998;在饲料中的方法检出限为5.0 μg/kg,定量下限为10 μg/kg。在10,50,500 μg/kg加标浓度下8种脂溶性着色剂的回收率为102%~111%,批内相对标准偏差(RSD)为2.8%~8.0%,批间RSD为2.8%~7.8%。该方法能满足饲料样品中脂溶性着色剂监控的需要。
分散固相萃取;饲料;脂溶性着色剂;液相色谱-串联质谱法;残留
苏丹红染料(Sudan dyes)是非生物合成亲脂性偶氮化合物,对位红(Para red)是一种常用的红色颜料,亦称对硝苯胺红,属于偶氮系列化工合成染色剂。苏丹红染料和对位红主要应用于机油、蜡、油彩、汽油等工业产品[1-2]。研究表明对位红对眼睛、皮肤和呼吸系统有刺激性[3];苏丹红Ⅰ~Ⅳ被国际癌症研究中心列为三级致癌物,苏丹红Ⅲ初级代谢产物 4-氨基偶氮苯、苏丹红Ⅳ初级代谢产物邻氨基偶氮甲苯和邻甲基苯胺均列为二级致癌物,对人可能致癌[4]。因而很多国家目前禁止苏丹红染料和对位红作为食品添加剂使用。虽然合理合规使用色素为促进我国饲料工业发展作出了一定贡献,但由于有些畜禽养殖企业或个人不遵守国家法律法规滥用色素,或非法使用未经批准的有毒工业合成颜料,给我国的动物性食品安全造成了一定的问题。因此为保障饲料和食品安全,我国农业部于2007年制定了农业行业标准NY/T 1258-2007《饲料中苏丹红染料的测定 高效液相色谱法》[5]。然而该标准中脂溶性色素仅包括苏丹红Ⅰ~Ⅳ,未包括与之性质相近的对位红和其它苏丹红染料;同时利用该标准测定时,在灵敏度和准确性方面不如普遍使用的液相色谱-串联质谱法(LC-MS/MS),因此从保障我国人民身体健康出发,建立简单、快速的测定饲料中包括苏丹红在内的脂溶性色素的分析方法具有重要意义。
目前苏丹红染料的检测方法常使用高效液相色谱法[6-7]和液相色谱-串联质谱法[8-10],主要集中在饲料[11]及鸡蛋[12]、辣椒[13]等食品,这些方法通常仅对苏丹红Ⅰ~Ⅳ进行分析,同时分析与之性质相近的对位红和其它苏丹红染料的报道较少[14-15]。在前处理手段上,常结合凝胶渗透色谱法[16]和固相萃取技术对样品进行进一步净化,如采用C18固相萃取柱、免疫亲和柱、中性氧化铝小柱等固相萃取柱进行净化[17-19],但这些方法工序复杂、操作繁琐,成本较高,而使用分散固相萃取,具有简便、快速、廉价且净化效果良好的特点。此外,使用同位素内标法定量可使结果更加准确,但目前已发表的方法中采用同位素内标稀释法进行定量分析的较少[20-21]。本研究针对现有方法存在的前处理复杂、成本高等问题,采用分散固相萃取,通过优化样品前处理及色谱-质谱条件,建立了分散固相萃取/高效液相色谱-串联质谱测定配合饲料(猪、鸡、鱼)中8种脂溶性着色剂的方法。该法可同时测定的药物种类多,灵敏度高,提取净化效果好,简化了前处理步骤,降低了成本。同时采用同位素内标法定量,有效消除了基质效应,结果准确可靠,为风险监测提供了技术支持。
1 实验部分
1.1 仪器与试剂
Waters UPLC XevoTMTQ MS超高效液相色谱-串联质谱仪(美国Waters公司),配置电喷雾离子源;IKA Vortex Genie 3旋涡振荡器(德国),低温高速离心机(德国Sigma公司)。
脂溶性着色剂标准品:苏丹红Ⅰ、苏丹红Ⅱ、苏丹红Ⅲ、苏丹红Ⅳ、对位红、苏丹红7B、苏丹红G、苏丹黄的纯度均大于95%,购自德国 Dr.Ehrenstorfer GmbH;脂溶性着色剂同位素标记标准品:苏丹红Ⅰ-D5、苏丹红Ⅱ-D6、苏丹红Ⅲ-D6、苏丹红Ⅳ-D6、苏丹红G-D3、苏丹黄-D5的纯度均大于95%,购自德国 Dr.Ehrenstorfer GmbH;乙腈(色谱纯,德国Merck公司);甲酸(色谱纯,美国Tedia公司);PSA(40~60 μm,美国Agilent公司),实验用水为 Milli-Q 超纯水。
1.2 样品前处理
1.2.1 提 取 称取饲料样品5 g(精确至0.01 g),置于50 mL聚四氟乙烯塑料离心管中,准确加入10 μg/mL的脂溶性着色剂同位素标记标准中间液100 μL,混合15 s,加入25 mL乙腈,于恒温振荡器上振荡提取30 min,离心,取上清液备用。
1.2.2 净 化 准确吸取上清液2 mL移入含50 mg PSA填料的带盖10 mL塑料离心管中,涡旋30 s后,以5 000 r/min离心3 min,取0.85 mL上清液与0.15 mL 0.2%甲酸溶液混合,过0.22 μm有机滤膜后供上机测定。
1.3 色谱-质谱条件
色谱柱:Acquity BEH C18(100 mm×2.1 mm,1.7 μm);流动相:A相为0.2%甲酸溶液,B相为乙腈;梯度洗脱条件:B相在0.5 min内保持85 %后,在2.5 min内线性增至95 %,保持1.5 min,然后在0.1 min内降至85 %,保持0.9 min;流速0.30 mL/min;进样量10 μL。
ESI源正离子模式电离;多反应监测(MRM);毛细管电压:3.8 kV;萃取锥孔电压:20 V;RF透镜电压:0.5 V;离子源温度:150 ℃;脱溶剂气温度:500 ℃;锥孔气流速:50 L/h;脱溶剂气流速:1 000 L/h;其它条件详见表1。

表1 8种脂溶性染料及其内标物的母离子、子离子、锥孔电压及碰撞能量Table 1 Precursor ions,product ions,cone voltages and collision energies of 8 fat soluble colorants and their internal standards
* quantitative ion
1.4 加标回收率实验
加标回收率实验样品处理同“1.2”,加标浓度为10,50,500 μg/kg,内标物的浓度为200 μg/kg。称样后加入标准溶液,涡旋混匀放置0.5 h后进行样品处理。
2 结果与讨论
2.1 质谱条件的优化
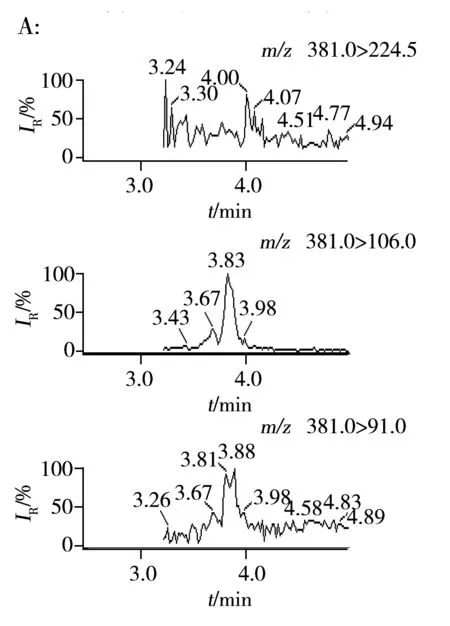
图1 空白饲料中苏丹红Ⅳ 3个子离子(A)及苏丹红Ⅱ-D62个子离子(B)的MRM色谱图Fig.1 MRM chromatograms of sudan Ⅳ(A) and sudan Ⅱ-D6(B) in blank feed
由于苏丹红和对位红分子中含有氮原子,易带正电荷,因此选择ESI+离子模式。为优化质谱条件,配制含8种着色剂浓度均为100 ng/mL的标准溶液(同时配制相同浓度的6种内标标准溶液)。利用该标准溶液在全扫描方式下,优化毛细管电压、锥孔电压、裂解温度、脱溶剂气流速等参数,得到待测物最强的分子离子峰。 在上述质谱条件下,对选定的母离子进行子离子扫描,优化碰撞能量等参数。再经仪器自带Intellistart软件优化和空白样品测定后,确定8种脂溶性着色剂和内标物的质谱条件(见表1)。其中苏丹红Ⅳ根据文献报道[13,16]及自带Intellistart软件优化后起初选择m/z381.0>91.0和m/z381.0>106.0两个离子对,但在分析时,m/z381.0>106.0离子对有一定的干扰峰存在(图1A),对低浓度(添加10 μg/kg)样品的定性定量会造成较大误差,因此本文使用灵敏度能达到要求且无干扰的m/z381.0>224.5离子。对于6个内标物质标准溶液采用同样的方法优化质谱条件,优化后苏丹红Ⅱ-D6起初选择的是m/z283.0>120.9,但经试验结果发现,所有饲料样品中该离子均存在一定的干扰(图1B),因此本实验最后选择灵敏度能达到要求且无干扰的m/z283.0>162.0离子。
2.2 色谱条件的优化
采用乙腈-水为流动相,由于苏丹红分子结构中含有偶氮基团,为了防止色谱峰拖尾和提高电离效率,在水相中加入甲酸,并参考杜振霞等[22]研究结果选择水相中添加甲酸的浓度为0.2%。本文尝试采用等度洗脱进行色谱分析,水相(含0.2%甲酸溶液)-乙腈的比例为5∶95。结果显示,采用乙腈提取液直接上样或经N-丙基乙二胺(PSA)净化后直接上样时,8种着色剂的抑制基质效应均非常强,如对位红直接上样和50 mg PSA净化后的抑制率分别达80%和50%。为减少基质抑制效应,同时简化提取净化步骤,实验尝试利用两方面措施改善基质效应:①用梯度洗脱增加洗脱时间,减少单位时间杂质量;②在上样液中加入一定的甲酸溶液,减少杂质总量。结果发现基质效应得到改善,其中对位红直接上样和50 mg PSA净化后的抑制率分别下降至50%和20%,实验最终确定的梯度洗脱条件见“1.3”。
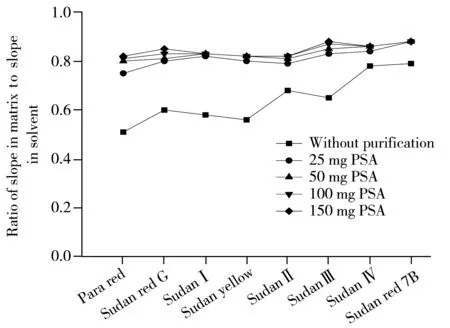
图2 不同PSA用量下8种脂溶性着色剂的基质效应Fig.2 Matrix effects of eight fat soluble colorants under different amounts of PSA
2.3 前处理条件的选择
对于食品中的苏丹红和对位红,通常采用在样品中加入乙腈、正己烷、甲醇、乙醇、二氯甲烷、丙醇、正己烷-丙酮等有机溶剂进行提取,其中前2种溶剂最为常用。而当使用乙腈提取时,溶剂与组织样品的相容性较好,渗透力强,兼有去蛋白和一定的脱脂功能,同时考虑到方法最终用同位素内标定量,为节省溶剂用量,采用5 g饲料样品(加标浓度1.0 mg/kg)考察了25 mL乙腈条件下8种脂溶性色素的提取效率(以外标法定量)。结果显示,极性越低的色素回收率相对较低,但所有着色剂的回收率均在70%以上,因此最终采用25 mL乙腈对5 g样品进行提取。经提取后未经基质分散固相萃取净化及加入不同PSA量净化的基质效应结果见图2,从图2可知未净化时各着色剂的基质抑制效应较强,当PSA用量达到50 mg及以上时,饲料的基质抑制效应已降到可接受的范围(斜率比值介于0.8~1.2之间),因此最终确定PSA的用量为50 mg。
2.4 线性实验
取10 μg/mL混合标准中间液,用0.2%甲酸-乙腈(15∶85)混合溶液逐级稀释配制浓度分别为1.0,2.0,5.0,20,50,200 μg/L的系列标准工作溶液,每个标准溶液加入100 μL用0.2%甲酸溶液-乙腈(15∶85)稀释的内标混合工作液(浓度为200 μg/L),使其内标浓度为20 μg/L。LC-MS/MS分析后以定量离子对峰面积和内标峰面积的比值为纵坐标,标准溶液浓度为横坐标,绘制标准曲线,其中苏丹红Ⅰ~Ⅳ、苏丹黄和苏丹红G分别选择苏丹红Ⅰ-D5、苏丹红Ⅱ-D6、苏丹红Ⅲ-D6、苏丹红Ⅳ-D6、苏丹黄-D5、苏丹红G-D3进行定量,对位红选择苏丹红G-D3进行定量,苏丹红7B选择苏丹红Ⅳ-D6进行定量,结果显示,各着色剂在1.0~200 μg/L范围内线性关系良好,相关系数(r2)均为0.999。
2.5 方法的回收率、精密度与检出限
以信噪比S/N=3确定8种脂溶性染料的检出限为5.0 μg/kg,以信噪比S/N=10确定其定量下限为10 μg/kg。加标回收实验每批次内同一浓度做5次平行实验,进行3次重复,因3种配合饲料(猪、鸡和鱼)的结果基本一致,仅列出猪配合饲料的结果(见表2),相关谱图见图3。结果显示,10~500 μg/kg加标浓度范围内,方法的平均回收率为102%~111%,批内相对标准偏差(RSD)为2.8%~8.0%,批间RSD为2.8%~7.8%,方法明准确度及精密度能满足饲料中8种脂溶性着色剂含量的测定要求。

表2 8种脂溶性着色剂的加标回收率及相对标准偏差Table 2 Recoveries and relative standard deviations(RSDs) of 8 fat soluble colorants in feeds
(续表2)

CompoundAdded(μg/kg)Averagerecovery(%)(n=5)Intra-assayRSD(%)Inter-assayRSD(%)SudanⅣ10,50,500110,105,1037.2,4.9,3.97.7,5.0,4.0Sudanred7B10,50,500111,109,1078.0,6.6,6.57.8,6.3,6.1SudanredG10,50,500105,104,1036.0,4.1,4.75.8,3.9,4.8Sudanyellow10,50,500105,106,1074.0,5.0,5.54.7,5.0,5.3Parared10,50,500104,105,1024.9,4.4,3.94.7,4.9,3.6
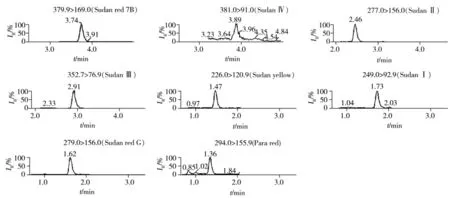
图3 饲料空白样品加标10 μg/kg的MRM色谱图Fig.3 MRM chromatograms of spiked feeds blank sample(10 μg/kg)
2.6 方法应用
采用优化后的样品前处理方法和分析条件对河北省石家庄市兽药监察所提供的阳性饲料样品进行了分析,其中苏丹红Ⅰ有检出,平均含量为17.3 mg/kg,其他7种脂溶性着色剂均未检出。
3 结 论
本文建立了饲料中8种脂溶性着色剂同时分析的同位素内标稀释/液相色谱-串联质谱方法。方法简单快速,样品经乙腈提取后进行分散固相萃取净化,净化液经稀释后即可进行仪器分析。饲料中8种着色剂在10~500 μg/kg加标浓度范围内,回收率为102%~111%,批内RSD为2.8%~8.0%,批间RSD为2.8%~7.8%。8种药物的检出限均为5.0 μg/kg,定量下限均为10 μg/kg。方法具有准确和灵敏的特点,能满足饲料中8种药物残留量的定量分析要求。
[1] Hahibi M H,Hassanzadch A,Mahdavi S.J.Photochem.Photobiol.A,2005,172(1):89-96.
[2] Nohynek G J,Fautz R,Benech K F,Toutain H.FoodChem.Toxicol.,2004,42(4):517-543.
[3] Zhou X,Li A J,Xu L M,Zhao Q S,Rong H,Chen M Y.FeedRes.(周晓,李爱军,徐立明,赵庆松,荣会,陈明岩.饲料研究),2007,3:20-23.
[4] Chen Q,Ban G F,Jia Z M,Wu N P,Song Z C,Fang Z Y,Liu S M,Qiu F N.J.Veter.Drug(陈蔷,班付国,贾振民,吴宁鹏,宋志超,方忠意,刘素梅,邱富娜.中国兽药杂志),2009,43(2):24-27.
[5] NY/T 1258-2007.Determination of Sudan Dyes in Feed by HPLC.Agriculture Professional Standard of the People's Republic of China(饲料中苏丹红染料的测定 高效液相色谱法.中华人民共和国农业行业标准).
[6] Chen N,Liu K F,Zhang Y P.J.Instrum.Anal.(陈娜,刘坤峰,张裕平.分析测试学报),2014,33(8):959-962.
[7] Zhai Y J,Cheng J H.J.Chromatogr.Sci.,2015,53(8):1333-1340.
[8] Wang L,Liu C Y,Wang Z J,Ren X D,Wu D D,You H D,Xiong S.J.Instrum.Anal.(王璐,刘成雁,王志嘉,任雪冬,吴冬冬,尤海丹,熊爽.分析测试学报),2016,35(5):526-531.
[9] Liu Z C,Yang F,Yin T K,Qian J.J.Instrum.Anal.(刘正才,杨方,尹太坤,钱疆.分析测试学报),2015,34(2):171-176.
[10] Li J,Ding X M,Zheng J X,Liu D D,Guo F,Liu H M,Zhang Y B.J.Sep.Sci.,2014,37(17):2439-2445.
[11] Cao Q L,Li R,Fang Z Y,Liu S M.FeedInd.(曹起灵,李锐,方忠意,刘素梅.饲料工业),2008,29(12):61-62.
[12] Wu N P,Peng L,Ban G F,Jia Z M,Guo F R.Chin.J.Veter.Drug(吴宁鹏,彭丽,班付国,贾振民,郭芙蓉.中国兽药杂志),2012,46(2):27-29,32.
[13] Huang X H,Liu S Y,Jin Q,Wang S T.Chin.J.HealthLab.Technol.(黄希汇,刘少颖,金铨,王姝婷.中国卫生检验杂志),2013,23(8):1875-1878.
[14] Qi Y H,Zhang H C,Xu R T,Liu J,Zhang L,Wang J P.J.Environ.Sci.HealthB,2015,50(9):645-653.
[15] Tsaia C F,Kuoa C H,Shihb D Y.J.FoodDrugAnal.,2015,23(3):453-462.
[16] Ban G F,Meng L,Wu N P,Dong Y C,Zhang F W,Du H G,Zhang C W.J.Instrum.Anal.(班付国,孟蕾,吴宁鹏,董颖超,张发旺,杜红鸽,张崇威.分析测试学报),2014,33(11):1262-1267.
[17] Wu Y L,Yang T,Zhao J,Huangfu W G,Shen J Z.FoodSci.(吴银良,杨挺,赵健,皇甫伟国,沈建忠.食品科学),2009,30(16):243-246.
[18] Zhu L X,Meng W,Qiu X M,Liu R R,Xu L,Xu F Y.Adv.Mater.Res.,2013,781/784:1694-1699.
[19] Zhang W G,Yan F,Li D N,Jiang Y,Cao Y,Huang S X.FeedRes.(张文刚,严凤,李丹妮,蒋音,曹莹,黄士新.饲料研究),2007,5:21-23.
[20] Di W S.Chin.FoodAddit.(邸万山.中国食品添加剂),2016,3:171-174.
[21] Ning X J,Wang D L,Yu C H,Lu Z Y,Zhang Y Q.J.Chin.MassSpectrom.Soc.(宁啸骏,王丁林,虞成华,陆志芸,张燕琴.质谱学报),2009,30(1):41-46.
[22] Du Z X,Sun S Q.Chin.J.Chromatogr.(杜振霞,孙姝琦.色谱),2007,25(5):705-710.
Determination of Eight Fat Soluble Colorants in Feed by Liquid Chromatography-Tandem Mass Spectrometry Combined with Dispersive Solid Phase Extraction
FU Yan,ZHU Yong,WU Yin-liang*
(The Ningbo Academy of Agricultural Sciences,Ningbo 315040,China)
A method was developed for the simultaneous determination of eight fat soluble colorants(para red,sudan Ⅰ,Ⅱ,Ⅲ,Ⅳ,sudan red 7B,sudan red G and sudan yellow) in feed by liquid chromatography-tandem mass spectrometry(LC-MS/MS) combined with dispersive solid phase extraction.The samples were extracted with acetonitrile.Then the extract was purified by dispersive solid phase extraction method with N-propylethylenediamine(PSA) sorbent.After purification,the extract was diluted with 0.2% formic acid solution.Before analysis by LC-MS/MS,the samples were separated on an Acquity BEH C18column with a mixture of 0.2% formic acid solution and acetonitrile as mobile phase under gradient elution conditions.The mass spectrometer was operated under multiple reaction monitoring(MRM) mode in the positive mode.The samples were quantified by the isotope dilution and the internal standard method.Good linearities were obtained for the eight fat soluble colorants in the concentration range of 1.0-200 μg/L with correlation coefficients more than 0.998.The recoveries of the analytes at fortified levels of 10-500 μg/kg were in the range of 102%-111%.The limits of detection and the limit of quantitation for eight fat soluble colorants were 5.0 μg/kg and 10 μg/kg,respectively.The relative standard deviations of intra-assay were between 2.8% and 8.0%.The relative standard deviations of inter-assay were between 2.8% and 7.8%.The method is suitable for the determination of eight fat soluble colorants in feed.
dispersive solid phase extraction;feed;fat soluble colorants;liquid chromatography with tandem mass spectrometry(LC-MS/MS);residue
10.3969/j.issn.1004-4957.2017.04.009
2016-09-21;
2016-11-10
O657.63;TQ047.2
A
1004-4957(2017)04-0496-06
*通讯作者:吴银良,教授级高级工程师,研究方向:农兽药残留分析方法研究,Tel:0574-89184044,E-mail:wupaddyfield@sina.com
