QuEChERS/HPLC/DAD法同时检测果蔬中多种植物激素残留
2017-04-27袁晓晴陈尚卫
朱 松,袁晓晴,戴 军,陈尚卫
(1.江南大学 食品科学与技术国家重点实验室,江南大学分析测试中心,江苏 无锡 214122;2.河南牧业经济学院,河南 郑州 450000)
QuEChERS/HPLC/DAD法同时检测果蔬中多种植物激素残留
朱 松1*,袁晓晴2,戴 军1,陈尚卫1
(1.江南大学 食品科学与技术国家重点实验室,江南大学分析测试中心,江苏 无锡 214122;2.河南牧业经济学院,河南 郑州 450000)
采用高效液相色谱法,建立了同时分析玉米素(Z)、赤霉酸(GA)、多效唑(PBZ)、4-氟苯氧乙酸(4-FPA)、4-氯苯氧乙酸(4-CPA)、吲哚-3-乙酸(IAA)、吲哚-3-丁酸(IBA)、6-苄氨基嘌呤(6-BA)、脱落酸(ABA)、萘乙酸(NAA)、氯吡脲(CPPU)、2,4-二氯苯氧乙酸(2,4-D)及2,4,5-三氯苯氧乙酸(2,4,5-T)13种植物激素含量的方法。采用含0.5%甲酸的80%乙腈进行提取,分散固相萃取吸附剂(C18和硅藻土)进行净化,选取Waters XBridge C18色谱柱,以乙腈-水为流动相进行梯度洗脱,二极管阵列检测器200~400 nm检测,外标法定量。结果表明,13种植物激素在50 min内可实现基线分离,在线性范围内的相关系数(r)为0.992 1~0.999 3;加标回收率为68.4%~95.1%;相对标准偏差(RSD)均小于5%;方法的检出限为0.005~0.020 mg/kg;定量下限为0.01~0.09 mg/kg。该方法前处理操作快速、简便,具有良好的灵敏度、精密度和回收率,适用于果蔬的质量监控。
QuEChERS;高效液相色谱(HPLC);植物激素;果蔬
植物激素是指人工合成或从微生物中提取的、外部施用于植物、可以调节植物生长发育的非营养的化学物质,使用较低浓度的植物激素即可对植物的生长发育起到促进或抑制作用[1]。近年来,植物激素的应用日益广泛。然而,植物激素与其他农药一样,在使用过程中存在潜在的安全风险。有植物激素残留的果蔬,在短期食用可能对人体影响不大,但长期食用会导致人体内分泌紊乱,影响体内的代谢平衡[2]。因此,国际食品法典委员会、欧盟、美国、日本等均对水果蔬菜中植物激素的残留限量进行了规定。我国《GB 2763-2012食品中农药最大残留限量标准》中规定PBZ,2,4-D和2,4,5-T的限量为0.5 mg/kg,NAA和CPPU的限量为0.1 mg/kg,6-BA的限量为0.2 mg/kg;国际食品法典委员会标准中规定GA3,Z,IAA和IBA的限量为0.2 mg/kg;欧盟标准中规定4-FPA和4-CPA的限量为0.2 mg/kg。目前植物激素的使用不当或滥用现象导致的食品安全问题日益增多,从食品安全的角度来看,有必要建立一种实用准确的果蔬中植物激素残留分析方法。
目前,常用的植物激素由于化学结构差异很大,因而残留分析方法也各不相同,已有的检测方法主要包括气相色谱法[3]、放射免疫法[4]、酶联免疫法[5]、毛细管电泳法[6]、液相色谱法[7-8]、色谱-质谱联用法[9-10]等。其中放射免疫法和酶联免疫法等免疫检测法由于检测过程中干扰因素较多,需继续完善,以减少交叉反应,提高测定结果的准确性;气相色谱法检测首先需要对样品进行衍生化处理,步骤较为繁琐,而且不同的植物激素采用的衍生化方法也不同,不能对多种植物激素残留进行同时检测;高效液相色谱法检测可以解决气相色谱法需衍生化的缺陷,并实现不同类型植物激素的多残留检测。而色谱-质谱联用法由于仪器较为昂贵,常用于超标样品的确证。相比较而言,液相色谱法是一种更为实用的植物激素分析方法。
对于液相色谱法而言,样品前处理决定着分析的准确性和精密度,是整个分析过程的重要步骤。QuEChERS方法具有快速、简单、成本低、有效、可靠和安全等特点,被广泛应用于水果、蔬菜和农作物中的农药残留检测[11-13]。本文选取玉米素、赤霉酸、4-氯苯氧乙酸、4-氟苯氧基乙酸、多效唑、3-吲哚乙酸、6-苄氨基嘌呤、对氯苯氧乙酸钠、脱落酸、3-吲哚丁酸、2,4-二氯苯氧乙酸、氯吡脲、2,4,5-三氯苯氧乙酸为研究对象,采用QuEChERS方法,建立了针对果蔬样品中上述13种不同植物激素的提取净化技术,并通过高效液相色谱法实现了果蔬样品中植物激素的多残留检测。
1 实验部分
1.1 仪器与试剂
Waters1525高效液相色谱仪,配有Waters 2707自动进样器和Waters2998 DAD检测器(美国Waters公司);EL204分析天平(上海梅特勒-托利多仪器有限公司);旋转蒸发仪(无锡市星海王生化设备有限公司)。
赤霉酸(GA,98.0%)、玉米素(Z,98.5%)、多效唑(PBZ,98.5%)、4-氟苯氧乙酸(4-FPA,98.5%)、4-氯苯氧乙酸(4-CPA,98.0%)、吲哚-3-乙酸(IAA,99.5%)、吲哚-3-丁酸(IBA,99.9%)、6-苄氨基嘌呤(6-BA,99.0%)、脱落酸(ABA,99.5%)、萘乙酸(NAA,98.5%)、氯吡脲(CPPU,98.7%)、2,4-二氯苯氧乙酸(2,4-D,99.0%)、2,4,5-三氯苯氧乙酸(2,4,5-T,99.0%)均购于德国Dr.Ehrenstorfer GmbH。甲醇、乙腈、甲酸(色谱纯,美国天地公司);草莓、猕猴桃等果蔬购于当地超市。
1.2 样品处理
提取:以含0.5%甲酸的80%乙腈水溶液为提取液,果蔬样品在多功能食品加工机内打成匀浆,准确称取5 g样品匀浆于50 mL离心管中,加入10 mL提取液,剧烈振荡1 min,加入6 g MgSO4和1.5 g NaAc,剧烈振荡1 min,4 000 r/min离心5 min,取上清液。
净化:在提取上清液中加入1.2 g MgSO4,400 mg C18和400 mg硅藻土,剧烈振荡30 s,4 000 r/min离心5 min,取上清液,用氮吹仪浓缩至近干,加入1.0 mL乙腈溶液复溶,超声30 s,过0.22 μm微孔滤膜,滤液供高效液相色谱仪检测。
1.3 标准溶液的配制
分别准确称取10 mg的赤霉酸、玉米素、多效唑、4-氟苯氧乙酸、4-氯苯氧乙酸、吲哚-3-乙酸、吲哚-3-丁酸、6-苄氨基嘌呤、脱落酸、萘乙酸、氯吡脲、2,4-二氯苯氧乙酸、2,4,5-三氯苯氧乙酸标准品置于10 mL容量瓶中,用80%甲醇水溶液溶解并定容后,充分混匀,配制成标准母液,置于4 ℃的冰箱内保存,逐级稀释制备成所需系列标准溶液,现用现配。
1.4 色谱条件
实验采用Waters XBridgeTMC18色谱柱(250 mm×4.6 mm,5 μm),柱温为30 ℃,二极管阵列器的检测波长为200~400 nm,采用梯度洗脱。流动相:A为乙腈-水-乙酸溶液(10∶90∶0.05),B为乙腈-水-乙酸溶液(80∶20∶0.05),梯度洗脱程序:0~40 min,20%~70 % B;40~50 min,70%~95% B;50~54 min,95% B,流速为0.9 mL/min。
2 结果与讨论
2.1 色谱条件的优化
本实验通过考察混合标准溶液的分离情况来对比不同型号C18色谱柱的效果,包括:Diamonsil C18色谱柱(250 mm×4.6 mm,5 μm)、XBridgeTMC18色谱柱(250 mm×4.6 mm,5 μm)以及GraceSmart RP 18色谱柱(250 mm×4.6 mm,5 μm),发现使用XBridgeTMC18色谱柱的分离效果最好,因此最终确定Waters公司的XBridgeTMC18色谱柱为本实验的色谱柱。
随后考察了流动相对分离的影响,直接以乙腈-水溶液作为流动相时,13种植物激素的混合标准样品不能完全分离,色谱峰拖尾严重,且峰形很差。乙酸可以抑制样品基质的电离,改善色谱峰的拖尾现象,因此流动相中需要加入乙酸[14]。本实验对流动相中乙酸的用量进行了考察,发现乙酸含量为0.05%时分离效果最佳,既能保证13种植物激素混合标样的有效分离,改善拖尾现象,也可防止流动相酸度过大而损坏色谱柱。因此最终确定流动相A为乙腈-水-乙酸溶液(10∶90∶0.05),B为乙腈-水-乙酸溶液(80∶20∶0.05),并采用梯度洗脱方式进行洗脱。
采用DAD检测器对13种植物激素进行检测,确定最佳检测波长分别为:4-氟苯氧乙酸、吲哚-3-丁酸、2,4,5-三氯苯氧乙酸的检测波长为220 nm;玉米素、赤霉酸、多效唑、吲哚-3-乙酸、6-苄氨基嘌呤、氯吡脲和2,4-二氯苯氧乙酸的检测波长为240 nm;4-氯苯氧乙酸、脱落酸和萘乙酸的检测波长为290 nm。
在优化色谱条件下,13种植物激素标样的高效液相色谱图见图1。

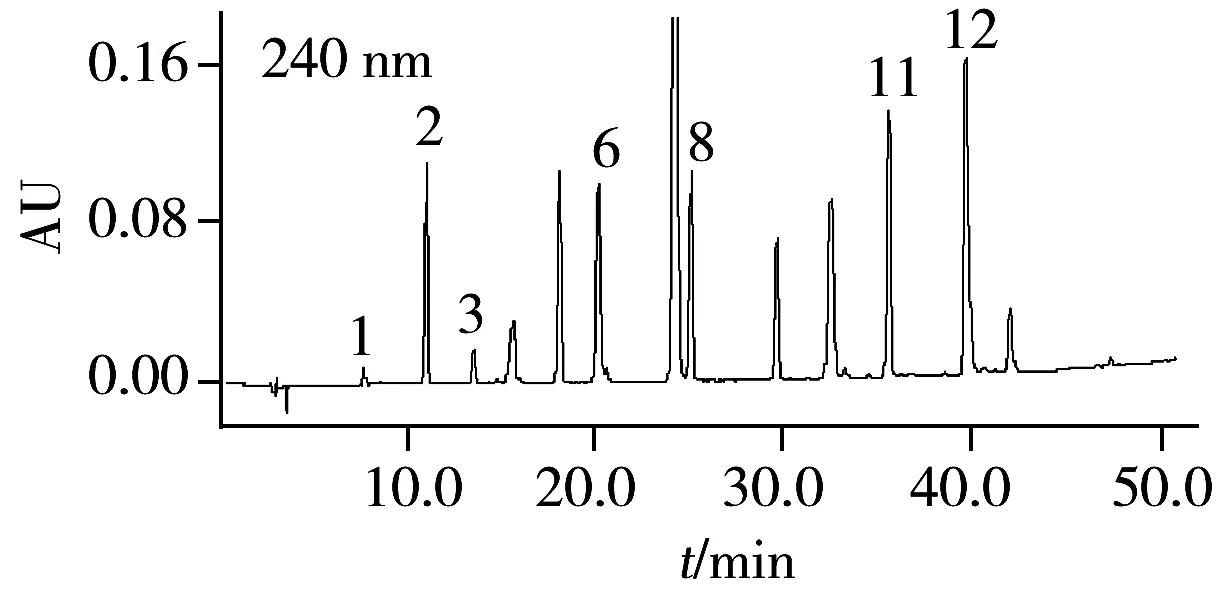
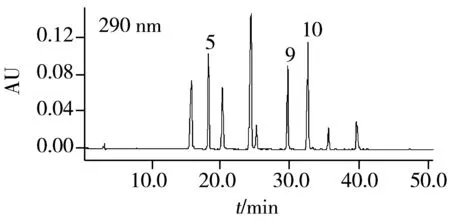
图1 植物激素标样的高效液相色谱图Fig.1 HPLC chromatograms of phytohormones standard mixture1.Z;2.GA;3.PBZ;4.4-FPA;5.4-CPA;6.IAA;7.IBA;8.6-BA;9.ABA;10.NAA;11.CPPU;12.2,4-D;13.2,4,5-T
2.2 样品提取条件的优化
根据13种植物激素的化学性质和已有文献报道[15-16],本实验考察了4种提取溶剂(80%乙腈,80%甲醇-0.5%甲酸,80%乙腈-0.5%甲酸,乙腈-0.5%甲酸)对不同植物激素在0.5 mg/kg加标水平下的提取效果,结果显示,由于4-氟苯氧乙酸、脱落酸、4-氯苯氧乙酸、吲哚-3-丁酸、萘乙酸、吲哚-3-乙酸、2,4-二氯苯氧乙酸和2,4,5-三氯苯氧乙酸的分子结构中均含有羧基,而酸性环境对羧基在溶液中呈现离子形态起到一定的抑制作用,所以在提取液中加入0.5%的甲酸有助于提高此类化合物的回收率。进一步比较了80%乙腈-0.5%甲酸和乙腈-0.5%甲酸的提取效果,发现对于大部分植物激素而言,80%乙腈-0.5%甲酸的回收率更好,考虑到提取目标物的极性差异,选择一个合适极性提取液是非常必要的。综合不同植物激素的回收率结果,本实验采用80%乙腈-0.5%甲酸作为提取溶剂,此时各植物激素的回收率为86.4%~105.0%。

图2 不同净化方法对植物激素的回收率比较Fig.2 Recoveries of phytohormones with different purification methods
2.3 净化条件的优化
分散固相萃取技术是QuEChERS方法的净化手段,它主要通过极性、非极性和离子相互作用选择性除去基质中的干扰组分,从而达到净化样品的目的。目前,常用的吸附剂有PSA、C18、硅藻土、中性氧化铝等。本实验比较了PSA、C18、硅藻土以及C18+硅藻土的净化效果(图2)。在使用PSA作为吸附剂时,极性较强和含有羧基的植物激素回收率较低,存在一定的吸附作用。而当采用C18作为吸附剂时,各植物激素均能得到较好的回收率,这与黄何何[17]和Cui[18]等的研究结果一致。实验过程中发现硅藻土能有效吸附果蔬提取液中的色素类物质,而对于目标化合物吸附较少,联合使用C18和硅藻土能达到更好的净化效果。因此,本文采用1.2 g MgSO4+400 mg C18+400 mg硅藻土作为吸附剂,此时,13种植物激素的回收率均高于80.4%。
2.4 方法学考察
2.4.1 线性范围、检出限及定量下限 采用优化的液相色谱分析条件对系列混合标样进行测定,13种植物激素的浓度(X,μg/mL)与对应的峰面积(Y)呈良好的线性关系,其相关系数(r2)为0.992 1~0.999 3。将3倍信噪比(S/N=3)和10倍信噪比(S/N=10)对应的样品质量浓度分别定义为该方法的检出限(LOD)和定量下限(LOQ),得13种植物激素的LOD为0.005~0.020 mg/kg,LOQ为0.01~0.09 mg/kg(见表1)。
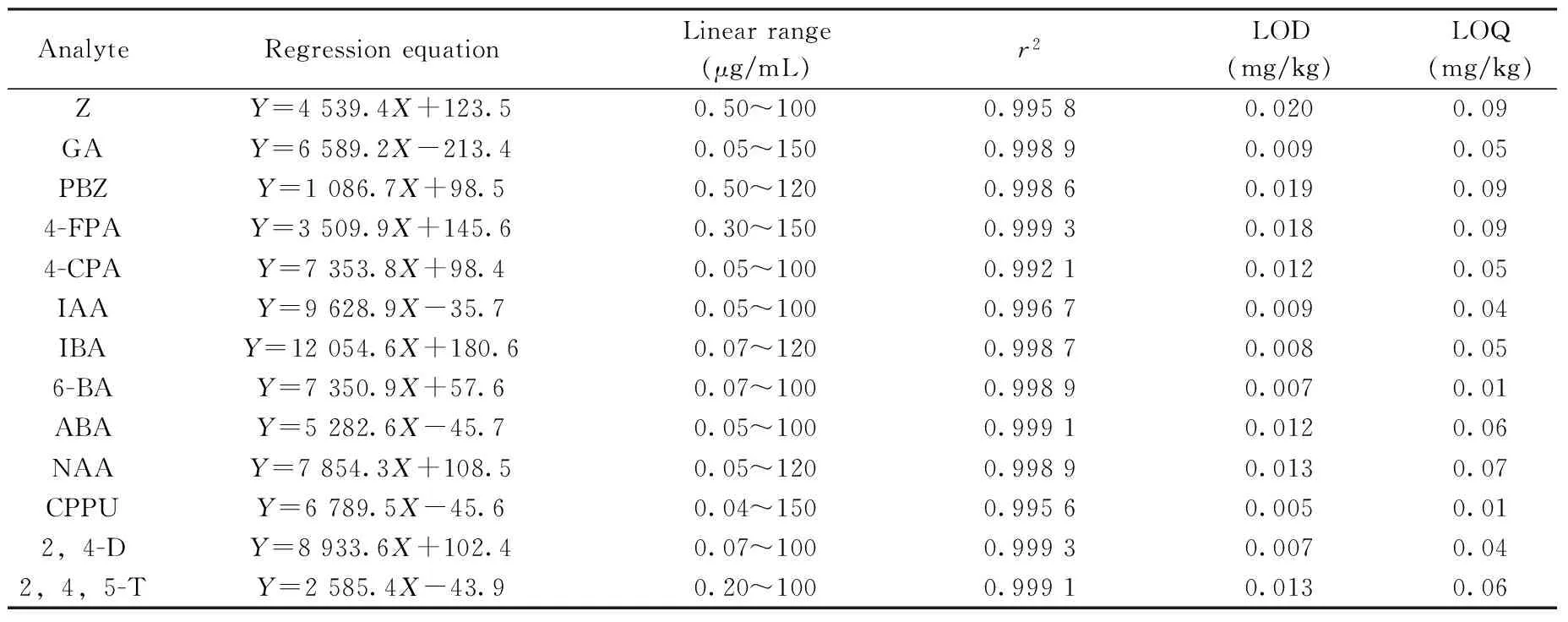
表1 13种植物激素的线性方程,检出限及定量下限Table 1 Linear equations,LODs and LOQs of 13 analytes
2.4.2 准确度与精密度 称取6份空白样品,分别添加0.3 mg/kg浓度的植物激素标准溶液,采用“1.2”方法预处理后,于同一天内上机分析,计算相对标准偏差(RSD),得到日内精密度;每日称取1份空白样品,添加0.3 mg/kg浓度的植物激素标准溶液,当天进行样品预处理和上机分析,连续测试5 d,计算RSD,得到日间精密度。由表2可知,日内精密度和日间精密度均小于5%,说明该方法精密度良好,能满足样品的检测要求。

表2 13种植物激素的回收率、精密度及稳定性实验结果Table 2 Precision,repeatability,stability and recovery of 13 analytes
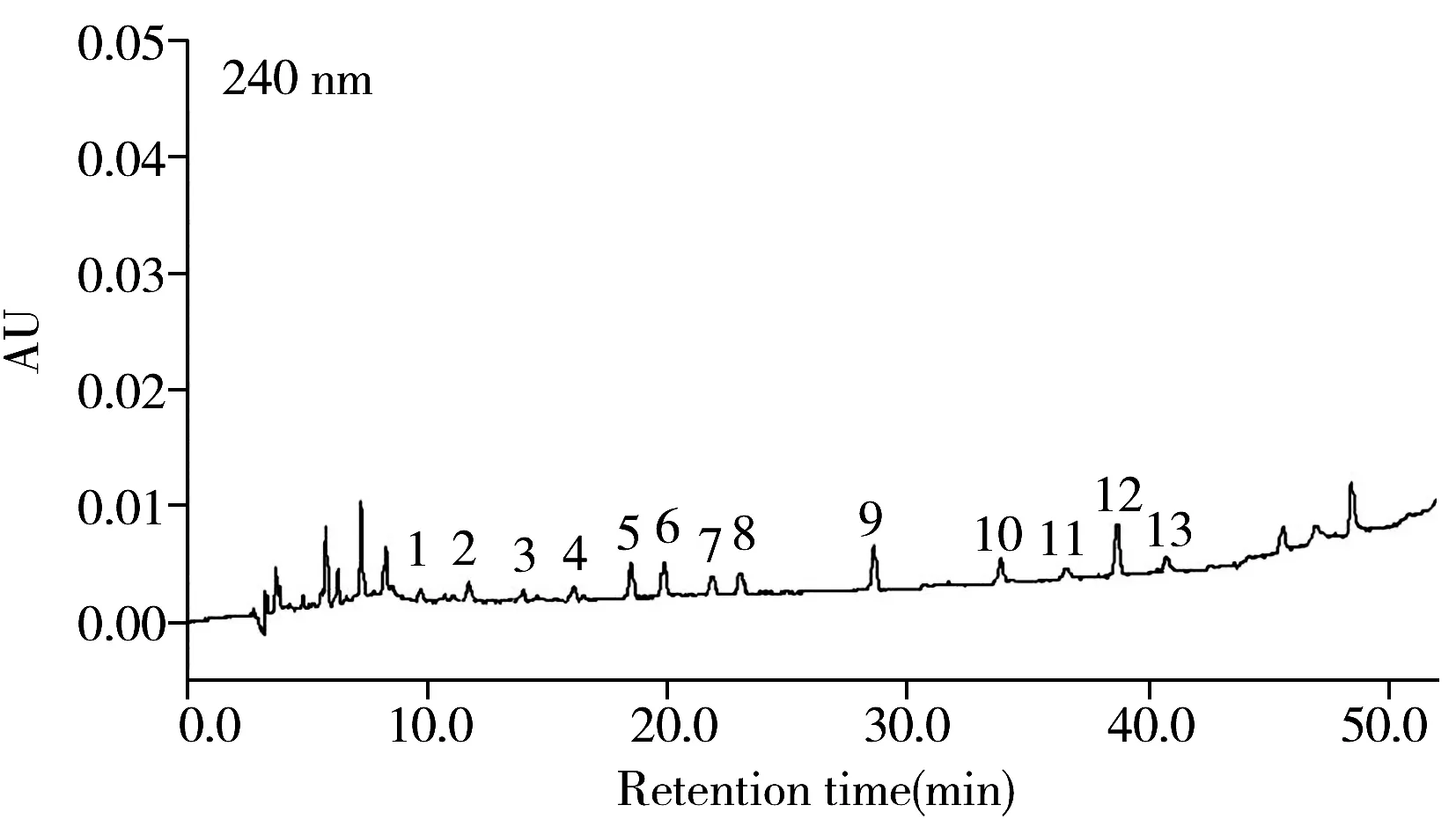
图3 草莓样品中添加0.1 mg/kg植物激素后的色谱图Fig.3 HPLC chromatogram of blank sample spiked with 0.1 mg/kg phytohormone peak numbers were the same as those in Fig.1
在空白样品中添加植物激素标准溶液,浓度均为0.3 mg/kg,预处理后每隔2 h进行测试,其RSD小于5%,说明样品在10 h内稳定性良好。重复制备样品6次进行测试,RSD小于5%,说明该方法的重复性良好。
对阴性样品进行加标回收率实验,分别取草莓、猕猴桃、豆芽样品,添加3个不同浓度(0.1,0.3,0.5 mg/kg)的植物激素标准溶液,13种植物激素的平均加标回收率为68.4%~95.1%,RSD均小于5%,方法的准确度和精密度均符合检测要求。图3为13种植物激素添加量为0.1 mg/kg的草莓样品色谱图,各植物激素在保留时间区域内无干扰,故本方法具有较好的选择性。
2.5 方法的应用
运用本文建立的方法对市售的猕猴桃、草莓、豆芽、青椒进行检测,每种果蔬样本量均为5份。结果显示,样品中均未检出此13种植物激素。
3 结 论
本文将QuEChERS净化方法与HPLC/DAD结合应用于果蔬样品中13种植物激素的同时检测,并成功应用于实际样品的测定。方法简便快速,仪器设备通用性强,能够满足我国对植物激素残留限量的要求,具有一定的实际应用价值。
[1] Shen Q Y,Lü J Z,Pan J T.J.BeijingInst.Petro-chem.Technol.(沈齐英,吕久琢,潘九堂.北京石油化工学院学报),2001,9(1):6-8.
[2] Jin M C,Chen X H,Li X P,Yao X P.Anal.Instrum.(金米聪,陈晓红,李小平,姚浔平.分析仪器),2005,(3):29-31.
[3] Du L M,Xu Q Q.Chin.J.Chromatogr.(杜黎明,许庆琴.色谱),2000,18(2):160-161.
[4] Babakov A V,Bartova L M,Margulis G U,Oganyan R R,Voblikova V D,Maisuryan A N,Dridze I L,Muromtsev G S.FEBSLett.,1994,2(351):243-245.
[5] Wang S C,Li G J,Kai X,Zhou X.ActaBot.Sin.,2001,43:1207-1210.
[6] Ji Y B,Wang C,Wu T,Ji C F.Chin.J.Chromatogr.(季宇彬,王翀,吴涛,汲晨锋.色谱),2007,25(3):322-325.
[7] Zhou Y M,Xin X.FoodSci.(周艳明,忻雪.食品科学),2010,31(18):301-305.
[8] Hayriye A,Tark A,Berrin Z,Recep Z.Talanta,2013,116:155-163.
[9] Matías M,Aurelio G,Vicent A.PlantPhysiol.Biochem.,2015,94:1-9.
[10] Ma Z,Ge L Y,Lee A,Yong J,Tan S,Ong E.Anal.Chim.Acta,2008,610(2):274-281.
[11] Han Y,Zou N,Song L,Li Y,Qin Y,Liu S,Li X,Pan C.J.Chromatogr.B,2015,1005:56-64.
[12] Luo Y,Zheng H,Jiang X Y,Li X,Zhang H F,Zhu F P,Pang Y Q,Feng Y Q.Chin.J.Anal.Chem.,2015,43(10):1538-1544.
[13] Xu G F,Nie J Y,Li H F,Yan Z,Li J.J.Instrum.Anal.(徐国锋,聂继云,李海飞,闫震,李静.分析测试学报),2015,34(12):1387-1391.
[14] Jolanta F,Magdalena P,Tomasz P,Jarogniew J.J.Chromatogr.B,2012,909:26-33.
[15] Cai B D,Ye E C,Yuan B F,Feng Y Q.J.Chromatogr.B,2015,1004:23-29.
[16] Li Y,Xu J L,Zheng L Y,Li M,Yan X J,Luo Q J.Chin.J.Chromatogr.(李艳,徐继林,郑立洋,李敏,严小军,骆其君.色谱),2014,32(8):861-866.
[17] Huang H H,Zhang J,Xu D M,Zhou Y,Luo J,Lü M L,Chen S B,Wang L Z.Chin.J.Chromatogr.(黄何何,张缙,徐敦明,周昱,罗佳,吕美玲,陈树宾,王连珠.色谱),2014,32(7):707-716.
[18] Cui K Y,Lin Y Y,Zhou X,Li S C,Liu H,Zeng F,Zhu F,Ouyang G F,Zeng Z X.Microchem.J.,2015,121:25-31.
Simultaneous Determination of Different Phytohormones Residues in Fruits and Vegetables by QuEChERS/DAD/HPLC
ZHU Song1*,YUAN Xiao-qing2,DAI Jun1,CHEN Shang-wei1
(1.Analysis & Testing Center,State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,China;2.Henan University of Animal Husbandry and Economy,Zhengzhou 450000,China)
This work describes the development of a sensitive and reliable method using QuEChERS sample preparation and high performance liquid chromatography-diode array detector(HPLC-DAD) for simultaneous determination of phytohormones, zeatin(Z), gibberellic acid(GA), paclobutrazol(PBZ), 4-fluorophenoxyacetic acid(4-FPA), 4-chlorophenoxyacetic acid(4-CPA), 3-indolyl-acetic acid(IAA), 3-indolyl-butyric acid(IBA), 6-benzylaminopurine(6-BA), abscisic acid(ABA), 1-naphthyl acetic acid(NAA), forchlorfenuron(CPPU), 2,4-dichlorophenoxyaceticacid(2,4-D), 2,4,5-trichlorophenoxyacetic acid(2,4,5-T), in fruits and vegetables.The samples were extracted with 80% acetonitrile containing 0.5% acetic acid,and the extract was cleaned up with dispersive solid phase extraction adsorbent(powder of C18and diatomaceous earth).The phytohormones were separated on a Waters XBridge C18,and eluated utilizing a gradient elution program of acetonitrile and water containing 0.05% acetic acid(by volume) as mobile phase.The correlation coefficients of calibration curves were over 0.99 in the corresponding concentration ranges.The average recoveries of the 13 analytes at three spiked concentration levels varied from 68.4% to 95.1% with relative standard deviations(RSD) less than 5%.The limits of detection(LOD) and quantitation(LOQ) were in the ranges of 0.005-0.020 mg/kg and 0.01-0.09 mg/kg,respectively.The real sample tests showed that the proposed method was simple,rapid,reliable and cost-effective,and was suitable for the simultaneous determination of phytohormones in fruits and vegetables.
QuEChERS;high performance liquid chromatography(HPLC);phytohormones;fruits and vegetables
10.3969/j.issn.1004-4957.2017.04.012
2016-09-21;
2016-11-15
食品科学与技术国家重点实验室自主科研课题;高等学校重点科研项目(15A550015);国家自然科学基金(31401532)
O657.72;O629.8
A
1004-4957(2017)04-0513-06
*通讯作者:朱 松,博士,副研究员,研究方向:食品分析,Tel:0510-85919609,E-mail:zhusong@jiangnan.edu.cn
