NaCl胁迫对两个辣椒品种幼苗叶绿素荧光参数等生理特性的影响
2017-04-26张玲,王华,周静,徐强
张 玲,王 华,周 静,徐 强
(安徽农业大学 园艺学院,安徽 合肥 230036)
NaCl胁迫对两个辣椒品种幼苗叶绿素荧光参数等生理特性的影响
张 玲,王 华,周 静,徐 强*
(安徽农业大学 园艺学院,安徽 合肥 230036)
试验以辣椒耐盐品种(强丰7301)和盐敏感品种(秋艳)为材料,以NaCl为盐胁迫处理,处理浓度分别为50、100、150、200、250 mmol·L-1,以不加NaCl为对照(CK),研究盐胁迫对辣椒幼苗叶绿素荧光参数及相关指标的影响。结果表明,与对照相比,在盐胁迫下两种辣椒品种的实际光化学效率(ФPSⅡ)、表观光合电子传递速率(ETR)、最大光化学效率(Fv/Fm)和光化学猝灭系数(qP)等指标均呈下降趋势,而非光化学猝灭系数(qN)、初始荧光(Fo)和质膜相对透性等指标均提高;在NaCl浓度0~100 mmol·L-1处理下,两种品种辣椒幼苗叶绿素和可溶性蛋白含量增大,但在NaCl浓度为150~250 mmol·L-1处理下明显减小;随着处理液浓度增加,秋艳可溶性糖含量在第5天和第10天呈现逐渐升高的趋势,在第15天和第20天先升后降;但强丰7301只在第20天呈现先增加后降低的趋势,其他时间均表现逐渐升高的趋势。试验结果说明,低浓度NaCl(0~100 mmol·L-1)胁迫对辣椒影响不明显,高浓度NaCl(150~250 mmol·L-1)胁迫对辣椒幼苗有很大影响;此外,从试验对各指标的影响发现,强丰7301受盐胁迫的影响程度小于秋艳,表现出较好的耐盐性。 表明辣椒耐盐品种具有较好的耐盐性,同时辣椒幼苗的耐盐性与盐胁迫浓度及胁迫时间密切相关。
辣椒;盐胁迫;叶绿素荧光;生理特性
随着设施园艺的兴起,土壤次生盐渍化程度不断加重,给设施作物栽培带来了很大影响[1-3]。盐胁迫能够改变植物细胞内的离子浓度和种类,降低相关酶的活性;同时也能够打破植物体内养分平衡,抑制植物的光合作用,进而对植物的生长产生影响[4-7]。盐胁迫下,茄子和黄瓜幼苗叶片质膜相对透性和叶绿素含量降低,可溶性糖和可溶性蛋白含量升高[8-10]。植物的叶绿素荧光参数对逆境的反应较为敏感,因其检测手段快速、无损伤,常作为检测逆境胁迫对植物光合器官的主要指标[9,11-14]。魏国强等[4]研究表明,盐胁迫下黄瓜的ΦPSⅡ、Fo、NPQ明显降低,Fv/Fm没有变化;葛江丽等[15]研究发现,甜高粱的ΦPSⅡ、NPQ、F0和Fv/Fm在盐胁迫下明显降低;张玲等[9]研究发现,盐胁迫下茄子幼苗的Fo、NPQ增加,Fv/Fm、qP、ФPSⅡ和ETR皆降低。辣椒是重要的设施栽培蔬菜,由于受土壤盐渍化的影响,产量逐年下降,因此,探究土壤盐渍化对辣椒的影响,了解其耐盐机制,研究如何提高辣椒产量成为园艺工作者的重要课题。本试验选取辣椒耐盐品种(强丰7301)和盐敏感品种(秋艳),研究其幼苗在盐胁迫下叶绿素荧光特性和叶绿素含量等指标的变化,为进一步了解辣椒在盐胁迫下的反应机制,积极有效地利用和开发盐碱地栽培提供参考依据。
1 材料与方法
1.1 试验材料
试验选用盐敏感品种秋艳(Qiuyan)和耐盐品种强丰7301(Qiangfeng7301)两个不同耐盐性的辣椒品种,由江淮园艺公司提供。这2个品种是通过对8个辣椒品种种子在盐胁迫下萌发能力的反应,筛选鉴定出来的[16]。
1.2 试验设计
选择籽粒饱满的秋艳和强丰7301种子,将选用的种子消毒、清洗、浸泡后放入培养皿中,每培养皿放入50粒,最后将培养皿放入(28±1)℃恒温培养箱中(DNP-9162,上海三发科学仪器有限公司)催芽[16]。待种子露白后移至营养钵中进行基质栽培(沙子∶珍珠岩∶草炭=1∶1∶1),在自然光照下进行正常管理,当辣椒两片子叶充分展开后,每隔1 d,浇灌一次1/2日本山崎营养液(甜椒配方)[16]。出苗后开始疏苗,每营养钵中保留5棵生长状况基本一致的幼苗,当辣椒幼苗长到四叶一心时,对幼苗进行NaCl处理,每个试验处理选用9盆辣椒幼苗,重复3次,分别将浓度为50、100、150、200、250 mmol·L-1的NaCl溶液加入营养液中,每隔1 d浇灌一次幼苗,以不加NaCl的全营养液为对照(CK),在试验处理后的5、10、15、20 d随机取样,进行各项指标的测定[16]。
1.3 测定项目与方法
参照孙璐等[1]方法,采用MINI-PAM 便携式叶绿素荧光仪(德国Walz公司)测定叶绿素荧光参数;采用电导率(EC)法测定叶片膜相对透性[17];采用蒽酮比色法测定可溶性糖含量[17];采用丙酮提取比色法测定叶绿素含量[17];采用考马斯亮蓝比色法测定可溶性蛋白含量[17]。
1.4 数据处理
用 Excel和SAS 9.1(SAS Institute,Cary,NC)进行数据分析和制图,用Duncan’s新复极差法对数据进行显著性方差分析。
2 结果与分析
2.1 NaCl胁迫对辣椒幼苗叶片叶绿素荧光参数的影响
2.1.1 NaCl胁迫对辣椒幼苗Fv/Fm和Fo的影响
由图1-A、B可以看出,NaCl胁迫下,两辣椒品种的Fv/Fm均呈下降趋势,且NaCl溶液浓度越大、处理时间越长,下降幅度越大。在NaCl处理过程中,秋艳的CK和50 mmol·L-1NaCl处理的Fv/Fm变化幅度较小,随着盐浓度增加和处理时间延长,Fv/Fm显著下降,100~250 mmol·L-1NaCl处理20 d 时的Fv/Fm分别比对照下降了5.70%、6.80%、9.76%、13.94%;强丰7301各处理的Fv/Fm在NaCl处理过程中变化较小,100~250 mmol·L-1NaCl处理20 d时Fv/Fm仅分别比对照下降了2.29%、3.18%、5.90%、7.00%,降幅明显小于秋艳。
图1-C、D所示,两辣椒品种的Fo总体上均呈上升趋势,且随着处理盐浓度的增加,Fo增幅加大。强丰7301的Fo增幅较小,在处理20 d时NaCl各处理分别比对照增加了0.63%、4.71%、8.55%、11.93%和17.65%;秋艳的Fo增幅较大,处理20 d时NaCl各处理分别比对照增加了8.23、11.94%、14.9%、20.56%和28.47%。
2.1.2 NaCl胁迫对辣椒幼苗ФPSⅡ和ETR的影响
两辣椒品种秋艳和强丰7301在NaCl处理下其ФPSⅡ均有所降低,且随着处理液NaCl浓度增加而降幅增大(图2-A、B)。强丰7301在50、100 mmol·L-1NaCl处理5 d时ФPSⅡ与对照相比差异不大,在15、20 d时各浓度 NaCl处理的ФPSⅡ均低于对照;秋艳的ФPSⅡ下降幅度明显大于强丰7301。NaCl处理20 d时,秋艳各处理的ФPSⅡ分别比对照下降了8.91%、20.04%、23.56%、35.25%、41.37%,而强丰7301的ФPSⅡ分别比对照下降了7.38%、9.31%、11.25%、19.68%、25.31%。
图2-C、D显示,在不同NaCl浓度胁迫下,随着处理时间延长,两辣椒品种的ETR不断下降,其中秋艳下降程度较强丰7301大。各NaCl浓度处理5 d时秋艳的ETR分别比对照下降了5.89%、11.37%、17.34%、18.68%、34.17%,而强丰7301的ETR分别比对照下降了2.18%、8.18%、13.17%、15.55%、26.78%;与对照相比,各NaCl浓度处理20 d时秋艳的ETR分别降低了17.52%、23.18%、31.64%、41.73%、57.94%,而强丰7301的ETR分别降低了14.94%、16.84%、26.45%、36.42%、46.03%。
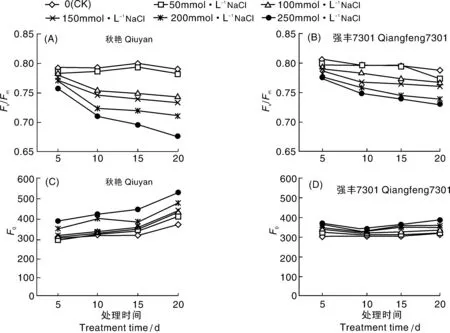
图1 NaCl胁迫对辣椒幼苗Fv/Fm和Fo的影响Fig.1 Effects of NaCl stress on Fv/Fm and Fo of pepper seedlings
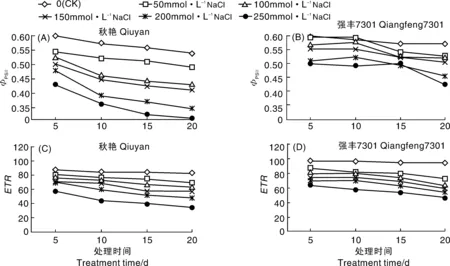
图2 NaCl胁迫对辣椒幼苗ФPSⅡ和ETR的影响Fig.2 Effects of NaCl stress onФPSⅡand ETR of pepper seedlings
2.1.3 NaCl胁迫对辣椒幼苗qN和qP的影响
由图3-A、B可知,两辣椒品种在非胁迫条件下qN变化很小,0~100 mmol·L-1NaCl胁迫下,qN皆呈上升趋势。150~250 mmol·L-1NaCl胁迫下,秋艳的qN随着处理时间的延长不断下降,而强丰7301的qN前10 d不断上升,然后开始下降,在相同条件下强丰7301的qN明显高于秋艳。
图3-C、D所示,两辣椒品种秋艳和强丰7301的qP皆呈下降趋势,且随着NaCl浓度的增加而增大。各NaCl浓度处理15 d时,秋艳的qP分别比对照降低了8.91%、10.58%、13.51%、28.83%、36.77%;而强丰7301的qP分别比对照降低了3.4%、9.58%、12.36%、18.70%、
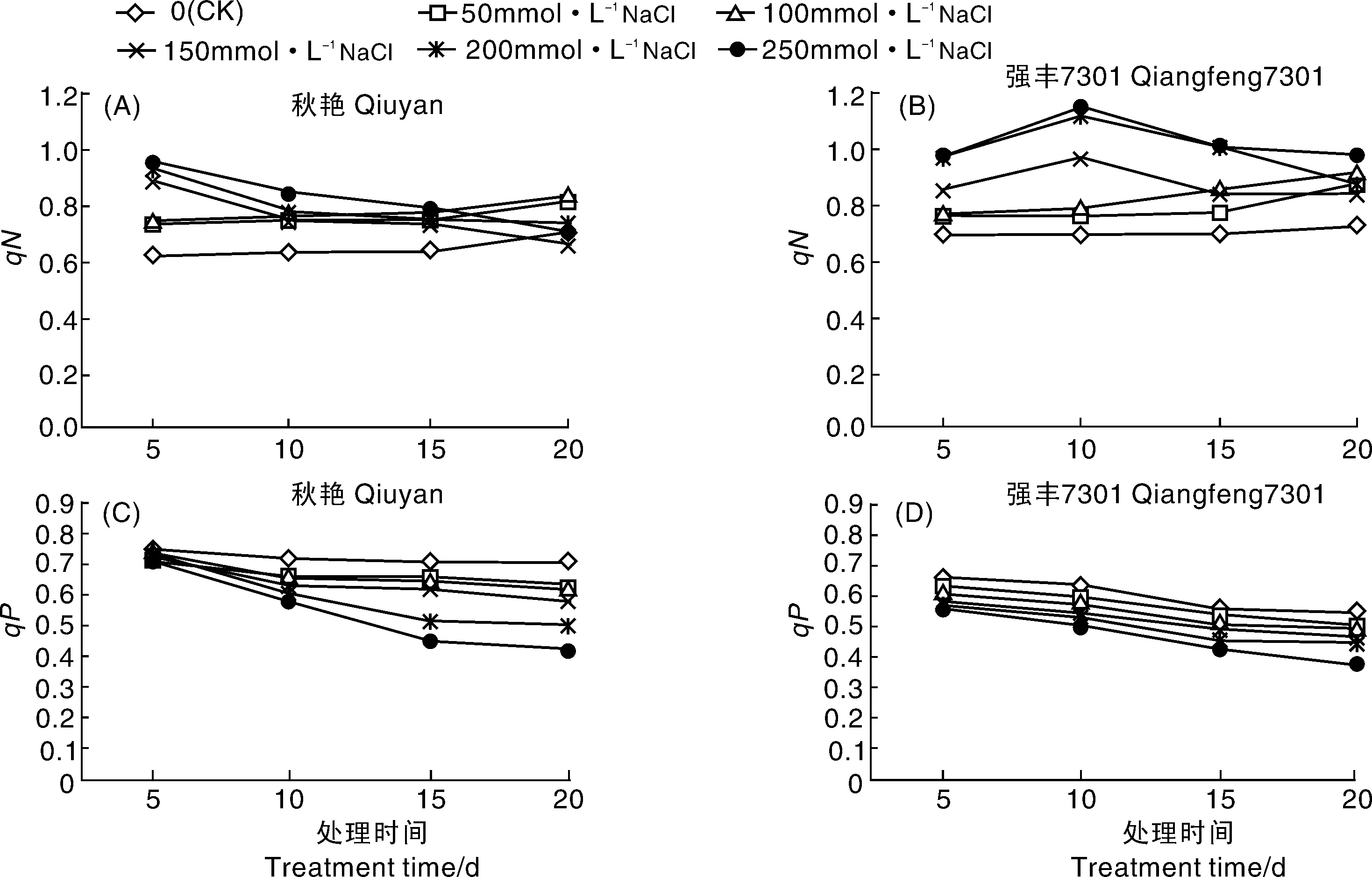
图3 NaCl胁迫对辣椒幼苗qN和qP的影响Fig.3 Effects of NaCl stress on qN and qPof pepper seedlings
23.18%;在胁迫20 d时,与对照相比,各NaCl处理下秋艳的qP分别下降了12.15%、13.69%、18.99%、30.03%、40.92%,强丰7301的qP分别下降了9.23%、10.49%、15.02%、18.47%、30.83%。
2.2 NaCl胁迫对辣椒幼苗叶绿素含量的影响
图4表明,随着NaCl浓度的增加,两个辣椒品种的叶绿素含量在处理5~15 d时表现出相同的变化趋势,其中低浓度处理下叶绿素含量与对照接近或高于对照,而高浓度处理下叶绿素含量低于对照,100 mmol·L-1NaCl处理的叶绿素含量最高。处理20 d时强丰7301各NaCl浓度处理的叶绿素含量先升后降,秋艳则呈下降趋势。50、100 mmol·L-1NaCl处理下强丰7301的叶绿素含量比对照分别增加了3.78%、7.53%,显著高于对照,150~250 mmol·L-1NaCl处理下叶绿素含量下降,分别比对照降低了15.1%、17.75%和15.38%;各NaCl浓度处理下秋艳的叶绿素含量显著低于对照,分别降低了5.23%、11.88%、17.81%、20.74%和26.37%。
2.3 NaCl胁迫对辣椒幼苗叶片质膜相对透性的影响
图5显示,各处理阶段两个辣椒品种质膜相对透性对盐胁迫的响应表现出相似的趋势,随NaCl 浓度增加而增加,但两品种增加幅度不同。在NaCl 处理5 d时,秋艳各处理的质膜相对透性均显著高于对照,分别为32.86%、34.5%、36.35%、41.35%和53.23%;强丰7301在NaCl浓度为50 mmol·L-1和100 mmol·L-1时分别比对照提高了2.52%和7.51%,差异不显著,在NaCl浓度为150~250 mmol·L-1时分别比对照显著提高了19.93%、24.23%和37.30%,增幅明显小于
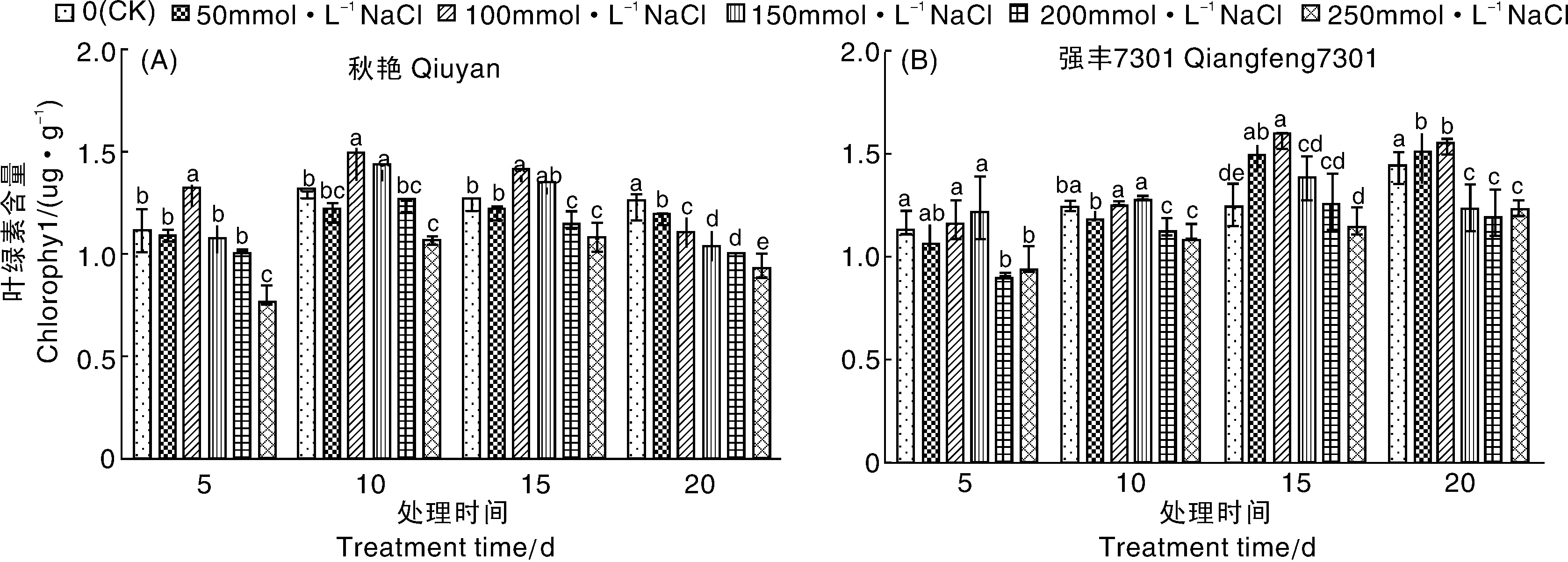
不同小写字母表示差异显著(P<0.05),下同The different small letters show significant differences(P<0.05),the same as below图4 NaCl胁迫对辣椒幼苗叶绿素含量的影响Fig.4 Effects of NaCl stress on the chlorophyll content of pepper seedlings
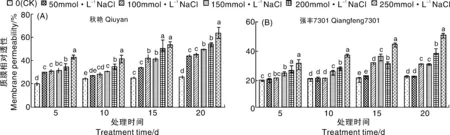
图5 NaCl胁迫辣椒幼苗质膜相对透性的影响Fig.5 Effects of NaCl stress on membrane permeability of pepper seedlings
秋艳。
在NaCl 处理20 d,两品种各处理值均显著高于对照。其中秋艳各处理的质膜相对透性分别比对照提高了41.60%、42.68%、48.22%、52.09%和59.55%,强丰7301分别比对照提高了0.40%、27.31%、27.47%、41.82%和56.28%,秋艳的增幅大于强丰7301。
2.4 NaCl胁迫对辣椒幼苗叶片可溶性糖含量的影响
图6表明,盐胁迫处理5、10 d时,秋艳各处理的可溶性糖含量随着NaCl浓度的增加而增加,在250 mmol·L-1NaCl处理下分别比对照提高了56.59%、41.32%。在处理15~20 d时,表现为低中浓度(0~100 mmol·L-1)处理下可溶性糖含量增加,高浓度(150~250 mmol·L-1)处理下可溶性糖含量降低。强丰7301各处理的可溶性糖含量在盐胁迫处理0~15 d随着NaCl浓度增加皆呈上升趋势,在250 mmol·L-1NaCl处理下分别比对照显著提高了59.73%、52.04%和53.45%,增幅明显大于秋艳,在处理20 d随NaCl浓度的增加,可溶性糖含量表现为先升后降。
2.5 NaCl胁迫对辣椒幼苗可溶性蛋白含量的影响
从图7可以看出,随着NaCl浓度增大,秋艳和强丰7301两辣椒品种的可溶性蛋白含量均呈现先升后降的趋势。秋艳在处理5~15 d皆以100 mmol·L-1NaCl处理的可溶性蛋白含量最高,分别比对照显著增加了40.1%、28.59%和12.51%;处理20 d时50 mmol·L-1NaCl处理的可溶性蛋白含量最高,比对照增加了10.5%;强丰7301在各处理时间内均以100 mmol·L-1NaCl处理的可溶性蛋白含量最高,分别比对照显著增加了20.11%、27.67%、23.6%和18.83%。且在同一处理条件下,强丰7301叶片中可溶性蛋白含量均高于秋艳。
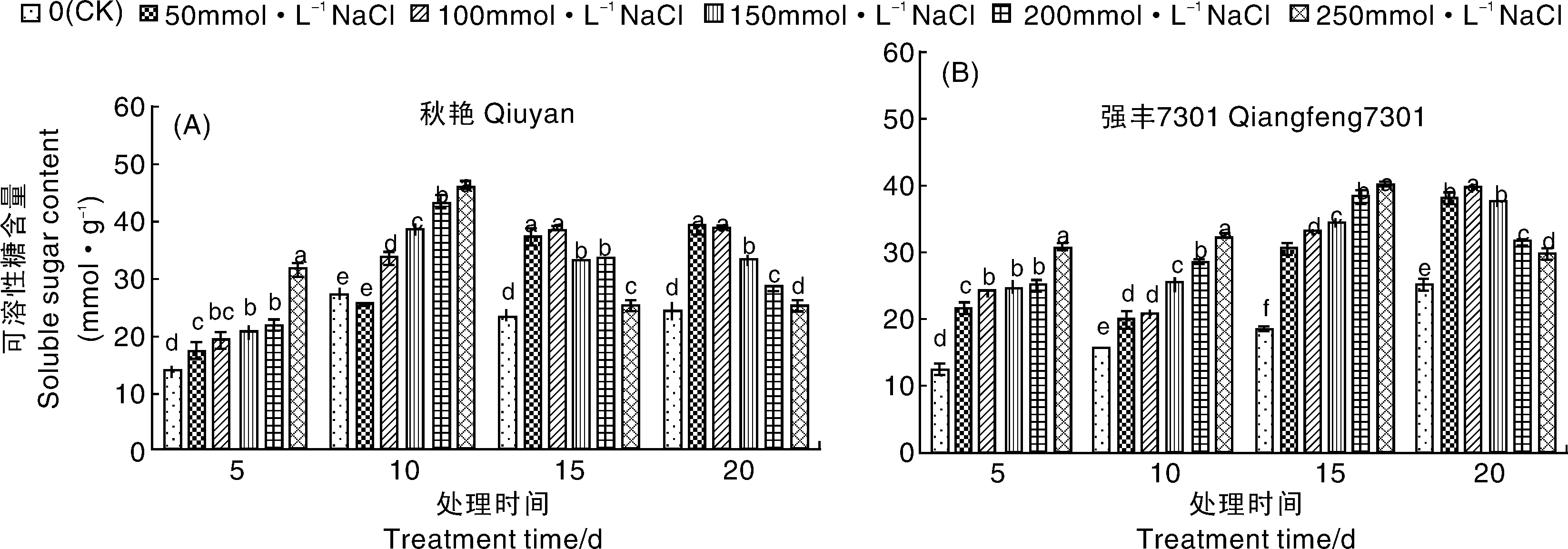
图6 NaCl胁迫对辣椒幼苗可溶性糖含量的影响Fig.6 Effects of NaCl stress on soluble sugar contents of pepper seedlings
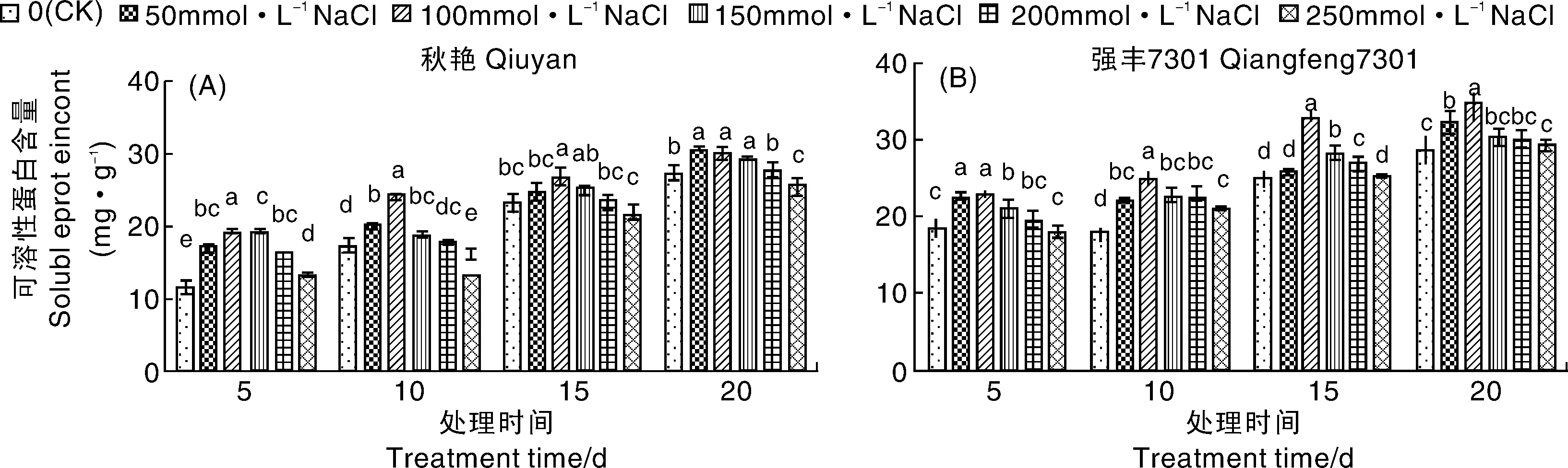
图7 NaCl胁迫对辣椒幼苗可溶性蛋白含量的影响Fig.7 Effects of NaCl stress on soluble protein contents of pepper seedlings
3 结论与讨论
研究发现,植物的叶绿素荧光参数的变化可以一定程度上反映其光合作用情况[9,16,18]。逆境胁迫会导致植物的叶绿体结构被破坏,降低植物PSⅡ系统原初光能转换效率,抑制植物PSⅡ系统潜在的活性[19]。本试验发现,在不同NaCl浓度胁迫下,秋艳和强丰7301两个辣椒品种的Fv/Fm、qP、ФPSⅡ、ETR下降,Fo升高,说明NaCl处理导致两辣椒品种幼苗的PSⅡ系统光化学活性、PSⅡ原初光能转化效率、光合电子传递和光合膜的能量化作用受到抑制;同时还发现,相同浓度NaCl胁迫下,强丰7301叶绿素含量比秋艳高,其Fv/Fm、qP、ФPSⅡ、ETR下降幅度与秋艳相比明显减小,Fo增加幅度变小,而qN的增幅明显变大;说明耐盐品种强丰7301在不同浓度NaCl胁迫下能够有效地保持 PSⅡ原初光能转换效率和PSⅡ的潜在活性,并且能够耗散过剩的光能,积极有效地启动其PSⅡ系统热能量耗散机制,从而使自身的光合结构得到保护,这可能是耐盐品种对盐胁迫等逆境环境的一种适应机制。
在植物光合作用的过程中,叶绿素在植物对光能的吸收、传递和转化等方面具有重要的作用。如果植物在生长过程中叶绿素受到损坏和降解,则会导致植物的光合作用效率降低,进而对植物的生长发育有直接影响[20]。有研究发现,在NaCl胁迫下,菠菜的叶绿素含量和光合速率显著降低[21]。也有研究发现,盐胁迫下水稻的叶绿素含量是提高的[22]。本试验结果表明,随着NaCl处理时间延长,在低浓度(0~100 mmol·L-1)盐胁迫下辣椒幼苗叶绿素含量增加,且耐盐品种强丰7301的叶绿素含量增幅较大;高浓度(150~250 mmol·L-1) 盐胁迫下,两辣椒品种的叶绿素含量均有所下降,盐敏感品种秋艳的叶绿素含量下降幅度明显大于耐盐品种强丰7301。这可能是由于盐胁迫对植物生长发育的影响存在一定的浓度效应。前人研究也发现,在低盐浓度处理下,能促进番茄等不同作物叶片叶绿素含量的增加,但盐浓度过高则对植株叶绿素合成有抑制作用[23-25]。
盐胁迫对植物细胞的膜脂和膜蛋白有很大影响,致使细胞膜的正常生理功能降低,从而影响植物的正常生长。耐盐品种在盐胁迫下有较小的电解质渗透率,其膜系统的渗透调节能力要强于盐敏感品种,其丙二醛含量增加较少,植株能够积累较多的可溶性糖和可溶性蛋白等以增加对逆境的抵抗[26-27]。本试验发现,随着NaCl浓度增加,强丰7301的质膜相对透性较小,可溶性糖和可溶性蛋白积累较多,说明耐盐品种强丰7301在盐胁迫下能够积累较多的抗逆物质,增强其细胞渗透调节能力,来缓解或减轻由于盐胁迫对自身造成的伤害,表现出较好的耐盐特性。
[1] 孙璐,周宇飞,李丰先,等.盐胁迫对高粱幼苗光合作用和荧光特性的影响[J]. 中国农业科学,2012,45(16):3265-3272. SUN L,ZHOU Y F,LI F X,et al. Impacts of salt stress on characteristics of photosynthesis and chlorophyll fluorescence of sorghum seedlings[J].ScientiaAgriculturaSinica,2012,45(16):3265-3272. (in Chinese with English abstract)
[2] TESTER M,DAVENPORT R. Na+tolerance and Na+transport in higher plants[J].AnnalsofBotany,2003, 91(5): 503-527.
[3] 贾亚雄,李向林,袁庆华,等. 披碱草属野生种质资源苗期耐盐性评价及相关生理机制研究[J]. 中国农业科学,2008,41(10): 2999-3007. JIA Y X,LI X L,YUAN Q H,et al. Evaluation of salt-tolerance and the related physiological characteristics of wild Elymus spp.[J].ScientiaAgriculturaSinica, 2008, 41(10): 2999-3007. (in Chinese with English abstract)
[4] 魏国强,朱祝军,方学智,等. NaCl 胁迫对不同品种黄瓜幼苗生长、叶绿素荧光特性和活性氧代谢的影响[J]. 中国农业科学,2004,37(11):1754-1759. WEI G Q,ZHU Z J,FANG X Z,et al. The effects of NaCl stress on plant growth, chlorophyll fluorescence characteristics and active oxygen metabolism in seedlings of two cucumber cultivars[J].ScientiaAgriculturaSinica, 2004, 37(11): 1754-1759. (in Chinese with English abstract)
[5] BETHKE P C,DREW M C. Stomatal and nonstomatal components to inhibition of photosynthesis in leaves ofCapsicumannuumduring progressive exposure to NaCl salinity[J].PlantPhysiology, 1992, 99(1): 219-226.
[6] MUNNS R. Physiological processes limiting plant growth in saline soils: some dogmas and hypotheses[J].PlantCellandEnvironment, 1993, 16(1): 15-24.
[7] SULTANA N,IKEDA T,ITOH R. Effect of NaCl salinity on photosynthesis and dry matter accumulation in developing rice grains[J].EnvironmentalandExperimentalBotany, 1999, 42(3): 211-220.
[8] 段吉锋,刘世琦,张自坤,等. 盐胁迫对尼日利亚茄子与普通茄子幼苗生理生化指标的影响[J]. 西北农业学报, 2010,19(2):159-162. DUAN J F,LIIU S Q,ZHANG Z K,et al. Effect of salt stress on physiological and biochemical indexes of nigeria and common eggplant seedlings[J].ActaAgriculturaeBoreali-occidentalisSinica, 2010, 19(2):159-162. (in Chinese with English abstract)
[9] 张玲,王华,徐强,等. NaCl 胁迫对茄子幼苗生理指标的影响[J].安徽农业大学学报, 2014, 41(6): 965-970. ZHANG L,WANG H,XU Q,et al. Effects of NaCl stress on physiological indexes of eggplant seedlings[J].JournalofAnhuiAgriculturalUniversity, 2014, 41(6): 965-970. (in Chinese with English abstract)
[10] 孙涌栋,姚连芳,李新峥,等. Na2CO3胁迫对黄瓜幼苗生长及生理指标的影响[J].西北植物学报,2008,28(11):2251-2256. SUN Y D,YAO L F,LI X Z,et al. Growth and physiological indexes of cucumber seedlings with Na2CO3stress[J].ActaAgriculturaeBoreali-occidentalisSinica, 2008, 28(11): 2251-2256. (in Chinese with English abstract)
[11] BAKER N R. A possible role for photosystem Ⅱ in environmental perturbations of photosynthesis[J].PhysiologiaPlantarum, 1991, 81(4): 563-570.
[12] ALLAKHVERDIEV S I, NISHIYAMA Y, MIYAIRI S, et al. Salt stress inhibits the repair of photodamaged photosystem II by suppressing the transcription and translation of psbA genes in synechocystis[J].PlantPhysiology, 2002, 130(3): 1443-1453.
[13] MURATA N, TAKAHASHI S, NISHIYAMA Y, et al. Photoinhibition of photosystem Ⅱ under environmental stress[J].BiochimicaetBiophysicaActa, 2007, 1767(6): 414-421.
[14] MELGAR J C, GUIDI L, REMORINI D, et al. Antioxidant defenses and oxidative damage in salt-treated olive plants under contrasting sunlight irradiance[J].TreePhysiology, 2009, 29(9): 1187-1198.
[15] 葛江丽, 石雷, 谷卫彬, 等. 盐胁迫条件下甜高粱幼苗的光合特性及光系统Ⅱ功能调节[J].作物学报,2007, 33 (8):1272-1278. GE J L,SHI L,GU W B,et al. Photosynthetic characteristics and the regulation of photosystemⅡfunction in salt stressed sweet sorghum seedlings[J].ActaAgronomicaSinica,2007,33(8):1272-1278. (in Chinese with English abstract)
[16] 周静. NaCl胁迫对辣椒种子、幼苗生长发育和叶绿素荧光特性的影响[D].合肥:安徽农业大学,2014. ZHOU J. Effects of NaCl stress on the growth and the chlorophyll fluorescence characteristic among pepper seeds and seedlings[D]. Hefei: Anhui Agricultural University . (in Chinese with English abstract)
[17] 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社,2006.
[18] HENDRICKSON L,FURBANK R T,CHOW W S. A simple alternative approach to assessing the fate of absorbed light energy using chlorophyll fluorescence[J].PhotosynthesisResearch, 2004, 82(1):73-81.
[19] LU C M,ZHANG J H. Effects of water stress on photosystem Ⅱ photochemistry and its thermostability in wheat plants[J].JournalofExperimentalBotany, 1999, 50(336): 1199-1206.
[20] 王邦锡,何军贤,黄久常. 水分胁迫导致小麦叶片光合作用下降的非气孔因素[J].植物生理学报,1992, 18(1): 77-84. WANG B X, HE J X, HUANG J C. Non-stomatal factors causing photosynthetic rate decline induced by water stress[J].ActaPhytophysiologicaSinica,1992,18(1): 77-84. (in Chinese with English abstract)
[21] DOWNTONW J S,GRANTW J,ROBINSON S P. Stomatal closure fully accounts for the inhibition of photosynthesis by abscisic acid [J]. Plant Physiology, 1985, 77: 85-88.
[22] PUSHPAM R,RANGASAMY S R S. Variations in chlorophyll contents of rice in relation to salinity[J].CropResearch, 2000, 20(2):197-200.
[23] 郭文忠,刘声锋,李丁仁,等 硝酸钙和氯化钠不同浓度对番茄苗期光合生理特性的影响[J]. 中国农学通报, 2003,19(5):28-31. GUO W Z,LIU S F,LI D R,et al. Effects on photosynthesis and parameter of young plant of tomato under different concentration of Ca(NO3)2and NaCl in solar greenhouse[J].ChineseAgriculturalScienceBulletin,2003,19(5):28-31. (in Chinese with English abstract)
[24] 薛忠财,高辉远,柳洁. 野生大豆和栽培大豆光合机构对NaCl 胁迫的不同响应[J]. 生态学报, 2011, 31(11): 3101-3109. XUE Z C,GAO H Y, LIU J. Different response of photosynthetic apparatus between wild soybean (Glycinesoja) and cultivated soybean (Glycinemax) to NaCl stress[J].ActaEcologicaSinica, 2011, 31(11):3101-3109. (in Chinese with English abstract)
[25] 杨淑萍,危常州,梁永超. 盐胁迫对不同基因型海岛棉光合作用及荧光特性的影响[J]. 中国农业科学, 2010, 42(8): 1585-1593. YANG S P,WEI C Z,LIANG Y C. Effects of NaCl stress on the characteristics of photosynthesis and chlorophyll fluorescence at seedlings stage in different sea island cotton genotypes[J].ScientiaAgriculturaSinica, 2010, 42(8): 1585-1593. (in Chinese with English abstract)
[26] DONG Y H. The effect of ABA or 6-BA on CO2assimilation in wheat seedlings under water stress [J].ActaAgronomicaSininca, 1997, 23(4):501-504.
[27] AMEGLI O T, PIGEON D, ARCHILLA O. Adaptation to cold temperature and response to freezing in roses[J].ActaHorticulturae, 2003, 618: 515-520.
(责任编辑 张 韵)
Effects of NaCl stress on chlorophyll fluorescence characteristics and physiological characteristics in seedlings of two pepper cultivars
ZHANG Ling, WANG Hua, ZHOU Jing, XU Qiang*
(CollegeofHorticulture,AnhuiAgriculturalUniversity,Hefei230036,China)
The salt-tolerant (Qiangfeng 7301) and salt-sensitive (Qiuyan) pepper varieties were selected to study chlorophyll fluorescence parameters as well as other related indexes change of pepper seedlings under NaCl stress with the concentrations of 50, 100, 150, 200, and 250 mmol·L-1, respectively, and no NaCl was set as control (CK) in this experiment. The results showed that salt stress decreased the ФPSⅡ,ETR,Fv/Fm,qPand increasedqN,Fo, electrolyte leakage rate of the two pepper varieties. The content of chlorophyll and soluble protein in the two varieties of pepper seedlings increased under NaCl concentration (0-100 mmol·L-1), but decreased significantly under NaCl concentration (150-250 mmol·L-1) with the concentrations of salt stress increased, soluble sugar content of Qiuyan showed a gradually increasing trend on the 5th and 10th day and increased firvstly and then decreased on the 15th and 20th day. However, Qiangfeng 7301 on the 20th day increased firstly and then reduced, and showed gradually rising trend at other treatment time. It indicated that low concentrations of NaCl (0-100 mmol·L-1) had no significant effect on pepper, while high concentrations of NaCl (150-200 mmol·L-1) had great influences on pepper seedlings. In addition, it was found that Qiangfeng 7301 showed better salt tolerance than Qiuyan. The results showed that salt tolerance of pepper had better salt tolerance, and the salt tolerance of pepper seedlings was closely related to salt concentrations and stress time.
pepper; salt stress; chlorophyll fluorescence; physiological properties
http://www.zjnyxb.cn
10.3969/j.issn.1004-1524.2017.04.12
2016-11-30
安徽省自然科学基金项目(1208085QC54);安徽农业大学青年科学基金重点项目(2011zb006);安徽农业大学稳定和引进人才科研资助项目(yi2011-38)
张玲(1974—),安徽金寨人,硕士, 实验师,研究方向为设施园艺栽培。E-mail: zhanglingyu@ahau.edu.cn
*通信作者,徐强,E-mail:qiang_xu1015@163.com
S641.3
A
1004-1524(2017)04-0597-08
浙江农业学报ActaAgriculturaeZhejiangensis, 2017,29(4): 597-604
张玲,王华,周静,等. NaCl胁迫对两个辣椒品种幼苗叶绿素荧光参数等生理特性的影响[J].浙江农业学报,2017,29(4): 597-604.
