橙皮素对大鼠离体心脏心功能的影响及其机制研究
2017-04-26石萌侯晓敏刘宇郭鹏美宋奇颖张明
石萌 侯晓敏 刘宇 郭鹏美 宋奇颖 张明升


[摘要] 目的 观察橙皮素(HSP)对大鼠离体心脏心功能的影响及其可能的机制。 方法 建立Langendorff离体心脏灌流模型,记录不同浓度HSP对大鼠离体心脏冠状动脉流量(coronary flow,CF)、心率(heart rate,HR)、左心室发展压(left ventricular developed pressure,LVDP )、左心室舒张末压(left ventricular end-diastolic pressure,LVEDP)、等容收缩期左心室内压上升的最大速率(positive dp/dtmax,+dp/dtmax)、等容舒张期左心室内压下降的最大速率(negative dp/dtmax,-dp/dtmax)的影响。使用钙激活K+通道(KCa)阻断剂四乙胺(TEA)、ATP敏感K+通道(KATP)阻断剂格列本脲(Gli)、内向整流K+通道(KIR)阻断剂氯化钡(BaCl2)、电压依赖性K+通道(KV)阻断剂4-氨基吡啶(4-AP)等工具药探究HSP对离体大鼠心脏心功能影响的机制。 结果 与用药前相比,HSP可以增加离体大鼠心脏的CF值(P<0.05),降低其LVDP、+dp/dtmax值(P<0.05)。4-AP能抑制HSP对离体心脏CF、LVDP、+dp/dtmax的作用(P<0.05),而TEA、Gli、BaCl2无明显作用(P>0.05)。 结论 HSP对离体大鼠心脏有负性肌力作用,其机制与心肌细胞的KV激活有关,与KCa、KATP、KIR无关。
[关键词] HSP;离体心脏灌流;作用机制;KV通道
[中图分类号] R285.5 [文献标识码] A [文章编号] 1673-9701(2017)04-0032-05
Effects and mechanism of hesperetin on cardiac function in isolated rat hearts
SHI Meng HOU Xiaomin LIU Yu GUO Pengmei SONG Qiying ZHANG Mingsheng
Departmet of Pharmacology, Shanxi Medical University, Taiyuan 030001, China
[Abstract] Objective To investigate the effects of hesperetin(HSP) on cardiac function in isolated rat hearts and explore its possible mechanism. Methods The model of Langendorff isolated heart perfusion system was used to record the results including coronary flow(CF), heart rate(HR), left ventricular developed pressure(LVDP), leftventricular end-diastolic pressure(LVEDP), positive dp/dtmax(+dp/dtmax) and negative dp/dtmax (-dp/dtmax)by different concentrations of HSP perfusion in isolated rat hearts. In this paper, the mechanism of effects of HSP on cardiac function in isolated rat hearts was explored by applying the inhibitors of KCa channel(TEA), KATP channel(Gli),KIR channel(BaCl2)and KV channel(4-AP). Results Compared with preadministration,HSP could increase the CF(P<0.05) and decrease the LVDP,+dp/dtmax(P<0.05) of isolated rat hearts. 4-AP could restrain the effects of HSP(P<0.05), while TEA, Gli and BaCl2 had no obvious effects(P>0.05). Conclusion HSP has a negative inotropic effect on isolated rat hearts,which could be related to the activation of KV channel on cardiomyocytes, but dont depend on KCa, KATP and KIR channel.
[Key words] HSP; Isolated heart perfusion; Mechanism; KV channel
橙皮素是一種黄烷酮类糖苷,主要来自柑橘属植物果实的果皮和果肉。据文献报道HSP具有显著的抗炎[1]、抗氧化[2]、抗肿瘤[3]作用。流行病学研究显示,在日常膳食中增加HSP的摄入可以有效地降低人类由于心血管疾病的死亡率[4]。研究表明,HSP可以通过JNK/Bax信号通路抑制脂多糖诱导的H9C2心肌细胞凋亡[5],还可以通过阻断PKCa/bⅡ-AKT、JNK和TGFb1-Smad信号通路抑制超压力负荷小鼠的心脏重构[6]。以上研究成果均提示,HSP有望成为保护心血管系统的良药。然而,HSP对正常心脏有何影响及其机制目前尚未有明确报道,本实验通过建立Langendorff离体心脏模型,研究HSP对正常心脏的直接作用及其可能的作用机制,旨在为临床应用HSP防治心血管疾病提供一定的实验依据。
1 材料与方法
1.1 药品与试剂
橙皮素(HSP)、四乙胺(TEA)、格列本脲(Gli)、氯化钡(BaCl2)、4-氨基吡啶(4-AP)、戊巴比妥钠购自美国Sigma公司,分析纯氯化钠(NaCl2)、分析纯氯化钾(KCl)购自天津市北辰方正试剂厂,分析纯氯化钙(CaCl2)、磷酸二氢钠(NaH2PO4)、磷酸氢钠(NaHCO3)、氯化镁(MgCl2)、二甲基亚砜(DMSO)购自生工生物工程(上海)股份有限公司,分析纯葡萄糖、无水乙醇购自天津市大茂化学试剂厂。
用无水乙醇溶解HSP,DMSO溶解Gli,TEA、BaCl2、4-AP均使用三蒸水溶解。
1.2 实验动物
成年雄性Spraguue Dawley (SD)大鼠80只,8周龄,体重为200~250 g,购自中国食品药品检定研究所,许可证号SCXK(京)2014-0013。
1.3 实验仪器
恒温水浴箱:HW-1000 超级恒温水浴箱,购自成都泰盟科技有限公司;多通道数显蠕动泵:LEAD-2-A,购自保定兰格恒流泵有限公司;离体心脏灌流系统:GL-2,购自成都泰盟科技有限公司;生物信号采集系统:Power LabPS4/8、Lab Chart 7.0 pro,购自埃德仪器(上海)有限公司;计算机:DELL E520。
1.4 Langendorff离体心脏模型的建立
按照文献所示方法[7],大鼠称重后,40 mg/kg戊巴比妥钠经腹腔注射麻醉大鼠后,迅速开胸取心,置于4℃台式液(配方为:NaCl2 118、KCl 5.0、CaCl2 1.5、NaH2PO4 1.2、NaHCO3 20、MgCl2 1.2、葡萄糖11,单位:mmol/L)中,迅速将心脏转移固定到Langendorff灌流装置上,以台式液行主动脉逆行灌流。实验过程中灌流液中持续通入95%O2+5%CO2混合气,维持恒温(37℃)、恒压(75 mmHg, 1 mmHg=0.133 kPa),恒定pH(pH 7.4)灌流。待心脏恢复跳动后,用眼科剪在左心房上剪一小口,把通过腰麻管与换能器相连通的小球囊经过左心房置于左心室内,球囊内注入少量水,使心脏初始前负荷维持于4~10 mmHg。当实验过程中出现严重的心律失常时舍弃该心脏8。
1.5 实验分组
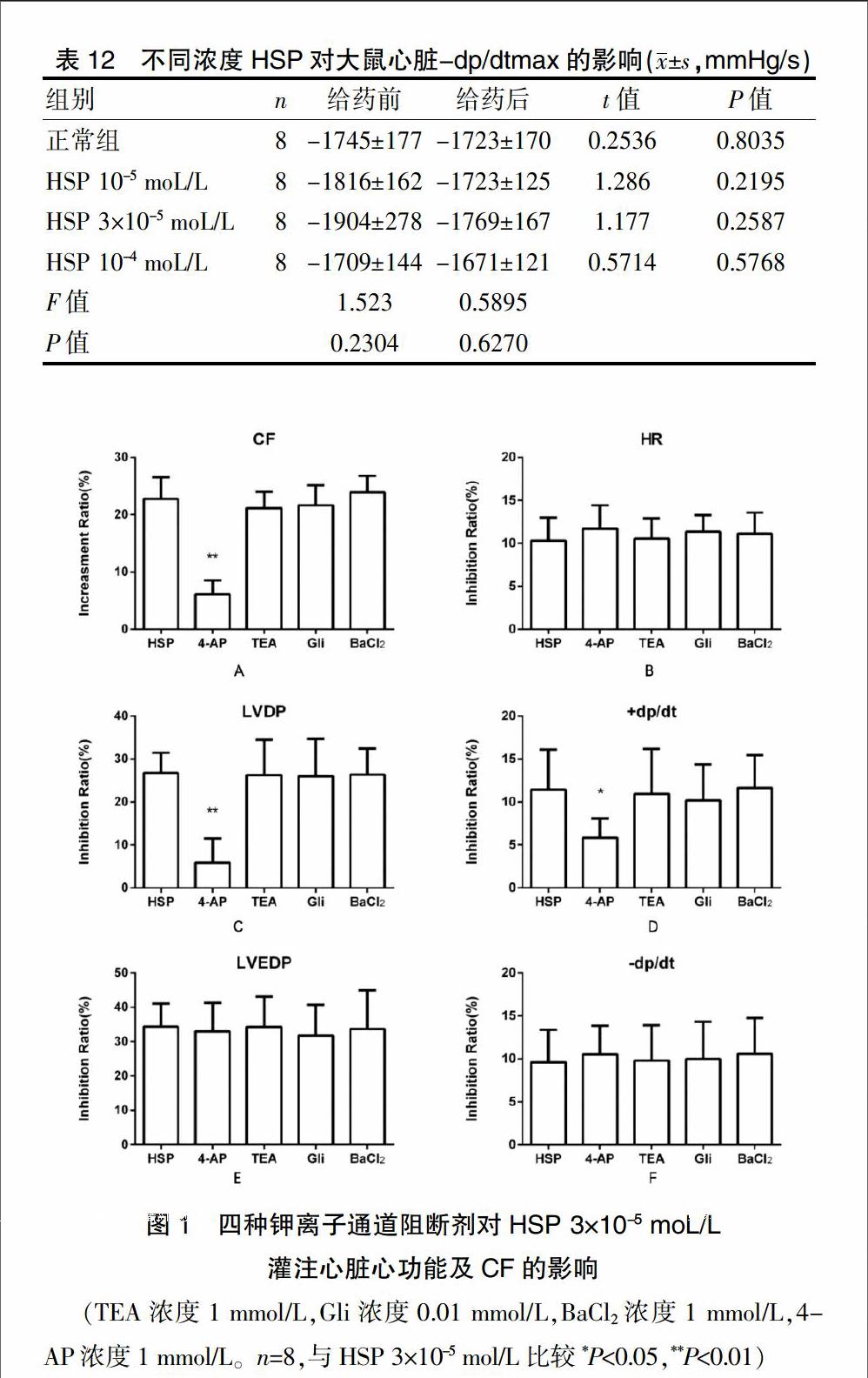
离体心脏随机分为10组,每组8只。待心脏稳定30 min后,可继续实验。(1)正常组:离体心脏持续灌注台式液。(2)溶剂对照组:乙醇组和DMSO組,用含0.1%(V/V)的Vehicle或DMSO台式液灌注心脏30 min。(3)药物作用组:分别用HSP终浓度为10-5、3×10-5、10-4 moL/L的台式液灌注心脏30 min,观察不同浓度HSP对心功能的影响。(4)钾通道阻断剂+HSP组:分别用含四种钾通道阻断剂TEA、Gli、BaCl2、4-AP的台式液(终浓度分别为1、0.01 、1、1 mmoL/L)预灌注心脏30 min,再用HSP终浓度为3×10-5 moL/L的台式液灌注心脏30 min。
1.6 左心功能评价指标
心脏固定好后,经台式液预灌注稳定30 min后,采用LabChart 7.0 pro生物信号采集处理系统监测记录离体心脏心率(HR)、左心室发展压(LVDP)、左心室舒张末压(LVEDP)、等容收缩期左心室内压上升的最大速率(+dp/dtmax)、等容舒张期左心室内压下降的最大速率(-dp/dtmax)等指标,在特定时间点记录离体心脏冠状动脉流量(CF)。以稳定30 min末的值为基础值,计算各指标的改变率。
1.7 统计学方法
使用SPSS13.0软件进行数据分析,计量资料以(x±s)表示,比较进行t检验或单因素重复测量方差分析,P<0.05为差异具有统计学意义。
2 结果
2.1 溶剂对大鼠离体心脏心功能及CF的影响
正常组与乙醇组、DMSO组各项数值之间差异无显著性(P>0.05),各组给药前后无显著差异(P>0.05)(表1~6),表明溶剂对大鼠离体心脏心功能及CF无明显影响。
2.2 不同浓度HSP对大鼠离体心脏心功能的影响
2.2.1 不同浓度HSP对大鼠离体心脏CF和HR的影响 HSP可以增加离体心脏的CF。随着HSP浓度增加,离体心脏的CF值逐渐增大,最大值为(10.4±0.9)mL/min(表7)。HSP对离体心脏的HR无明显影响(表8)。
2.2.2 不同浓度HSP对大鼠离体心脏左心室收缩功能(LVDP,+dp/dtmax)的影响 HSP可以浓度依赖性地降低离体心脏的LVDP,+dp/dtmax。随着HSP浓度增加,离体心脏的LVDP,+dp/dtmax值逐渐降低,最小值分别为(50±3)mmHg、(1592±261)mmHg/s(表9、10)。
2.3 四种钾通道阻断剂对HSP灌流心脏的影响
与HSP 3×10-5 mol/L组相对比,用KV阻断剂4-AP预处理心脏30 min后,4-AP可以显著抑制HSP对离体心脏CF的增加,其增长率由(22.8±3.8)%降至(6.1±2.4)%(图1A);减弱HSP对LVDP的抑制作用,其抑制率由(26.8±4.7)%降至(5.9±5.6)%(图1C);减弱HSP对+dp/dtmax的抑制作用,其抑制率由(11.4±4.7)%降至(5.8±2.3)%(图1D)(P<0.05)。而KCa阻断剂TEA、KATP阻断剂Gli和KIR阻断剂BaCl2对HSP灌流心脏心功能的影响均不显著(P>0.05)。
3 讨论
多酚类包括黄酮类和单宁类。黄酮类是由两个芳香环以及一个含氧杂环构成。根据结构以及中央杂环的氧化状态,黄酮类又可以分为八种:黄酮类化合物、黄酮醇、黄烷酮、查尔酮、异黄酮、花色素类、橙酮类、双黄酮类和新黄酮类聚合物。
研究发现,黄酮类可以降低缺血性脑卒中以及慢性血管性疾病的死亡率[9]。黄酮类具有显著地心血管保护作用[10],在心血管系统,黄酮类化合物影响胆固醇的内源性合成以及自由基的清除。在体外实验中Havsteen BH[11]发现,黄酮类可以促进家兔主动脉内皮依赖性的舒张作用。有研究表明,枳类果实的黄酮类提取物可以通过NO-cGMP途径舒张猪冠状动脉[12]。HSP是柑橘属二氢黄酮类中具有多种生物学活性的一种物质,在柑橘汁、橙汁、西柚汁等中含量丰富。我们的实验表明HSP可以抑制心肌收缩功能并且可以舒张冠状动脉。
Langendorff离体心脏模型广泛应用于生理、药理等领域的研究,其优点是可以排除神经体液调节,从而研究某单一因素对心功能及代谢的影响。LVDP和+dp/dtmax反映了心脏收缩功能,+dp/dtmax可以间接地反映心肌的收缩速度[13],本实验结果显示HSP可以降低正常大鼠离体心脏的LVDP、+dp/dtmax值,证明HSP对心脏收缩功能有抑制作用。LVEDP和-dp/dtmax反映了心脏舒张功能,-dp/dtmax可以反映左心室等容舒张期左心室内压力最大下降速率以及左心室顺应性[14]。CF可以一定程度上反应冠脉的收缩与舒张状况,本实验中HSP可以浓度依赖性的增加离体大鼠心脏的CF值,证明HSP对冠脉有一定的舒张作用,该结论本课题组前期15的研究结果相一致。HR也是反映心功能的一项重要指标,与心输出量密切相关,此外,HR减慢可延长冠脉灌注时间,改善心肌血供。
在本实验研究中,为了进一步探索HSP对心功能影响的机制,我们采用了四种K+通道抑制剂,实验结果显示HSP对心功能的影响可以被4-AP所阻断,而不被TEA、Gli、BaCl2所影响,证明HSP对离体大鼠心脏的负性肌力作用可能与心肌细胞的KV激活有关,而与KCa、KATP、KIR无关。
Ca2+是肌细胞兴奋-收缩耦联的关键因子,由于心肌细胞的肌质网不发达,储存的Ca2+较少,所以主要依赖外Ca2+通过肌膜及横管膜中的L型钙通道内流入胞质触发兴奋-收缩耦联。KV通道的活性与心肌细胞静息电位的形成,动作电位的时程与频率尤其是动作电位复极相密切相关16。在心肌细胞动作电位2期,Ca2+通过L型钙通道内流形成去极化电流,而这一内向电流则被KV外向电流所抗衡,当KV激活时,Ca2+内流减少,从而导致心肌收缩力减弱。我们的研究表明KV的激活的参与了HSP对心脏收缩功能的抑制。
综上所述,HSP可以浓度依赖性地抑制心肌收縮功能,舒张冠状动脉,其机制与KV激活有关,而与KCa、KATP、KIR无关。
[参考文献]
[1] Hirata A,Murakami Y,Shoji M,et al. Kinetics of radical-scavenging activity of hesperetin and hesperidin and their inhibitory activity on COX-2 expression[J]. Anticancer research,2005,25(5):3367-3374.
[2] Choi EJ. Antioxidative effects of hesperetin against 7,12-dimethylbenz(a) anthracene-induced oxidative stress in mice[J]. Life sciences,2008,82(21-22):1059-1064.
[3] Li F,Chow S,Cheung WH,et al. The citrus flavonone hesperetin prevents letrozole-induced bone loss in a mouse model of breast cancer[J]. The Journal of nutritional biochemistry,2013,24(6):1112-1116.
[4] Knekt P,Kumpulainen J,Jarvinen R,et al. Flavonoid intake and risk of chronic diseases[J]. The American journal of clinical nutrition,2002,76(3):560-568.
[5] Yang Z,Liu Y,Deng W,et al. Hesperetin attenuates mitochondria-dependent apoptosis in lipopolysaccharide-induced H9C2 cardiomyocytes[J]. Molecular medicine reports,2014,9(5):1941-1946.
[6] Deng W,Jiang D,Fang Y,et al. Hesperetin protects against cardiac remodelling induced by pressure overload in mice[J]. Journal of molecular histology,2013,44(5):575-585.
[7] Stojic I,Srejovic I,Zivkovic V,et al. The effects of verapamil and its combinations with glutamate and glycine on cardiodynamics,coronary flow and oxidative stress in isolated rat heart[J]. Journal of physiology and biochemistry,2016.
[8] Ikizler M,Erkasap N,Dernek S,et al. Dietary polyphenol quercetin protects rat hearts during reperfusion:Enhanced antioxidant capacity with chronic treatment[J]. Anadolu kardiyoloji dergisi:AKD=the Anatolian journal of cardiology,2007,7(4):404-410.
[9] Toufektsian MC,de Lorgeril M,Nagy N,et al. Chronic dietary intake of plant-derived anthocyanins protects the rat heart against ischemia-reperfusion injury[J]. The Journal of nutrition,2008,138(4):747-752.
[10] Cassidy A,Rimm EB,O'Reilly EJ,et al. Dietary flavonoids and risk of stroke in women[J]. Stroke,2012,43(4):946-951.
[11] Havsteen BH. The biochemistry and medical significance of the flavonoids[J]. Pharmacology & therapeutics,2002, 96(2-3):67-202.
[12] Yu DJ,Jun JH,Kim TJ,et al. The relaxing effect of Poncirus fructus and its flavonoid content on porcine coronary artery[J]. Laboratory animal research,2015,31(1):33-39.
[13] Gao XM,Dart AM,Dewar E,et al. Serial echocardiographic assessment of left ventricular dimensions and function after myocardial infarction in mice[J]. Cardiovascular research,2000,45 (2):330-338.
[14] Ji DB,Zhang LY,Li CL,et al. Effect of Hydroxysafflor yellow a on human umbilical vein endothelial cells under hypoxia[J]. Vascular pharmacology,2009,50(3-4):137-145.
[15] Liu Y,Niu L,Cui L,et al. Hesperetin inhibits rat coronary constriction by inhibiting Ca(2+) influx and enhancing voltage-gated K(+) channel currents of the myocytes[J]. European journal of pharmacology,2014,735:193-201.
[16] Hatano N,Ohya S,Muraki K,et al. Dihydropyridine Ca2+ channel antagonists and agonists block Kv4.2,Kv4.3 and Kv1.4 K+ channels expressed in HEK293 cells[J]. British journal of pharmacology,2003,139(3):533-544.
(收稿日期:2016-10-13)
